Introducción
La diabetes insípida (DI) es la manifestación de una secreción o acción reducidas de la vasopresina u hormona antidiurética (ADH) por sus siglas en inglés, caracterizada por la producción de grandes volúmenes de orina muy diluida. Esto resulta en un discreto incremento de la osmolalidad plasmática, que estimula la sed y la polidipsia correspondiente. Los signos clínicos de deshidratación no son muy frecuentes, a menos que se altere la ingestión de líquidos.1
Los antecedentes se remontan al siglo XVIII, cuando en 1769 William Cullen estableció por primera vez la distinción entre diabetes mellitus y DI.2 En 1928 Kamm aísla la vasopresina.3
Se enuncian en la literatura principalmente la DI central (DIC) y la DI nefrogénica. En la DIC el eje hipotalámico-neurohipofisario es incapaz de secretar y sintetizar la vasopresina en respuesta a un aumento de la osmolalidad, por tanto, los niveles plasmáticos de la hormona son no medibles o bajos para la osmolalidad plasmática. Se han descrito otros tipos: la DI gestacional, la polidipsia primaria y la disfunción de los osmorreceptores.4
Casi la mitad de los pacientes son de causa idiopática; sin embargo, la DI puede obedecer a trastornos genéticos, congénitos o adquiridos después de daño cerebral traumático,5 cirugía de hipófisis, encefalopatía hipóxica, aneurisma, meningitis o encefalitis infecciosa, neoplasias, toxinas o fármacos, hipercalcemia, hipopotasemia, necrosis tubular aguda,1 apoplejía hipofisaria,6 síndrome de Sheehan agudo7 e hipopituitarismo secundario a síndrome de Sheehan de largo tiempo de evolución.8 La DIC también puede aparecer secundariamente a una hipofisitis autoinmune, caracterizada por la presencia de autoanticuerpos específicos como anti alfaenolasa o enolasa neuronal específica y anti-ADH. Es el cuadro clínico principal de la infundibuloneurohipofisitis (INH) aunque también se ha descrito en el curso de panhipofisitis.9
El virus del Zika (ZIKV) es un arbovirus del género flavivirus. Se identificó en 1947 en los bosques de Zika de Uganda, aislado en monos, pero no se consideró un importante patógeno humano hasta 2007. En 2015 se informó por primera vez la transmisión local en América del Sur, Centroamérica y el Caribe.10 Es una enfermedad viral autolimitada, de leve intensidad y evolución benigna. Se transmite principalmente por la picadura de mosquitos hembras del género Aedes.11 Este virus tiene un fuerte tropismo cutáneo, y también neuronal.11,12 La replicación viral desencadena una respuesta inmune antiviral innata con producción de interferón de tipo 1, y adaptativa con expresión de anticuerpos neutralizantes y linfocitos T citotóxicos que adquieren capacidad citolítica. El resultado de la infección está dado por la competencia entre la replicación y la respuesta inmune del hospedero, lo que ocasiona entonces diversas manifestaciones clínicas.11
Los virus pueden inducir autoinmunidad a través de varios mecanismos, incluyendo el mimetismo molecular, la activación de células T por superantígenos, y la diseminación de células T previamente activadas en un sitio de inflamación.13
El ZIKV se ha relacionado con el desarrollo de un trastorno de tipo autoinmune, y presencia de alteraciones neurológicas.14 Estas incluyen manifestaciones neurooftalmológicas, microcefalia en hijos de madres infectadas durante el embarazo, síndrome de Guillain Barré, encefalomielitis diseminada aguda, mielitis transversa y polineuropatía desmielinizante inflamatoria crónica.15
La DI en vinculación con el ZIKV no ha sido reportada con anterioridad en la literatura médica nacional e internacional revisada, por lo que se presenta el primer caso a propósito de esta asociación.
Presentación del caso
Se trata de una paciente femenina de 53 años de edad, mestiza, hipertensa desde los 36 años de edad, para lo cual lleva tratamiento con hidroclorotiazida y enalapril (½ tab de 25 mg y 20 mg al día respectivamente), alérgica a la penicilina, con desarrollo psicosocial normal, sin alteraciones psicológicas, menopáusica desde los 45 años de edad. No refirió antecedentes patológicos familiares de interés y tampoco traumatismos, transfusiones, hábitos tóxicos ni cirugías relacionadas con los sistemas neurológico o renal. Ingresa en el Centro de Investigaciones Médico-Quirúrgicas (CIMEQ), de La Habana, Cuba, por la presencia de un cuadro clínico de dolor de cabeza, decaimiento y orinas abundantes.
Aproximadamente 15 días antes de su ingreso presentó cuadro de malestar general, artralgias, cefalea intensa de localización frontal y retroorbitaria que no respetaba horarios ni aliviaba con el reposo, decaimiento y febrícula de 37ºC, que se acompañó de erupción cutánea, irritación conjuntival, sequedad de piel y mucosas e hipotensión arterial que la obligó a abandonar el tratamiento hipotensor. Se realiza el diagnóstico clínico de infección por el ZIKV, posteriormente confirmado con la realización del examen de Reacción de Cadena de la Polimerasa (PCR) para ZIKV y se indicó tratamiento sintomático.
Aproximadamente 12 días después retoma el tratamiento hipotensor y comenzó a presentar decaimiento, fatiga intensa y sequedad bucal; acude al cuerpo de guardia y se determinan signos de deshidratación y niveles elevados de sodio (Na) plasmático, lo que obligó la utilización de hidratación parenteral con solución salina hipotónica 0,45 %. Al lograr mejoría de la sintomatología retorna a su domicilio. Sin embargo, regresa 48 h después al cuerpo de guardia con cuadro similar acompañado de dolor de cabeza intenso y refiriendo que las orinas cada vez son más frecuentes y abundantes, impidiéndole conciliar el sueño.
Al examen físico se constataron como datos positivos: pliegue cutáneo ligero, mucosas ligeramente secas y tensión arterial 170/105 mmHg. Se ingresa y se constata una diuresis de 13050 mL en 24 h.
Se realizan exámenes complementarios de laboratorio, que incluyen hemograma completo con diferencial, sin grandes alteraciones en los valores de hemoglobina (11,0 g/L), hematocrito (36,8 %), plaquetas (245 x109 /L) ni leucocitos (conteo global: 6,1 x109 /L; linfocitos: 39,2 %; monocitos 10,9 % y neutrófilos 49,9 %). La hemoquímica mostró igualmente valores normales (glucemia 5,5 mmol/L; creatinina 98 mmol/L; urea 5,52 mmol/L; ácido úrico 252 U/L; triglicéridos 1,21 U/L; colesterol 4,6 U/L; albúmina 44 g/L; proteínas totales 69 g/L; TGO 24 U/L; TGP 16 U/L; GGT 27 U/L). La gasometría con ionograma en sangre venosa arrojó valores de Na 146,8 mmol/L [VR: 135-145] y Osm 304,62 mOsm/kg [VR: 280-300]. La osmolalidad urinaria fue de 149 mOsm/kg y la densidad de orina, de 1006. Para evaluar función adenohipofisaria se indicó determinación hormonal que mostró valores normales, incluyendo FSH y LH a pesar de ser una mujer menopáusica, pues sus cifras elevadas demuestran la integridad funcional de dicha glándula (ACTH 66,71 pg/mL [VR: 6-76]; TSH 1,80 µUI/mL [VR: 0,27-4,2]; LH 50,72 mUI/mL [VR: 7,7-58,5]; FSH 82,62 µUI/mL [VR: 25,8-134,8]). No se indica medición de prolactina ya que se comprobó la ausencia de galactorrea mediante el examen físico de las mamas.
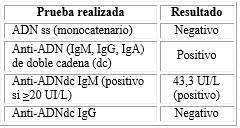
Se indica la medición de anticuerpos antinucleares (ANA) para la detección, en un primer nivel, de estos anticuerpos en su conjunto, por la sospecha de un proceso autoinmune en esta paciente. Al recibir el resultado positivo del examen, se continuó en un segundo nivel con la identificación de las especificidades antinucleares involucradas, resultando positivos los marcadores de autoanticuerpos anti ADN de doble cadena (dc) con isotipos IgA, IgM e IgG, este último considerado el más patogénico en las enfermedades asociadas a estos anticuerpos (tabla 1). A pesar de ser marcadores típicos para lupus eritematoso sistémico (LES), no hubo expresión clínica alguna de esta enfermedad en la paciente.
En el Instituto de Medicina Tropical Pedro Kourí (IPK) de La Habana, Cuba se realiza el examen de Reacción de Cadena de la Polimerasa (PCR) para ZIKV, con resultado positivo.
Los estudios de imagen realizados (fig) y sus correspondientes resultados se muestran en la tabla 2.
Tabla 2 Estudios de imagen y resultados
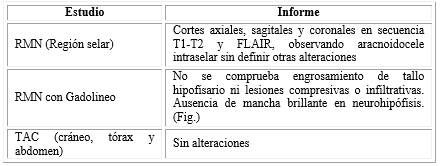
*RMN: resonancia magnética nuclear (área hipotálamo-hipofisaria). TAC: tomografía axial computarizada.
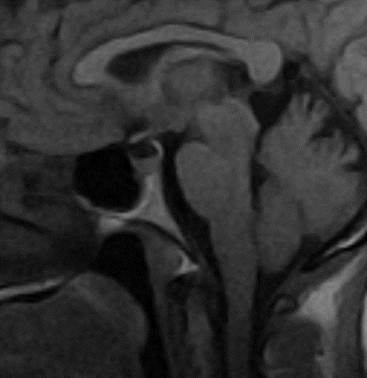
Fig Diabetes insípida central. Imagen sagital en T1 que muestra ausencia de hiperintensidad de hipófisis posterior, hipófisis anterior normal.
Se realiza la prueba de Desmopresina (4 mcg EV) logrando una caída significativa de la diuresis a 3548 mL en 24 h.
Se continúa con la utilización de spray nasal al 0,01 % de dos a tres soplos al día según la respuesta a la diuresis, con dosis inicial de 4 gotas al día: 0,2 mL=4 gotas = 20 µg, administrado en la Unidad de Cuidados Intensivos, y 1 puff nasal cada 8 h, tratamiento que se le administró en la sala, logrando un control rápido del cuadro. Evolutivamente hasta el alta médica hubo un restablecimiento a valores normales de la osmolalidad plasmática (279,7 mOsm/kg) y sodio (137 mmol/L) en el ionograma en sangre venosa y también de la diuresis con 2500 mL en 24 h. Se indica la realización de RMN de hipófisis evolutiva con Gadolineo, que mostró regresión de las alteraciones.
Se consideró que no era necesaria la realización del test de deprivación hídrica a pesar de estar descrita su utilidad diagnóstica para esta entidad, ya que el cuadro clínico de DI era claro y similar al descrito ampliamente en la literatura, lográndose una notable mejoría con la administración de Desmopresina. Además, la RMN, como prueba de oro para el diagnóstico etiológico de la DI, evidenció la ausencia de hiperintensidad en neurohipófisis, signo imaginológico sugestivo de DIC.
Discusión
La DI puede ser completa, parcial, permanente o temporal. La ADH es sintetizada en el hipotálamo; sin embargo, el lóbulo posterior hipofisario es el sitio principal de almacenamiento y liberación de esta hormona.4
La forma de inicio puede ser brusca o insidiosa. Para el diagnóstico fisiológico la prueba de privación hídrica es la mejor descrita; no obtante puede además estar apoyado en la respuesta al tratamiento con un agonista de la vasopresina, siendo la Desmopresina por vía oral, en spray endonasal o en inyección el tratamiento habitualmente prescrito también a largo plazo.16
La herramienta fundamental para determinar el diagnóstico etiológico de esta entidad es la resonancia magnética (RMN) del área hipotálamo-hipofisaria. La causa probable de la mayoría de los casos de etiología idiopática es una enfermedad autoinmunitaria donde se incluyen las hipofisitis.4
Los arbovirus pueden tener afinidad y avidez incrementada por el sistema nervioso. El mecanismo de acción de los virus neurotrópicos parece ser la replicación viral directa en el tejido cerebral, con la subsecuente destrucción neuronal, provocada también en gran medida por la acción del sistema inmune contra el virus y la subsiguiente generación de linfocitos T-CD8 autorreactivos y autoanticuerpos e inmunocomplejos que condicionan afectación al tejido cerebral. También se ha demostrado que, después de la primoinfección, el virus persiste de forma latente sobre el tejido nervioso, pudiéndose reactivar en situaciones de inmunosupresión.17
El ZIKV está relacionado con un trastorno autoinmune que ataca la mielina.15 Cuando la infección con el virus se propaga de la sangre al cerebro, las células inmunitarias T-CD8 generadas por la infección comienzan a atacar a las neuronas. Al tiempo que las células T limitan de manera notable la infección de las células nerviosas, también desencadenan la parálisis relacionada. El daño no ocurre por la infección con el virus, sino por la respuesta inmunitaria a este.18
Se maneja la posibilidad de que el ZIKV genera neurotoxicidad viral directa. Su gran neurotropismo se puede explicar no solo por la entrada y la señalización a través del receptor Axl, sino también por un mecanismo de entrada mediado por uno de sus componentes estructurales: la proteína de envoltura E.20 Esta es responsable de la fusión de las membranas viral y celular y participa en la generación de efectos citopáticos como la inducción de anormalidades en el ciclo celular, apoptosis, autofagia y reducción de la proliferación celular, con fuertes efectos citotóxicos incluyendo muerte celular. Además, esta proteína es estructuralmente similar a las de otros virus neurovirulentos, lo que pudiera explicar la generación de alteraciones similares, incluyendo la inducción de anticuerpos neutralizantes por el receptor celular del virus, como la glucoproteína de mielina del oligodendrocito, en el sistema nervioso.19,20
El componente C1q del complemento y la proteína E del ZIKV poseen propiedades biológicas similares. C1q está involucrado no solo en la inmunidad, sino también en la organización sináptica y en diferentes enfermedades autoinmunes, por lo que se ha planteado que la infección por ZIKV induce una respuesta de liberación de autoanticuerpos a C1q, pudiendo contribuir a las complicaciones neurológicas.21
El ZIKV además infecta naturalmente las células inmunes innatas, incluidas los monocitos y macrófagos, manipulando la transcripción de estos últimos a múltiples niveles. Con la supresión de la transcripción del huésped durante la infección viral aumentarían los recursos celulares disponibles para la producción viral y suprimiría las respuestas antivirales del huésped.22
No hay un tratamiento antiviral específico contra la infección por ZIKV. El tratamiento es sintomático.23
Los ANAs y específicamente anti-ADNdc poseen un rol fundamental en el diagnóstico del lupus eritematoso sistémico (LES), sin embargo la autoinmunidad contra ADNdc per se no está confinada a individuos con LES o predispuestos genéticamente a padecer esta enfermedad, pudiendo ser detectables transitoriamente en varias enfermedades infecciosas.24
Se han reportado casos de infecciones por arbovirus donde se observa positividad en las determinaciones de ANAs.y anti-ADNdc.13,25,26
Gran cantidad de observaciones experimentales y descriptivas señalan que los anticuerpos anti-ADNdc se originan por procesos celulares y moleculares comúnmente observados en respuestas inmunes T-dependientes clásicas,24 como la desencadenada por el ZIKV descrita anteriormente.
La capacidad de las proteínas estructurales de algunos virus para inducir la expresión de anticuerpos anti-ADN gracias a su capacidad inmunogénica ha sido planteada en la literatura.24 La proteína estructural E de ZIKV posee notable potencial inmunológico, con sitios capaces de desencadenar una respuesta T-dependiente, por su potencial antigénico, tanto para células B, como para el complejo principal de histocompatibilidad tipo II.27
Se ha postulado que células T específicas para ciertas partes de la proteína del complejo inmunógeno debían producirse durante la respuesta inmune, provocando la activación de células B ADN-específicas. Posteriormente estas células B estimuladas con ADN inmunogénico pueden, o bien sufrir expansión clonal y pasar a producir anticuerpos anti-ADNdc, o adquirir la capacidad de unir ADNdc como consecuencia de un proceso de maduración de la afinidad desarrollado progresivamente a lo largo de la respuesta inmune.24
En este caso se plantea que la DI desarrollada por la paciente fue de tipo central, diagnosticada de acuerdo a los criterios de poliuria (13050 mL de orina en 24 h), polidipsia, hipernatremia (Na sérico 146,8 mmol/L), osmolalidad plasmática de 304,62 mOsm/kg, producción de orina diluida con densidad de 1006 y osmolalidad urinaria de 149 mOsm/kg. Además, por los hallazgos en la RMN, el resultado positivo del Test de Desmopresina y la corrección y restauración a valores normales en los exámenes complementarios en respuesta al tratamiento con Desmopresina.
El suplemento de Desmopresina en spray nasal solo fue necesario por 4 meses, con disminución paulatina de la dosis hasta su total suspensión. Por tanto, se pudo definir como una DIC transitoria.
La paciente desarrolló una DIC como fenómeno autoinmune de carácter transitorio secundario a la respuesta inmunológica ante la infección por el ZIKV que, por las características ya descritas, puede elevar títulos de anticuerpos anti-ADNdc. A pesar de ser estos marcadores típicos de LES, la paciente no cumple con los criterios de diagnóstico clínico, ni presenta antecedentes familiares a propósito de la enfermedad. Sin embargo, no se excluye la posibilidad de que esta sea la antesala de un trastorno autoinmune, por lo que se hace necesario el monitoreo en esta paciente de la cinética de expresión de los anticuerpos del panel disponible en nuestro país, por el riesgo de instauración de una enfermedad autoinmune, incluido un LES, frente a otro evento desencadenante de naturaleza viral.
Se postula que la DIC fue resultado de una hipofisitis autoinmune, específicamente INH, ya que no hubo evidencias de alteración funcional en adenohipófisis. Además, este es un proceso poco habitual que se ha postulado ser de origen autoinmune, cuyo cuadro clínico principal es la DIC y que ocurre habitualmente después de la quinta década de la vida con predominio del sexo femenino;9 unido a los resultados de la RMN que, a pesar de no evidenciar engrosamiento del tallo hipofisario, sí constató la ausencia de la mancha brillante en neurohipófisis, signo imaginológico sugestivo de DIC y uno de los presentes con más frecuencia en la INH. Sin embargo, no es posible determinar con certeza la ocurrencia de esta entidad, por la no disponibilidad en nuestro país de reactivos para la detección de anticuerpos antihipofisarios, en la práctica clínica. Además, no se realizó toma de muestra para diagnóstico histopatológico que es el descrito como definitivo.28
En cuanto al tratamiento indicado en este caso, se decidió no usar corticoides ya que poseen un papel controversial, hecho demostrado en la literatura por resultados contradictorios. También está descrito que el manejo de la INH es el mismo de la DIC, con un agonista de la ADH, ya que la gran mayoría de las INH son autolimitadas y no es necesario el uso de corticoides.9
Otras virosis han sido asociadas a la ocurrencia de DI: parotiditis,29 infección por virus linfotrópico de las células T humanas tipo I (HTLV-I) por sus siglas en inglés30 e infección por Dengue,31 este último, como el ZIKV, es un arbovirus del género Flavivirus de la familia Flaviviridae. Sin embargo, los autores no tienen conocimiento de que haya sido reportado algún caso anterior a propósito de la asociación de DI con ZIKV en la literatura nacional e internacional consultada en: PubMed, MedLine, SciElo, BMC, Elsevier, Redalyc, Scopus, Web of Science, Neurologia.com, Asociación Colombiana de Radiología (ACR), IntraMed, JAMA Neurology, Manuales MSD.
Al analizar otras posibilidades de DI, se descartaron las causas nefrogénicas, ya que la paciente mantiene función renal conservada, no existen antecedentes de enfermedad renal infiltrativa o granulomatosa ni de utilización de drogas nefrotóxicas, ni antecedentes familiares que puedan sugerirlas.
Se propone el enfoque de que el Zika, virosis que se ha hecho relativamente frecuente y catalogada como leve, puede tener consecuencias neurológicas posinfecciosas devenidas en una enfermedad endocrina. Es necesario un alto grado de sospecha clínica para establecer el diagnóstico certero y oportuno de DI como causa de poliuria, frecuentemente no considerada. Se plantea que la paciente desarrolló una hipofisitis autoinmunitaria, que devino DIC como expresión de un fenómeno autoinmune de carácter transitorio secundario a la respuesta inmunológica ante la infección por el ZIKV, basado en su potencial neurotrópico y capacidad para expresar marcadores de autoinmunidad anti-ADNdc positivos en la paciente.