Introducción
El ovario cumple una función reproductiva y una función hormonal, con los objetivos de la generación de un óvulo capaz de ser fertilizado y la preparación del endometrio para la implantación, lo cual se complementa armoniosamente para lograr la conservación de la especie.1
El folículo ovárico constituye la unidad funcional fundamental del ovario.2) Las mujeres tienen un número finito de folículos primordiales que constituyen la reserva ovárica, la cual va disminuyendo con la edad, así como su función reproductiva. Si bien la edad promedio de la menopausia es de 51 años hay una gran variabilidad individual; para una mujer sería de gran utilidad poder predecirla unos años antes de que esta ocurra y cese por completo su capacidad reproductiva. Varias son las pruebas que se utilizan para evaluar la reserva ovárica: hormona folículo estimulante (FSH), Inhibina B, Estradiol (E2) y recuento de folículos antrales (RFA), pero ninguna de ellas se modifica con tanto tiempo de anticipación.2
La hormona antimülleriana (AMH) es producida por las células granulosas de los folículos preantrales (primarios y secundarios) y antrales pequeños. Al expresarse exclusivamente en las células granulosas de los folículos no seleccionados se convierte en un candidato ideal para representar tanto la cantidad como la calidad de la reserva de folículos ováricos.2,3
Se ha demostrado que los niveles séricos de AMH decrecen a lo largo del tiempo en mujeres normo-ovuladoras, inclusive cuando el patrón menstrual todavía es regular, identificando a las mujeres que se encuentran en el estadio tardío de su edad reproductiva.2,3
La medición de la AMH sérica es de gran utilidad para las mujeres que realizan tratamientos de fertilidad ya que el envejecimiento ovárico produce una baja respuesta a la administración exógena de gonadotropinas y una baja tasa de embarazo.4
La fertilización in vitro (FIV) se considera una de las técnicas más complejas en el ámbito de la reproducción asistida. Gran parte del éxito de estas técnicas depende de una adecuada valoración inicial de la reserva ovárica y del desarrollo de protocolos de estimulación individualizados, con el fin de optimizar los resultados reproductivos.5
Desde hace más de una década se han publicado estudios prospectivos y retrospectivos que analizan la utilidad de la AMH y como sus niveles se relacionan como marcador de la reserva ovárica, intentando encontrar en ella un método fácil y seguro para predecir este potencial. La mayoría de los estudios publicados coinciden en que la AMH es un buen marcador de reserva ovárica. Varios estudios consideran a la AMH como un buen predictor de respuesta ante tratamientos de inducción de la ovulación. La han relacionado con calidad y número de ovocitos aspirados y en algunos casos como predictor de embarazo por ciclo estimulado.6
Las ventajas de la AMH sobre otros marcadores de reserva ovárica incluyen su cambio precoz con la edad, su menor ciclicidad, y la posibilidad de medirla en cualquier momento del ciclo menstrual, lo cual permite un mejor manejo de las pacientes con trastornos de la fertilidad.
El objetivo de esta investigación fue evaluar los niveles de la hormona antimülleriana como marcador de respuesta ovárica en pacientes tratadas por fertilización in vitro.
Método
Se realizó un estudio descriptivo, observacional y de corte transversal en la consulta protocolizada de Reproducción Asistida del servicio de Endocrinología del Hospital Clínico Quirúrgico ¨Hermanos Ameijeiras¨ en el periodo abril 2017 hasta abril 2019.
El universo se constituyó por pacientes con diagnóstico de infertilidad candidatas a reproducción asistida de alta tecnología. La muestra fue de 137 pacientes que cumplieron con los criterios de inclusión y exclusión.
Los criterios de inclusión que se tomaron en cuenta fueron: mujeres en edad reproductiva, la presencia de al menos un ovario y la firma del consentimiento informado. Como criterios de exclusión: pacientes que presenten efectos adversos a los medicamentos inductores de la ovulación, aquellas que no respondan a la inducción de la ovulación, pacientes que presenten enfermedades de transmisión sexual, genéticas, malignas, degenerativas o caquectizantes, y parejas con infertilidad relacionada a factor masculino.
Para la recogida de datos se realizó una entrevista médico-clínica, donde fueron indicados y luego evaluados, los resultados bioquímicos y ultrasonográficos. Los estudios hormonales para determinar los valores de la AMH, la FSH, LH, y E2, fueron realizados mediante el método inmunorradiométrico (IRMA). En los estudios de imágenes se contabilizó el número de folículos ováricos en ambos ovarios al segundo día por ultrasonografía transvaginal en equipo ALOKA con transductor transvaginal 5 MHz. Para clasificar la respuesta ovárica de las pacientes se tomó en cuenta tres de los criterios de Bologna, estos son, la edad, RFA y los valores de la AMH.
Se tomaron datos del Laboratorio de Reproducción Asistida relacionados con la calidad ovocitaria y embrionaria. Todos los resultados se recogieron en una planilla de recolección de datos creada para al efecto y, posteriormente, se rellenó una base de datos en formato Excel para su análisis.
Se confeccionaron tablas de distribución de frecuencias, a las que se les aplicaron métodos estadísticos mediante el programa Statistical Page for Social Sciences (SPSS) y medidas de resumen para variables descriptivas, media, desviación estándar y porcentaje de acuerdo al tipo de variable. Se emplearon técnicas de estadística descriptiva como el promedio y la desviación estándar, y técnicas de estadística inferencial como el test Chi cuadrado para verificar asociación significativa entre las variables involucradas; el nivel de significación empleado fue del 5 % (p ˂ 0,05).
Resultados
El grupo etario más frecuente en nuestro estudio fue el comprendido entre 31 a 35 años para un 46,0 %, seguido de las menores de 31 años para un 27,0 %. (Fig. 1). La edad promedio de las pacientes en estudio fue de 33,1 ± 7,4 años.
En la relación entre los niveles de AMH y la edad de las pacientes predominaron las mujeres con AMH dentro de los rangos normales para un 48,2 %; dentro de esta categoría se observó que a medida que aumentaba la edad, disminuían los niveles de dicha hormona (tabla 1).
Tabla 1 Niveles de la hormona antimülleriana respecto a la edad
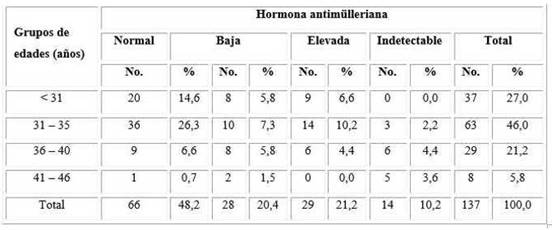
Fuente: Historias clínicas. X2 = 38,70; p = 0,0000 ˂ 0,05
Los resultados de la tabla 2 muestran una asociación estadísticamente significativa entre la AMH y la FSH. Se observaron rangos normales de la FSH en el 70,8 % de los casos, sobre todo en las mujeres con rango normal de AHM para un 39,4 %, le siguieron las pacientes con FSH elevado para un 18,2 % y con rango bajo para AMH un 10,9 %.
En la relación entre los niveles de la AMH y RFA, se observó que predominaron las pacientes con recuento normal (46,7 %) y con rango normal de la AMH para un 24,1 %, le siguieron las pacientes con recuento elevado de folículos antrales en el 23,4 % de los casos, donde también se comprobó un nivel predominantemente normal de la AMH para un 16,8 %, resultados que fueron estadísticamente significativos (Fig. 2).
Tabla 2 Niveles de la hormona antimülleriana y la hormona folículo estimulante

Fuente: Historias clínicas. X2 = 36,45; p = 0,00000˂ 0,05
Se realizó una asociación entre los resultados del RFA y la edad (Fig. 3), observándose que predominaron las pacientes con recuento bajo de folículos antrales (46,7 %), sobre todo en las edades entre 31 a 35 años (27,7 %). Aquí se demuestra la relación predominantemente inversa y proporcional entre el RFA y la edad, pues a medida que aumenta la edad, disminuye el RFA.

Fuente: Historias clínicas. X2 = 53,83, p = 0,0000 ˂ 0,05
Fig. 3 Resultados del recuento de folículos antrales y la edad.
En cuanto a la relación entre la calidad ovocitaria y los niveles de la AMH (Fig. 4), resultó que predominaron las pacientes con buena calidad ovocitaria (66,4 %), donde fueron superiores las de rango normal de la AMH para un 39,4 %. En el caso de las que presentaron mala calidad ovocitaria (33,6 %), fueron más frecuentes las indetectables para un 9,5 %. Se comprobó que la calidad ovocitaria se asoció significativamente (p = 0,0000 ˂ 0,05) a los niveles de la AMH.

Fuente: Historias clínicas. X2 = 29,49, p = 0,0000 ˂ 0,05
Fig. 4 Niveles de la hormona antimülleriana y calidad ovocitaria (metafase I y metafase II).
En las pacientes con niveles plasmáticos normales de AMH predominó la buena calidad embrionaria (36,5 %). Del total de pacientes a las cuales no se les detectó niveles plasmáticos de la AMH, 10,2 %.tenían mala calidad embrionaria La calidad embrionaria se asoció significativamente con los niveles de la AMH (Fig. 5).
Se realizó un análisis de las pacientes según los criterios de Bologna para así clasificarlas en normorrespondedoras o no normorrespondedoras (tabla 3), aquí se incluyeron tanto aquellas con baja respuesta como las que tuvieron una respuesta exagerada.
Discusión
El grupo etario más frecuente fue el comprendido entre 31 a 35 años, para un 46.0 %. La influencia de la edad sobre la reserva ovárica ha sido ampliamente estudiada y se ha demostrado la disminución del número de folículos, la alteración de la calidad ovocitaria y la disminución de la tasa de implantación secundaria al envejecimiento ovárico.
Los resultados del presente estudio nos muestran que la edad de las pacientes candidatas a FIV influyó significativamente en los niveles de la AMH, siendo así que, a medida que aumentaba la edad se registró una disminución en los niveles de la AMH.
Estos resultados son concordantes con un estudio realizado por De Vet y otros7 en relación con la edad y a los niveles séricos de AMH y con el RFA, se observó que ambos parámetros disminuían a medida que aumentaba la edad de las mujeres. Sowers y otros relacionaron la AMH con la edad de la menopausia.8
En cuanto a la asociación de la AMH y la FSH, donde se demostró una relación inversamente proporcional entre estos parámetros, Hehenkamp y otros9 estudiaron los niveles de FSH, LH, E2 y AMH a lo largo de un ciclo menstrual de 44 mujeres. Las variaciones de AMH en un ciclo menstrual normal son mínimas, por lo tanto, una sola medida de AMH en cualquier momento del ciclo es válida para estudiar la actividad ovárica.
La FSH basal, la edad materna, la Inhibina B, el número de folículos antrales y el volumen ovárico han demostrado ser predictores de respuesta ovárica.7,10,11 Sin embargo, ninguno de estos parámetros son predictores realmente confiables, los trabajos son controvertidos y no se han obtenido aún conclusiones significativas acerca de sus valores en cuanto a otros parámetros como la calidad ovocitaria o la tasa de embarazo total.7,12,13,14
En la relación de la AMH y RFA, a medida que disminuía la hormona se observó una reducción estadísticamente significativa del recuento folicular. Resultados similares a los de nuestro estudio obtuvieron Unger y otros,15 quienes señalaron que el capital folicular puede cuantificarse especialmente por la AMH.
Se observó una importante correlación inversa entre la edad de las pacientes y el RFA, a la vez que se constató una correlación inversa muy pronunciada entre la edad y la recuperación de ovocitos.15,16
Unger y otros15 observaron una correlación con la edad de las pacientes con una mediana de edad de 33 años; en ellas se recuperaron mayor cantidad de ovocitos. Así, se puede concluir que a mayor edad, menor es el RFA y menor la cantidad de ovocitos recuperados. Según la literatura revisada, la reserva ovárica cuantitativa se encuentra en relación con la edad cronológica de la mujer. Esto coincide con lo expuesto por Scheffer y otros16 que afirman que la edad cronológica puede predecirse según el número de folículos antrales en mujeres fértiles, pero que esto no es posible en aquellas con trastornos de la fertilidad, señalamiento que coincide también con otros estudios.17
Natalia Cano y otros18 publicaron un estudio donde de las 71 pacientes que fueron aspiradas, 65 tenían ovocitos maduros en metafase II, coincidiendo los valores más altos de AMH con un mayor número de ovocitos maduros. Los resultados obtenidos en esta tesis muestran una asociación significativa entre los niveles de AMH y la calidad de ovocitos en concordancia con la mayoría de los trabajos publicados, que reportaron correlaciones variables de 0,33 a 0,80,19 excepto un estudio en el que AMH correlacionó −aunque débilmente− con el número de OR (r = 0,32; p < 0,0001), pero no lo hizo con la tasa de ovocitos maduros.20
En relación con los resultados de la figura 5, donde se asoció significativamente los niveles normales de AMH con una buena calidad embrionaria, y se resaltó que en aquellas pacientes con niveles indetectables de dicha hormona tuvieron una mala calidad embrionaria, se puede concluir que la AMH puede sugerirse como un marcador de la calidad embrionaria. Este ha sido el primer estudio en donde se comparan estos dos parámetros.
Al analizar los resultados obtenidos de la clasificación de la respuesta ovárica podemos argumentar que según un estudio realizado por Salvador Godoy y otros,21) la AMH se correlacionó mejor que la edad con respecto al número de ovocitos recuperados. Es posible, por lo tanto, que las concentraciones basales de AMH reflejen la cantidad de folículos antrales existentes y, de esta forma, pueda representar un marcador confiable del número de ovocitos que serán recuperados después de la estimulación ovárica. Recientemente, Lekamge y otros14 publicaron un trabajo en el cual consideran a la AMH como el marcador reproductivo más fuerte, hecho que se reafirma con el presente estudio.
Las concentraciones séricas de la hormona antimülleriana fueron menores a medida que aumentaba la edad. Los valores normales de la hormona antimülleriana se asociaron con valores normales de hormona folículo estimulante, el recuento de los folículos antrales y la buena calidad ovocitaria. Predominó la buena calidad embrionaria con los niveles normales de hormona antimülleriana. La hormona antimülleriana es un marcador endocrino de la respuesta ovárica para pacientes candidatas a fertilización in vitro.



















