Introducción
El síndrome de ovario poliquístico (SOP) es un trastorno con fuerte implicación reproductiva, pero también metabólica. Sin embargo, es común que las mujeres en edad fértil con SOP tiendan a enfocar su prioridad en la dificultad para lograr la concepción, sin tener en cuenta que durante el curso de su vida están presentes una serie de factores de riesgo metabólicos que es importante identificar y controlar para mejorar su salud reproductiva, materna, y calidad de vida a largo plazo.1,2,3
Son conocidos los múltiples factores de riesgo cardiovasculares clásicos y no clásicos que se asocian al SOP.1,2,3 Entre los más importantes están: la obesidad abdominal, la hipertensión arterial (HTA), la resistencia a la insulina, los trastornos en el metabolismo de la glucosa y dislipidemia (DLP), además de valores elevados de proteína C reactiva (PCR), factor inhibidor del activador del plasminógeno (PAI-1), homocisteína, entre otros.1,2,3 Se estima que el 70 % de estas mujeres tienen al menos una de las alteraciones lipídicas de acuerdo con los criterios de la ATPIII;3,4 con predominio de hipertrigliceridemia, concentraciones bajas de colesterol de lipoproteínas de alta densidad (HDL-c) y altas de colesterol de lipoproteínas de baja densidad (LDL-c) o muy baja densidad (VLDL) ambas con alto poder aterogénico, esto se debe principalmente a que la resistencia a la insulina deteriora la capacidad de la insulina para suprimir la lipólisis, lo que aumenta la movilización de los ácidos grasos libres del tejido adiposo. Este patrón es similar al encontrado en sujetos con diabetes,5 por lo que en este grupo de pacientes el riesgo de desarrollar alteraciones en el metabolismo de la glucosa y enfermedad cardiovascular debe tenerse presente.5
Son múltiples los indicadores que se han empleado en la clínica para identificar riesgo cardiometabólico. El fenotipo hipertrigliceridemia-obesidad abdominal (FHGOA) ha sido el binomio más estudiado de los componentes del síndrome metabólico (SM) y se ha reafirmado como predictor de riesgo cardiovascular, mediante su asociación con alteraciones metabólicas, entre las que figuran: la alteración del perfil de lípidos, la hipertensión arterial (HTA), la diabetes tipo 2 (DM2) y la resistencia a la insulina.6,7,8,9 El FHGOA también se ha reconocido como una herramienta que apoya la detección sencilla y más económica de estas enfermedades.6,7,8,9
Particularmente en las mujeres con SOP, la importancia de incorporar este indicador en su manejo clínico radica en la necesidad de disponer de una herramienta de fácil acceso, que permita tener un alto índice de sospecha para identificar alteraciones metabólicas y cardiovasculares y prevenir su progresión; razón por la cual se realizó esta investigación, con el objetivo de identificar la frecuencia del FHGOA en mujeres con SOP y su asociación con la resistencia a la insulina, trastornos del metabolismo de la glucosa y ateroesclerosis subclínica (AS).
Métodos
Se realizó un estudio transversal, en el que participaron 30 pacientes con SOP, entre los 40 y 59 años, atendidas en consulta del Instituto de Endocrinología. Se excluyeron las que tenían otras causas de hiperandrogenismo y factores que favorecían la aparición de enfermedad cardiovascular temprana (ooforectomía, diabetes mellitus con más de 10 años de evolución, obesidad ≥ 40 kg∕m2, dislipidemia primaria, antecedentes patológicos familiares de cardiopatía isquémica temprana no asociada a SOP).
El fenotipo hipertrigliceridemia-obesidad abdominal (FHGOA) se definió como la presencia de triglicéridos ≥ 1,7 mmol/L (150 mg/dL) o tratamiento para esta dislipidemia7) y una circunferencia de cintura (CC) ≥ 80 cm.10,11
Se registraron las variables clínicas edad, peso, talla, tensión arterial, circunferencia de cintura y cadera, estado de la función ovárica, así como antecedentes patológicos personales de hipertensión arterial y trastornos del metabolismo de la glucosa. Se determinó índice de masa corporal [Peso (kg) / Talla (m2)] e índice cintura/cadera (ICC), además de las concentraciones de glucosa, lípidos (colesterol total, triglicéridos, HDL-C y LDL-C), insulina, testosterona y estradiol).
La medida de la CC se tomó con una cinta métrica con el sujeto colocado de pie, en espiración, con el abdomen relajado, tomando como referencia el punto medio entre el borde inferior de la última costilla y la espina ilíaca anterosuperior de cada lado. En el caso de abdomen péndulo la medición se realizó en el punto más prominente del abdomen. La medida de la circunferencia de la cadera se tomó con el sujeto en posición de pie, con la cinta métrica flexible totalmente horizontal rodeando la máxima protrusión de los glúteos a nivel del trocánter mayor del fémur a cada lado, que en general coincide con la sínfisis pubiana. El índice cintura/cadera (ICC) se calculó dividiendo la circunferencia de la cintura (CC) entre la circunferencia de la cadera, en centímetros.
En la medición de la tensión arterial se empleó un esfigmomanómetro con mango acorde al tamaño del brazo. Previamente, la mujer estuvo sentada en reposo durante 10 minutos. El procedimiento se realizó tres veces en el brazo derecho, con un intervalo de 5 minutos. El valor final de la TA correspondió al promedio de las tres mediciones obtenidas.
El ecocardiograma y doppler arterial se realizaron con un equipo ultrasonográfico multipropósito de alta resolución (ALOKA L-10), versión 2.0.1.420, con un transductor S5-1 y arreglo de fase de 1,3-3,6 MHz. La presencia de AS se identificó por la positividad de, al menos, un criterio de las pruebas cardiovasculares planificadas para su detección [grosor íntima-media carotídeo (GIMC) ≥ 0,9 mm o placas de ateroma, grasa epicárdica ≥ 5 mm y presencia de hipertrofia del ventrículo izquierdo].
En muestras de sangre venosa se analizaron la concentración de glucosa en ayunas y el perfil lipídico, medidos en un analizador automático con el empleo de métodos enzimáticos. Las concentraciones de insulina, testosterona y estradiol se determinaron por un método inmunoradiométrico (IRMA). El índice de resistencia a la insulina según el modelo homeostático (HOMA-IR) (insulina en ayunas μU/mL x glucosa en ayunas mmol]/L /22,5) se consideró positivo con valores ≥ 2,6.12
Análisis estadístico
Para los cálculos estadísticos se utilizó el programa SPSS versión 19 para Windows. Se realizó un análisis descriptivo de la muestra expresando las variables en sus respectivas medidas de resumen: las cualitativas en cifras relativas y absolutas (números y por cientos), y las cuantitativas, en sus medidas de posición y dispersión (media y desviación estándar). En cuanto a las variables cualitativas o categóricas, se usó la prueba exacta de Fisher. Se empleó la prueba U de Mann-Whitney para la comparación de las características clínicas y bioquímicas entre las personas con y sin presencia del FHGOA.
El grado de concordancia diagnóstica entre el FHGOA y algunas variables clínicas y bioquímicas estudiadas se calculó mediante el coeficiente Kappa (k) de Cohen. La interpretación del coeficiente Kappa se realizó correlacionando su valor con una escala cualitativa que incluye seis niveles de fuerza de concordancia propuestos por Landis y Koch,13 en los que, si es menor o igual a 0,00 se considera que hay una pobre concordancia, entre 0,01-0,20 la concordancia es leve, entre 0,21-0,40 es aceptable, entre 0,41-0,60 es moderada, entre 0,61-0,80 es considerable, y entre 0,81-1,00 se considera casi perfecta.
En todos los casos se trabajó para un nivel de confianza del 95 %, considerando que existió significación estadística cuando p < 0,05.
Resultados
De las 30 mujeres con SOP incluidas en el estudio, la mayoría tenía entre 40 y 44 años de edad, más de la mitad eran obesas (53,3 %) y el 80 % mostró obesidad abdominal (CC ≥ 80 cm). El 60,0 % y 43,3 % presentó hipercolesterolemia e hipertrigliceridemia, respectivamente. La presencia de dislipidemia mixta se observó en el 70 % de las mujeres con SOP estudiadas; la frecuencia del FHGOA fue de 43,3 %, el 30 % presentó trastorno del metabolismo de la glucosa (glucosa alterada en ayunas o diabetes mellitus tipo 2) y el 26,7 % tuvo hipertensión arterial (tabla 1).
Tabla 1 Características generales de las pacientes con SOP
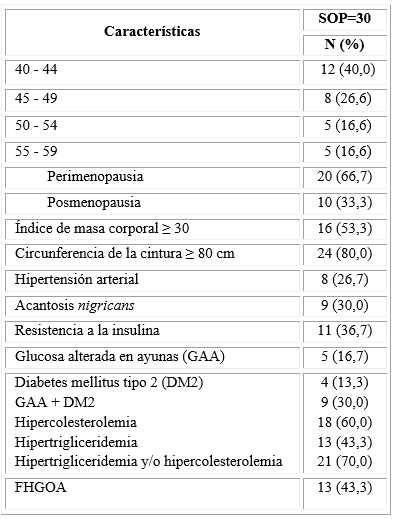
SOP: Síndrome de ovario poliquístico
FHGOA: Fenotipo hipertrigliceridemia-obesidad abdominal
Dentro de las características clínico-antropométricas analizadas en las pacientes con SOP, se encontró que aquellas con el FHGOA tuvieron mayor medida de la circunferencia de la cintura que aquellas sin el fenotipo, (99,88 ± 15,32 vs. 87,44 ± 15,19), pero sin diferencias estadísticas significativas entre ambos grupos (p = 0,059) (tabla 2).
Tabla 2 Relación del FHGOA con las características clínicas en las mujeres con SOP
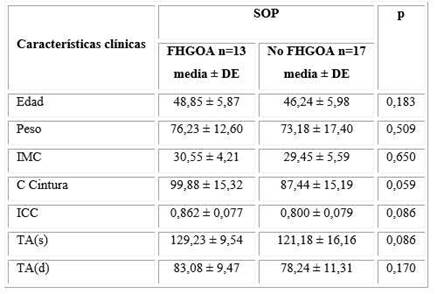
SOP: Síndrome de ovario poliquístico; FHGOA: Fenotipo hipertrigliceridemia-obesidad abdominal; DE: Desviación estándar
IMC: Índice de masa corporal; C: Circunferencia; TA: Tensión arterial; s: Sistólica; d: Diastólica;
Se identificó que las mujeres con el fenotipo estudiado tuvieron valores medios más elevados de insulinemia, HOMA-IR, y cifras de glucemia en ayunas compatibles con trastornos del metabolismo de la glucosa (GAA y DM2) que aquellas sin el fenotipo (tabla 3).
Tabla 3 Relación entre la presencia o no del FHGOA y variables bioquímicas y hormonales en mujeres con SOP
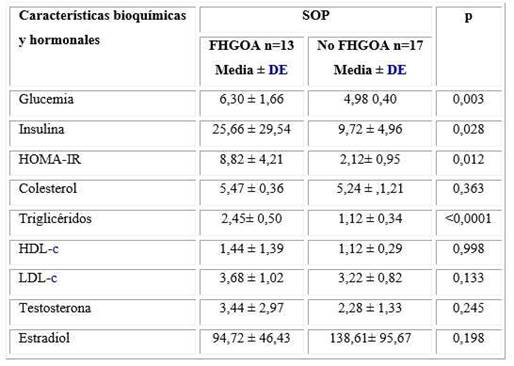
SOP: Síndrome de ovarios poliquístico; FHGOA: Fenotipo hipertrigliceridemia-obesidad abdominal; DE: Desviación estándar; HDL-c: Colesterol de lipoproteínas de alta densidad; LDL-c: Colesterol de lipoproteínas de baja densidad.
A pesar de que no hubo diferencias significativas en los resultados de las pruebas diagnósticas cardiovasculares realizadas para identificar ateroesclerosis subclínica, las pacientes con SOP y FHGOA tuvieron una frecuencia modestamente superior en la positividad de las pruebas diagnósticas realizadas cuando se compara con las que no tienen el fenotipo (tabla 4).
Tabla 4 Relación entre la presencia del FHGOA y signos de aterosclerosis subclínica en mujeres con SOP
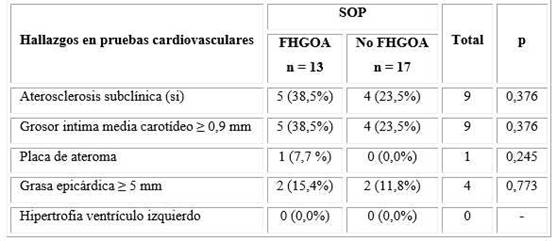
SOP: Síndrome de ovario poliquístico; FHGOA: Fenotipo hipertrigliceridemia-obesidad abdominal.
Al analizar la frecuencia y concordancia del fenotipo en las mujeres con SOP, se identificó que la presencia del FHGOA ofrece un grado de concordancia adecuado (moderado) con los trastornos del metabolismo de la glucosa (glucosa alterada en ayunas y diabetes mellitus tipo 2), dislipidemia (hipertrigliceridemia y/o hipercolesterolemia) y de resistencia a la insulina (tabla 5), así como aceptable con la DM2 y la obesidad abdominal (0,335 y 0,321, respectivamente) (tabla 5). En síntesis, las mujeres con SOP y FHGOA presentaron una mayor frecuencia de resistencia a la insulina, disglucemia y otros trastornos lipídicos, que aquellas sin el FHGOA (tabla 5).
Tabla 5 Frecuencia y concordancia diagnóstica entre algunas variables clínicas y bioquímicas con la presencia del FHGOA en mujeres con SOP
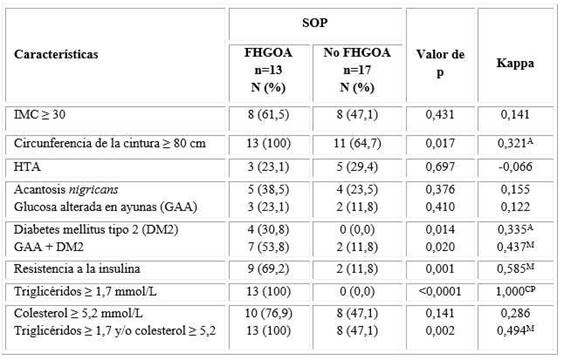
SOP: Síndrome de ovario poliquístico; FHGOA: Fenotipo hipertrigliceridemia-obesidad abdominal;
IMC: Índice de masa corporal; HTA: Hipertensión arterial. CP: Concordancia casi perfecta; M: Concordancia moderada;
A: Concordancia aceptable
Discusión
El empleo de herramientas clínicas y exámenes de laboratorio utilizados en la práctica para identificar riesgo metabólico y cardiovascular tiene como dificultad fundamental la falta de consenso sobre cuáles son el conjunto de elementos que uniformemente se pueden considerar para identificar la población de riesgo cardiometabólico.
Desde 1998, la Organización Mundial de la Salud estandarizó los criterios para definir el SM, utilizados para identificar sujetos con alto riesgo metabólico y cardiovascular.14) Posterior a ello, múltiples organizaciones internacionales realizaron modificaciones de estos criterios, lo que conllevó a perder la homogeneidad con los preestablecidos inicialmente y, por ende, la comparabilidad de los resultados de las investigaciones al respecto. En el 2009, publicado como Joint Interin Statement (JIS),10 un grupo de expertos concluyó que la circunferencia de la cintura debía ser individualizada a grupos étnicos y zonas geográficas, por lo que quedaría determinado para América Latina y el Caribe ≥ 80 cm como punto de corte de riesgo para la mujer y ≥ 90 cm para el hombre. Recientemente Díaz Díaz y otros confirmaron valores similares para el punto de corte de la circunferencia de la cintura en la población cubana.11
Es conocido que el acúmulo de grasa abdominal puede ser el resultado de un aumento del tejido adiposo visceral o subcutáneo, pero con un comportamiento metabólico diferente. El incremento de grasa visceral se encuentra directamente asociado a un aumento de alteraciones metabólicas, por lo que surge de esta forma el binomio que combina la anomalía estructural y funcional del tejido adiposo, conformando el conocido fenotipo hipertrigliceridemia-cintura alterada. Su utilidad se puso de manifiesto hace algunos años por Lemieux como herramienta de pesquisa para identificar enfermedad cardiovascular (ECV), diabetes tipo 2 y otras alteraciones metabólicas que probablemente tengan estos sujetos con obesidad abdominal, como elevación del cociente colesterol / HDL-c, hiperlipidemia posprandial e hiperinsulinemia, triada potencialmente aterogénica.6,7,8,9
Los resultados de las investigaciones encaminadas a determinar mortalidad cardiovascular e incidencia de eventos cardiovasculares en mujeres con SOP son contradictorios. Estudios como el Women’s Ischemia Syndrome Evaluation study (15) y el realizado por Shaw LJ y otros,16 refieren mayor frecuencia de enfermedad y eventos cardiovasculares en mujeres con SOP en etapa posmenopáusica y el hallazgo más significativo en el Nurse’s Health Study17 fue que las mujeres con ciclos menstruales más irregulares tenían un mayor riesgo de ECV fatal en comparación con aquellas con ciclos regulares (riesgo relativo [RR] = 1,88). Un metanálisis de 73 estudios de cohorte indicó que el riesgo relativo de sufrir una angina o infarto de miocardio es de 2,02 y 1,5 más en las mujeres con SOP vs. controles respectivamente, tras ajuste por IMC.
En contraste con lo citado, otras investigaciones no reportan una asociación significativa entre ECV y SOP, tales son los estudios de Pierpoint T y otros18 y el de Elting MW y otros,19 quienes no alcanzaron diferencias estadísticas en cuanto a la presencia de síntomas cardíacos, al comparar con controles. Lo antes documentado, evidencia que aún no se ha podido demostrar una asociación uniforme entre SOP y ECV a pesar de que las mujeres con SOP muestran una elevada prevalencia de factores de riesgo.
Los resultados de este estudio muestran que la presencia del fenotipo hipertrigliceridemia-obesidad abdominal (FHGOA) en mujeres con SOP fue similar a la encontrada por Fermín y otros.5 Se identificó, además, que la frecuencia de la mayoría de las características estudiadas coincide con la de varios estudios en cuanto a la presencia de obesidad,3,20 glucosa alterada en ayunas,20 diabetes tipo 2,3 disglucemia (GAA + DM2),21 hipertrigliceridemia y/o hipercolesterolemia;3,5 no así en relación con la frecuencia de hipertensión arterial y obesidad abdominal, que fue superior a lo reportado por otros autores, 5,20,22 en contraste con la acantosis nigricans que fue inferior a los resultados de Jiménez y otros21 y, de igual forma, la resistencia a la insulina se presentó en menor frecuencia a lo informado por Fermín y otros.
Al comparar las características clínicas entre las mujeres con SOP, de acuerdo con la presencia o no del FHGOA, no se encontró variable en particular que diferenciara la presencia del fenotipo. Sin embargo, en la comparación de las características bioquímicas en estas mujeres con SOP de acuerdo con la presencia del FHGOA, se encontró que tenían cifras superiores de glucemia, insulinemia y del índice HOMA-IR en comparación con aquellas sin el fenotipo.
En la literatura revisada no se encontraron referencias al respecto en mujeres con SOP y el FHGOA. Aunque, un estudio en mujeres con SOP mostró que los triglicéridos se pueden usar como un marcador útil para la resistencia a la insulina en estas mujeres, especialmente en las obesas.23 No obstante, estudios realizados en personas sin SOP y que evalúan variables similares (glucemia, insulinemia e índice HOMA-IR) encuentran valores más elevados de estas en las personas que presentan el FHGOA.24,25,26,27,28)
Hernández Rodríguez explica por qué la presencia de obesidad abdominal e hipertrigliceridemia están siendo útiles para identificar riesgo metabólico y vascular. Según este autor, esto se debe a que el exceso de ácidos grasos en el adipocito desencadena procesos oxidativos locales, ampliando el estrés oxidativo celular, seguido del reclutamiento de células inmunológicas desde la periferia hacia el tejido adiposo, lo que inicia un proceso inflamatorio local; (4,29 procesos que no son capaces de conducir a la pérdida funcional de los tejidos ni lesionarlos, pero sí tienen una estrecha relación con el desarrollo de enfermedades cardiometabólicas y el daño endotelial.29
Esta base teórica se corresponde con los resultados reportados por Vaverková, (30 donde tanto hombres como mujeres con el FHGOA tuvieron un mayor perfil aterogénico, incremento de los marcadores de resistencia a la insulina (insulinemia en ayunas y HOMA- IR), marcadores proinflamatorios (TNF-α, IL-6, IL-1ß) al compararlos con aquellos sin el fenotipo. Resultados similares se obtuvieron en este estudio en el grupo de mujeres con SOP y FHGOA, donde los valores medios de insulinemia y HOMA-IR fueron superiores. Estos resultados permiten sugerir que el FHGOA pudiera ser utilizado, además, como indicador de resistencia a la insulina.24
A pesar de que la mayoría de los estudios revisados utilizan diferentes puntos de corte de la circunferencia de la cintura y de triglicéridos para identificar el fenotipo, la mayoría coincide en que es un potente predictor para identificar trastornos metabólicos y cardiovasculares.10,11,24Janghorbani y Amin utilizaron como criterios para identificar el fenotipo puntos de corte de CC ≥ 88 cm para la mujer y ≥ 102 cm en el hombre, y encontraron que los sujetos con el FHGOA tuvieron 2,4 veces más probabilidad de desarrollar diabetes mellitus tipo 2.27
Por otra parte, el grupo de Leblanc utilizó criterios similares a los de este estudio para identificar el fenotipo,28 y concluyó que el FHGOA puede ser útil como un marcador independiente de riesgo vascular, ya que el 61,9 % de los sujetos con el fenotipo tuvieron signos de ateroesclerosis subclínica y el 50,1 % de ellos presentó placas de ateroma, además de mayor grosor de la íntima media de la carótida (p = 0,014). Sin embargo, en esta investigación no se encontró una mayor frecuencia de signos de aterosclerosis subclínica en las mujeres con SOP y FHGOA.
De igual forma, Tanko,31 luego de seguir por 8 años a un grupo de mujeres posmenopáusicas, con el propósito de identificar la utilidad relativa del FHGOA para estimar riesgo de muerte de origen cardiovascular en comparación con los criterios de SM, concluyó que el riesgo de sufrir eventos cardiovasculares fatales se asoció 4,7 veces más en mujeres con el fenotipo (95 % CI 2,2 a 9,8; p = 0,001) al compararlo con un incremento de 3,2 veces más en aquellas con componentes del síndrome metabólico; los autores llegaron a la conclusión que la presencia del fenotipo pudiera ser el mejor indicador de riesgo cardiovascular en la mujer posmenopáusica.
Son conocidas la sensibilidad y especificidad de la TAC y la RMN para identificar grasa visceral; basado en esto Sam32 las utilizó con este fin, y encontró que los sujetos con diabetes y FHGOA tuvieron mayor calcio coronario comparados con aquellos sin el fenotipo (p = 0,0001).
La mayor parte de la literatura que estudia mujeres con SOP evalúa la influencia de la obesidad y/o el hiperandrogenismo sobre el deterioro del perfil metabólico y cardiovascular,33,34 pero hasta el momento que se hizo la revisión bibliográfica para este estudio, las evidencias acerca del uso del fenotipo FHGOA en mujeres con SOP con este propósito, son escasas.
En Cuba son pocos los estudios que han buscado la relación del SOP con la ECV, por lo que la utilidad de una herramienta simple en este grupo de mujeres es necesaria. Carmenate35 y otros, encontraron que el 46,6 % de las pacientes con SOP tuvieron signos de ateroesclerosis subclínica vs. 16,6 % en el grupo control y, además, encontraron diferencias significativas en los valores medios de glucemia [5,2 vs. 4,65 mmol/L, (p = 0,009)], triglicéridos [1,5 vs. 1,15 mmol/L (p = 0,010)], insulinemia (10,47 vs. 6,55 mUi/L, p = 0,009) a favor de este grupo de mujeres.
En correspondencia con lo anterior, esta investigación reveló un grado de concordancia moderado entre las frecuencias del FHGOA y los trastornos del metabolismo de la glucosa, dislipidemia y la resistencia a la insulina, y no así entre el fenotipo, la DM2 y la obesidad abdominal, en cuyo caso los niveles de concordancia fueron aceptables. Este resultado coincide con lo observado por varios autores, que han encontrado que las personas con el FHGOA tienen mayor riesgo de desarrollar disglucemia, dislipidemia y resistencia a la insulina que aquellas sin el FHGOA.6,9,18,19,20,21,22
Las limitaciones de este estudio incluyen el tamaño de la muestra y que no se pudieron realizar otras determinaciones para la evaluación de los trastornos del metabolismo de la glucosa (prueba de tolerancia a la glucosa oral). No obstante, la importancia de la investigación radica en que, hasta donde se conoce, no existen artículos en Cuba en los cuales se investigue la frecuencia del FHGOA en mujeres con SOP y su asociación con la resistencia a la insulina, trastornos del metabolismo de la glucosa y ateroesclerosis subclínica, así como la concordancia diagnóstica entre el FHGOA con algunas variables clínicas (IMC, circunferencia de la cintura, acantosis nigricans e hipertensión arterial) y bioquímicas (algunos trastornos del metabolismo de la glucosa, resistencia a la insulina, colesterol y triglicéridos).
La intención de este estudio fue un acercamiento al uso del FHGOA en este grupo de mujeres en las cuales la literatura evidencia un perfil metabólico de riesgo y que en nuestro contexto este fenotipo en cuestión ha sido poco estudiado. Los resultados obtenidos apuntan a que la presencia del FHGOA en mujeres con SOP puede ser una señal de alarma para el médico especialista, por la asociación de este fenotipo con los trastornos del metabolismo de la glucosa, la resistencia a la insulina, así como con el riesgo cardiovascular, por lo que el estudio cumplió con los objetivos propuestos.
Se concluye que la hipertrigliceridemia-obesidad abdominal es un fenotipo frecuente en mujeres con SOP, que se asocia a alteraciones del metabolismo de la glucosa y a la resistencia a la insulina. El fenotipo pudiera ser utilizado en la práctica clínica como un marcador de riesgo para alteraciones cardiometabólicas. No obstante, se requiere realizar otros estudios semejantes en Cuba, con mayor número de participantes, que sustenten estos resultados de modo que puedan ser generalizables.















