Introducción
El periodo prenatal en el desarrollo del ser humano es uno de los más críticos y de mayor impacto del ciclo ontogenético humano. Son el desarrollo embrionario y el fetal el resultado de complejas interacciones entre el potencial genético del individuo en formación y el ambiente intrauterino al que se encuentra expuesto.1 Además, depende del control que se ejerce sobre la programación de la expresión genética y las modificaciones epigenéticas. No menos influyente es el control de la división celular y el funcionamiento de mecanismos sensores capaces de apreciar los recursos que provee el medio intrauterino para asegurar la calidad del desarrollo.2
El crecimiento fetal depende en gran medida de la disponibilidad de glucosa, que es el nutriente fetal por excelencia.3 El aporte de este monosacárido al producto de la concepción está íntimamente relacionado con la concentración de glucosa que aporta la madre y la capacidad de transporte a través de la placenta.4 La glucosa materna atraviesa la interfase materno/fetal, pero la insulina no lo hace. Si la madre mantiene altas concentraciones de glucosa, ya sea sostenidamente o en episodios que alternan con normoglucemias, obliga al feto a producir insulina en mayor cantidad, incluso, aunque el páncreas todavía esté inmaduro.5) El aumento de la producción de insulina, estimulado por mayores niveles de glucosa en el feto, también incrementa la adiposidad, lo cual puede condicionar más tarde en su vida adulta la posibilidad de sufrir de obesidad, de diabetes, así como resistencia a la insulina.2
Además de estimular la secreción de insulina, el incremento de los niveles de glucosa en el feto puede conducir al incremento de la secreción de los factores de crecimiento tipo insulina (IGF-I y IGF-II), los cuales son indispensables para mantener el ritmo de crecimiento fetal.4,5 Igualmente indispensable, en especial para el cerebro, resulta el adecuado transporte de aminoácidos y ácidos grasos.3
Numerosos estudios han demostrado que factores ambientales, metabólicos y nutricionales desfavorables durante la gestación pueden determinar diversas alteraciones a largo plazo, pudiendo además provocar cambios estructurales de diversos órganos durante la vida intrauterina.5,6 Entre los órganos que pueden experimentar desafíos y adaptaciones cruciales se encuentra el cerebro, por lo que pudieran generarse alteraciones en el desarrollo neurológico.7
Las afecciones del neurodesarrollo incluyen síndromes diferentes. Se encuentran en esta categoría, el autismo, los trastornos del sueño, la insuficiente capacidad para actuar en sociedad, las deficiencias cognitivas, el déficit de atención y los desórdenes de hiperactividad (attention deficit and hyperactivity disorders, ADHD), el malfuncionamiento motor, la respuesta aberrante a estímulos sensoriales, la ansiedad, la depresión, la psicosis, la esquizofrenia y la disminución en el coeficiente intelectual, lo que se evidencia en bajos índices en pruebas de inteligencia (intelligence quotation, IQ).8
Desde hace más de cuatro décadas se conoce que las malformaciones congénitas en hijos de madres con diabetes implican trastornos en el desarrollo de varios órganos y sistemas, en particular, en los sistemas nervioso y cardiovascular. Sin embargo, otras secuelas más sutiles y que no pueden ser detectadas al momento del nacimiento son aquellas que afectan la capacidad de socializar y comprometen el aprendizaje y el comportamiento en general. Es de poco conocimiento, aún entre profesionales del campo de la salud, las causas moleculares que subyacen en algunas de las enfermedades del espectro autista y la relación que poseen con el control glucémico deficiente de las madres de hijos con este tipo de trastornos.
Para profundizar en este conocimiento y actualizar la información sobre las consecuencias de la diabetes sobre la descendencia nos propusimos como objetivo explicar los mecanismos moleculares que subyacen en la aparición de los trastornos del neurodesarrollo en hijos de gestantes con diabetes.
Métodos
Para la adquisición de la información se llevó a cabo una revisión de la literatura que aparece en las siguientes fuentes: Google, MEDLINE/PubMed y SciELO. Se revisaron 9 artículos originales, 35 de revisión bibliográfica, 3 estudios prospectivos y una tesis de doctorado, dos capítulos de un libro y un informe de la OMS. Los artículos revisados fueron publicados durante el periodo 2000-2020 y más de la mitad pertenecen al último quinquenio. Se seleccionaron los artículos de revisión teniendo en cuenta la trayectoria de sus autores, la mayoría líderes en estos temas desde hace más de dos décadas. Las palabras clave utilizadas fueron: hiperglucemia, desarrollo del cerebro, diabetes y neurodesarrollo, malformaciones congénitas y epigenética.
El cerebro, un órgano valioso y complejo
El desarrollo del cerebro humano es un largo proceso que comienza entre la segunda y tercera semana de gestación, periodo a partir del cual el embrión enfrenta un proceso altamente coordinado para el control de la proliferación y migración neuronal, sinaptogénesis, mielinización y apoptosis para el adecuado desarrollo del cerebro fetal.9,10
Los humanos al nacer tienen un cerebro que consume el 74 % de la energía del cuerpo entero y pesa alrededor del 11 % del peso corporal, lo que constituye una relación de peso única entre las especies que viven en la tierra.11 Al alcanzar la etapa de adultez, el peso del cerebro solo representa aproximadamente el 2 % del peso del individuo, no obstante, requiere cerca del 20 % de la glucosa que posee para realizar sus funciones fisiológicas y el 20 % del oxígeno que respira.12 En resumen, la principal fuente de energía del cerebro es la glucosa, aunque otros compuestos como los cuerpos cetónicos, el acetato y otros, pueden ser también metabolizados para la obtención de energía en determinadas condiciones.11,13 Esta dependencia hace que el cerebro precise de una gran regulación de la entrada de glucosa que ejercen sus transportadores, unas proteínas conocidas como GLUT.13
Los GLUT son moléculas de proteínas cuya única función conocida es transportar la glucosa a través de las membranas, en particular hacia el interior de las células, requerimiento imprescindible para que estas últimas puedan obtener la energía necesaria.13 Se conocen varios tipos de moléculas que transportan glucosa y que difieren en su afinidad y localización en los diferentes tejidos. En el tejido cerebral existen fundamentalmente cuatro, dos de ellos transportan la glucosa independiente de sodio: GLUT1 y GLUT3, y dos, conocidos por sus siglas SGLT (sodium-dependent glucose transporters), transportadores de glucosa dependientes de sodio.12) Cada uno de ellos posee una afinidad diferente por la glucosa. El GLUT1 se expresa en células endoteliales de la microvasculatura de la barrera hematoencefálica y en astrocitos. El más abundante transportador de glucosa en el cerebro es el GLUT 3 con una capacidad de transporte cinco veces mayor que el GLUT1. Este se encuentra principalmente en los axones y dendritas y su densidad en ese tejido se asocia con la demanda de glucosa del cerebro.12,13
Existen varias condiciones que pueden presentarse durante la gestación e implican la existencia de un riesgo para la descendencia, en particular, con respecto a su desarrollo neurológico, siendo la hiperglucemia una de estas.14
Diabetes mellitus y alteraciones del neurodesarrollo en la descendencia
La descendencia de las gestantes con diabetes tiene el riesgo de presentar un desarrollo anómalo del sistema nervioso central (SNC). Como este sistema en el feto comienza su maduración alrededor de la semana 20, se ve afectado por la hiperglucemia (HG) que experimentan las madres con diabetes mellitus (DM) durante la gestación, cualquiera que sea el tipo de diabetes materna que esta tenga.13 De particular interés es el hecho de que el hipotálamo se desarrolla casi completamente durante la vida fetal, lo que explica por qué es tan lábil frente a los cambios metabólicos que tienen lugar durante la gestación.14) El cerebro recibe variadas señales periféricas a través del hipotálamo que participa en la transducción de estas e influye así en las neuronas que producen péptidos orexigénicos y anorexigénicos. Este último, regula el apetito y, por tanto, la ingesta, así como el gasto de energía. De esta manera, el cerebro puede reconocer el estatus de nutrientes, detectar perturbaciones en el balance energético y permite la activación de mecanismos adaptativos.14
La DM es un síndrome metabólico complejo caracterizado por alteraciones en el metabolismo de los glúcidos, lípidos y proteínas como consecuencia de una deficiencia absoluta o relativa de la secreción de insulina, de su acción o de ambas. Su origen es multifactorial y entre sus causas se encuentran distintos factores genéticos, ambientales, inmunológicos y virales. Su característica fundamental es la hiperglucemia crónica.15
Existen diferentes tipos de diabetes que pueden presentarse durante la gestación: la diabetes mellitus pregestacional (DMPG) incluye a la diabetes mellitus tipo 1 (DMT1), que es una enfermedad autoimmune en la cual el cuerpo agrede a las células beta del páncreas. Su debut se atribuye a dos grupos de factores: hereditario y promovido por desencadenantes externos como, la dieta o infecciones. La diabetes mellitus tipo 2 (DMT2) afecta al 6 % de los adultos al nivel mundial y es el tipo de diabetes con mayor prevalencia, ya que representa el 92-95 % de los casos con esta enfermedad. Se caracteriza por un deterioro progresivo en la tolerancia a la glucosa, lo que es compensado con una secreción incrementada de insulina. En estados avanzados de la enfermedad, además de disminuir la función de las células pancreáticas, se produce una disminución de la masa de células que finalmente conduce a la pérdida de la capacidad del páncreas para la liberación de la insulina.16) Se desarrolla con mayor frecuencia en personas con 40 años o más y tiene una marcada asociación con la obesidad, aunque actualmente se observa una tendencia a aparecer en edades más jóvenes y, por tanto, en las mujeres con edad reproductiva.15)
Otros tipos de DMPG son las conocidas como MODY (maturity-onset diabetes of the young) y LADA (latent autoimmune diabetes in adults).16 Estos tipos de diabetes que constituyen menos del 1 % de los casos de personas con diabetes, comparten algunas características de las formas más predominantes antes mencionadas (DMT1 y DMT2) y pueden estar presentes en mujeres con edad reproductiva. No obstante, dada su baja incidencia no serán objeto de análisis en esta revisión bibliográfica.
La diabetes materna comprende, además, la diabetes mellitus gestacional (DMG), que es aquella que se establece durante el embarazo y se diagnostica fundamentalmente a partir de la semana 24 de gestación.16) Como aparece generalmente cuando ha culminado el periodo embrionario, no produce las malformaciones congénitas (MFC) conocidas en conjunto como, “embriopatía diabética”, aunque sí puede provocar la aparición de otras que se producen en estadios del desarrollo prenatal posteriores a la embriogénesis.17,18. La DMG es el tipo de diabetes más prevalente en la etapa gestacional.14
Se estima que unos 3,3 millones de niños menores de 5 años mueren en el mundo anualmente como consecuencia de las MFC.17) En el caso de la diabetes, la HG que puede presentarse en los periodos críticos de la morfogénesis, es el principal teratógeno,18 aunque eventos posteriores inducidos por esta condición como la hipoxia, el estrés oxidativo (EO) y la apoptosis, convergen para provocar los daños.17,18,19) Además, las mujeres con esta condición tienen un riesgo de aborto espontáneo (15-20 %), así como de complicaciones obstétricas, las que se presentan en el 15-20 % de estas.18,19,20 Si la gestante con diabetes mellitus pregestacional (PGDM) presenta HG antes de la concepción y durante los primeros 3 meses de embarazo, tendrá un 5-10 % de riesgo de tener hijos con defectos congénitos mayores como defectos de cierre del tubo neural (DTN), cardiacos o múltiples.17,18
Entre los riesgos a los que la descendencia de madres con diabetes se encuentra expuesta, además de las conocidas malformaciones congénitas, se encuentran los trastornos del neurodesarrollo. Estos trastornos incluyen a una gran cantidad de afecciones, cuyo impacto en la comunicación social y el bienestar del individuo y la familia es perdurable.(21,22,23,24,25
En común con sus madres (dado por la conexión mediante la placenta), los hijos de madres con diabetes tienen HG, que es un factor implicado en la producción del daño al SNC de la progenie.20-24 El cerebro inmaduro es susceptible a las variaciones de la glucemia, la HG en particular, incrementa la actividad metabólica y con ello, el consumo de oxígeno. La hipoglucemia provoca que disminuya drásticamente la disponibilidad de energía, lo cual puede modificar la ocurrencia programada de eventos moleculares que conducen a la apoptosis.26 La glucosilación de proteínas, que se incrementa ante la presencia de HG, afecta la entrega de oxígeno por la hemoglobina, ya que la hemoglobina glucosilada posee una gran afinidad por este gas. Otras alteraciones que presentan los hijos de madres con diabetes son la síntesis incrementada de eritropoyetina y la policitemia, asociadas con los bajos niveles de hierro.20-23
Los recién nacidos de madres con DMPG presentan con frecuencia una escasez orgánica de hierro, aunque su madre no tenga una marcada carencia. La causa molecular de este suceso radica en el hecho de que en condiciones de HG el receptor de transferrina de la placenta disminuye su afinidad por este metal, lo que no se aviene con los crecientes requerimientos de hierro correspondientes con el crecimiento del producto.24
La carencia de hierro interfiere con la diferenciación y sobrevivencia celular en el cerebro, ya que afecta la biodisponibilidad de proteínas que son cruciales en la transferencia de electrones dentro de la cadena respiratoria mitocondrial, lo que limita la entrega de energía por afectación de la respiración celular.23 Con la afectación de la masa celular, disminuye la concentración de neurotransmisores, lo que explica las limitaciones para un desarrollo adecuado del sistema nervioso central. Todo esto puede afectar severamente la aparición de algunos reflejos y condicionar una pobre memoria, según se constató en niños de un año de edad nacidos de madres con DMPG al ser evaluados por estudios de potencial y pruebas neurológicas.27) La susceptibilidad a la alteración del desarrollo cerebral en hijos de madres con diabetes es tal que presentan 15,5 veces mayor riesgo de nacer con malformaciones del SNC, que los hijos de gestantes sin diabetes.21
Consecuencias de la HG sobre el producto de la concepción
Se reconoce desde hace más de dos década que la teratogenicidad de la diabetes se basa en la migración incorrecta de las células caudales que afecta, además del cierre del tubo neural, la formación del corazón y los grandes vasos.18,19,28,29,30 Se ha demostrado también que la acumulación de radicales libres derivados del aumento del EO, conjuntamente con el estado hipóxico que presenta el embrión (situaciones íntimamente relacionadas con la HG), condicionan la aparición de cambios epigenéticos en el ADN, los que pueden producir silenciamiento en la expresión genética capaz de limitar el control de genes como, el p 53.28,29,30,31 Este gen, cuya expresión se encuentra a su vez bajo el control del gen Pax 3, logra influir negativamente en programas apoptóticos que delimitan la migración de las células de la cresta neural,28-31 así como en el desarrollo celular de áreas del cerebro como el hipotálamo, la corteza y el hipocampo.21,27,32
Las investigaciones en humanos y modelos animales han demostrado que la HG materna es un importante teratógeno, pero la paterna no.9,18,33) La diabetes materna altera el epigenoma del embrión, lo que impacta en la expresión genética34,35,36 y se asocia con una deficiente morfogénesis, además de que incrementa la probabilidad en la descendencia de sufrir enfermedades a lo largo de su vida.18,19,28-30 La propuesta de que los cambios epigenéticos que ocurren en el embrión provocados por la HG materna contribuyen a la aparición de las MFC se sustenta en el hecho de que no todos los descendientes de gestantes con una DMPG mal controlada tienen hijos con MFC. A este fenómeno se le ha denominado “penetrancia parcial” y significa en esencia, que aunque individuos expuestos a una noxa sean genéticamente idénticos, alteraciones derivadas de las modificaciones epigenéticas y no de la secuencia de bases nitrogenadas que conforman el ADN determinaran en cada caso la presencia de MFC.3,19,30 En un estudio reciente se asegura que una cascada de eventos iniciados por la HG y mediados por la hipoxia, la inflamación y el EO incrementa el riesgo de esquizofrenia.37,38
Aunque aún no están identificados todos los mecanismos moleculares relacionados con el metabolismo energético en la gestante con diabetes, ni la forma en que la HG afecta las estructuras embrionarias, algunos estudios recientes continúan revelando información acerca del tema.22,35 Uno de estos fue desarrollado por un grupo de investigadores chinos y demostró que el EO crónico provocado por la HG puede conducir a la supresión neuronal del gen de la enzima antioxidante mitocondrial, superóxido dismutasa (SOD2).22 La actividad de esta enzima es esencial en la eliminación del radical superóxido, una especie reactiva del oxígeno que participa activamente en el daño oxidativo mitocondrial.19
El estudio antes referido, el cual fue desarrollado en un modelo de ratas con diabetes, permitió constatar la supresión del gen SOD2 en células de la estructura cerebral (amígdala) cuando estaban expuestas a EO. En el experimento de análisis del comportamiento de los animales cuyo gen fue suprimido, se evidenció un comportamiento de tipo autista. También se pudo demostrar que la supresión del gen se debió a mecanismos epigenéticos, específicamente, a la acetilación de las histonas de clase 3 (H3),22) pero inducido por señales que la célula recibe producto de la acumulación de especies reactivas del oxígeno (ERO). Cuando estas últimas sobrepasan las potencialidades de las células para mantener la homeostasis, causan una condición conocida como EO.19,35,36 El efecto ocasionó la inhibición de la remodelación de la cromatina, lo que es indispensable para que el gen pueda ser inducido. Cuando por manipulación genética se produjo la sobreexpresión del gen SOD2, se generó una reducción de la conducta autista en las camadas, lo cual prueba que existe una relación de causalidad entre el silenciamiento del gen y este tipo de comportamiento.22
Otro estudio prueba el avance que se ha ido obteniendo en la dilucidación de las causas moleculares de las MFC en los hijos de madres con diabetes. Fue publicado por la Dra. Mary R. Loeken de la Universidad de Harvard.35 En este se confirma que el EO provocado por la HG afecta negativamente a procesos como el cierre del tubo neural y la formación de grandes vasos, demostrándose además que el evento que subyace en este fenómeno es de naturaleza epigenética. La metilación permanente del gen de la proteína PAX3 por una metiltransferasa (Dnmt3b) en respuesta a EO provocó su silenciamiento, en el tiempo en que se produce la formación de estructuras embrionarias, específicamente las que se derivan del cierre del tubo neural.35
En resumen, cuando la concentración de ERO aumenta como consecuencia de la HG materna, la dotación de antioxidantes (AO) en las estructuras del feto disminuye aún más (fisiológicamente, los AO se encuentran en baja concentración durante el desarrollo intrauterino),34 lo que condiciona algunos efectos como alteraciones de la membrana de las células, disfunción mitocondrial y estimulación del programa de muerte celular (apoptosis).18,19) El alcance del EO que la HG materna produce es tal, que aun cuando se alcanza la normoglucemia puede afectar la genética y epigenética del embrión y con ello determinar la aparición de MFC.19,30
Función del estrés oxidativo en la gestación con diabetes
La noción de que el EO está involucrado en los daños que produce la diabetes en las personas que la presentan, se ha asegurado por muchos autores.18-20,22,25,29) Algunas evidencias provienen de los estudios de Michael Browlee, pionero en los trabajos de experimentación relacionados con el tema.19) Numerosos artículos científicos muestran datos que revelan elevadas concentraciones de especies oxidantes y biomoléculas con daño oxidativo al nivel sistémico en pacientes con diabetes, además de los hallazgos en animales de experimentación.18,19,28,30) Especialmente expuesto al EO se encuentra el embrión de la madre con diabetes (posee una baja dotación de sustancias AO), pero específicamente el cerebro en esa etapa del desarrollo es una de las estructuras menos dotadas de sustancias AO.9,21 De ahí se deriva el daño que el EO provoca en el desarrollo de este órgano.
La DMPG, ya sea una DMT1 o una DMT2, y la DMG se relacionan también con la disfunción endotelial.39,40 El factor relajante derivado del endotelio u óxido nítrico (ON), se debe a una molécula radicálica con una gran avidez para reaccionar con el radical superóxido, cuya concentración aumenta en condiciones de HG.40 La reacción entre el ON y el radical superóxido se favorece en condiciones de EO, generando productos altamente reactivos como el peroxinitrito y disminuye la biodisponibilidad de ON, tan necesaria para la vasodilatación.19 Esta situación se torna crítica para la microvasculatura, especialmente, durante la gestación, ya que compromete el aporte de nutrientes al feto y el intercambio de sustancias que se produce entre el feto y la madre a través de la placenta.39 Se ha observado que en gestantes con DM, acompañada o no de obesidad, las defensas antioxidantes pueden incrementarse como respuesta al EO. En tales circunstancias, la placenta tendrá que lidiar también con un medio con un potencial oxidativo alto si la gestación avanza, pero el costo de la adaptación podría ser una insuficiencia placentaria que privará al feto de las ventajas de un adecuado transporte y, por tanto, afectará su crecimiento.41
La acumulación en la vasculatura del cerebro de lípidos modificados, productos finales de la glucosilación avanzada (AGE) y agregados de proteínas, que aparecen como consecuencia de reacciones oxidativas, dañan las células endoteliales. Este daño vascular provoca que disminuya la producción de sustancias vasodilatadoras y se reduzca el flujo sanguíneo en el cerebro, pudiendo aparecer hipoxia. El incremento sostenido de las ERO puede inducir la actividad de las metaloproteinasas de la matriz y la reorganización del citoesqueleto y, debido a esto el aumento de la permeabilidad vascular. El resultado es la aparición de un escenario agudo, que se asocia con la disminución de las fuentes de energía y la alteración de la viabilidad de las células neurales.41
El daño oxidativo sobre las biomoléculas, cuando una condición de EO se establece, puede afectar a las proteínas que participan en la sinapsis, reducir la disponibilidad de ATP en las neuronas, afectar la comunicación celular y provocar que se acumulen proteínas dañadas oxidativamente. La acumulación se debe a que las modificaciones oxidativas de las proteínas las hacen resistentes a su eliminación por el mecanismo ubiquitina proteosoma, entre otros fenómenos aberrantes.6) Estos y otros eventos moleculares podrían explicar la aparición de MFC, los problemas en la capacidad de memorizar y el desempeño escolar y, en general, la carencia de habilidades para la adquisición de información que manifiestan los hijos de madres con diabetes.8,27,41,42
Función de la inflamación en la gestación con diabetes
La placenta de las gestantes con diabetes presenta, además de un elevado contenido de moléculas producidas por el estado inflamatorio crónico, cambios en el perfil de expresión de células del sistema inmune, con una elevación de la producción de células auxiliares Th1 en detrimento de las Th2.32,38 Este cambio hace que el tejido adiposo produzca citoquinas proinflamatorias como, TNF-alpha, IL-6 y MCP1 (macrophage chemotactic protein 1).43
La exposición a la inflamación durante la concepción, unida a la programación genética y a la inadecuada nutrición, se relaciona con trastornos en el neurodesarrollo como los que se observan en personas con enfermedades del espectro autista, esquizofrenia y otras. Asociada con la inflamación, se encuentran también otros trastornos perinatales; bajo peso al nacer, nacimiento prematuro y muerte intrauterina.44 Las moléculas mediadoras de la inflamación son capaces de atravesar la placenta e influir negativamente con el desarrollo neurológico del feto.45 La neuroinflamación es una condición que afecta negativamente el cerebro prenatal, pero la inflamación sistémica en el feto y en la placenta es una condición que deja su impronta negativa en la descendencia, ya sea a corto o a largo plazo (vida posnatal).45
Entre los eventos moleculares que subyacen a los cambios en el desarrollo fetal provocados por la DMPG se destaca el papel que juega una proteína conocida como mTOR. Esta molécula pertenece a la familia de las quinasas relacionadas con la fosfoinositol 3 fosfato quinasa (PI3K), conocida también como la molécula blanco de rapamicina (target of rapamycin).46 Además, se considera que la mTOR podría estar implicada en el desarrollo del cerebro durante la embriogénesis y en los procesos de aprendizaje y memoria. Esta molécula regula rutas de señalización esenciales y está implicada en la progresión del ciclo celular.46
La vía de transducción de señales en las que participa la mTOR integra varios procesos celulares en respuesta a gran variedad de señales relevantes en los procesos de la reproducción. La mTOR constituye la subunidad catalítica de los complejos mTORC1 y mTORC2. Estos complejos actúan como sensores de la condición metabólica del ambiente uterino, en el manejo de procesos fisiológicos como la organización del citoesqueleto, la autofagia y la síntesis de proteínas y lípidos, así como en la diferenciación de diferentes células como las de la médula ósea, entre otras funciones celulares. Además, la mTOR regula el metabolismo de la glucosa y la función mitocondrial mediante el control de la subunidad catalítica del factor inducible por hipoxia (HIF1A).45,47 En resumen, esta molécula funciona como un punto de chequeo de la exitosa implantación y el desarrollo durante la reproducción.
La adaptación al entorno del útero, con su característico dinamismo en cuanto a las concentraciones de glucosa, ácidos grasos y aminoácidos, resulta vital para la sobrevivencia celular, en particular cuando se trata de células como las placentarias y las embrionarias, cuya vida media es limitada. En situaciones en las que las células no reciben un adecuado aporte de nutrientes, ya sea porque no hay suficiente cantidad de insulina para que se produzca la entrada de glucosa o se instauran dietas bajas en proteínas, existe un transporte inadecuado de nutrientes por afectaciones de los transportadores específicos (de zinc, de aminoácidos y de ácidos grasos). En estos casos la actividad de mTOR disminuye, razón por la cual se puede producir una invasión inadecuada del trofoblasto y, como consecuencia, una insuficiencia placentaria. Esta situación puede conducir a RCIU y preeclampsia.39
Función de la epigenética en la gestación con diabetes
La repercusión negativa de la HG en la gestación, puede explicarse también por las modificaciones epigenéticas que provoca. Estas se producen como consecuencia de diferentes factores, entre los cuales se encuentra la alteración de los procesos de señalización celular. Los cambios en el estado redox celular en ambientes de hiperglucemia favorecen el predominio del estado oxidado de moléculas como los cofactores reducidos nicotinamida adenina dinucleótido (NADH) y el tripéptido glutatión (GSH), entre otros. La acumulación en su estado oxidado (NAD+ y GSSG) condicionan el inicio de señales celulares que favorecen la aparición de las modificaciones epigenéticas.
La regulación epigenética es un proceso complejo en el que intervienen distintos mecanismos interrelacionados para modular la expresión génica sin producir cambios en la secuencia de nucleótidos. Se produce de forma dinámica, acorde con las necesidades específicas de cada tejido en momentos específicos y en respuesta a los distintos estímulos a los que se exponen los diferentes organismos.48
Existen cuatro variantes de mecanismos epigenéticos: la metilación del ADN (que tiene lugar en las bases nitrogenadas que lo forman), la formación de ARN no codificantes, las modificaciones en las proteínas histonas y los factores de trascripción.3,30,47
La función del 97 % de los genes afectados por la diabetes materna se relacionan con sitios de unión para factores de transcripción involucrados en las diferentes respuestas a EO e hipoxia.18 Está comprobado que la exposición a la HG puede modificar además la cromatina del embrión, produciendo modificaciones en su epigenoma. Este efecto se ha reconocido que tiene lugar aun en eventos de HG transitoria, capaces de inducir persistentes cambios epigenéticos y en la expresión de genes, incluso, una vez que la glucemia se ha normalizado.18 Combinaciones específicas en la modificación de las histonas sirven como una especie de código que determina si el gen ha de ser silenciado o expresado; otra forma de cómo se puede producir la regulación epigenética.49
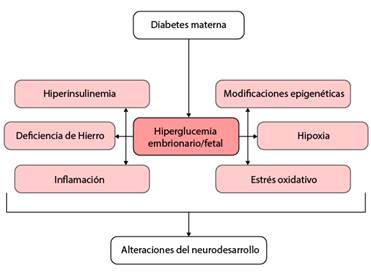
Sobre esta base, se presume que la diabetes materna puede provocar un efecto negativo en el feto, causando modificaciones epigenéticas que perduran durante la diferenciación y el desarrollo neural (Fig. 1).5 Entre estos cambios se destacan la formación de ARN no codificantes y las modificaciones en las histonas provocadas por enzimas que intervienen en la unión o separación de grupos acetilo, fosfato, metilo u otros. Se ha demostrado la ocurrencia de eventos de este tipo en histonas (especialmente, la H3) relacionadas con zonas donde se localizan algunos genes íntimamente relacionados con la diabetes y la obesidad. Estos genes son los de factores de transcripción, específicamente el del receptor activado del proliferador de peroxixoma (PPARs), el del factor 4 del hepatocito (Hnf4α), que es uno de los genes que se encuentra vinculado con la DM Tipo 2, y el gen Pdx1 (pancreas duodenum homeobox 1), el cual codifica un regulador transcripcional, cuya acción fundamental se relaciona con la formación de todas las células del páncreas.3
La hiperglucemia materna contribuye al surgimiento del estado de hipoxia durante el desarrollo embrionario y afecta la vascularización feto-placentaria, entre otras consecuencias. La concentración de glucosa en el organismo fetal se encuentra en equilibrio con la de la madre. La presencia de una hiperglucemia en el feto, consecuencia de la elevación de la glucemia materna, se produce una mayor cantidad de insulina para lograr la homeostasis de la glucosa y por ende la hiperinsulinemia.
En este estado alterado, el estrés oxidativo constituye una condición crónica que está presente tanto en la madre con diabetes como, en el feto. El agotamiento de las reservas de sustancias antioxidantes disminuye la protección ante el daño oxidativo de diferentes biomoléculas. Como resultado, se alteran la estructura y la función de los lípidos (especialmente abundantes en el tejido cerebral), de las proteínas y de los ácidos nucleicos. La deficiencia de hierro relacionada con la diabetes afecta la obtención de energía por las células cerebrales y, consecuentemente la formación del cerebro. La inflamación de bajo grado que caracteriza a la diabetes y que se exacerba por la gestación provoca complicaciones obstétricas que pueden producir daño cerebral.
Conclusiones
Con esta revisión se explicó que existen factores relacionados con un desarrollo anómalo de las estructuras cerebrales que se presentan con una elevada frecuencia en los hijos de madres con diabetes. Las alteraciones metabólicas provocadas por la hiperglucemia, el estrés oxidativo, la inflamación de bajo grado, las modificaciones epigenéticas y la carencia de hierro crean un ambiente adverso que favorece el desarrollo anómalo.
Los más importantes hallazgos consisten en la alteración del número y de la dimensión de las células cerebrales, patrones de maduración y de diferenciación incorrectos, trastornos en la actividad sináptica, modificaciones epigenéticas y cambios en la expresión de proteínas, fundamentalmente en el hipocampo. Esta es el área del cerebro que más interviene en la comprensión y la memoria, y es especialmente sensible a los cambios en los niveles de glucosa. Por esta razón, urge la necesidad de optimizar el control glucémico antes y durante el embarazo. Las limitaciones en la vida cotidiana con las que deberán lidiar estos niños y su familia pueden ser evitadas.