Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Higiene y Epidemiología
versión On-line ISSN 1561-3003
Rev Cubana Hig Epidemiol v.41 n.2-3 Ciudad de la Habana Mayo-dic. 2003
Instituto de Medicina Tropical "Pedro Kourí"
Infección con poliovirus vacunal en niños con anticuerpos neutralizantes homólogos, inducidos por vacunaciones con VOP-T
Dr. Pedro Más Lago,1 Dr. Helenio Ferrer Gracias2 y Dr. Ángel Goyenechea Hernández1
Resumen
Una investigación sobre seroconversión y circulación de los virus excretados de la vacuna oral antipoliomielítica (VOP), se realizó durante varios años y sus resultados se introdujeron en el perfeccionamiento del programa para la erradicación de la enfermedad. Un análisis retrospectivo de los datos demostró nuevos resultados que mantienen vigencia en el contexto del programa de la erradicación mundial. En 98 niños menores de dos años de edad se administraron dos dosis de vacuna oral antipoliomielítica trivalente (VOP-T) con intervalo de 4 sem. Se obtuvieron muestras de heces fecales semanalmente, desde la primera dosis hasta 4 sem después de la segunda dosis y también de sueros antes de la vacunación y 4 sem después de la segunda dosis. El porcentaje de aislamiento de poliovirus homólogos en niños sin anticuerpos previos fue más alto (116,7 %) que los obtenidos en niños con anticuerpos previos (34,2 %), mientras los porcentajes de aislamientos totales a poliovirus en niños con seroconversión (72,4 %) resultó más elevado que los registrados en niños con reactivación (167 %).
Los casos sin aislamientos en seroconversiones con anticuerpos heterólogos previos más las reactivaciones sin estímulos, anamnesis o aislamientos homólogos permitieron inferir una circulación silenciosa autolimitada. La interferencia a los poliovirus por los enterovirus no polio, conjuntamente con el incremento de anticuerpos por las campañas, produjo que las circulaciones de poliovirus fueran autolimitadas a corto tiempo después de concluida la campaña masiva.
PALABRAS CLAVES: POLIOVIRUS; VOP; INMUNIDAD; CIRCULACIÓN SILENCIOSA; INTERFERENCIA; SEROCONVERSIÓN.
Desde su inicio, en el año 1962, las actividades contra la poliomielitis en Cuba consistieron en las campañas de vacunación masiva ejecutadas en corto tiempo con vacuna oral antipoliomielítica trivalente (VOP-T), lo que ha constituido la estrategia fundamental de ese programa.1 Este tipo de vacunación, designada con el nombre de pulse, se informó por Cuba, el único país que la utilizó sistemáticamente desde la instauración del programa2 y la continúa utilizando en la actualidad.3 Los éxitos obtenidos desde su inicio se demostraron con la erradicación de la circulación de los poliovirus salvajes, en contraposición a lo reportado en varias publicaciones, que consideraban que el uso de VOP-T no era efectivo en los países tropicales,4-19 fundamentalmente los poliovirus 1 y 3, los cuales eran más importantes como agentes etiológicos de epidemias. En 1980, Brasil fue el segundo país que utilizó las campañas de vacunación, con la aplicación de una sola dosis, ocasión que denominaron "día nacional de vacunación". Posteriormente, continuó con dos dosis y amplió la edad hasta 5 años.20 Actualmente, las campañas masivas de vacunación constituyen la estrategia fundamental que emplea la OMS para la erradicación del poliovirus salvaje y las epidemias por virus derivados de la VOP.
Los resultados que se obtuvieron en estudios serológicos fueron útiles para orientar el uso del tipo de vacuna (mono, di o trivalente) y estabilizar las edades incluidas en las vacunaciones. Es por eso que en el año l964 se decidió, por las autoridades de salud correspondientes, que se debían realizar las investigaciones necesarias por el laboratorio de enterovirus del Instituto Nacional de Higiene y Epidemiología, con el objetivo de aportar las bases científicas del programa de vacunación contra la enfermedad e impedir que ocurrieran nuevas epidemias de poliomielitis en el país. En 1965 se realizó, entre otras, una compleja investigación con los objetivos de conocer y/o determinar los siguientes aspectos:
- Esquema de vacunación.
- Excretores de poliovirus vacunal según dosis en niños.
- Seroconversión.
- Interacción de poliovirus con otros virus en el intestino.
- Tiempo de intervalo entre la primera y la segunda dosis.
Esa investigación se fundamentó en el poco uso de la VOP-T en países tropicales y la poca efectividad de su empleo según las publicaciones de aquellos tiempos. De esta investigación se obtuvieron varios resultados introducidos en el programa contra la poliomielitis. Entre ellas:
- Determinar el esquema de vacunación a los niños desde 1 mes hasta los 3 años con dos dosis anuales.
- Continuar las encuestas serológicas anuales en todo el país para determinar la edad y los tipos (mono, bi o trivalente) de VOP.
- Incrementar hasta 6-8 sem el período entre la primera y segunda dosis.
- Investigar en la población infantil la circulación del poliovirus salvaje.
En el marco del programa mundial de la erradicación de la poliomielitis, se consideran de interés los resultados de la circulación de los poliovirus vacunal, los enterovirus no polio (EVNPs) y la interacción con la seroconversión y reactivación en campañas masivas. El objetivo de este trabajo es dar a conocer esos aspectos, por su importancia en el contexto de diseñar una estrategia para discontinuar el uso de la VOP-T y no incluir la seroconversión como medida de efectividad de la vacuna.
Métodos
Se seleccionaron 98 niños entre <1 hasta 2 años de edad en dos casas cunas. En la tabla 1 se presentan las actividades de la toma de muestras y vacunación realizada en la investigación.
Se obtuvieron las muestras de heces fecales semanalmente durante un período de cuatro sem después de cada dosis de vacunación. Las heces se conservaron y transportaron en frío hasta la inoculación en cultivos de células HeLa. Se realizaron tres pases ciegos para dar las muestras como negativas si no se detectaba efecto citopatogénico (ECP). Los aislamientos con ECP característicos de enterovirus se identificaron como poliovirus con sueros hiperinmunes obtenidos en el Instituto de Poliomielitis y Virus de Encefalitis de Moscú, y se utilizaron en mezcla de los tipos 1 + 2, 1 + 3, 2 + 3 y 1 + 2 + 3. En el caso de los ECP característicos de adenovirus, se realizó la identificación por la detección del antígeno del grupo mediante la prueba de fijación del complemento, utilizando un suero hiperinmune donado por el Instituto de Microbiología de Sofía, Bulgaria.Vacuna antipoliomielítica: Fue utilizada la VOP-T producida en forma de caramelo por el Instituto de Poliomielitis y Virus de Encefalitis de Moscú. La concentración de virus vacunal en cada dosis fue 500 000 TCD50 de polio tipo 1, 200 000 del tipo 2 y 300 000 del tipo 3.
Muestras de sueros: Se obtuvo una muestra de sangre de cada niño antes de la vacunación y en la cuarta semana después de la segunda dosis. Los sueros se conservaron en refrigeración a 40c hasta su procesamiento.
Determinación de anticuerpos neutralizantes: Se realizó por el método metabólico,21 semimicrométodo en bandejas plásticas, con diluciones de sueros desde 1:4 hasta 1:1024, y la mezcla de cada una con diluciones de cada tipo de poliovirus, que contenían concentración de 100 TCD50, así como el uso de volúmenes de 0,2 mL de cada suero y virus. El tiempo del contacto virus-sueros fue de 2-3 h a temperatura ambiente. Se añadieron 0,2 mL de suspensión de células HeLa con concentración de 150 000 células por mL. Se utilizó medio Parker 199 con el 2 % de suero de ternero para suspender las células y diluir los sueros y virus. Las mezclas se cubrieron con 0,5 mL de aceite mineral estéril. Las pruebas se incubaron durante 5 días a 370c. Cada prueba se acompañó con controles de viabilidad de células, toxicidad de sueros y dosis de cada virus. La lectura se realizó por el cambio del medio al color amarillo, como indicador de la presencia de anticuerpos neutralizantes.
De acuerdo con esta investigación se obtuvieron las siguientes definiciones:
Seroconversión: Cuando un título de anticuerpos neutralizantes < 1:4 en el suero obtenido antes de la primera dosis de VOP-T, se incrementa al titulo 1:8 o más en el suero obtenido cuatro semanas después de la segunda dosis.
Reactivación: Es cuando un titulo 1:4 en el suero obtenido antes de la primera dosis de VOP-T, se incrementa en cuatro o más diluciones (titulo > 1:16) en el suero obtenido cuatro sem después de la segunda dosis.
Reactivación por estímulo anamnésico: Puede ser explicada por seroconversión (con aislamiento o no) o por aislamiento de poliovirus heterólogo.
Reactivación sin estímulo antigénico explicada: Es la reactivación en que no se encontró estímulo anamnésico ni por aislamientos homólogos.
Circulación silenciosa: La producida por el estimado de un poliovirus por cada seroconversión sin aislamiento, más la reactivación sin estímulo anamnésico o aislamiento homólogo.
Curva "simulada": Es la curva de aislamientos de poliovirus incrementada con la circulación silenciosa, distribuida proporcionalmente según los porcentajes de acuerdo con las muestras semanales.
Para calcular los títulos promedio geométricos (TPG) se tuvieron en cuenta solamente los sueros con títulos de anticuerpos neutralizantes 1:4 o más, mientras que para el análisis estadístico de tablas con porcentajes de anticuerpos se utilizó el programa Epidat. Para comparar los TPG se utilizó la prueba t de Student.
Resultados
La planificación para obtener sueros en 98 niños antes de la primera dosis de VOP-T y 4 sem después de la segunda dosis (tabla 1), se cumplió en el 100 %. De las 784 muestras de heces fecales planificadas, se tomaron 728 (93 %) en las 8 sem. Las muestras recibidas variaron de 72 en la primera semana, a 97 en la tercera.
Tabla 1. Diseño experimental para circulación y respuesta inmune en 98 niños vacunados con VOP-T en campañas masivas
| Calendario de las actividades | |||||||||||
| Día 1 | Día 2 | Día 9 | Día 16 | Día 23 | Día 30 | Día 31 | Día 38 | Día 45 | Día 52 | Día 59 | Día 60 |
| 1ros. 98 | 1ra. d | 1ra.sem. 72 f | 2da. 90 | 3ra. 97 | 4ta. 95 f | 2da. d V | 5ta. 94 f | 6ta. 96 f | 7ma. 92 f | 8va. 92 f | 2dos. s |
En la tabla 2 se observa que los porcentajes totales de aislamientos de poliovirus homólogos en niños con seroconversiones fueron más altos (p con corrección de Yates = 0,007), que en las reactivaciones (16,7 %). Un caso similar ocurrió con el poliovirus tipo 2 (p con corrección de Yates = 0,001). Los poliovirus tipos 1 y 3 no tuvieron diferencias significativas por pocas reactivaciones.
Tabla 2. Aislamientos de poliovirus homólogos en niños con seroconversión o reactivación
| Virus | Seroconversión | Reactivación1 | ||||
| Casos | Aislados | Porcentaje | Casos | Aislados | Porcentaje | |
| Polio 12 | 9 | 5 | 55,5 | 1 | 0 | 0,0 |
| Polio 23 | 9 | 13 | 144,4 | 29 | 5 | 17,2 |
| Polio 32 | 11 | 3 | 72,3 | 6 | 1 | 16,7 |
| Total 4 | 29 | 21 | 72,4 | 36 | 6 | 16,7 |
- Los aislamientos en reactivaciones fueron homólogos.
- No significado por escasas reactivaciones.
- p con corrección deYates = 0,001.
- p con corrección de Yates = 0,007.
En 4 niños con seroconversión se obtuvieron aislamientos en 2 sem, y en uno se obtuvo en 3 sem. Los niños sin aislamientos homólogos con seroconversiones fueron: Polio 1 en 6 casos, polio 2 en 1 y polio 3 en 8.
En la tabla 3 se muestran los resultados de los TPG en los primeros y segundos sueros obtenidos en los niños sin cambio inmunológico, los que presentaron reactivación y los de seroconversión. El primer resultado interesante de las comparaciones es la similitud entre los TPG de los primeros y segundos sueros obtenidos en niños que no tuvieron cambios de la inmunidad. Esta fue una demostración de la sensibilidad y repetibilidad del método utilizado para determinar los anticuerpos neutralizantes.
No hubo diferencia significativa entre los primeros sueros de niños sin cambio de la inmunidad y los de reactivación a polio tipo 3. Esto se debió al bajo número de casos de reactivación a polio tipo 3. Tampoco se obtuvo diferencia significativa entre segundos sueros de niños con seroconversiones a polio tipos 1 y 3.
Los TPG en los segundos sueros de niños sin cambios inmunológicos difieren de los que mostraron reactivaciones a los poliovirus tipos 2 y 3 (p = 0,000004 y 0,0002) respectivamente. Este resultado es considerado como un indicador de niños con infecciones al poliovirus vacunal, a pesar de haberse obtenido pocos aislamientos en los cuales el estímulo antigénico no puede explicarse por un recuerdo anamnésico.
Tabla 3. Título promedio geométrico (TPG) en grupos de niños que no tuvieron cambios inmunológicos y los que presentaron reactivaciones y seroconversiones
| Grupos | Sueros | n | Poliovirus 1 | Poliovirus 2 | Poliovirus 3 | n | Total | n | TPG |
| TPG | n | TPG | TPG | ||||||
| No cambio | 1ro. 2do. | 88 | 26,9 26,9 | 60 | 211,4 211,4 | 81 | 35,5 44,8 | 229 | 72,3 70,3 |
| Reactivación | 1ro. 2do. | 1 | 32,0 512,0 | 29 | 65,5 1210,5 | 6 | 17,9 1024,0 | 36 | 51,8 1149,4 |
| Seroconversión | 1ro. 2do. | 9 | <4 37,3 | ,0 9 | < 4,0 276,5 | 11 | <4,0 41,2 | 29 | < 4,0 72,1 |
El porcentaje de aislamientos en niños excretores de poliovirus derivados de la vacuna en la que no tenían anticuerpos previos a ningún poliovirus (116,7 %), fue significativamente más alto (tabla 4) que los aislamientos en niños con seroconversión y reactivación sin estímulo anamnésico, con anticuerpos previos a uno o dos virus (34,2 %) (p con corrección de Yates = 0,02).
Tabla 4. Porcentajes de aislamientos de poliovirus homólogos en niños con y sin anticuerpos heterólogos previos
| Grupos | Casos | Aislamientos | % |
| Sin anticuerpos previos* | 12 | 14 | 116,7 |
| Con anticuerpos previos* | 38 | 13 | 34,2 |
* p con corrección de Yates = 0,02
El total de aislamientos en las 8 sem fueron 325 cepas de virus (44,6 %), de las cuales 35 (4,8 %) correspondieron a poliovirus, 164 (22,5 %) a EVNP y 126 (17,3 %) a adenovirus. El porcentaje de aislamiento de poliovirus fue bajo en todas las sem, lo cual se confirmó con los resultados serológicos (figura 1). Los mayores números de aislamientos fueron en las sem 1, 2, 3, 5, 6 y 7, en los cuales se obtuvieron 4, 7, 6, 6, 5 y 5 cepas de poliovirus vacunal, respectivamente. Los poliovirus tipo 2 fueron los más frecuentes (23 cepas), seguidos por el tipo 1 (8 cepas) y el menos encontrado fue el tipo 3 (4 cepas). El aislamiento de poliovirus tipo 2 predominó después de la primera y segunda dosis de VOP-T, en tanto el polio tipo 1 se aisló después de la primera dosis y el tipo 3 en las últimas sem después de la segunda dosis. Los EVNP mostraron los mayores porcentajes de aislamientos a todos los poliovirus en todas las sem. Sin embargo, la circulación de los EVNP tuvo una curva con valores más bajos en las sem 2, 3, 6 y 7, lo que coincide con los más altos de la curva de circulación de los poliovirus. En las sem 4 y 8 (32,6 y 46,7 % respectivamente) se presentaron altos picos de la circulación de los EVNP. La curva de circulación de Adenovirus coincidió con la de polio, aunque con porcentajes más altos en todas las sem.
FIG.1. Porcentajes de aislamientos de poliovirus, EVNP y adenovirus según semanas.
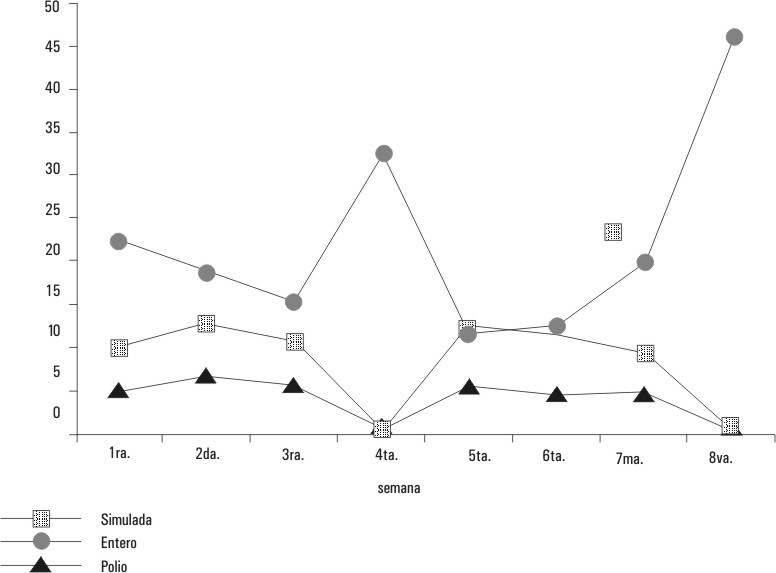
En la figura 2 se presentan la curva de circulación de EVNP y la curva de circulación por aislamiento de poliovirus, las que son comparadas con la curva simulada de circulación de poliovirus. La curva simulada fue la producida por los 35 poliovirus aislados, más los 29 poliovirus incrementados ocurridos a 15 seroconversiones sin aislamientos homólogos más las 14 reactivaciones en las cuales no tuvieron estímulos antigénicos anamnésicos ni aislamientos homólogos ni heterólogos. El área delimitada entre la curva de circulación por aislamiento de poliovirus y la curva simulada representa gráficamente la circulación silenciosa de poliovirus.
FIG. 2. Circulación de EVNP, poliovirus y curva simulada de aislamientos de poliovirus incrementados con seroconversión
y reactivación sin aislamientos.
Discusión
Se debe explicar algunos aspectos que demuestran la actualidad y vigencia de los resultados obtenidos en 1965, a pesar de los años transcurridos. En primer lugar, la investigación se realizó en niños internados en dos casas cunas en ese año. En Cuba, desde mayo de 1962 existían resultados que permitieron ser interpretados como terminación de la circulación del poliovirus salvaje. La vigilancia de circulación de este poliovirus, mediante la confirmación virológica en las parálisis flácidas agudas (PFA), fue superior a los indicadores establecidos actualmente en el programa mundial de erradicación. Desde mayo de 1962 hasta diciembre de 1965 se estudiaron 37 casos de parálisis flácidas agudas (promedio de 10,3 casos por año).22 Para el período 1990 a 1994, con una población duplicada, se estudiaron 64 PFA (promedio 16 casos por años).3 En ese período se reportaron un caso en 1963 y otro en 1964, ambos por polio tipo 2 en niños menores de un año, y enfermados con un tiempo de incubación posterior a los dos meses de la administración de la vacuna VOP-T. Con esos datos, ambos casos se clasificaron como poliomielitis paralítica asociada a la vacuna por definición. Por tal motivo, los resultados de la investigación se realizaron sin estar interferidos por la circulación de poliovirus salvaje. En segundo lugar, a pesar de los resultados obtenidos hace tantos años, se considera que son interesantes en el contexto del programa de erradicación de la poliomielitis y se pudieran publicar por la importancia de los aspectos de circulación y persistencia de los poliovirus vacunales y su interacción en los cambios de la ecología de los EVNP. En tercer lugar, los resultados con células HeLa, disponibles en aquellos momentos fueron útiles de acuerdo con la sensibilidad y especificidad en relación con los objetivos de interés para esta publicación. Esas reflexiones, que se consideran premisas de la vigencia de esos resultados, permiten la discusión y expresión de algunos criterios que pudieran ser útiles para esclarecer algunos aspectos no completamente explicados actualmente.
Los aislamientos obtenidos en niños con seroconversión y reactivación se correlacionaron con la formulación de la VOP-T empleada (0,5-0,2 -0,3 millones de TCD50 a los polio tipos 1, 2 y 3 respectivamente) y la preexistencia o no de anticuerpos a uno o dos poliovirus. En 8 (88,9 %) de 9 niños que tuvieron seroconversión a polio tipo 2, se obtuvieron 13 aislamientos (144,4 %). Sin embargo, a los poliovirus tipo 1 y 3 que tuvieron 9 y 11 seroconversiones, excretaron 3 niños con ambos polio (33,3 y 27,3 %) y de ellos se aislaron 5 (55,6 %) y 3 (27,3 %) cepas correspondientes. Las diferencias de los aislamientos en los niños excretores de poliovirus de la vacuna, están influenciadas por la preexistencia de uno o dos tipos de anticuerpos, inducidos por la VOP-T. Las nueve seroconversiones al poliovirus tipo 2 se realizaron en niños sin anticuerpos previos a ninguna polio y se obtuvieron los más altos porcentajes de aislamientos (9/13, 144,4 %). De las 11 seroconversiones a polio tipo 3, se demostró que en 3 niños no existían anticuerpos previos, y de ellos, en uno se obtuvo un virus homólogo; de las 11 seroconversiones referidas, 7 niños tenían anticuerpos previos a un poliovirus y se obtuvo un aislamiento homólogo; el niño restante de las 11 seroconversiones, tenía dos anticuerpos previos y también se obtuvo un aislamiento homólogo. Por último, de las 9 seroconversiones a polio tipo 1, en 2 niños que tenían anticuerpos previos a un poliovirus se obtuvieron 3 aislamientos de cepas del virus homólogo en uno, y de los 7 niños que tenían 2 anticuerpos previos se obtuvieron 2 poliovirus homólogos. De esos datos se puede inferir, que la existencia y la cantidad de los anticuerpos preexistentes son una dificultad para obtener los aislamientos en cultivos celulares en niños que fueron infectados con el virus vacunal de la VOP-T. La inferencia es más consistente, ya que los indicadores de la infección son más confiables con la inmunidad que los obtenidos por aislamientos en sistemas celulares. Otro aspecto interesante en este caso, es que de acuerdo con la fórmula de la VOP-T y la estrategia de vacunación, el orden de la infección fue ocurrida a los polio tipos 2, 3 y 1, según la existencia y cantidad de anticuerpos previos, lo cual había sido publicado previamente.23
En la investigación se demostró un total de 36 reactivaciones, de las cuales 1 fue a polio tipo 1, 29 a polio tipo 2 y 6 a polio tipo 3. Las reactivaciones, a diferencia de las seroconversiones, no siempre son por un estímulo antigénico por virus homólogo. En las que tuvieron explicaciones como estímulos antigénicos para las reactivaciones, se encontraron que las seroconversiones a otros virus fueron en 15 (41,7 %) casos (9 seroconversiones a polio 1, una seroconversión a tipo 2 y 5 seroconversiones a tipo 3); en 6 (16,7 %) casos ocurrieron por aislamientos de virus homólogos (5 por polio 2 y l; uno por polio 3); en un caso (2,8 %) tuvo reactivación por aislamiento heterólogo polio 3, en el cual también se presentó reactivación a polio 3, y en 14 (38,9 %) casos en que no reencontró estímulo antigénico. Las posibles causas de las reactivaciones por las seroconversiones fueron: en las 9 seroconversiones a polio tipo 1 se produjo reactivaciones a 6 polio 2 y 3 a polio tipo 3; un caso por seroconversión a polio tipo 2 produjo una reactivación al tipo 3 y 5 seroconversiones a polio tipo 3 produjeron 5 reactivaciones a polio tipo 2. En conjunto, excluyendo las reactivaciones que se encontraron por estímulo anamnesis por seroconversiones (15 casos) y por aislamiento heterólogo (un caso), se encontró que en los 20 restantes se explicaron por 6 (28,6 %) aislamientos homólogos. Esos aislamientos fueron muy pocos y similares a lo encontrado en seroconversiones con anticuerpos previos. Los aislamientos de niños con seroconversión sin anticuerpos previos (12 niños con 14 aislamientos) fueron significativamente más altos (116,7 %) que los obtenidos en conjunto en niños con seroconversión con anticuerpos previos y reactivación, sin ser explicados por estímulo anamnesis (tabla 4), que correspondieron en 38 niños con 13 aislamientos (34,2 %) (p con corrección de Yates = 0,02).
Los títulos de anticuerpos neutralizantes inducidos por seroconversión fueron del orden cercano a 100, y los títulos producidos por reactivaciones, superiores a 1 000, lo cual es conocido como ocurre con los estímulos antigénicos primarios y secundarios.
El TPG de 65,5 en los primeros sueros con reactivación a poliovirus tipo 2, fue significativamente más bajo que los primeros sueros de niños sin reactivación, quienes tuvieron un TPG 211,4 al igual virus (p = 0,005). De esa diferencia se puede inferir que esos niños, como grupo, tenían más posibilidades de infección por los virus de la VOP-T. En esa comparación a los poliovirus tipos 1 y 3, no pudieron tener diferencias por los escasos niños con reactivación. Aunque los datos no fueron presentados en tablas, los TPG a polio tipo 2 en los segundos sueros de 14 niños con reactivación sin encontrar estímulos antigénicos (1 248,3), fueron significativamente más altos (p = 0,0002) que con los TPG de los segundos sueros en niños sin cambios inmunológicos. Se considera que la comparación anterior y la encontrada entre los TPG en segundos sueros con reactivación a polio tipo 2 y 3, con los TPG en los segundos sueros a iguales virus, que fue incrementada a p = 0,000004 y 0,0002 respectivamente, puede inferir como un indicador de circulación silenciosa a los virus.
Chin24 reportó un 75 % de aislamiento de poliovirus de heces si no se detectaban anticuerpos en sueros antes de administrar la VOP, y solo en el 25 % de los niños con anticuerpos inducidos por vacuna antipoliomielítica inactivada (VPI) que mostraron títulos igual o mayor 1:128. Si los anticuerpos fueran inducidos por VOP con igual título, y no encontraran aislamiento de polio de las heces y de la faringe, se recuperaba el virus en un 10 % de niños con anticuerpos entre 1:8-1:64. Estos datos difieren de los referidos por Chin; sin embargo, en su reporte no se especifican los intentos de aislamientos ni la fórmula de la vacuna, pero en este caso las muestras fueron obtenidas semanalmente, después de administrada la VOP-T. Por otro lado, en estos resultados los anticuerpos en los niños fueron inducidos por la VOP-T; por lo tanto, se han encontrado 6 aislamientos con anticuerpos previos en los niños con reactivación, entre los cuales dos fueron infectados con polio tipo 2 y que previamente tenían anticuerpos previos homólogos superiores a título 1:100, y otro fue infectado con polio tipo 3 y preexistencia de anticuerpos homólogos a título 1:64.
Investigaciones posteriores a 1965 demostraron y confirmaron que en Cuba no existe circulación de poliovirus vacunal dos meses después de la segunda dosis de VOP-T aplicada en campañas masivas de vacunación cada año, desde 1962 hasta el presente.3,23,25,26 Sin embargo, con los datos de la seroconversión, reactivación y aislamientos, se puede inferir que la VOP-T confiere una circulación silenciosa autolimitada. Esto se basa en los resultados inmunológicos que son una indicación de infección por los virus de la VOP-T en el curso del tiempo de las campañas. Se han confirmado esos resultados por métodos de cultivos celulares más específicos y sensibles, como las RD (Rhabdomiosarcomas) y Lb20 (fibroblastos de ratón transgénicos)27
Por otro lado, a pesar de los altos porcentajes (27/98, 27,5 %) de niños sin anticuerpos a ningún poliovirus, los cuales se presentaron fundamentalmente en los menores de 2 años de edad, la circulación de poliovirus vacunal tendía a terminar en las 4ta. y 8va. sem (figura 2). Como el número de niños era similar en cada casa cuna en que se tomaron las muestras, fue interesante observar que la casa de aislamiento con una cepa de poliovirus en la 4ta. sem era distinta a la casa en que se obtuvo un aislamiento de poliovirus en la 8va. sem. Con esos datos, se podía pensar en aquellos tiempos, que se terminaba la circulación de poliovirus, lo cual se confirmó posteriormente.3, 23, 30 Una teoría posible es que la contención de la circulación de los poliovirus vacunales estaban influidos por los cambios en la ecología producida entre los EVNP y los poliovirus introducidos en la población en las campañas masivas de corta duración. Sabin et al 28, 29 demostraron que la utilización masiva de la VOP-T en países tropicales con gran infección por EVNP en niños, era más efectiva por la interferencia ocurrida de dichos EVNP, por el uso masivo del poliovirus vacunal.
La curva de circulación de los EVNP se inició con un 22,2 % de aislamiento en la 1ra. sem, y se ha encontrado entre 20-30 % para esos niños de edad y tiempo. 23, 27,30 En la 2da. y 3ra. sem se encontró una disminución hasta 19,0 y 15,5 %, por incrementos de circulación de poliovirus vacunal 7,8 y 6,2 %, según las muestras recibidas. En la 4ta. sem se produjo un 32,6 % de EVNP y solamente 1,0 % de poliovirus. Al administrarse la segunda dosis de VOP-T, se obtuvo de nuevo un bajo porcentaje de EVNP hasta 11,7 y 12,5 % en las sem 5ta. y 6ta., en las cuales se incrementó el porcentaje de aislamiento de polio con 6,4 , 5,2 y 5,4 % en la 5ta. y 7ma. sem. Con una circulación relativamente alta de poliovirus en la 7ma. sem, ya se fue normalizando la circulación de EVNP con 20,6 %. Sin embargo, en la 8va. sem bajó el aislamiento de polio a 1,1 %, mientras se elevó hasta 46,7 los EVNP. Es interesante encontrar que al final de la circulación de poliovirus vacunal administrada en campañas masivas, se produjo un incremento del aislamiento de EVNP por encima de lo que debía considerarse normal para ese período del año y edad de niños. Este fenómeno es más verdadero, ya que se ha encontrado en poblaciones con distintas condiciones (cerrada una vez y abiertas tres veces), con el mismo período del año (4 veces al final de nuestro "invierno"). Además, siempre se ha observado con la VOP-T, 3 veces con las 2 dosis de campañas masivas en niños de < 1 hasta los 2 años de edad, y en una vez con la 2da. dosis. También, se ha observado con dos VOP-T de distintas fórmulas de concentración de los virus.23, 27, 30
De los tipos de las curvas de los poliovirus y EVNP, se puede interpretar que están producidas por las interferencias bis direccional durante las campañas masivas de la vacunación (fig. 1). La primera interferencia fue la producida por los poliovirus vacunales a los EVNP en las sem 2, 3, 5 y 6, y la 2da. por los EVNP a los poliovirus vacunales en las sem 4 y 8.
El primer aspecto de la interpretación de las curvas fue referido anteriormente; sin embargo, el segundo aspecto de las curvas no se ha publicado hasta el presente.
La circulación de los adenovirus no se ha informado como causas de interferencia a los poliovirus vacunales4 y entre el análisis tampoco se pueden encontrar elementos para inferir interferencia en el aislamiento de los poliovirus, los que por otro lado coinciden con los resultados serológicos.
A partir de los datos serológicos en niños con seroconversión y reactivación, su relación con los aislamientos de poliovirus, el incremento de la inmunidad con la VOP-T en campañas masivas y el incremento de la circulación de EVNP por la interferencia del polio vacunal (fig. 2), se puede plantear que existe una circulación silenciosa autolimitada. La circulación silenciosa se demuestra gráficamente por el área delimitada entre la curva de aislamiento de poliovirus y la "curva simulada".
En Israel se describió una circulación peculiar en las poblaciones con alta cobertura de inmunidad, la cual fue identificada como "brotes silenciosos",31 pero las circulaciones prolongadas de los virus derivados de la vacuna en Israel, Egipto,32 República Dominicana y Haití,33,34 Filipinas,35 Madagascar36 u otras, pueden ser "silenciosas" o "no silenciosas", según sea la cobertura de inmunidad.
En Cuba, la circulación de los virus vacunales, obtenidos por aislamientos, y la circulación silenciosa inferida por métodos inmunológicos, se terminaron 2 meses después de concluidas las campañas de vacunación. Esto se ha demostrado en las poblaciones y en el medio ambiente desde los años 1970, mediante numerosos resultados de investigaciones virológicas e inmunológicas que abogan por la rápida autolimitación de la circulación del poliovirus vacunal,3 reafirmados posteriormente.26, 30 Todavía falta conocer la esencia de la causa para explicar la circulación silenciosa que se ha planteado.
Summary
An investigation on seroconversion and circulation of the viruses excreted from the oral polio vaccine (OPV) was made for some years and its results were introduced into the improvement of the program for erradicating this disease. A retrospective analysis of the data showed new results that are still into effect in the context of the program for the world erradication of polio. 98 children under 2 were administered 2 doses of trivalent oral polyo vaccine (T-OPV) with an interval of 4 weeks. Stool samples were obtained weekly from the first dose to 4 weeks after the second dose. Serum samples were taken before vaccination and 4 weeks later. The percentage of isolation of homologous poliovirus in children with no previous antibodies is higher (116.7 %) than the one attained in children with previous antibodies (34.2 %). The percentages of total isolations from poliovirus in children with seroconversion (72.4 %) is higher than those registered in children with booster (167 %). The cases without isolations in seroconversions with previous heterologous antibodies plus the boosters without anamnestic reaction, or homologous isolations allowed to infer a selflimited silent circulation. The interference to the polioviruses by the non-polio enteroviruses, together with the increase of antibodies by the campaigns, caused that the circulations of poloivirus were selflimited shortly after concluding the mass campaign
Key words: POLIOMYELITIS/immunology; POIOMYELITIS/PREVENTION & CONTROL; MASS IMMUNIZATION; POLIO VIRUS VACCINE, ORAL; POLIOVIRUS VACCINES; INFANT.
Referencias bibliográficas
- Ferrer GH, Más Lago P. Estado actual de la campaña de erradicación de la poliomielitis en Cuba. Bol Hig Epidemiol 1967:5:145-55.
- Sabin AB. Vaccination against poliomyelitis in economically underdeveloped countries. Bull World Health Org 1980; 58:141-57.
- Más Lago P. Erradication of poliomyelitis in Cuba: A historical perspective. Bull World Health Org 1999; 77:681-87.
- Maldonado YA, Peña-Cruz V, Sánchez ML, Loga L, Blandón S, Cantwell MF. Host and viral factors affecting the decreased immunogenicity of Sabin type 3 vaccine after administration of trivalent oral polio vaccine to rural mayan children. J Infect Dis 1997;175:545-53.
- Morag A, Abed Y, Schoub BD, Lifshitza A, Zakay-Rones Z. Enteric viral infections in Gaza children-incidence and associated factors and phenomena. Isr J Med Sci 1995;31:49-53.
- Patriarca PA, Wright PF, John TJ. Factors affecting immunogenecity of oral poliovirus vaccine in developing countries: Reriew. Rev Infect Dis 1991;13:926-939.
- Balraj V, John TJ, Thomas M, Mukundan S. Efficacy of oral poliovirus vaccine in rural communities of North Arcot District, India. Inter J Epidemiol 1990; 19:711-14.
- Arya SC. Non-immunological facets of poliovirus vaccines. Vaccine 1990; 8:179.
- Patriarca PA, Laender F, Palmeira G, Couto Oliveira MJ, Lima Filho J, de Souza Dantes MC, Cordeiro MT, Risi JB, Orenstein WA. Randomized trial of alternative formulations of oral poliovaccine in Brazil. Lancet i 1988 :429-33.
- Schatmayr HG, Maurice F, Fujita M, de Fillipis AMB. Serologic evaluation of poliomyelitis oral and inactivated vaccines in an urban low-income population at Rio de Janeiro. Vaccine 4 1986;111-13.
- Schoub BD. A comprehensive investigation of immunity to poliomyelitis in a developing country. Am J Epidemiol 1986;123:316-24.
- Mokhtary T, Sabouri N, Nategh R, Biniaz A, Behzadi S, Malekafzali H, et al. Oral polio vaccination in a semi-tropical rural area of the Islamic Republic of Iran. EMR Health Svcs J i 1986:21-6.
- Oduntan SO, Lucas AO, Wennan EM. The immunologic response of Nigerian infants to attenuated and inactivated poliovaccines. Aun Trop Med Parasitol 1978;72:111-15.
- John TJ. Oral polio vaccination of children in tropics. II. Antibody response in relation to vaccins infection. Am J Epidemiol 1975; 102:414-21.
- Ratmaswamy L, John TJ, Jadhav M. Paralytic poliomyelitis. Clinical and virologic studies. Indian Pediatr 1973;10:443-47.
- John TJ, Jayabal P. Oral poliovaccination of children in the tropics. I. The poor seroconversion rates and the absence of viral interference. Am J Epidemiol 1972;;96:263-69.
- Montefiere DG. Problems of poliomyelitis immunization in countries with warm climates. International conference on the application of vaccines against viral, rickettsial and bacterial diseases of man. WHO. Washington 14-18 December 1970. Washington: WHO;1970:182-85.
- Poliomyelitis Commission, Western Region, Ministry of Health. Nigeria: Poliomyelitis vaccination in Ibadan, Nigeria during 1964 with oral vaccine. Bull World Health Org 1966;34:65-876.
- Lee LH, Lim KA, Tyo CY. Prevention of poliomyelitis in Singapore by live vaccine. Br Med J 1 1964:1077-80.
- Sabin AB. Oral poliovirus vaccine: history of its development and use and current challenge to eliminate poliomyelitis from the world. J Infect Dis 1985; 151:420-35.
- Salk JB, Youngeer JS, Ward EN. Use of color change of phenol red as the indicator in titrating poliomyelitis virus and its antibody in a tissue culture system. Amer J Hyg 1954; 60:214-30.
- Más Lago P, Farran JL, Veiga MR, Cartaya I, Chacón W, Jacobo M, Palomera R, Louzara C, Beltrán J. Aspectos de laboratorio en el control de la poliomielitis en Cuba. Consejo Científico, Ministerio de Salud Pública, Cuba, 1984.
- Más Lago P, Louzara C, Beltrán J, Jacobo M, Palomera R. Circulación de poliovirus en la población infantil de Cuba. Bol Ofic Sanit Panam 1979; 87:443-49.
- Chin TDY. Immunity induced by inactivated poliovirus vaccine and excretion of virus. Rev Infect Dis 6 (Suppl 2) 1984;S369-70.
- Más Lago P, Resik AS, Comellas FMM, Galindo AM, Balmaseda A. Marcador serológico como indicador de no-circulación de poliovirus en Cuba. Rev Cubana Med Trop 1992;44:177-80.
- Más Lago P, Cáceres VM, Galindo MA, Gary HE Jr, Valcárcel M, Barrios J, Sarmientos L, Ávalos I, Bravo JA, Palomera R, Bello M, Sutter RW, Pallansch MA, de Quadros CA. Persistence of vaccine-derived poliovirus following a mass vaccination campaign in Cuba: implications for stopping polio vaccination after global eradication. Inter J Epidemiol 2001;30:1029-34.
- Diaz TJ. Circulación y persistencia de poliovirus vacunal en niños con diferentes dosis de OPV. Tesis para Máster en Epidemiologia. Instituto de Medicina Tropical "Pedro Kouri". Cuba, 2002.
- Sabin AB, Ramos-Alvarez J, Alvarez-Amezquita JW, Pelen RM, Michaela I, et al. Live orally given poliovirus vaccine. Effects of rapid mass immunization on population under conditions of massive enteric infection with other viruses. JAMA 1960; 173:1521-26.
- Sabin AB, Ramos-Alvarez J, Pelen M, Michaels RN, Spigland I, Koch M, Vonsover A, Shulman L, Kew O, Mendelson E. Effects of rapid mass immunization of a population with live oral poliovirus vaccine under conditions of massive enteric infection with other viruses. Live poliovirus vaccine. Second Internac. Confer. Scient. Pub. No. 50 PAHO/WHO 1960; pp 377-85.
- Más Lago P, Gary HE Jr, Sarmiento LP, Cáceres VM, Barrios OJ, Palomera PR, Bello CM, Jimenez P, Pallansch AM, Gonzalez CR. Poliovirus detection in wastewater and stools following an immunization campaign in Havana, Cuba. Inter J Epidemiol 2003 (in press).
- Manor Y, Handsher R, Halmut T, Neuman M, Bobrov A, Rudich H et al. Detection of poliovirus circulation by environmental surveillance in the absence of clinical cases in Israel and the Palestinian authority. J Clin Microbiol 1999;37:1670-75.
- Circulation of a type 2 vaccine-derived poliovirus. Egypto. WER 2001;74:27-29.
- Outbreak of poliomyelitis Dominican Republic and Haití. MMWR 2001;50:147-8.
- Outbreak news. Poliomyelitis, Dominican Republic and Haití. WER 2000;75:397-9.
- WHO. Acute flaccid paralysis associated with circulation vaccine-derived poliovirus, Philippines. WER 2001;76:319-20.
- WHO. Paralytic poliomyelitis in Madagascar. WER 2002;77:241-2.
Recibido: 16 de mayo de 2003. Aprobado: 18 de julio de 2003.
Dr. Pedro Más Lago. Departamento de Virología del Instituto de Medicina Tropical "Pedro Kourí". Apdo. 601, Ciudad de La Habana, Cuba. E-mail: pmasl@ipk.sld.cu
1 Investigador. Laboratorio de Enterovirus. Departamento de Virología.
2 Profesor Consultante. Instituto Superior de Ciencias Médicas de La Habana.