My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Higiene y Epidemiología
Print version ISSN 0253-1751On-line version ISSN 1561-3003
Rev Cubana Hig Epidemiol vol.42 no.1 Ciudad de la Habana Jan.-Apr. 2004
Instituto Nacional de Higiene, Epidemiología y Microbiología (INHEM)
Control de medios de cultivo con empleo de cepas bacterianas autóctonas como patrones secundarios de referencia
Lic. Zulia Weng Alemán,1 Téc. Bárbara Iglesias Hernández,2 Téc. Mercedes Abreu Orta3 y Téc. José Ramón Beltrán Díaz3
Resumen
Se realizó un estudio comparativo entre cepas bacterianas patrones, mantenidas en la colección de cultivos microbianos del Instituto Nacional de Higiene, Epidemiología y Microbiología, y cepas salvajes aisladas en los laboratorios microbiológicos de ensayo del citado centro, para su utilización como patrones secundarios de referencia en el control de la calidad de los medios de cultivo y reactivos. Se probaron en el Departamento de Microbiología Sanitaria 7 medios de cultivo de los de mayor demanda, en el período de octubre de 2001 a noviembre de 2002, para lo cual se utilizaron las técnicas de Miles y Misra (modificadas) e inoculación directa, según los procedimientos de trabajo establecidos para este fin. No se encontraron diferencias en las respuestas obtenidas de los cultivos ensayados durante su verificación en los medios de cultivo, lo que demuestra que las cepas pueden ser útiles en la práctica diaria como patrones secundarios de referencia en el aseguramiento de la calidad microbiológica.
Palabras clave: Cepas bacterianas, medios de cultivo, patrones de referencia, control de calidad.
El control de la calidad en la preparación y evaluación de los medios de cultivo es considerado como una esencial y buena práctica de laboratorio, necesaria para mantener el nivel y la ejecución de cualquier técnica microbiológica. Este es un proceso continuo que se extiende desde las materias primas, a través del productor hasta el producto final utilizado en la meseta.1 Por esta razón, se le confiere una gran importancia y está considerado como uno de los puntos críticos de control en el análisis microbiológico, del cual depende la seguridad de los resultados que emiten los laboratorios de ensayo.
La ejecución de pruebas microbiológicas con calidad exige también de reactivos y colorantes de calidad,2 así como de medios de cultivo y patrones de referencia óptimos. Para lograr resultados satisfactorios y deseados en el campo de la investigación, es necesario disponer de microorganismos que sean capaces de facilitar y garantizar la calidad en el desarrollo del trabajo.
En el Departamento de Microbiología Sanitaria del Instituto Nacional de Higiene, Epidemiología y Microbiología (INHEM) se trabaja desde hace algún tiempo en la disponibilidad de microorganismos para asegurar la calidad del trabajo diario. El empleo de cepas aisladas como microorganismos de ensayo en los laboratorios, que garanticen la calidad de los medios de cultivo y reactivos, es una alternativa posible cuando se tienen limitaciones en la adquisición de material biológico certificado, siempre que la pureza y estabilidad de las cepas sean garantizadas. Con el objetivo de evaluar la utilidad de estos microorganismos en el control interno de la calidad, se realizó un estudio comparativo entre cepas bacterianas salvajes y cepas patrones de referencia primaria, para lo cual se probaron 7 medios de cultivo, producidos en el laboratorio de medios de cultivo del INHEM, entre octubre de 2001 y noviembre de 2002, para el examen microbiano de muestras ambientales (aguas y alimentos).
Métodos
Se emplearon réplicas de cultivos procedentes de la colección americana de cultivos tipo (ATCC), como Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048, Pseudomonas aeruginosa ATCC 27853, Salmonella typhimurium ATCC 14028, Shigella sonnei ATCC 25931, Enterococcus faecalis ATCC 19433, Proteus vulgaris ATCC 13315, utilizadas como cepas patrones, mientras que como cepas salvajes se probaron cultivos de Escherichia coli 3002 (aislada de agua de consumo), Enterobacter aerogenes 3006 (aislado clínico), Pseudomonas aeruginosa 4001 (agua para hemodiálisis), Salmonella typhimurium 3004 (agua de río), Shigella sonnei (aislada de alimento); Enterococcus faecalis 6001 (aislada de agua consumo) y Proteus vulgaris 3011 (aislado clínico).
Medios de cultivo
El estudio se realizó con 3 medios de cultivo sólidos (agar Mac Conkey (MAC); agar Salmonella-Shigella (SS); agar verde brillante (VB) y 4 medios para la caracterización bioquímica (agar hierro de Kligler; agar citrato de Simmons (Cit); caldo triptona para la producción de indol y caldo rojo de metilo-Voges Proskauer (MRVP) que corresponden a los medios de mayor demanda en microbiología sanitaria, preparados entre octubre de 2001 a noviembre de 2002, según las especificaciones del fabricante y los procedimientos de elaboración establecidos en el área para los medios de cultivo deshidratados, procedentes de las casas comerciales BIOCEN3 y OXOID4 y los preparados a partir de ingredientes básicos (api), respectivamente. Su verificación se ejecutó de acuerdo con la frecuencia de control definida en el laboratorio, que establece realizar el control de la calidad cada vez que se abra un nuevo lote de medio deshidratado y cada 6 meses para el medio en uso, mientras que si es un lote pasado de su fecha de vencimiento, siempre será controlado al igual que los medios de cultivo preparados a partir de ingredientes básicos (api).
Evaluación microbiológica de los medios de cultivo sólidos
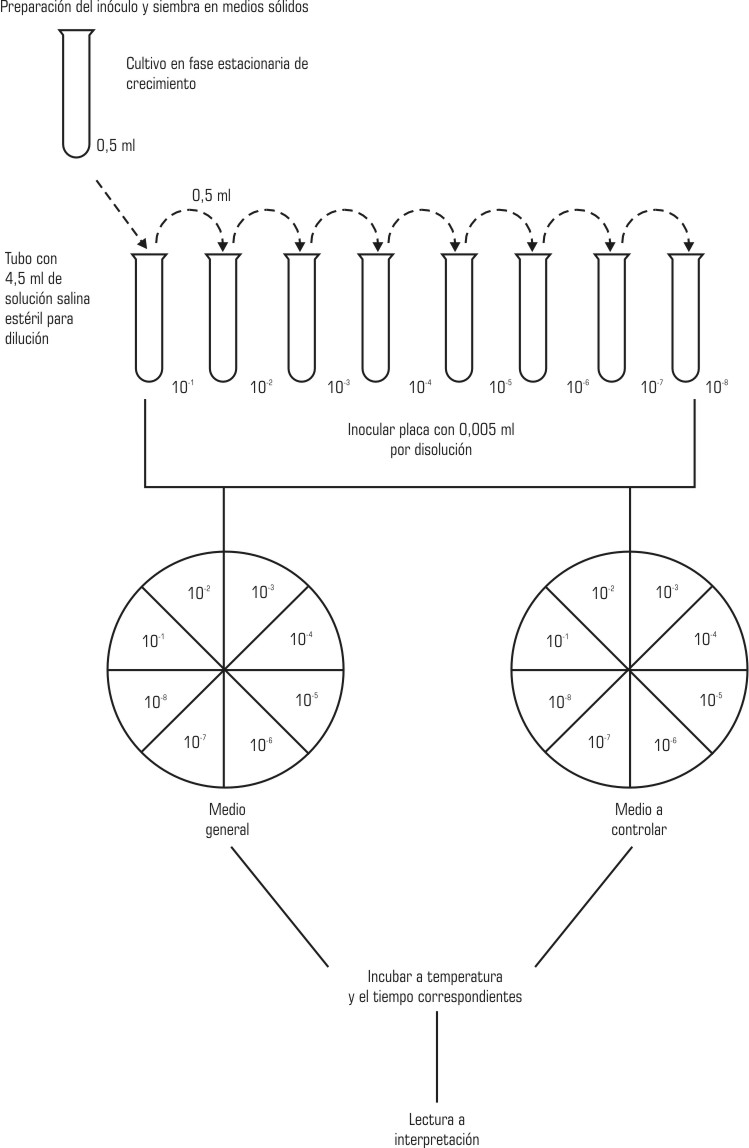
Se prepararon los cultivos de trabajo en caldo cerebro corazón,3 con la incubación a 35 ± 2 ºC durante 18 a 24 h. A partir de los caldos con crecimiento se realizaron diluciones seriadas con solución salina fisiológica, de las cuales se sembraron alícuotas de 5 µL de cada dilución con pipeta Eppendorf, en cada placa de medio a probar (MAC, SS y VB), la que estaba dividida en 8 sectores radiales. Se probaron las 8 diluciones por cepa (figura). Para el análisis de las muestras se utilizó la técnica de Miles y Misra "modificada" (López N. Procedimiento de control de la calidad de los medios sólidos. En: INHEM, eds. Manual de procedimientos del área de control de la calidad. 2 ed. La Habana: INHEM, 1998:5-7), y como medios de referencia, agar nutriente y agar sangre.3 Una vez inoculados se dejaron reposar por 30 min para luego incubar a 35 ± 2 ºC por 24 h. La lectura se realizó según los criterios del anteproyecto de norma ramal del MINSAP 1990.
FIG. Procedimiento de trabajo para la evaluación de los medios sólidos.
Cálculos
Se determinaron las UFC/mL y las razones de productividad (RP) de cada medio de cultivo mediante las fórmulas siguientes:
UFC/mL = no x fd x vo (no: número de colonias contables en la primera dilución; fd: factor de dilución; vo: volumen sembrado).
Los rangos de razón de productividad para microorganismos controles positivos en medios selectivos son de 30 a ³ 70 %, mientras que para los microorganismos que no deben crecer son de 0,1 % a 0 %, según el anteproyecto de norma ramal del MINSAP 1990 (López N. Procedimiento de control de la calidad de los medios sólidos. En: INHEM, eds. Manual de procedimientos del área de control de la calidad. 2 ed. La Habana: INHEM, 1998:5-7).
Evaluación microbiológica de los medios para caracterización bioquímica
A partir de los caldos con crecimiento fueron inoculados directamente las cepas de control en cada medio de cultivo, según las características de este. Los medios bioquímicos evaluados fueron agar citrato de Simmons y agar hierro de Kligler,3 caldo triptona para la producción de indol y caldo MRVP (api).
Para cada medio de cultivo se verificó el pH del medio listo para usar, mediante cintas indicadoras de pH VEB (rango 5-9) y Merck (6,5-10), así como su esterilidad, para lo cual una placa o tubo de medio se incubó durante 24 h a 35 ± 2 °C.
Resultados
La tabla 1 muestra los resultados del control de la calidad de los medios de cultivo sólidos, mientras que la tabla 2 ilustra los datos del chequeo de la calidad de los medios utilizados en las pruebas bioquímicas. Ningún medio de cultivo fue descartado por contaminación que indicara fallas en la esterilidad ni en el pH de los medios listos para usar.
Tabla 1. Resultados del control de la calidad de los medios de cultivo sólidos; INHEM, 2002.
| Microorganismos de ensayo | Medios de cultivo evaluados | ||
| Agar Mac Conkey | Agar Salmonella-Shigella | Agar verde brillante | |
| n = 20 | n = 17 | n = 17 | |
| Promedio RP | Promedio RP | Promedio RP | |
| Escherichia coli ATCC 25922 | 95 % | 0,1 % | 50 % |
| Escherichia coli 3002 | 100 % | 0 % | 35 % |
| Salmonella typhimurium ATCC 14028 | 110 % | 75 % | 80 % |
| Salmonella typhimurium 3004 | 104 % | 80 % | 82 % |
| Enterococcus faecalis ATCC 19433 | 0,1 % | - | - |
| Enterococcus faecalis 6001 | 0,1 % | - | - |
| Proteus vulgaris ATCC 13315 | - | - | 70 % |
| Proteus vulgaris 3010 | - | - | 70 % |
Total de controles realizados (n); no se evaluó (-).
Tabla 2. Datos del chequeo de la calidad de los medios utilizados en las pruebas bioquímicas; INHEM, 2002.
| Microorganismos de ensayo | Medios de cultivo evaluados | |||||||
| Agar hierro de Kligler | Cit | CTI | RM | VP | ||||
| Glu | Lac | Gas | H2S | |||||
| Escherichia coli ATCC 25922 | + | + | + | - | - | + | + | - |
| Escherichia coll 3002 | + | + | + | - | - | + | + | - |
| Enterobacter serogenes ATCC 13048 | NP | + | - | - | + | |||
| Enterobacter aerogenes 3006 | NP | + | - | - | + | |||
| Salmonella typhimurlum ATCC 14028 | + | - | + | + | + | NP | NP | NP |
| Salmonella typhimurlum 3004 | + | - | + | + | + | NP | NP | NP |
| Shigella sonnel ATCC 25931 | + | - | - | - | - | NP | NP | NP |
| Shigella sonnel | + | - | - | - | - | NP | NP | NP |
| Pseudomonas aeruginosa ATCC 25923 | - | - | - | - | NP | NP | NP | NP |
| Pseudomonas aeruginosa 6001 | - | - | - | - | NP | NP | NP | NP |
| Total de controles realizados | 30 | 30 | 35 | 35 | 35 | |||
Fermentación de glucosa y lactosa (Glu y Lac); producción de gas y sulfúrico (Gas y H2S); agar citrato de Simmons (Cit); caldo triptona para la producción de indol (CTI); rojo de metilo (RM); Voges-Proskauer (VP); respuesta positiva (+); respuesta negativa (-); no procede (NP).
Discusión
El control de reactivos, colorantes, medios de cultivo y patrones de referencia constituye uno de los parámetros más importantes para garantizar la calidad de las investigaciones en el campo de la microbiología.
Del análisis de la tabla 1, se aprecia correspondencia entre los porcentajes de recobrado de las cepas evaluadas (referencia y salvajes) y la selectividad del medio para el total de controles ejecutados. La totalidad de los chequeos realizados al medio agar Mac Conkey correspondió a un lote vencido (fecha de caducidad: 1998, verificado cada vez que se preparó) mientras que para los medios agar verde brillante y agar Salmonella-Shigella, un 50 y un 60 % correspondieron a la apertura de frascos de nuevos lotes y en tiempo (2 de cada medio con fecha de caducidad: 2002) y un 50 y 40 % a lotes vencidos (2 de agar VB y 3 de agar SS), respectivamente, lo que pudiera explicar el dato relativo al recobrado de las cepas de Escherichia coli para el medio agar verde brillante.
Por su parte, los datos que muestra la tabla 2 ilustran que el 100 % de las respuestas bioquímicas obtenidas para todos los medios verificados son iguales para ambas cepas de control (referencia y salvaje), lo que justifica su utilización como microorganismos de control siempre y cuando su pureza y estabilidad sean íntegras. Además, estos resultados se corresponden con los obtenidos por Rivas Beades (López N. Procedimiento de control de la calidad de los medios sólidos. En: INHEM, eds. Manual de procedimientos del área de control de la calidad. 2 ed. La Habana: INHEM, 1998:5-7) y Leyva (López N. Procedimiento de control de la calidad de los medios sólidos. En: INHEM, eds. Manual de procedimientos del área de control de la calidad. 2 ed. La Habana: INHEM, 1998:5-7) durante la evaluación de medios de cultivo útiles en el estudio de las características fisiológicas de bacterias de la familia Enterobacteriaceae.5
El 100 % de los controles realizados a los medios agar hierro de Kligler y agar citrato de Simmons correspondieron a lotes vencidos (fecha de caducidad: 1997 y 1998 en cada caso), mientras que todas las evaluaciones realizadas para los medios caldo triptona para la producción de indol y MRVP corresponden a cada una de las veces que se preparó el medio de cultivo, por ser preparado a partir de sus ingredientes básicos.
Consideraciones finales
De los resultados de este estudio se concluye que no se encontraron diferencias significativas entre las respuestas de las cepas bacterianas ensayadas (referencia y autóctonas) durante la evaluación de los medios de cultivo, lo que permite su utilización como microorganismos secundarios de referencia en la evaluación de la calidad de los medios de cultivo y reactivos para ensayos microbiológicos. Por otra parte, se recomienda extender el estudio a microorganismos de otros géneros bacterianos para la verificación de la calidad de medios de cultivo y reactivos.
Summary
A comparative study was conducted between bacterial pattern strains kept in the collection of microbial cultures of the National Institute of Hygiene, Epidemiology and Microbiology and wild strains isolated in the microbiological assays laboratories of this center in order to be used as secondary reference patterns in the quality control of the culture media and reagents. 7 culture media of the most demanded were tested at the Department of Health Microbiology from October, 2001, to November, 2002. Miles and Misra's techniques (modified) as well as the direct innoculation technique were used according to the working procedures established to this end. No differences were found in the responses obtained from the cultures tested during the verification in the culture media, which proves that the strains may be useful in the daily practice as secondary reference patterns in the assurance of microbiological quality.
Key words: Bacterial strains, culture media, reference patterns, quality control.
Referencias bibliográficas
- Snell JJS. Quality control in microbiology. En: Barrow GI., Feltham RKA, eds. Cowan & Steel´s manual for identification of medical bacteria. 3 ed. Cambridge: University Press, 1999:p.184-218[ STANDARDIZEDENDPARAG]
- Ortega Y, Quevedo F. Control de la calidad en los laboratorios de microbiología sanitaria. 1 ed, México DC: OPS/OMS, 1991:p.152[ STANDARDIZEDENDPARAG]
- Rodríguez C. Manual de medios de cultivo. 2 ed, La Habana: BIOCEN, 2001:p.200.
- OXOID. Manual. Barcelona: UNIPATH;1995:p.389.
- Garrity GM, Winters M, Searles DB. Taxonomic outline of the prokaryotic genera. Bergey´s Manual of Systematic Bacteriology. 2nd ed. New York: Springer Verlag, 2001;p.13-4.
Recibido: 7 de marzo de 2004. Aprobado:12 de abril de 2004.
Lic. Zulia Weng Alemán. Instituto Nacional de Higiene, Epidemiología y Microbiología (INHEM). Infanta 1158 e/ Llinás y Clavel, Centro Habana, Ciudad de La Habana, Cuba. e-mail: weng@infomed.sld.cu
1 Licenciada en Ciencias Farmacéuticas. Aspirante a investigadora.
2 Técnica en Procesos Biológicos. Adiestrada.
3 Técnico A en Laboratorio Sanitario.