Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Higiene y Epidemiología
versión On-line ISSN 1561-3003
Rev Cubana Hig Epidemiol vol.52 no.1 Ciudad de la Habana ene.-abr. 2014
ARTÍCULO ORIGINAL
Eventos adversos en la vacunación de menores de 2 años, Hospital Pediátrico de Centro Habana (2002-2007)
Adverse events associated with the vaccination of children under 2 at the children's hospital in the municipality of Centro Habana (2002-2007)
Dra. Addys María Díaz Piñera,I MsC. Iván Edelberto Cuevas ValdespinoII
I Departamento de Salud Pública. Instituto Nacional de Higiene, Epidemiología y Microbiología (INHEM). La Habana, Cuba.
II Instituto Finlay. Centro de Investigación-Producción de Vacunas. La Habana, Cuba.
RESUMEN
Introducción: a partir de la notificación de los profesionales de la salud se recopila información acerca de las reacciones adversas, que aunque sólo son sospechosas de su posible asociación con medicamentos utilizados (incluidas las vacunas), sirve para generar señales de posibles riesgos nuevos que permiten tomar medidas reguladoras.
Objetivo: determinar los resultados exploratorios de la búsqueda activa los eventos adversos graves a vacunas detectados en niños menores de 2 años ingresados en el Hospital Pediátrico de Centro Habana durante el período 2002-2007.
Métodos: se estudió 13 912 egresos hospitalarios en menores de 2 años durante el periodo 2002 al 2007. En un diseño observacional de serie de casos de carácter retrospectivo en el Hospital Pediátrico de Centro Habana, utilizando los registros hospitalarios, historias clínicas, registros y tarjetas de vacunación en vacunatorios centrales y consultorios médicos.
Resultado: se detectó 83 casos con diagnósticos de eventos adversos a la vacunación, que representan el 0,6 % [IC 95 % (0,48-0,74)], y de ellos, 43 casos de eventos adversos relacionados causalmente con las vacunas que fueron detectados mediante la combinación de búsqueda pasiva y activa de casos. Los eventos más frecuentes fueron, fiebre, celulitis, abscesos, convulsión e irritabilidad asociados a las vacunas DPT y sus combinaciones, el desenlace fue satisfactorio en el 93 % de los casos.
Conclusiones: la exploración de la búsqueda activa de eventos adversos a vacunas, mostró la posibilidad de detectar diagnósticos loables de ser considerados eventos adversos a la vacunación, lo que brinda la posibilidad de completar los datos de farmacovigilancia de vacunas en los servicios de pediatría en hospitales.
Palabras clave: vacunas, farmacovigilancia, serie de casos.
ABSTRACT
Introduction: information about adverse reactions is collected from reports submitted by health professionals. Even when their relationship to drugs administered (including vaccines) is only a suspicion, such information might hint at potential new risks, thus allowing to take regulatory action.
Objective: determine the exploratory results of the active search for serious adverse events associated with the vaccination of children under 2 hospitalized in the children's hospital of the municipality of Centro Habana from 2002 to 2007.
Methods: a study was conducted of 13 912 hospital discharges of children under 2 from 2002 to 2007. The study followed an observational retrospective case-series design. Data were obtained from hospital records, medical records, and vaccination records and cards from central immunization centers and doctor's consultation offices.
Result: vaccine-related adverse events were found in 83 cases, representing 0.6 % [CI 95 % (0.48-0.74)], of which 43 were detected by a combination of passive and active screening. The most common events were fever, cellulitis, abscesses, convulsions and irritability, associated with DPT vaccines and their combinations, with a satisfactory development in 93 % of the cases.
Conclusions: exploration of the active screening of vaccine-related adverse events revealed the possibility of obtaining accurate diagnoses providing pediatric services in hospitals with relevant pharmacovigilance data about vaccination.
Key words: vaccines, pharmacovigilance, case series.
INTRODUCCIÓN
La práctica de inmunizaciones constituye una de las más prósperas, ventajosas y efectivas intervenciones de salud para la prevención de enfermedades infecciosas, con impacto positivo sobre la reducción de la morbilidad, mortalidad y crecimiento poblacional.1
Las vacunas, aunque son bastante inocuas, no están exentas de riesgo de eventos adversos o experiencias no deseables en el ser humano, cuestión muy difícil de determinar en los primeros años de vida donde se aplica la mayor parte de las vacunas que se administran durante toda la vida. Con un intervalo relativamente corto, entre una dosis y otra. Además, el lactante se pone en contacto con muchas enfermedades infecciosas, o se manifiesta por vez primera enfermedades que se venían desarrollando desde una etapa muy temprana de la vida.2-7
Se considera Evento Temporalmente Asociado con las Vacunas (ETAV) a cualquier incidencia médica perjudicial que se puede presentar asociada temporalmente a la vacunación y ocurre dentro de los 30 días siguientes a la administración de una o más vacunas. Independientemente, de su gravedad o severidad y sin juicio de la causalidad. Estos eventos suelen afectar la salud del individuo e influyen de manera negativa sobre los padres de los niños afectados, al percibir la vacunación como la responsable del daño.4,5,8,9
Los ETAV pueden variar desde una simple reacción local que son las más comunes y se resuelven sin tratamiento, hasta manifestaciones sistémicas graves que suelen ser muy raras y pueden amenazar la vida del paciente, ocasionar hospitalización, discapacidad parcial o total e incluso la muerte.3-5,8
La vigilancia permanente de la seguridad de los medicamento y en especial de las vacunas una vez que han sido aprobados y generalizado su uso (farmacovigilancia) permite la detección precoz de estos eventos; prevenir su ocurrencia, limitar los daños y ampliar la información sobre el perfil de seguridad en condiciones reales de los servicios de salud. La vigilancia es una responsabilidad compleja y compartida entre los gobiernos, la industria farmacéutica, los agentes de salud y los pacientes.4,5,10,11
En la mayoría de los países, la piedra angular de los sistemas de vigilancia son los mecanismos de notificación pasiva o espontánea (búsqueda pasiva) de los eventos adversos, lo cual es sumamente bajo, sobre todo a nivel de la atención secundaria. Por lo que se hace necesario para mejorar la notificación de estos eventos la implementación de un sistema de vigilancia donde los datos provenientes de la vigilancia activa (búsqueda de casos entre los ingresos hospitalarios) complemente los datos de la vigilancia pasiva, como un procedimiento viable e indispensable para incrementar la validez y sensibilidad en la vigilancia de eventos adversos.11-16
Existen referencias sobre las diferencias entre farmacovigilancia pasiva y la farmacovigilancia activa, así como de las razones por las cuales la notificación no es suficiente.11,12La farmacovigilancia activa o vigilancia proactiva de la seguridad, significa que se adoptan medidas solícitas para detectar eventos adversos. La metodología más completa es el “Cohort Event Monitoring” (monitoreo de eventos en cohortes). Ejemplo de la utilización de estas metodologías son; el programa de monitoreo intensivo de medicamentos de Nueva Zelandia (IMMP), el monitoreo de eventos luego de la prescripción de medicamentos de Inglaterra (PEM) entre otros,17-19 quedando registrados en sitios centinelas todos los eventos clínicos, y no sólo las sospechas de reacciones adversas; mediante preguntas directas a los pacientes o detección de estas manifestaciones entre los registros documentales, la vinculación de bases de datos y evaluación de los resultados de los laboratorios médicos.16,18-24
La evaluación de la causalidad es un componente fundamental de la vigilancia de los eventos adversos postvacunales; fomenta la confianza en los programas nacionales de vacunación, y consiste en el análisis de la probabilidad de una asociación causal entre un fármaco (la vacuna) y la aparición de un evento adverso.
El evento adverso u enfermedad, siempre es un fenómeno de origen multicausal; el medicamento sólo representa un factor contribuyente más dentro de las posibles etiologías y factores de riesgo que conforman el entorno clínico de un paciente. Pocas veces se puede identificar una causa que sea a la vez suficiente y necesaria para que se produzca un evento adverso o enfermedad, es decir, que sea el único factor causal de un evento.5
Con la garantía de la atención médica en los hospitales pediátricos de nuestro país, están creadas las condiciones para ser considerados sitios centinelas en la vigilancia de eventos adversos a la vacunación, a través de la combinación de búsqueda activa-pasiva de casos, lo que permitiría además de mejorar el seguimiento de los eventos adversos, detectar y actuar de manera integra y oportuna sobre aquellos eventos adversos graves que pueden poner en riesgo la vida del paciente; por lo que constituiría un elemento de fortaleza para el programa materno infantil.
El objetivo del artículo es determinar los resultados exploratorios de la búsqueda activa de eventos adversos a vacunas detectados entre niños menores de 2 años ingresados en el Hospital Pediátrico de Centro Habana durante el período 2002-2007.
MÉTODOS
Se realizó un estudio descriptivo de la serie de casos de eventos adversos a vacunas detectados con carácter retrospectivo que requirieron ingreso en el Hospital Pediátrico de Centro Habana en el período del 2002 al 2007.
El universo estuvo representado por los 13 912 egresos hospitalarios en menores de 2 años durante el periodo analizado, entre los cuales se buscaron los casos egresados con manifestaciones que cumplieran la definición de eventos adversos a vacunas.
Las variables analizadas fueron: diagnóstico y localización de las manifestaciones clínicas detectadas, tipo de vacuna administrada, causalidad y desenlace.
Para completar la información fue necesario realizar una búsqueda activa de datos. La fuente de información la constituyó los registros de egresos hospitalarios, las historias clínicas de casos considerados eventos adversos graves, registro de vacunación en los vacunatorios centrales, y tarjetas o carnet de vacunación.
Para este trabajo se consideraron los documentos que reglamentan la vigilancia de eventos adversos post vacunales en la OMS y el Ministerio de Salud Pública.3,5,6
Se consideró:
- Criterio de caso con evento adverso a vacunas: a todo niño ingresado ‹ de 2 años, con acontecimientos médicos que ocurrieron hasta 4 semanas después de la vacunación y que reuniera alguna de las condiciones siguientes: presentar algunas de las manifestaciones clínicas esperadas para todas las vacunas administradas en ese grupo de edad, diagnósticos de “reacción vacunal” o que en la discusión diagnóstica se valoró la posibilidad de que fueran manifestaciones clínicas relacionadas con la vacunación y cuya etiología no estuviera bien precisada. Se utilizó la Clasificación Internacional de Enfermedades CIE-10.25
- Criterio de caso con relación causal: es aquel que después del análisis de la causalidad, se demuestra que la vacuna o acciones alrededor de ésta fueron la que provocaron la aparición del evento adverso. Se realizó de acuerdo a lo regulado por la autoridad regulatoria cubana, Centro Estatal para Control de Calidad de los Medicamentos, (CECMED).5
La información se introdujo en una base de datos confeccionada al efecto, utilizando el programa de Excel, y para su procesamiento estadístico se usó el programa EpiInfo versión 6.1. Se calcularon frecuencias absolutas, porcentajes e intervalos de confianza, cuyos resultados se reflejaron en tablas.
RESULTADOS
De 13 912 egresos hospitalarios en menores de 2 años durante el periodo 2002 al 2007, se detectaron 83 casos con diagnósticos de eventos adversos a la vacunación, que representan el 0,6 % [IC 95 % (0,48-0,74)].
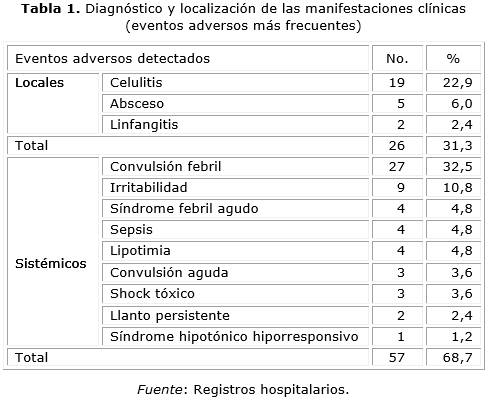
Según su localización el 68,67 % de estas manifestaciones clínicas se correspondió con eventos sistémicos como se puede apreciar en la tabla 1.
De las manifestaciones locales raras, la celulitis fue la manifestación clínica que más se expresó en este estudio (22,9 %) seguida de los abscesos (6,08 %) y las linfadenitis (2,4 %). A pesar de no ser una manifestación realmente grave, fueron consideradas como tal porque requirieron de hospitalización, se presentaron por más de 3 días en el 100 % de los casos y en un 15,7 % se extendió a más de una articulación, ocasionando impotencia funcional en el 66,6 % de estos pacientes. Todos respondieron de forma satisfactoria a la antibioticoterapia y en el 94,7 % de los casos no quedaron secuelas.
Las vacunas relacionadas con este evento fueron DPT (vacuna contra difteria, tétano y tosferina) - Hib (Quimihib, vacuna contra el Haemophylus influenza tipo b) en 7 casos (36,8 %), la DPT y la aplicación simultanea de Tetravalente (vacuna contra difteria, tétano, tosferina y hepatitis B) - Hib con 3 casos cada una para 15,8 %.
Los abscesos y linfadenitis por BCG así como sus complicaciones son eventos definidos como frecuentes. En este estudio, el 60 % de los abscesos fue provocado por la vacuna DPT, 2 de ellos llegaron a fistulizar (40 %). El 100 % de las linfadenitis supurativas se relacionó con la vacuna BCG, aparecieron en la región axilar del mismo lado de la inoculación, con una evolución que duró entre 2 y 3 meses. La evolución fue satisfactoria en la mayoría de los casos.
Dentro de las manifestaciones sistémicas predominó la fiebre como síntoma acompañante y como diagnósticos las convulsiones febriles y la irritabilidad. La fiebre posterior a la administración de vacuna fue el evento más sobresaliente de este estudio (56,6 %), presente en los diferentes diagnósticos principales. Esta no sobrepasó los 40 °C con excepción de 1 caso. Se manifestó como signo acompañante en el 51,8 % de los diagnósticos y como manifestación principal en el 4,8 % de los casos. Todas las vacunas estuvieron asociadas a este evento, aunque las vacunas con componente pertussis y la aplicación simultánea de estas con otras resaltaron en 40,9 %. La fiebre no persistió por más de 2 días en el 91,3 % de los casos.
Las convulsiones fueron generalizadas, la temperatura osciló entre 38° y 39 °C en el 82,5 % de los casos, con una evolución satisfactoria (96,3 %) y una estadía promedio de 4 días/pte. El 81,5 % de estos niños se mantuvo bajo seguimiento por neurología.
De las 27 convulsiones febriles detectadas, 17 fueron inducidas por la vacuna DPT y la aplicación simultanea de esta con otras vacunas. La irritabilidad fue otra de las manifestaciones observadas 10,8 %, secundaria a las vacunas que contienen DPT (44,4 %) y a la aplicación simultanea de BCG y HBV (vacuna contra la hepatitis b) con 22,2 % respectivamente. Este evento apareció dentro de las primeras 24 horas posteriores a la aplicación de la vacuna, como síntoma acompañante del dolor en el sitio de inyección (11,11 %), cianosis (30,0 %) y de las manifestaciones en piel (44,4 %). Todos los casos evolucionaron de manera adecuada con una estadía promedio de 2,1 día/pte.
Entre los eventos sistémicos raros está el síndrome hipotónico hiporresponsivo, representó el 1,2 % se asoció a la vacuna DPT, se inició de forma súbita a las pocas horas de la vacunación, con pérdida de la tonicidad muscular, evolucionó de forma favorable y desapareció de forma espontánea sin dejar secuelas neurológicas, con una estadía hospitalaria de 2 días.
En el 56,6 % de todos los eventos detectados (tabla 2) se pudo constatar que las vacunas con componente pertussis (DPT y sus combinaciones) estuvo presente, sola o en aplicación simultánea, seguidas de las inclasificables (10,8 %), AMC (Vamengo BC) y Hib con (8,4 %) respectivamente.
La DPT es la vacuna que junto con el Hib más se aplica durante este período de la vida, 3 dosis y un refuerzo a los 18 meses. A pesar de su reactogenicidad, ellas continúan siendo utilizadas en todo el mundo debido a su efectividad en la prevención de la tos ferina. Es por ello que la Organización Mundial de la Salud aún recomienda su inclusión en los programas nacionales de inmunización, independientemente del surgimiento de las vacunas acelulares, que son menos reactogénicas.26
Inclasificable: fueron consideradas aquellos casos donde la madre o familiar refiere que el niño fue inmunizado próximo al desarrollo del evento por el cual ingreso, pero no existen evidencias de la misma.
Al analizar la causalidad general de los eventos adversos, de los 83 eventos detectados, el 51,8 % (43 casos) lograron estar relacionados causalmente con las vacunas. Predominó la categoría probable con 65,1 % en 28 de los eventos. En esta categoría se incluyó todo aquel evento que guardó relación temporal con la administración de la vacuna e improbablemente pueda ser explicado por otra alternativa.
Se expresaron en un mayor por ciento las vacunas con componente pertussis y la aplicación simultanea de esta con otras vacunas 71,4 % (20 casos), BCG 14,2 % (4 casos), HBV 7,2 % (2 casos) y AMC-BC y Hib con 1 caso cada uno (3,6 %). Los diagnósticos relacionados con estas vacunas fueron: celulitis (63,1 %), abscesos (80 %), convulsión febril (18,5 %), irritabilidad (22,2 %), adenitis (50 %). La mayoría de los eventos que tuvieron este tipo de causalidad se encuentran dentro de las manifestaciones esperados para estos tipos de vacunas (tabla 3).
Las causas definitivas ocuparon el 18,6 % (8 casos) el diagnóstico más representativo en esta categoría fue la celulitis con 4 casos (50 %) asociada a vacunas con componente pertussis. En esta categoría el evento además de guardar una relación temporal razonable con la administración de la vacuna, no puede ser explicado por la concurrencia de enfermedades o de otros medicamentos o productos químicos.
De los casos catalogados como no relacionados, 40 casos (48,2 %) fueron aquellos donde el evento además de no guardar relación temporal con la administración de la vacuna, podía ser explicado por la presencia de enfermedades subyacentes u administración de medicamentos o productos químicos.
Entre estos, el evento que predominó fue las convulsiones febriles con 15 casos. Los eventos inclasificables (15 casos, el 37,5 %) fueron aquellos donde no existía información suficiente que permitiera la evaluación e identificación de la causa.
Es de destacar que de los 43 eventos adversos relacionados con la vacunación (30) el 69,8 % se detectó luego de la administración de vacunas combinadas donde el componente pertussis estaba presente en diferentes formulaciones.
El desenlace de los casos relacionados con la administración de vacunas se refleja en la tabla 4, de los 43 eventos adversos catalogados con esta condición. El 93,0 % tuvo un desenlace satisfactorio, sólo en el 7,0 % (3 casos) quedaron secuelas, dos fístulas secundarias a abscesos (uno de ellos, lactante de 8 meses, quien tuvo una evolución tórpida con seguimiento y tratamiento por más de 4 años) y una epilepsia luego de una convulsión febril simple donde se recogieron antecedentes patológicos familiares de primera línea (convulsión febril en el padre), y el que a partir de este primer cuadro convulsivo, la niña presentó 5 crisis (2 de ellas sin fiebre).
A pesar de que el desenlace fue satisfactorio de forma general, la evolución de las manifestaciones locales raras (abscesos y celulitis) fue lenta en el 37,7 % de los casos, dado por el tiempo de resolución de las mismas mayor de 5 días.
DISCUSIÓN
En Cuba la vigilancia de eventos adversos a las vacunas, es fundamentalmente a predominio de la búsqueda pasiva y aproximadamente el 95 % de la misma es a expensas del Nivel Primario de Atención. Lo que se corresponde con la mayoría de los países del mundo, a excepción de Canadá Inglaterra, Francia, Suiza, Nueva Zelanda, donde se realiza además, vigilancia activa de eventos adversos a la vacunación, a través de la búsqueda de casos entre los ingresos hospitalarios, disminuye de esta forma los subregistros relacionados con esta causa, lo cual se evidencias en algunos estudios realizados.15-18,27,28
Existen eventos adversos a las vacunas que forman parte de la respuesta inmunitaria normal del organismo. Sin embargo, hay otros factores o condiciones que favorecen la aparición de los mismos como, la susceptibilidad individual, la composición de las vacunas donde se incluye los adyuvantes, conservantes, componente propios (Ejemplos: el Hidróxido de Aluminio, Tiomersal, el componente Pertussis) y los errores programáticos responsables de muchas de las manifestaciones locales y sistémicas, estos pueden presentarse en un periodo de tiempo variable que pude ir de minutos u horas a semanas o meses.5-7,29-32
La mayor parte de las reacciones vacunales son locales y leves, su recuperación no exigen tratamiento y no producen ninguna consecuencia a largo plazo; sin embargo, en este estudio existió un predominio de los sistémicos. Las vacunas que más se relacionaron con las reacciones vacunales de forma general fueron la BCG y las que contienen además del componentes pertussis el hidróxido de aluminio (DPT, sus combinaciones aplicaciones simultaneas).4,6,30,31
Según la literatura revisada en el contexto internacional, los eventos adversos por errores programáticos constituyen el 95 % de estas causas (errores que van desde la conservación, almacenaje, manipulación, transportación o en la administración de las vacunas). Por ejemplo, la aplicación demasiado superficial de la vacuna (subcutánea en vez de intramuscular) o en el sitio inadecuado, bulbo mal agitado, reutilización de las jeringuillas y agujas desechables, vacuna o diluyente contaminado, preparación incorrecta de vacunas, reutilización de vacunas reconstituidas el día anterior (en caso de vacunas multidosis) y a la acción irritante del hidróxido de aluminio; utilizado como coadyuvante de algunas de las vacunas que se aplican en nuestro esquema de inmunización. Estos errores pueden conducir a un conglomerado de eventos sobre todo si no se cumple con las buenas prácticas de vacunación.4,7,30-32
Los abscesos por DPT y linfadenitis por BCG son eventos frecuentes, generalmente se asocian a errores en la técnica de administración y a infecciones sobreañadidas. En el caso de la DPT, se ha comprobado que puede ocasionar entre un 40 y 80 % de eventos locales leves, que aumentan con el número de dosis y suelen ser más intensas cuando la inyección se aplica a nivel subcutáneo y el hidróxido de aluminio es adsorbido a este nivel provocando acción imitativa en las inmediaciones del sitio de inyección. Existen evidencias de una disminución considerable de la frecuencia de estos eventos, cuando se reducen las concentraciones de hidróxido de aluminio presentes en estas vacunas. Las celulitis se asocian más a reacciones de hipersensibilidad.4,6,7
Los eventos adversos sistémicos son poco habituales en relación con los locales, representan alrededor el 10 % en los pacientes vacunados, salvo en el caso de la vacuna DTP, los más usuales son fiebre, irritabilidad, dolor muscular, malestar general. Las reacciones sistémicas raras son todavía menos frecuentes que las anteriores como convulsiones febriles, anafilaxia, síndrome hipotónico hiporresponsivo, trombocitopenia e irritabilidad según referencias bibliográficas,4,6,30 sin embargo, algunas de ellas se distinguieron en este estudio.
La fiebre se considera una reacción normal del organismo ante la presencia de diversos estímulos (inmunógenos, metabolitos, condiciones tóxicas, etc.), se presenta con una frecuencia, que oscila entre el 1 % y 50 % de los vacunados, según numerosos estudios, sin embargo, difiere en que la temperatura nunca superó los 40,5 °C como es común en los casos vacunados con DPT.6,32,33
Numerosos estudios exponen que las convulsiones febriles son siempre banales, aparece el primer día, en el momento en que la fiebre sube o baja bruscamente, casi siempre es superior a los 38 ºC, y se asocia en un porciento elevado con vacunas donde el componente pertussis está presente, lo que coincide con nuestros hallazgos. Su evolución depende de su duración y del número de convulsiones acontecidas en el mismo proceso febril.4,6,7,34,35
La literatura señala que los niños con mayor tendencia a tener convulsiones en presencia de fiebre, son aquellos que presentan una predisposición, o sea que lo heredan de sus padres; es por tanto, probable que alguno de sus progenitores haya tenido convulsiones febriles cuando eran pequeños. Este antecedente está presente entre un 20-30 % de los casos.
En el estudio, convulsiones febriles se expresaron en un número importante de casos. Se recogieron antecedentes patológicos prenatales en el 22,2 % de los casos y familiares 29,6 %., todos ellos superaban los 4 meses de edad, lo que aumenta aún más el riesgo para desarrollar este tipo de entidad.4,6,34,35 Los factores de riesgos que más sobresalieron fueron partos distócicos, hipoxia fetal, antecedentes de epilepsia y convulsión febril de 1era línea.
Esta investigación concuerda con otros estudios que señalan a la irritabilidad como una manifestación frecuente de las vacunas con componente pertussi.3,6 Sin embargo, difiere en que la irritabilidad se asocia con mayor frecuencia a la fiebre y dolor, pues en este estudio se asoció además, a otros signos y síntomas.30,36,37
En cuanto a la reactogenicidad de las vacunas, como se pude apreciar en la tabla 2, el 51,8 % de los eventos que se produjeron estuvo asociada a la DPT, generalmente las vacuna contra la HVB, Antimeningocóccica BC o Vamengo y Hib son más inocuas, se relacionan con reacciones locales mínimas (leves), mientras que los eventos adversos graves son poco comunes.4,7
Diversas publicaciones confirman que el componente de células enteras de B pertussis es en gran parte, pero no exclusivamente el responsable de las reacciones que aparecen luego de la administración de DPT. Refieren además, que con una dosis de esta vacuna no sólo pueden aparecer efectos locales como dolor, inflamación y enrojecimiento en la zona de aplicación, también se pueden manifestar abscesos estériles o bacterianos de la misma manera, convulsiones, llanto persistente y grito estridente que pueden persistir durante más de 20 horas, manifestaciones que se vieron reflejadas en menor intensidad en este estudio, no correspondiéndose con otros hallazgos encontrados en estudios nacionales e internacionales.6,7,30,32
La vacuna cubana contra el Hib (Quimihib) brinda protección a largo plazo, tiene una eficacia cercana al 100 %. Las reacciones adversas de esta vacuna son pocas en sentido general, de escasa intensidad y resuelven espontáneamente en pocos días por lo que no requieren de asistencia médica en la mayoría de los casos.4,6 En estudios nacionales se ha encontrado la irritabilidad y la febrícula, como eventos adversos a esta vacuna, no coincidiendo con nuestros hallazgos donde se asoció a las convulsiones febriles, celulitis y lipotimia, a pesar de que la literatura refiere que las manifestaciones sistémicas son raras e incluso nulas en algunos estudios realizados.4,6,38
La vacuna Vamengo BC, en general, es una vacuna bien tolerada en todos los grupos de edades. Las reacciones locales en el lugar de la inyección, son las más frecuentes y aumentan con la edad, lo cual se ha visto reflejado en otros estudios nacionales9,39 y no en este, donde hubo predominio de las manifestaciones sistémicas como la fiebre leve, irritabilidad, dificultad para conciliar el sueño, vómitos que son frecuentes en niños pequeños, lo cual se ajusta a otros estudios.40,41 La literatura ha reportado otras manifestaciones sistémicas más graves con síntomas sensoriales motores transitorios del sistema nervioso periférico o síndrome purpurico con o sin poliartitis, anafilaxia secundaria a esta vacuna no manifestada en este estudio.9,39,42
Establecer o descartar las relaciones causales entre la aparición de síntomas y signos con la administración de la vacuna, resulta compleja, exige considerar algunos elementos del episodio (como las manifestaciones clínicas, la incidencia natural, los factores etiológicos, etc.); establecer relación cronológica con la exposición a la vacuna según el mecanismo fisiopatológico de producción y el posible efecto de otros agentes o condiciones causantes (como una enfermedad subyacente o la administración de otros medicamentos.5,43
En este estudio la vacuna más relacionada con los eventos adversos fue la DPT y sus combinaciones además de la administración simultánea con Hib. Se ha comprobado que entre los principales problemas asociados al desarrollo de vacunas combinadas está el incremento de la reactogenicidad (por excesiva carga de endotoxina, carga excesiva de toxoides, efectos sinérgicos o aditivos, desplazamiento del antígeno del adyuvante o estimulación de respuestas inmunes excesivas o inapropiadas.43,44
También la presencia de materias primas en los materiales biológicos o químicos que inician el proceso o que se introducen durante la fabricación como estabilizantes, coadyuvantes, preservantes, o en el caso de las vacunas vivas, la existencia de organismos virulentos, son responsables de algunos de estas manifestaciones.6,7
Generalmente casi todas las reacciones vacunales raras, como las convulsiones, trombocitopenia, episodios de hipotonía hiporresponsivo y llanto persistente, se caracterizan por su remisión espontánea y no causan problemas posteriores ni secuelas.4,6
Muchos de estos eventos adversos pueden ser prevenibles, sobre todo los relacionados con errores programáticos, mediante la capacitación del personal en cuanto a la técnica de vacunación, conocimiento de eventos adversos más frecuentes a las vacunas que se administran en el esquema de vacunación cubano. Conducta a seguir ante la aparición de los mismos tanto operativas como de tratamiento, la supervisión del trabajo del personal encargado del mismo y el suministro adecuado de material seguro.4,29,32
La exploración de la búsqueda activa de eventos adversos a vacunas, mostró la posibilidad de detectar eventos adversos a la vacunación que no fueron considerados como tal.
Los eventos adversos más frecuentes fueron fiebre, celulitis, abscesos, convulsiones e irritabilidad, relacionados a vacunas y/o combinaciones donde el componente pertussis estaba presente. En los casos relacionados con la vacunación, según análisis de causalidad, predominó la categoría probable y el desenlace satisfactorio.
RECOMENDACIONES
Es muy conveniente tomar en cuenta estos resultados por la posibilidad de completar los datos de farmacovigilancia de vacunas en los servicios de pediatría en hospitales, lo cual permitiría un mejor conocimiento del perfil de seguridad de las vacunas utilizadas en el programa de inmunización a través de una red de sitios centinelas.
REFERENCIAS BIBLIOGRÁFICA
1. Laporte JR, Armadams X. Detección de reacciones adversas a medicamentos a partir del diagnóstico de ingreso hospitalario. Métodos y resultados. Med. clin 1998;91(3):124-27.
2. Ministerio de Salud Pública. Formulario Nacional de medicamentos. La Habana: Ed Ciencias Médicas; 2006. p. 401-405.
3. Galindo Santana B M, Galindo Sardiñas MA, Pérez Rodríguez A. El sistema de vigilancia de eventos adversos consecutivos a la vacunación de la República de Cuba. Rev Cubana Med Trop [Internet]. 1999 [citado 2 oct. 2012];51(3):194-200. Disponible en: http://www.bvs.sld.cu/revistas/mtr/vol51_3_99/mtr11399.htm
4. Restrepo Restrepo JA, editor. Eventos temporalmente asociados a la vacunación. Manual de procedimientos técnicos [Internet]. México: Secretaría de Salud/CENSIA; 2002 [citado 23 oct. 2012]. Disponible en: http://www.salud.gob.mx/unidades/cdi/documentos/manualetav.pdf
5. Ministerio de Salud Pública. Regulación No. 17 – 2008. Directrices para la investigación de los eventos adversos supuestamente atribuibles a la vacunación o inmunización (ESAVI) [Internet]. La Habana: MINSAP/Centro para el control estatal de la calidad de los medicamentos; 2008 [citado 23 oct. 2012]. Disponible en: http://www.bvv.sld.cu/download.php?url=regulaciones/124412616539.doc
6. Departamento de vacunas y productos biológicos. Información suplementaria sobre seguridad de las vacunas. Parte 2: tasas básales de incidentes adversos consecutivos a la vacunas [Internet]. Ginebra: DVPB/OMS; 2000 [citado 23 oct. 2012]. Disponible en: http://whqlibdoc.who.int/hq/2000/WHO_V&B_00.36_spa.pdf
7. Vacunación segura: Módulo de capacitación. Módulo VI. Sistema de monitoreo de los eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI) [Internet]. Washington, D.C: OPS/Oficina regional OMS; 2007. [citado 23 nov. 2012]. Disponible en: http://www.enfermeriaaps.com/portal/download/VACUNAS/OPS-%20Vigilancia%20ESAVI.pdf
8. Saldaña Hernández PM. Eventos temporalmente asociados a la vacunación (ETAV) [Internet]. México DF: Asociación Mexicana de Farmacovigilancia/CENSIA, SS; 2013 [citado 4 ene. 2013]. Disponible en: http://salud.edomexico.gob.mx/html/doctos/regsan/foros/fv%20hospitales/etav.pdf
9. Cuevas IE, Jiménez G, Ávila J, González BE. Resultados de la farmacovigilancia de vacunas producidas por el Instituto Finlay. Rev Cubana Farm [Internet]. 2007 [citado 26 oct. 2012];41(3): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75152007000300004&lng=es .
10. Vacunación segura: Módulos de capacitación. Módulo I Autoridad Regulatoria Nacional Organización Panamericana de la Salud [Internet]. Washington, DC: OPS/Oficina regional OMS; 2007. [citado 23 nov. 2012]. Disponible en: http://www.enfermeriaaps.com/portal/?wpfb_dl=2406
11. Collet JP, MacDonald N, Cashman N, Pless R. Vigilancia de la seguridad de las vacunas: evaluación de las notificaciones de episodios adversos por un comité consultivo de expertos. Bulletin of the World Health Organization. 2000;78(2):178–85.
12. Beragua R, Korzewycz N. Farmacéuticas. Área de Farmacovigilancia del Hospital Italiano de Buenos Aires. ¿Qué es la Farmacovigilancia y a quienes compete? Práct. Ambul [Internet]. 2004 nov.-dic. [citado 23 nov. 2012];7(6). Disponible en: http://www.foroaps.org/hitalba-pagina-articulo.php?cod_producto=1500
13. Navarro-Calderón E, Navarro MJ, Muelas J, Escoms V, Rodríguez R, Salazar A. Importancia de la búsqueda activa en la detección de reacciones adversas medicamentosas. Seguim Farmacoter. 2004;2(1):24-8.
14. Varricchio F, Iskander J, Destefano F, Ball R, Pless R, Braun M M, et al. Understanding vaccine safety information from the Vaccine Adverse Event Reporting System. Pediatr Infect Dis J. 2004;23:287-94.
15. Abarca K. Vigilancia de eventos adversos a vacunas. Rev. Chil Infect. [Internet]. 2007. [citado 26 oct. 2012];24(1):53-6. Disponible en: http://www.scielo.cl/pdf/rci/v24n1/art08.pdf
16. Madurga Sanz M, Abajo Iglesias FJ. Farmacovigilancia de las vacunas: cómo identificar nuevos riesgos. Revista Pediatric de Atención Primaria. [Internet]. 2005 [citado 26 oct. 2012];7(S4):S75-91. Disponible en: http://www.pap.es/files/1116-495-pdf/520.pdf
17. Coulter DM. The New Zealand intensive medicines monitoring programme. Pharmacoepidemiology and Drug Safety [Internet]. 1998 March/April [cited 2012 Oct 8];7(2):79-90. Available from: http://onlinelibrary.wiley.com/store/10.1002/(SICI)1099-1557(199803/04)7:2%3C79::AID-PDS330%3E3.0.CO;2-1/asset/330_ftp.pdf?v=1&t=i05jiwi7&s=2503cf55e47d339b7722aa90720994d1473c3a4c
18. Davis RL, Kolczak M, Lewis E, Nordin J, Goodman M, Shay DK, et. al. Active Surveillance of Vaccine Safety a System to Detect Early Signs of Adverse Events. Epidemiology. 2005;16(3):336-41.
19. Clark DW, Harrison-Woolrych M. The role of the New Zealand Intensive Medicines Monitoring Programme in identification of previously unrecognised signals of adverse drug reactions. Curr Drug Saf [Internet].2006. [citado 8 oct. 2012];1(2):169-78. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/18690928
20. Barrera BA, Wilton L, Harris S, Shakir S. Prescription-event monitoring study on 13,164 patients prescribed risedronate in primary care in England. Osteoporosis International [Internet]. [citado 8 oct. 2012];16(12):1989-1998. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/16133643
21. Menniti Ippolito F, Raschetti R, Da Cas R, Giaquinto C, Cantarutti L. Active monitoring of adverse drug reactions in children. Lancet. 2000;355(9215):1613-4.
22. Ferreira G. Prescription-Event Monitoring. Developments in Signal Detection. Drug Safety. 2007;30(7):639-41.
23. A practical handbook on the pharmacovigilance of antiretroviral medicines. World Health Organization. 2009;78(2):178-85.
24. Almenoff JS. Innovations for the Future of Pharmacovigilance. Drug Safety. 2007;30(7):631-33.
25. Clasificación Internacional de Enfermedades 10. CIE 10. Revisión [Internet]. Buenos Aires: Superintendencia de Servicios de Salud/Ministerio de Salud; 2012 [citado 14 Oct. 2012]. Disponible en: http://www.sssalud.gov.ar/hospitales/archivos/cie_10_revi.pdf
26. Abarca V, Valdivieso F, Potin MS, Ibáñez I W, Vial P. Inmunogenicidad y reactogenicidad de una vacuna de difteria, tétanos, pertussis celular de contenido antigénico reducido (dTpa) en niños de 10 a 11 años de edad y en adultos. Rev Méd. Chile. [Internet]. 2002 Mayo [citado 16 sep. 2012];130(5):502-510. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0034-98872002000500004&lng=es;http://dx.doi.org/10.4067/S0034-98872002000500004
27. Behinger J A, Halperin SA, De Serresle, Scheifele DN, Tam T. What is Impact? Pediatric Infect Dis J. 2007;26(1):31-5.
28. Estudio IBEAS. Prevalencia de efectos adversos en hospitales de Latinoamérica. Informes, estudios e investigación [Internet]. Madrid: Ministerio de Sanidad y Política Social; 2009 [citado 10 oct. 2012]. Disponible en: http://www.msssi.gob.es/organizacion/sns/.../docs/Informe_Ibeas.pdf
29. Ochoa RF, Acosta J, Ferriol XR, Ginebra M. Evaluación de anticuerpos contra enfermedades prevenibles por vacunas en el binomio madre–recién nacido en hospitales de Ciudad de La Habana. Vaccimonitor [Internet]. 2007 Ago [citado 13 sep. 2012];16(2):10-5. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2007000200003&lng=es
30. Vacunación segura: Módulo IV Aspectos técnicos y clínicos de los eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI). Washington, DC: OPS/Oficina regional OMS; 2007.
31. Vacunación segura: ¿Cómo enfrentar los eventos supuestamente atribuidos a la o inmunización vacunación? Washington, DC: OPS/Oficina regional OMS; 2002.
32. Peña Machado MA, Triana Rodríguez TM, Menéndez Hernández J, Mirabal Sosa M, Armesto del Río M, Baró Suárez M, et al. Seguimiento de la reactogenicidad de la vacuna DTP cubana, utilizando dos métodos paralelos. Vaccimonitor [Internet]. 2005 Jun [citado 16 Sep 2012];14(1):10-20. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2005000100002&lng=es
33. Cody CL, Baraff LJ, Cherry JD, Marcy SM, Manclark CR. Nature and rates of adverse reactions associated with DTP and DT immunizations in infants and children. Rev Pediatrics. 1981;68(5):650-60.
34. Pozo Lanzón D, Pozo Alonso J. Epilepsia y discapacidades neurológicas en el niño. La Habana: Ed. Ciencias Médicas; 2007.
35. Riesgo de convulsiones por uso de vacunas de células enteras contra la tos ferina, o contra el sarampión, la parotiditis y la rubéola. Rev Panam Salud Pública [Internet]. 2001 Sep [citado 16 Sep 2012];10(3):181-3. Disponible en: http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S1020-49892001000900006&lng=en; http://dx.doi.org/10.1590/S1020-49892001000900006
36. Carlettis K, Dayan G, Kataife F, Man C, Sanguinetti R, Tarlouski A, et.al. Reactogenicidad de las vacunas DPT acelular y celular. Arch Arg Pediatr. [Internet]. [citado 5 oct. 2012]. 1998 abril;96(2):95-102. Disponible en: http://www.sap.org.ar/docs/publicaciones/archivosarg/1998/98_95_102.pdf
37. González A, Aristeguí J, Diez J, Dol-Ré R. Vacuna tetravalente frente a difteria, B pertussis y hepatitis. Experiencias en España. An Esp Pediatr. [Internet]. 1998. [citado 5 oct. 2012];48(2):132-7. Disponible en: www.aeped.es/sites/default/files/anales/48-2-5.pdf
38. Gavilla B, Alonso M F, Gonzáles B, Gonzáles M, Pérez R. Inmunogenicidad y reactogenicidad de la vacuna cubana Quimihib en lactantes sanos. Cárdenas 2005. Rev Méd. Electr [Internet]. 2007. [citado 22 Sep 2010];29(4). Disponible en: www.revmatanzas.sld.cu/revista%20medica/ano%202007/vol4%202007/tema03.htm
39. Cuevas IE, Cruz G, Rosete LE, Casanueva V, Castañeda I, Pérez J. Eventos adversos temporalmente asociados a VAMENGOC-BC. Municipio La Lisa, 1998-1999. Vaccimonitor [Internet]. 2000 Dic. [citado 16 Sep 2012];9(4):1-9. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1025-028X2000000400001&lng=es
40. Cuevas IE, Casanueva V, Galindo MA, Armesto M, Domínguez F, Mesa I, Quintero D. Exploración de eventos adversos al Vamengo en tres municipios de Ciudad de la Habana 1998. Vaccimonitor [Internet]. 1999 [citado 16 Sep 2012];8(7):5-11. Disponible en: http://www.finlay.sld.cu/publicaciones/tomo2/T2-05.PDF
41. Hood DA., Edwards IR. Meningococcal vaccine–do some children experience side effects?. New Zealand Medical Journal. [Internet]. 1989 [cited 2012 Dic 22];102:65–7. Available from: www.who.int/vaccinesdocuments/DocsWord/word585.doc
42. Fundaçao Nacional de Saúde. Manual de Vigilância Epidemiológica dos Eventos Adversos Pós-Vacinação. Série A. Manual e Normas Técnicas em Saúde. 2a ed.[Internet]. Brasília/DF: Ministerio de Saúde – Fundaçao Nacional de Saúde; 2008 [citado 16 Dic 2012]. Disponible en: http://bvsms.saude.gov.br/bvs/publicacoes/manual_pos-vacinacao.pdf
43. Landys Chovel M, Figueroa JM, Perdomo V. Limitaciones del ensayo de toxicidad específica para el componente pertussis de células completas. Vaccimonitor [Internet]. 2008 [citado 16 ene 2013];17(3):6-12. Disponible en: www.redalyc.uaemex.mx/redalyc/pdf/2034/203414609002.pdf
44. Landys M, Figueroa JM, Lara A, Perdomo V. Interacción del componente pertussis de células completas con los antígenos tetánico, Haemophilus influenzae tipo B y hepatitis B en ensayos de potencia para vacunas combinadas. Vaccimonitor [Internet]. 2008 [citado 16 ene 2013];17(1):7-15. Disponible en: www.redalyc.uaemex.mx/redalyc/pdf/2034/203414611002.pdf
Recibido: 4 de marzo de 2013.
Aprobado: 15 de septiembre de 2013.
Addys María Díaz Piñera. Departamento de Salud Pública. Instituto Nacional de Higiene Epidemiología y Microbiología (INHEM). Infanta 1158 entre Llinás y Clavel. CP: 10300. La Habana, Cuba.
Correo electrónioco: addys@inhem.sld.cu