Introducción
La leptospirosis es una enfermedad de distribución mundial causada por espiroquetas patógenas del género Leptospira. Actualmente constituye un problema de salud a escala global, tanto para los países desarrollados como los subdesarrollados, por lo que se dedican esfuerzos y recursos para el control y erradicación de esta zoonosis.1 Es una enfermedad que padece el ser humano y los animales, además afecta la economía. El clima, el suelo, la fauna y la actividad agrícola son factores que favorecen la propagación de la leptospira, los trabajadores en labores agropecuarias son los más afectados.(2)
El desarrollo de la agricultura y la ganadería lleva implícito el aumento del personal incorporado a estas actividades de forma permanente o temporal, lo que incrementa los expuestos al riesgo de enfermar. La leptospirosis presenta patrones de trasmisión epidémico, endémico y por brotes esporádicos, estos últimos tienen tendencia ascendente en los últimos años con incremento en las tasas de incidencia.1,2
En la década de los años 70 del siglo xx la incidencia de la leptospirosis aumento en Cuba, lo que afectó principalmente a los trabajadores agrícolas,la provincia de Camagüey fue una de las más afectada, con un brote que alcanzó gran magnitud en el año 1980.1 Para controlarlo se realizaron estudios clínicos y epidemiológicos en el terreno y se introdujeron nuevas técnicas de laboratorio que facilitaron el diagnóstico de la zoonosis. Además, se estableció el Programa Nacional de Control de la Leptospirosis Humana (PNCLH), que se puso en vigor por los Ministerios de Salud Pública (Minsap) y de la agricultura en junio de 1981.1
Son antecedentes de las primeras acciones de la vacunación contra la leptospirosis en Cuba, un ensayo clínico con una vacuna procedente de la pretérita Unión de Repúblicas Socialistas Soviéticas (URSS), producida en el Instituto de Sueros y Vacunas (ISV) de Stávropol para proteger al personal con riesgos. Lo expuesto permite plantear la siguiente hipótesis: las recomendaciones derivadas de aquella investigación fueron referencias para las acciones realizadas en la inmunoprofilaxis para la prevención de la zoonosis.
El objetivo del presente trabajo es reconstruir los primeros pasos en la inmunoprofilaxis contra la leptospirosis en Cuba.
Métodos
Se empleó el método historiográfico y analítico-sintético. Los datos se obtuvieron en bases de datos profesionales: Infomed, Dialnet, Medigraphic, Medline y Scielo.
Análisis y síntesis de la información
Primeros pasos
En 1982, hace cuatro décadas, en el marco de una investigación orientada por la Dirección Nacional de Zoonosis y la colaboración de los Servicios Médicos del Ejército Juvenil del Trabajo (EJT), un grupo de científicos dirigidos por el doctor Cruz de la Paz realizó el estudio sobre inmunogenicidad y reactogenicidad de una vacuna procedente del ISV de Stávropol, que se aplicó por primera vez en Cuba.3
En aquellos años se utilizaron las primeras vacunas para la inmunoprofilaxis de la leptospirosis en humanos, que mostró validez en países como Italia, Polonia, Israel y China.2 La vacuna polivalente producida por el ISV de Stávropol cumplía los índices requeridos de eficiencia, eficacia e inocuidad en humanos y se utilizaba con éxitos en el país euroasiático.3 Estos elementos y la necesidad de incrementar las medidas de protección en los grupos de riesgo de adquirir la zoonosis, fundamentaron la ejecución de la mencionada investigación en nuestro país.
La utilización por primera vez en Cuba de una vacuna antileptospirósica para uso en humanos se realizó en una zona rural del municipio de Vertientes en la provincia de Camagüey. Fue un ensayo clínico con el producto procedente de la URSS, puesto a disposición del Minsap para su aplicación como parte del PNCLH.3 En estas acciones participaron combatientes del EJT, de este modo se inició en Cuba hace cuarenta años la inmunoprofilaxis contra la enfermedad causada por leptospiras.
La vacuna procedente de la antigua URSS
El propósito de aquel estudio era evaluar la reactogenicidad y la inmunogenicidad de la vacuna antileptospirósica de uso en humanos, integrada por gérmenes muertos por calor, de los serogrupos icterohaemorrhagiae, pomona, gripotyphosa y hebdomadis. Se usó en un grupo representativo de trabajadores agrícolas expuesto a la enfermedad por la actividad que realizaban en el corte de caña. En los vacunados se evaluaron las reacciones locales y generales. Mediante la prueba de microaglutinación se determinó el título de anticuerpos antileptospirosis, para constatar la respuesta serológica inducida y comparar con el grupo control.3
Los resultados del ensayo clínico demostraron que la vacuna de producción soviética presentó baja reactogenicidad, sin reacciones adversas locales o generales de relevancia, además, se corroboró la formación de anticuerpos atribuibles a la acción de la vacuna, aunque en bajo porcentaje de los vacunados. No se constató la formación de anticuerpos para todas las cepas de leptospiras contenidas en la vacuna y se registraron casos de infección leptospirósica entre los que recibieron la vacuna. No fue posible en aquel momento evaluar íntegramente la respuesta inmunogénica a la vacuna por no disponer de las técnicas serológicas necesarias.3
Con el título “Reactogenicidad a la vacuna humana antileptospirósica en Cuba” las experiencias de la investigación se presentaron en el Taller Nacional de Zoonosis celebrado en La Habana en 1985 y se publicaron en la Revista Cubana de Higiene y Epidemiología en 1986.3
Las recomendaciones
A partir de los resultados alcanzados en la investigación se plantearon dos recomendaciones.3 La primera consistió en la aplicación extensiva de la vacuna antileptospirósica como inmunoprofilaxis a los grupos de riesgo en la población cubana. Esto, junto a la quimioprofilaxis, los medios de protección en el trabajo agrícola y las medidas sanitarias, contribuiría al control de la enfermedad con la disminución del riesgo de contagio. La segunda fue la necesidad de producir una vacuna cubana con cepas autóctonas de leptospiras, que incluyera en su composición los serogrupos con mayor circulación en Cuba.
A partir del análisis de los datos en la bibliografía consultada de las últimas cuatro décadas se pudo corroborar el cumplimiento de las recomendaciones derivadas de aquella investigación, que fue precursora en el campo de la vacunación antileptospirósica en el país como medida para preservar la salud de los trabajadores agrícolas y del pueblo en general, un propósito del Programa del Moncada y de la Revolución.4
De modo gradual se hiso extensivo la aplicación de la vacuna del ISV de Stávropol para la inmunoprofilaxis en los trabajadores agrícolas, incluidos los miembros del EJT, una protección adicional para precaver la leptospirosis. De este modo, desde 1983 eran inmunizados las personas expuestas al riesgo de la enfermedad, cumpliendo el PNCLH. La vacuna procedente de la URSS se utilizó hasta 1991, año en que se dejó de aplicar por dificultades en el suministro del producto.2
La vacuna cubana contra la leptospirosis
Por otro lado, en Cuba se habían creado centros de investigaciones con las condiciones necesarias para lograr vacunas propias contra cepas autónomas de leptospira. Se destaca la obtenida por un grupo de investigadores del Instituto “Finlay”, el Centro de Investigación y Producción de Vacunas y Sueros.2 El producto biofarmacéutico vax-SPIRAL® es una vacuna trivalente cubana para evitar la leptospirosis en humanos, obtenida a partir de leptospiras inactivadas por medios químicos, para las cepas de importancia epidemiológica por su mayor circulación en Cuba. Contó en su composición con Leptospira interrogans, con los serovares canicola, icterohaemorragiae y pomona.5 De este modo, la vacuna cubana presentó ventajas en relación con la procedente del ISV de Stávropol.6
Los resultados favorables de la evaluación preclínica permitieron a los investigadores del Instituto de Medicina Tropical “Pedro Kourí” realizar la fase I del ensayo clínico en 1998 para evaluar inmunogenicidad y reactogenicidad de la vacuna cubana contra la leptospirosis humana.2 Ya se disponía de técnicas más precisas para determinar la inmunogenicidad, mediante la medición de los títulos de anticuerpos antileptospirales en sangre, además, se emplearon pruebas de ELISA y microaglutinación para cepas vivas según el método descrito por la Organización Mundial de la Salud (OMS) para demostrar la baja reactogenicidad y la seguridad de la vacuna.2
Dos años después, el Centro Nacional de Investigaciones Científicas (Cenic) realizó la fase II del ensayo clínico, para evaluar reactogenicidad de la vacuna vax-SPIRAL®. Se corroboró su seguridad y baja reactogenicidad en adultos humanos. La vacuna en su composición tenía serovares canicola, copenhageni y mozdok.6
Se realizaron estudios de toxicidad y tolerancia local en ratas Sprague Dawley para conocer la posible letalidad causada por la administración de una dosis de la vacuna de ensayo, que en su composición tenía Leptospira interrogans: serovares canicola, icterohaemorragiae, pomona, copenhageni y mozdok. Se evaluaron signos tóxicos, reacciones locales en el sitio de inoculación, así como en los órganos y sistemas susceptibles a la toxicidad potencial, para las vías de inoculación intramuscular e intraperitoneal. Los resultados mostraron que la vacuna vax-SPIRAL® cumplía los requisitos toxicológicos para el estudio de dosis única en animales de experimentación.(7)
En los cuatro decenios transcurridos los avances en la biología molecular han permitido conocer mejor el agente causal de la leptospirosis y los biomarcadores asociados a la enfermedad.(8) Se desarrollaron técnicas para el diagnóstico, fundamentadas en el conocimiento del genoma y los factores de virulencia que le confieren capacidad patógena a la leptospira.(9) Por ejemplo, la reacción en cadena de la polimerasa (PCR) para reconocer secuencias de nucleótidos del ácido desoxirribonucleico (ADN) permite identificar genes,(10,11) entre los que se encuentra LipL32 que codifica una lipoproteína de la superficie externa de la membrana celular de especies de leptospiras patógenas,(12,13) además, las técnicas inmunológicas de microaglutinación y ELISA para detectar anticuerpos en el suero y otros fluidos de los enfermos permiten estudiar la respuesta inmunológica humoral y celular del organismo a la leptospira, así como la intervención de mediadores moleculares.(14,15,16)
Estudios recientes sobre esta especie de espiroqueta aportan nuevos conocimientos sobre la distribución geográfica, la relación con las condiciones climatológicas y la patogénesis de la zoonosis, así como la caracterización clínica epidemiológica y las complicaciones(17,18,19,20,21) El desarrollo de los medios microbiológicos y de microscopia para identificar la leptospira permite mayor precisión en el diagnóstico y posibilitan acciones terapéuticas más efectivas.(22)
La leptosprosis, enfermedad zoonótica
Existe un creciente interés por desarrollar capacidades y sistemas para enfrentar las enfermedades zoonóticas. Estudios recientes confirman que la leptospirosis es un problema de salud pública en muchos países, con mayor riesgo para los que trabajan en labores agrícolas.23,24,25,26,27 Las experiencias médicas insisten en la importancia del tratamiento preventivo en los grupos de riesgo ocupacional como aspecto esencial para evitar la enfermedad: el estricto cumplimiento de las medidas sanitarias, la utilización de los medios de protección laboral, la quimioprofilaxis y la vacunación.
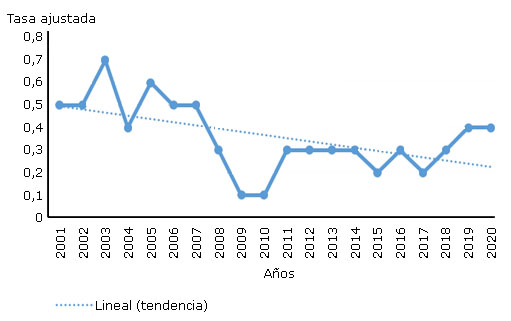
La leptospirosis puede ser una enfermedad grave en el humano y potencialmente mortal por la disfunción de múltiples órganos: hígado, riñones, pulmones, músculos y sistema nervioso.28 En Cuba, aunque la mortalidad por esta enfermedad es baja, se incluye entre las primeras 35 causas de muertes en todas las edades y sexo. Los datos divulgados por la Dirección Nacional de Registros Médicos y Estadísticas de Salud en el Anuario Estadístico del Minsap muestran la tendencia decreciente de las defunciones por leptospirosis en los últimos dos decenios (Fig.).
Una opinión común sostiene que la mortalidad por la enfermedad y sus complicaciones aumenta cuando no se realiza el diagnóstico oportuno y el tratamiento adecuado.
Como se señaló, la inmunoprofilaxis es importante para proteger la salud y mejorar la situación epidemiológica, es un modo también de reducir los gastos porque se evitan los hospitalización, tratamiento y rehabilitación. Actualmente se investigan nuevas formas para lograr vacunas efectivas contra la leptospiras, entre las que se encuentran las obtenidas a partir del ADN de la bacteria.29
En Cuba se le presta atención a la obtención de vacunas para evitar enfermedades infecciosas, como la leptospirosis. Igualmente se desarrollan los medios de diagnóstico, acciones prioritarias en el PNCLH (2da versión, 1997) para el control y prevención de la enfermedad en animales y en humanos, lo que ha contribuido al control de la enfermedad y disminución de la mortalidad por las complicaciones, aunque la morbilidad fluctúa en diferentes regiones del país según las condiciones higiénicas y sanitarias.30,31
Como se señaló, la investigación que realizó el grupo de científicos en Camagüey inició la vacunación contra la leptospirosis en Cuba, que significó una contribución a la salud pública. Los resultados y recomendaciones del estudio realizado en 1982 fundamentaron las acciones de inmunoprofilaxis para prevenir la zoonosis, como la obtención de la vacuna con cepas autónomas de leptospiras, un producto de la ciencia cubana para preservar la salud de nuestro pueblo y el de otros países que lo necesiten,(32) expresión de las ideas del principal impulsor del Sistema de Salud en Cuba, el líder histórico de la Revolución Fidel Castro Ruz (4)
Conclusiones
Hace cuarenta años científicos cubanos realizaron los estudios iniciales sobre inmunogenicidad y reactogenicidad de una vacuna procedente de la pretérita Unión Soviética. Las recomendaciones de la investigación se cumplieron. Se realizó la vacunación a grupos de riesgo en la población, principalmente trabajadores agrícolas y se logró una vacuna con cepas autóctonas de leptospiras. Los datos expuestos sobre los primeros pasos en la inmunoprofilaxis contra la leptospirosis en Cuba tienen relevancia para la historiografía médica por los aportes a la salud pública, prioridad del Estado cubano.