Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de Ciencias Médicas de Pinar del Río
versión On-line ISSN 1561-3194
Rev Ciencias Médicas vol.21 no.4 Pinar del Río ago. 2017
PRESENTACIÓN DE CASO
Anemia de Blackfan Diamond
Blackfan Diamond Anemia
Omar Viñas Díaz 1, César Valdés Sojo 2, Sarah Álvarez Reinoso 3
1Médico. Especialista de Primer Grado en Pediatría. Instructor Hospital Pediátrico Provincial Docente Pepe Portilla. Pinar del Río. Cuba Vinas54@infomed.sld.cu
2Médico. Especialista de Primer Grado en Pediatría. Instructor. Hospital Pediátrico Provincial Docente Pepe Portilla. Pinar del Río. Cuba csojo@infomed.sld.cu
3Médica. Especialista de Segundo Grado en Pediatría. Profesor Auxiliar y Consultante. Máster en Urgencias Médicas. Hospital Pediátrico Provincial Docente Pepe Portilla. Pinar del Río. Cuba. saadilen@infomed.sld.cu
Recibido: 02 de mayo de 2017
Aprobado: 29 de junio de 2017
RESUMEN
Introducción: la anemia de Diamond-Blackfan es una causa poco frecuente de anemia en el recién nacido y el lactante menor.
Objetivo: presentar un lactante de 6 meses de edad, con el diagnostico de anemia de Diamond-Blackfan, con cifras bajas de hemoglobina desde el nacimiento. Método: se revisa y actualiza la bibliografía sobre anemia de Diamond-Blackfan en edades pediátricas.
Presentación del caso: se presenta una niña de 6 meses de edad producto de un parto por cesárea por sufrimiento fetal con buen peso al nacer presentando en el periodo neonatal anemia severa, que requirió transfusión de eritrocitos, permaneciendo en el servicio de neonatología durante 27 días, se valora además por cardiología diagnosticándose una miocardiopatía congénita por lo cual lleva tratamiento y seguimiento por esta especialidad A los 35 días se repite hemoglobina con cifra de 50 gramos / litro. Se ingresa en el hospital Pediátrico para estudio de la anemia, donde después de examen físico, complementarios y discusión colectiva con pediatría cardiología, genética y hematología, se decide transfundir con glóbulos bajo vigilancia por su miocardiopatía. Previa a la transfusión se le realiza medulograma constatándose integridad de las líneas incluso hiperplasia granulopoyetica y megacariopoyetica con depresión selectiva del sistema eritroide y presencia de proeritroblastos como única forma de este, estableciéndose el diagnostico de certeza de anemia de Blackfan Diamond.
Conclusiones: se considera importante el examen completo de estos afectados para su delineación fenotípica y diagnóstico clínico
DeCS: ANEMIA DE DIAMOND-BLACKFAN; ANEMIA NEONATAL; ANEMIA HIPOPLÁSTICA CONGÉNITA
ABSTRACT
Introduction: Diamond-Blackfan anemia is a rare cause of anemia in the newborn and the youngest infant.
Objective: to present a 6-month-old infant, diagnosed with Diamond-Blackfan anemia, with low hemoglobin levels since birth.
Method: the literature on Diamond-Blackfan anemia at pediatric ages is reviewed and updated.
Case report: a 6-month-old girl born from a cesarean section due to fetal distress with good birth weight, presenting a severe anemia in the neonatal period, requiring red blood cell transfusion, remaining in the neonatology service for 27 days, the patient was also assessed by the cardiologist, a congenital myocardiopathywas diagnosed, that is why she is treated and monitored by this specialty. At 35 days, hemoglobin level is repeated with a figure of 50 grams / liter. She was hospitalized in the Pediatric Hospital for a study of the anemia she suffered from, where after physical examination, complementary examinations and a collective discussion with pediatricians, cardiologists, geneticistsand hematologists, it was decided to transfuse her with globules under surveillance for her myocardiopathy. Prior to transfusion, a medullogram was performed, confirming the integrity of the lines, including granulopoieticand megakaryopoietichyperplasia with selective depression of the erythroidsystem and presence of proerythroblastsas the only form of this, establishing the diagnosis of certainty of Blackfan Diamond anemia.
Conclusion: the complete examination of these affected infants is considered important for their phenotypic delineation and clinical diagnosis.
DeCS: ANEMIA, DIAMOND-BLACKFAN; NEMIA, NEONATAL; ANEMIA, HYPOPLASTIC, CONGENITAL
INTRODUCCIÓN
Cuando se aborda el tema de las aplasias medulares aparece como referencia dentro de las causas hereditarias la anemia de Blackfan Diamond (ABD), por lo interesante de su comportamiento desde el nivel molecular hasta el fisiopatológico. Resulta en una enfermedad que debuta durante el primer año de vida, caracterizada por el desarrollo muy precoz de anemia macrocítica hiporregenerativa con hipoplasia medular selectiva eritroblástica en niños. 1
Anteriormente se le conoció con varios términos: Anemia hipoplásica congénita, síndrome Blackfan-Diamond, síndromeAase y síndrome Aase-Smith. 2-5
La anemiade Diamond Blackfan fue reportada por primera vez por Josephs en 1936 4, 5 y más completamente descritos por Diamond Blackfan y en 1938 4 - 6.Los criterios diagnósticos de DBA publicados en 1976 consisten en: presentación de la anemia antes del primer cumpleaños con el recuento de neutrófilos cerca de lo normal o ligeramente disminuido, recuento de plaquetas variables, reticulocitopenia, macrocitosis y la celularidad de la médula normal con una escasez de precursores de células rojas. 7Estos criterios, hasta hace poco, siguen siendo la norma aceptada.
En Cuba existen 20 casos reportados 4y en la provincia Pinar del Río existen tres pacientes estudiados, la novedad de este paciente es que comienza con la anemia severa desde el nacimiento y no tiene anomalías congénitas fenotípicas, como se describe en la literatura revisada. 1-5
PRESENTACIÓN DEL CASO
Paciente femenina de 6 meses, edad, producto de un parto por cesárea por sufrimiento fetal con buen peso al nacer presentando en el periodo neonatal anemia severa, permaneciendo en el servicio de neonatología durante 27 días, se valora además por cardiología diagnosticándose una miocardiopatía congénita por lo cual lleva tratamiento y seguimiento por esta especialidad
A los 35 días se repite hemoglobina con cifra de 50 gramos / litro. Se ingresa en el Hospital Pediátrico para estudio de la anemia, donde después de examen físico, complementarios y discusión colectiva con pediatría cardiología, genética y hematología, se decide transfundir con glóbulos bajo vigilancia por su miocardiopatía.
Previa a la transfusión se le realiza medulograma constatándose integridad de las líneas incluso hiperplasia granulopoyetica y megacariopoyetica con depresión selectiva del sistema eritroide y presencia de proeritroblastos como única forma de este. (Figura 1) Concluyendo anemiahipo plástica congénita como diagnóstico.
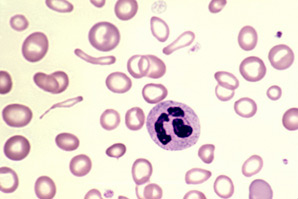
Figura 1.Lámina del medulograma realizado a la paciente, donde se observa depresión selectiva del sistema eritroide con integridad de los demás sistemas.
Aunque los antecedentes neonatales no son muy orientadores y no hay evidencia de reticulopenia, no se descarta del todo causas secundarias de eritroblastopenias a esta edad como son las infecciones virales Se inician tratamiento vitamínico para estimular la eritropoyesis medular sin respuesta medular.
A los dos meses de nacida sin respuesta medular se decide iniciar tratamiento con esteroides a 2 mg/kg/día con buena respuesta en el primer mes disminuyendo a la mitad la dosis de esteroides.
A los tres meses reingresa con Hb de 48 gr/l y en el examen físico solo tiene como dato positivo la palidez cutáneo mucosa se decide transfundir nuevamente y aumentar nuevamente la dosis de esteroides, prueba de Coombs directa e indirectas negativas lo que descarta el diagnostico de una anemia hemolítica.
A los seis meses de vida es visto de nuevo en la consulta de Atención Primaria y se observa un peso en el percentil 75, con una longitud y un perímetro cefálico en percentil 50. Presenta un aspecto cushingoide, sin ningún otro hallazgo a la exploración física. En el momento actual la dosis de Predinisona es de 1 mg/K a días alternos, permaneciendo la hemoglobina en 9 gr/dl
DISCUSIÓN
La anemia de Blkackfam Diamond es una enfermedad caracterizada por una deficiencia genética en la formación de las células eritropoyéticas madre probablemente debida a un defecto de los receptores para eritropoyetina en las células madre eritropoyéticas o a una ausencia en la médula ósea de los factores BFU-E y CFU-E. 6 - 8
Desde el punto de vista clínico la enfermedad se caracteriza por una anemia severa en el 10% de los casos en el momento del nacimiento y que se desarrolla en el 90% de los casos restantes en un plazo de 12 meses.
El paciente muestra los síntomas típicos de una severa anemia: palidez, letargia, irritabilidad, insuficiencia cardíaca y muerte. La enfermedad suele ir acompañada de dismorfismos en la cara (13% - macro o microcefalia, micrognacia, macroglosia, fontanela mayor de lo normal) en los miembros superiores (10% - eminencia tenar aplastada acompañada de una reducción del pulso radial, dedos supernumerarios, ausencia o malformación de los pulgares), oculares (7%, cataratas, glaucoma, hipertelorismo, esclerótida azul) y renales (4%, ausencia de un riñón o riñones en forma de herradura). 9,10
Desde el punto de vista genético se caracteriza por la marcada heterogeneidad de locus (dadas las diversas variantes alélicas ubicadas en cromosomas diferentes y asociadas con las manifestaciones clínicas del trastorno), la expresividad variable (porque la magnitud y severidad del cuadro clínico oscilan en un rango muy amplio, incluso dentro de una misma familia) y el efecto pleiotrópico (porque una misma mutación es capaz de producir un cortejo de múltiples signos que comprometen diferentes órganos y sistemas). 6
Se transmite con un patrón mendeliano autosómico dominante, salvo el trastorno producido por mutaciones en el gen GATA (1) que se hereda de forma recesiva, ligado al cromosoma X. 1
A pesar de clasificar en el grupo de enfermedades raras, dada su infrecuencia, se ha estudiado en detalle, pues sus mecanismos etiopatogénicos pueden abrir nuevos cauces para el conocimiento y la comprensión de las variantes adquiridas de aplasia medular con componente multifactorial. 7
Esta paciente presentó una anemia hipoplastica congénita sin otra anomalía congénita visible en su fenotipo con manifestaciones clínicas desde el nacimiento lo que dentro de los pacientes con anemia de Balckfam Diamond que solo existen 400 casos en el mundo solo el 10 % tienen las manifestaciones clínicas desde la etapa neonatal. 7, 8
La anemia de Blackfan-Diamond, se incluye actualmente dentro de un emergente grupo de trastornos conocido como ribosomopatías. 9 Su biología molecular ha sido extensamente explorada y en más del 50% de los casos el desorden aparece como resultado de una haploinsuficiencia de las proteínas asociadas a cualquiera de las dos subunidades ribosomales, sin embargo el mecanismo por el cual la haploinsuficiencia de estas proteínas conduce a un fallo eritroide, así como la presencia de algunas de las manifestaciones clínicas acompañantes no está aún bien esclarecido.10, 11
Eventualmente el 40% de los individuos afectados son esteroideo dependientes, 40% dependen de transfusiones y solo el 20% evolucionan hacia la remisión. 2
Los esteroides pueden ser disminuidos hasta la mínima dosis efectiva. Es necesario el monitoreo de la hemoglobina para asegurar cifras mínimas requeridas con independencia de la transfusión.
Las dosis de mantenimiento de los esteroides varían y pueden resultar extremadamente bajas en algunos individuos. La dosis máxima de mantenimiento es entre 0.5 y 1 mg/kg/día.
Si con las dosis recomendadas los esteroides no logran restablecer las cifras normales de hemoglobinas en un rango de aproximadamente un mes entonces deben irse disminuyendo hasta descontinuarlos totalmente.
Los efectos adversos de los esteroides incluyen la osteoporosis, la ganancia de peso, apariencia cushingoide, hipertensión, diabetes mellitus, retardo del crecimiento, fracturas óseas patológicas, úlceras gástricas, cataratas, glaucoma, y aumento de la susceptibilidad para las infecciones.1,12
Transfusión de eritrocitos. Si el individuo resulta resistente a la terapéutica con esteroides, entonces se requiere de transfusiones de eritrocitos a repetición hasta garantizar las cifras de 80-100 g/L, adecuadas para mantener el crecimiento y desarrollo.12, 13
Trasplante de células madre del cordón umbilical. Es la única terapia curativa para la ABD. Las personas con esta enfermedad que resultan dependientes de transfusiones o desarrollan otras citopenias deben ser necesariamente tratadas con este método, siempre que estén creadas las condiciones y se identifique el donante adecuado.1
En los individuos con rechazo a las terapéuticas convencionales se ensaya el trasplante de medula ósea, lo que representa actualmente la cura más prometedora para este desorden.1
Se considera importante el examen completo de estos afectados para su delineación fenotípica y diagnóstico clínico, porque aún no se cuenta con estudios moleculares para llegar a la confirmación molecular de los afectados. Siendo necesario el asesoramiento a estas familias.
REFERENCIAS BIBLIOGRÁFICAS
1. Genetic and Rare Diseases Information Center. Anemia de Diamond-Blackfan [Internet]. Estados Unidos; 2016 [citado 13 oct 2016]. Disponible en: https://rarediseases.info.nih.gov/diseases/12933/diamond-blackfan-anemia
2. Yang Z, Keel SB, Shimamura A, Liu L, Gerds A, Abkowitz JL Delayed globin synthesis leads to excess heme and the macrocytic anemia of Diamond Blackfan anemia and del (5q) myelodysplastic syndrome. Science translational medicine [Internet]. 2016 [citado 2016 oct 23]; 8(338): [aprox. 12 p.]. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5010382/
3. Clinton C, Gazda H. Diamond-blackfan anemia [Internet]. Estados Unidos: University of Washington; 2016 [citado 2016 oct 23]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK7047/?report=reader
4. Hernández Marino A. Anemias en la infancia y adolescencia. Clasificación y diagnóstico. Pediatría Integral [Internet]. 2016 jun [citado 2016 oct 23]; XX(5): [aprox. 9 p.]. Disponible en: http://www.pediatriaintegral.es/wp-content/uploads/2016/07/Pediatria-Integral-XX-05_WEB.pdf#page=9
5. Cooper Morúa M, Cruz León JP, Córdoba Madrigal G, Jimenes Fonseca R. Anemia de Diamond-Blackfan [Internet]. Costa Rica: Terapia Física UAM; 2010 [citado 2016 may 12]. Disponible en: http://wwwtrastornoshematologicos.blogspot.com/2010/08/anemia-de-diamond-blackfan.html.
6. Garcia Pacheco H. Anemias en pediatría [Internet]. Argentina: Biblioteca Médica; 2012 [citado 2016 may 12]. Disponible en: http://www.biblioteca-medica.com.ar/2012/11/anemias-en-pediatria.html
7. Kazerounian S, Ciarlini P, Yuan D, Ghazvinian R, Alberich-Jorda M, Joshi M. Development of Soft Tissue Sarcomas in Ribosomal Proteins L5 and S24 Heterozygous Mice. J Cancer. [Internet]. 2016 [citado 2016 Ene 10]; 7(1): 32–36. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4679378/
8. Diamond Blackfan Anemia. Centers for Disease Control and Prevention (CDC). [internet]. 2015 [citado 2015 abr 04].Disponible en : https://rarediseases.info.nih.gov/espanol/12933/anemia-de-diamond-blackfan
9. Diamond-Blackfan anemia. Genetics Home Reference. November 2015; [citado 2015 mar 12]. Accessed :https://ghr.nlm.nih.gov/condition/diamond-blackfan-anemia
10. Clinton, C & Gazda, HT. Diamond Blackfan Anemia. GeneReviews. [internet]. 2014[citado 2016 abr 07]. Accessed: https://www.ncbi.nlm.nih.gov/books/NBK7047/?report=reader
11. Bravo L. Mireya, Rodríguez Z. Natalie. Anemia de Diamond-Blackfan: Experiencia clínica en 20 pacientes (1968-1998). Rev. chil. pediatr. [Internet]. 2000 Mayo [citado 2016 Nov 28] ; 71( 3 ): [Aprox.4.p.] Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0370-41062000000300003&lng=es.
12. Landowski M, O'Donohue MF, Buros C, Ghazvinian R, Montel-Lehry N, Vlachos A, et al. Novel deletion of RPL15 identified by array-comparative genomic hybridization in Diamond-Blackfan anemia. Hum Genet [Internet]. 2013 nov [citado 2016 ene 13]; 132(11):[Aprox.9.p.]. Disponible en: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3797874/
13. Sociedad Española de Transfusión Sanguínea. Guía sobre la transfusión de componentes sanguíneos y derivados plasmáticos. 5ªedicion 2015. SETS; [internet]2015 [citado 2017 jun 10]. Disponible en: http://www.prioridadcero.com/wp-content/uploads/2014/03/Guia_transfusion_quinta_edicion2015.pdf
Omar Viñas Díaz: Médico. Especialista de Primer Grado en Pediatría. Instructor Hospital Pediátrico Provincial Docente Pepe Portilla. Pinar del Río. Cuba. Si usted desea contactar con el autor de la investigación hágalo aqui














