Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009versión On-line ISSN 1818-1686
Fitosanidad v.13 n.2 Ciudad de la Habana abr.-jun. 2009
Control biológico
Evaluación de cepas de Bacillus thuringiensis para el control de Drosophila melanogaster Maengi
Evaluation of Bacillus thuringiensis Strains for the control of Drosophila melanogaster Maengi
Bertha Carreras Solís y Dayamí Rodríguez Batista
Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, CP 11600, bcarreras@inisav.cu
RESUMEN
El uso de Bacillus thuringiensis como biolarvicida es una alternativa viable para el control de insectos, por lo que el número de cepas activas contra diptera está en ascenso. En el presente trabajo se realizó la caracterización de cepas de esta bacteria aisladas de las diferentes regiones de Cuba, la cual se basó en la actividad insecticida contra Drosophila melanogaster, observación al microscopio electrónico de la mezcla de esporas y cristales, y electroforesis en gel de poliacrilamida con duodecil sulfato de sodio de la suspensión de esporas-cristales. Las cepas LBT-63 y LBT-87 mostraron similitudes con el B. thuringiensis subsp. israelensis usado en este estudio, en relación con el perfil proteico y la morfología de las inclusiones cristalinas. Estas cepas mostraron proteínas de 130, 70 y 27 kDa y cristales amorfos; sin embargo, solamente la cepa LBT-87 mostró actividad contra D. melanogaster, aunque más baja que el B. thuringiensis subs. israelensis control.
Palabras claves: Bacillus thuringiensis, Drosophila melanogaster, perfil proteico, cristal, toxicidad
ABSTRACT
The use of Bacillus thuringiensis as biolarvicide is a viable alternative for insect control so the number of known Bacillus thuringiensis strains active on diptera is growing. The characterization of strains of this bacterium isolated from different regions of Cuba is presented. Characterization was based on their insecticidal activity against Drosophila melanogaster, electron microscopy observation of the spores and crystal mixtures and sodium dodecyl sulfatepolyacrylamide gel electrophoresis (SDS-PAGE) of spore-crystal suspensions. Strains LBT-63 and LBT-87 displayed similarities with the B. thuringiensis subs. israelensis used in this study with regard profile protein and morphology of crystal inclusions. These strains had major proteins of 130, 70 and 27 kDa and amorphous crystal; however, the strain LBT-87 only showed insecticidal activity against D.melanogaster but lower than B. thuringiensis subs. israelensis control.
Key words: Bacillus thuringiensis, Drosophila melanogaster, profile protein, crystal, toxicity
INTRODUCCIÓN
El uso constante y creciente de los productos que se obtienen a partir de Bacillus thuringiensis se debe fundamentalmente a su alta especificidad, así como a su inocuidad para insectos benéficos, plantas y mamíferos, incluidos los humanos [Támez et al., 2007]. Dadas sus propiedades, esta bacteria representa una alternativa útil y complementaria a los insecticidas químicos actuales para el control de algunos insectos fitófagos [Kwang-Bo y Cóte, 2002].
El uso de B. thuringiensis como biolarvicida es una alternativa viable para el control de insectos. La toxicidad hacia dípteros está reportada principalmente hacia larvas de mosquitos (72 especies) y moscas negras (22 especies) [Regis et al., 2001]. La toxicidad, específicamente hacia larvas de Drosophila melanogaster Maengi se reportó por Saadoun et al. (2001) y por Al-Momani et al. (2004). Este pequeño organismo es en extremo prolífico y fácil de mantener, se alimenta de cualquier materia vegetal fermentada y no necesita cuidados especiales.
Drosophila transmite diversos microorganismos, en particular levaduras de los géneros Kloeckera y Saccharomyces, y bacterias del género Acetobacter, capaces de provocar una podredumbre ácida de las frutas, caracterizada por su fuerte olor ácido parecido al del vinagre. Los piretroides resultan muy eficaces, aunque precisarían tratamientos repetidos a pequeños intervalos y debe tenerse en cuenta el posible efecto favorecedor de la proliferación de ácaros.
Las gran mayoría de las cepas de B. thuringiensis que conforman la colección del Laboratorio de Bacterias Entomopatógenas del Instituto de Investigaciones de Sanidad Vegetal (Inisav) presentan patogenicidad, generalmente hacia lepidópteros ( Plutella xyllostela, Mocis Carreras y Rodríguez latipes y Spodoptera frugiperda), coleópteros (Cylas formicarius), ácaros (Polyphagotarsonemus latus, Tetranichus tumidus y Phylocoptruta oleivora) y nematodos (Meloidogyne incognita) [Fernández-Larrea, 1998, 1999; Márquez, 2005]. Hasta el momento no se ha reportado la acción de ninguna cepa hacia dípteros, por lo que el objetivo del presente trabajo fue la evaluación patogénica de cuatro cepas nativas de B. thuringiensis hacia el díptero D. melanogaster.
MATERIALES Y MÉTODOS
Las cepas de Bacillus thuringiensis utilizadas fueron B. thuringiensis subsp. israelensis HD567 (Bti) y Bacillus thuringiensis var. kurstaki (HD-1), del Bacillus Genetic Stock Center (Columbus, Ohio); cepas LBT-62 y LBT-63 aisladas en Ciudad de La Habana del Instituto del Arroz de Cuba, semillas de línea 8013 y variedad IA-Cuba 30, respectivamente; cepa LBT-87 aislada en Palma Soriano, provincia de Santiago de Cuba, en suelo de cultivo de tabaco, y cepa LBT-99 aislada en Sancti Spíritus, en raíz de tabaco de la variedad H1392.
Las cepas se pusieron a crecer en caldo Luria Bertani (LB) [Sambrook et al., 1989] a 28-30°C con agitación a 240 rpm hasta esporulación. La presencia del cristal se determinó mediante tinción simple con violeta cristal 0,5% y observación al microscopio óptico 1000 X.
Los precipitados de cultivos celulares de B. thuringiensis se fijaron en glutaraldehído al 5% en solución amortiguadora de fosfato de sodio 0,1 M y pH 7,4; se posfijaron en tetróxido de osmio al 2% en la misma solución amortiguadora, se deshidrataron en una serie de disoluciones de etanol de gradación creciente desde 20 hasta 100% y se infiltraron en mezclas de óxido de propileno y resina Supr. Con aumento gradual de la concentración de Supr se incluyeron finalmente en esta. Se obtuvieron cortes ultrafinos que se contrastaron con acetato de uranilo y citrato de plomo. Las muestras se observaron en un microscopio electrónico de transmisión, y para la observación se utilizaron dos réplicas de cada muestra.
La electroforesis en geles de poliacrilamida-SDS (SDSPAGE) se realizó como describieron previamente Schagger y von Jagow (1987). Suspensiones concentradas de esporas y cristales disueltos en buffer de lisis 4X se hirvieron durante 5 min. Se empleó como referencia una suspensión del marcador de peso molecular comercial Novagen 10-225 kDa.
El primer paso para el ensayo biológico se basó en obtener individuos adultos de D. melanogaster Meingende la propia zona de trabajo. El método descrito por Guerrero (2003) consistió en ofrecer un medio de puesta de huevos a las moscas salvajes, y con esto se dispuso de individuos adultos listos para elaborar los cultivos caseros. El medio de puesta consistió en tomar unos trozos de tomates bien maduros macerados. El olor avinagrado que produjo la fermentación resultó un poderoso atrayente para estos insectos. Se cubrió el fondo de unos recipientes plásticos con el alimento y se colocaron en un lugar cercano soleado durante dos o tres días, hasta que la multitud de estos insectos poblaron los alrededores del recipiente y comenzaron a depositar los huevos sobre la pasta de tomates maduros fermentados. Una vez que la pasta se pobló de larvas se retiraron para establecer la cría.
Los ensayos se hicieron con 20 larvas por cepa a probar. Se realizaron tres repeticiones con tres réplicas cada una. En una placa de Petri con medio nutriente que contenía un cultivo totalmente esporulado y cristalífero de la bacteria se colocaron 20 larvas, se sellaron con parafilm y se incubaron a 25°C.
Se realizó el mismo procedimiento con una placa de Petri con medio nutriente sin cultivo de B. thuringiensis, el que se consideró como control negativo. Las placas se observaron durante 10 días cada 24 h, y se determinaron los parámetros de mortalidad de las larvas, formación de pupas y emergencia de adultos.
RESULTADOS Y DISCUSIÓN
Las cepas LBT-63 y LBT-87 mostraron cristales amorfos muy similares a los encontrados en B. thuringiensis subs. israelensis; sin embargo, las cepas LBT-62 y LBT-99 manifestaron inclusiones muy pequeñas adheridas a las esporas.
La SDS-PAGE de las suspensiones de esporas y cristales muestra que las cepas LBT-63 y LBT-87 tuvieron un patrón proteico similar al informado para B. thuringiensis subs. israelensis, con proteínas de 130, 70 y 27 kDa. Las cepas LBT-62 y LBT-99 presentaron una proteína de 27 kDa.
Las Figs. 1 y 2 muestran la observación de los cristales al microscopio electrónico de transmisión, y el patrón proteico obtenido por SDS-PGE de las cepas LBT-87 y LBT-99.
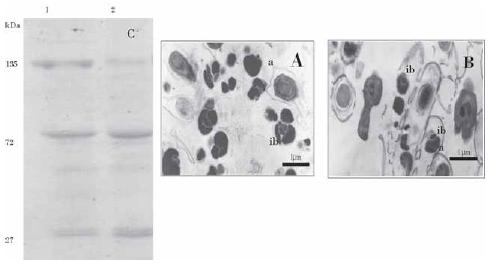
Figura1. Microfotografía al microscopio electrónico de transmisión [30000 X] de las cepas de B. thuringiensis: A) Bti, se observan cristales amorfos [a] con inclusiones en forma de barra [ib]; B) LBT-87, se observan cristales amorfos e unas inclusiones en forma de barra, más pequeñas [ib]. Análisis SDS-PAGE 10% de proteínas Cry; C) Carril 1. Bti, 2. carril 2. LBT-87.

Figura 2. Microfotografía al microscopio electrónico de transmisión [30000 X] de la cepa LBT-99 de B. thuringiensis. Cuerpoparaesporal de la cepa LBT-99 de B. thuringiensis localizado dentro del exosporio (señalizado por flecha). Análisis SDS-PAGE 10% de proteínas Cry: carril 1. HD1, 2. carril 2. LBT-99.
La evaluación de la actividad biológica frente a D. melanogaster muestra cómo la cepa LBT-87 provocó una mortalidad del 70% en las larvas. De las que lograron sobrevivir y formar pupas nunca llegaron a la fase de adulto. Las cepas restantes solamente retrasaron un poco la formación de las pupas, pero finalmente se produjo la emergencia de los adultos. Aunque la cepa LBT-87 mostró efecto contra D. melanogaster, la virulencia resultó menor que la obtenida con la cepa patrón Bti, específica para dípteros (mosquitos y jejenes) [Golberg y Margalit, 1977] (Tabla).
La toxicidad de B. thuringiensis hacia dípteros se atribuye a cepas del serotipo israelensis [Goldberg y Margalit, 1977]. Además de esta subespecie existen otros serotipos que presentan actividad tóxica hacia larvas de dípteros como lo son morrisoni, fukuokaensis, darmstadiensis, kyushuensis y jegathesan; sin embargo, israelensis es considerada la más tóxica e importante. De acuerdo con numerosos estudios e informes ha resultado muy activa contra larvas de mosquitos (72 especies) y moscas negras (22 especies).
La toxicidad de B. thuringiensis, específicamente cepas de patrón 134, 72 y 27 kDa hacia larvas de D. melanogaster, se informó por Saadoun et al. (2001) y por Al-Momani et al. (2004). Estos autores destacan a las cepas con cristales de morfología amorfa como las principales responsables de la patogenicidad. Los resultados de este trabajo no coinciden totalmente, pues aunque en el ensayo solo se probaron dos de las cepas que presentaron este tipo de morfología, la cepa LBT-63 no mostró efecto sobre las larvas de D. melanogaster; es decir, aunque esta cepa presentó una morfología y patrón Cry informado como el más efectivo para díptero, la respuesta frente a D. melanogaster fue negativa. Este resultado pudiera atribuirse a que la expresión de los genes que codifican para las proteínas Cry en la cepa LBT-63 sean más bajos, como informaron Ibarra et al. (2003) en un ensayo con cepas mosquitocidas de B. thuringiensis.Estos autores plantean que los genes cry pueden ser idénticos, pero los niveles de expresión de al menos alguno de ellos pueden ser diferentes, aunque la cepa tenga la combinación de proteínas más efectiva.

Otra posible explicación al no efecto de la cepa LBT-63 hacia larvas de D. melanogaster es la no especificidad a ese díptero, como informaron Saadoun et al. (2001), al encontrar cepas de B. thuringiensis de cristales amorfos con muy baja toxicidad hacia D. melanogaster, pero alta hacia Culex sp.
Las cepas LBT-62 y LBT-99 presentaron un perfil Cry caracterizado por una sola proteína de muy bajo peso molecular, que pudiera considerarse como proteínas Cyt según Guerchicoff et al. (2001), o como una proteína Cry de pequeño tamaño de acuerdo con lo informado por Rampersad y Ammons (2005). Al no resentar estas cepas actividad contra D. melanogaster, se pudiera pensar que se trata de una proteína Cry de pequeño tamaño, cuya actividad biológica no se conoce para dípteros; o de una proteína Cyt que al no estar acompañadas de las Cry de 134 y 72 kDa que conforman el patrón para díptero, no mostraron el efecto esperado. Una de las características de las cepas que muestran actividad contra dípteros es la presencia de toxinas Cyt, pero estas no son tóxicas por sí solas, sino que manifiestan su acción al potenciar a las Cry y establecer una clara acción sinérgica [Bravo et al., 2006; Soberón, 2007]. Esto explica los resultados con las cepas LBT-62 y LBT-99.
Se puede considerar que la cepa LBT-87 es promisoria no solo para el control de plagas de importancia agrícola, sino también médica, al ser D. melanogaster un vector de enfermedades.
CONCLUSIONES
• Las cepas LBT-63 y LBT-87 mostraron similitudes con el B. thuringiensis subsp. israelensis en relación con el perfil proteico y la morfología de las inclusiones cristalinas.
• La cepa LBT-87 solamente mostró actividad contra Drosophila melanogaster, aunque más baja que el B. thuringiensis subs. israelensis control.
REFERENCIAS
Al-Momani, F.; M. Obeidat; I. Saadoun; M. Meqdam: «Serotyping of Bacillus thuringiensis Isolates, Their Distribution in Different Jordanian Habitats and Pathogenicity in Drosophila melanogaster», World Journal of Microbiology and Biotechnology 20(7):749-753, EE.UU., 2004.
Bravo, A.; M. Soberón; I. Gómez; C. Muñoz; L. Pardo; L. Galán; H. Luna; A. Alcázar; B. Pereira; J. A. Carrillo; R. García; L. Serrano; M. Patino; E. Galindo; M. C. del Rincón; J. E. Ibarra: «Los microorganismos en el control biológico de insectos y fitopatógenos», Rev. Latinoam. Microbiol. 48(2):113-120, México, 2006.
Fernández-Larrea, O.: «Proyecto 300104. Desarrollo de productos de Bacillus thuringiensis para el control de ácaros, nematodos y coleópteros. Etapa 01. Estudio del espectro de acción de las cepas », Inisav, Cuba, 1998.
____: «Review of Bacillus thuringiensis Production in Cuba», Biocontrol News and Information 20(1):47-48, EE.UU.,1999.
Goldberg L. J.; J. Margalit: «A Bacterial Spore Demonstrating Rapid Larvicidal Activity Against Anopheles sergentii, Uranotaenia unguiculata, Culex univittatus, Aedes aegypti and Culex pipiens», Mosq. News 37:355-358, EE.UU., 1977.
Guerchicoff, A.; A. Delecluse; C. P. Rubinstein: «The Bacillus thuringiensis cyt Genes for Hemolytic Endotoxins Constitute a Gene Family», Appl. Environ. Microbiol. 67:1090-1096, EE.UU., 2001.
Guerrero, M.: «Las moscas de la fruta», Seca 1:71-23, 2003. Ibarra, J. E.; M. C. del Rincón; O. Orduz; D. Noriega; G. Benintende; R. Monnerat; L. Regis; C. M. F. de Oliveira; H. Lanz; M. H. Rodríguez; J. Sánchez; G. Peña; A. Bravo: «Diversity of Bacillus thuringiensis Strains from Latin America with Insecticidal Activity Against Different Mosquito Species», Appl. Environ. Microbiol. 69:5269-5274, EE.UU., 2003.
Kwang-Bo, J.; J.Cóte: «A Review of the Environmental Impacts of the Microbial Insecticide Bacillus thuringiensis», Agriculture and Agri- Food, Canadá. 2002. Accesible en http://www.res2.agrca7stjean/ (consultado el 8 de octubre del 2003).
Márquez, M. E.: «Selección y evaluación tóxico-patogénica de cepas cubanas de Bacillus thuringiensis con actividad nematicida», tesis en opción al grado científico de Doctora en Ciencias Agrícolas, Universidad Central de Las Villas, Cuba, 2005.
Rampersad, J.; A. Ammons: «A Bacillus thuringiensis Isolation Method Utilizing a Novel Stain, Low Selection and High Throughput Produced Atypical Results», BMC Microbiol. 5:52, 2005.
Regis, L.; S. B. da Silva; M. A. V. Melo-Santos: «The Use of Bacterial Larvicides in Mosquito and Black Fly Control Programs in Brazil», Memórias do Instituto Oswaldo Cruz 95:207-210, Brasil, 2001.
Saadoun, I.; F. Al-Momani; M. Obeidat; M. Meqdam; A. Elbetieha: «Assessment of Toxic Potential of Local Jordanian Bacillus thuringiensis Strains on Drosophila melanogaster and Culex sp. (Diptera)», Journal of Applied Microbiology 90(6):866-872, EE.UU., 2001.
Sambrook, J.; E. F. Fritsch; T. Maniatis: Molecular Cloning. A laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NuevaYork, 1989.
Schagger, H.; G. von Jagow: «Tricine-Sodium Dodecyl Sulfate- Polyacrylamide Gel Electrophoresis for the Separation of Proteins in the Range from 1 to 100 kDa», Analytical Biochemistry 166:368- 379, EE.UU., 1987.
Soberón, M.; L. E. Fernández; C. Pérez; S. S. Gill; A. Bravo: «Mode of Action of Mosquitocidal Bacillus thuringiensis Toxins», Toxicon. 49(5):597-600, México, 2007.
Támez, P.; M. M. Iracheta; B. Pereira; L. J. Galán; R. Gómez; R. Támez; C. Rodríguez: «Caracterización de cepas mexicanas de Bacillus thuringiensis tóxicas para larvas de lepidópteros y coleópteros», Ciencia UANL 8(4):477-482, México, 2007.














