Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión On-line ISSN 1818-1686
Fitosanidad v.13 n.2 Ciudad de la Habana abr.-jun. 2009
Control Biológico
Patogenicidad de Beauveria bassiana (Bals.) Vuillemin sobre estados inmaduros de mosquita blanca (Bemisia tabaci Genn.)
Beauveria bassiana (Bals.) VuilleminPathogenicity on Immature States of Bemisia tabaci Genn
Esaú Ruiz Sánchez¹, Agatha T. Rosado Calderón¹, Wilberth Chan Cupul¹, Jairo Cristóbal Alejo¹ y Ricardo Munguía Rosales²
¹Instituto Tecnológico de Conkal. Km 16,3 Antigua Carretera Mérida-Motul, Conkal, Yucatán, México, CP 97345, fax (999) 9124135, esauruizmx@yahoo.com.mx
²Comité Estatal de Sanidad Vegetal del Estado de Yucatán. Calle 19 no. 443, Colonia, Ciudad Industrial, CP 97288, Mérida, Yucatán, México
RESUMEN
Se evaluó la patogenicidad de tres aislamientos nativos (Bb-Cam, Bb-C y Bb-M) y uno comercial (Bea-sin) de Beauveria bassiana (Bals.) Vuillemin en inmaduros de Bemisia tabaci Genn. La evaluación se llevó a cabo en laboratorio a temperatura de 27 ± 3ºC y humedad relativa del 75 ± 8% con una solución conidial de 1 x 107 esporas • mL_1 sobre huevos y ninfas de primer instar. El efecto de los hongos fue mayor en ninfas que en huevos. No se observó diferencia significativa (p > 0,05) en la mortalidad de huevos por efecto de los aislamientos de B. bassiana. En la aplicación a ninfas, los aislamientos mostraron diferente grado de patogenicidad y sobresalió el aislamiento Bea-sin como el más patogénico (p < 0,05), que causó el 67,9% de mortalidad. El resto de los aislamientos causó del 42 al 50% de mortalidad. Con los datos de mortalidad en ninfas se calculó el tiempo medio letal de cada aislamiento (TL50) y el área bajo la curva de la mortalidad acumulada (ABCMA). El aislamiento que presentó menor TL50 y mayor ABCMA fue Bea-sin con 3,6 días y 381,22 unidades, respectivamente. Estos resultados indican que Bea-sin fue más virulento que los aislamientos nativos.
Palabras claves: patogenicidad, Bemisia tabaci, Beauveria bassiana, hongos entomopatógenos
ABSTRACT
The pathogenicity of three indigenous (Bb-Cam, Bb-C y Bb-M) and one commercial (Bea-sin) isolates of Beauveria bassiana were evaluated on immature states of Bemisia tabaci. The evaluation was carried out under laboratory conditions with temperature of 27 ± 3ºC and relative humidity of 75 ± 8%, by the application of a conidial suspension containing 1 x 107 spores • mL_1 to eggs and first instar nymphs. The effect of B. bassiana was higher on nymphs than on eggs. No significant difference (p> 0.05) was observed on egg mortality caused by B. bassiana isolates. These isolates showed different degree of pathogenicity on nymph bioassay. The isolate Bea-sin showed the highest (p < 0.05) effect (67.9% mortality). The rest of the isolates caused mortality from 42 to 50%. The medium lethal time (TL50) and the area under the curve of cumulative mortality (AUCCM) were calculated for the nymph bioassay. Bea-sin showed the lowest TL50 and the highest AUCCM, with values of 3.6 days and 381.22 units, respectively. These results indicate that Bea-sin showed more virulence than the indigenous isolates.
Key words: pathogenicity, Bemisia tabaci, Beauveria bassiana, entomopatogen fungi
INTRODUCCIÓN
La mosquita blanca (Bemisia tabaci (Gennadius) (Homoptera: Aleyrodidae)) es una de las plagas que limitan el desarrollo de una amplia gama de cultivoshortícolas [Gutiérrez et al., 2007; Sotero et al., 2007]. Los daños que produce pueden ser directos, como la succión de savia, e indirectos, como la transmisión de virus fitopatógenos [Cárdenas, 1999]. Los últimos grupos de insecticidas organosintéticos que se registraron en el mercado, como los neonicotinoides y reguladores de crecimiento, hasta hace poco habían sido un medio eficiente de manejo de B. tabaci. No obstante, en la actualidad existen numerosos reportes de resistencia de poblaciones de B. tabaci a esos grupos insecticidas [Horowitza et al., 1999; Palumbo et al., 2001; Nauen et al., 2002].
El uso de hongos entompatógenos para el control biológico de B. tabaci ha cobrado importancia en los últimos años. En este contexto, los géneros Paecilomyces, Lecanicillium, Aschersonia, Beauveria y Metarhizium se han empleado con bastante éxito de manera experimental o en aplicaciones de campo [Monzón, 2001; Dos Santos y Pozo, 2003; Pucheta et al., 2006]. En general, los hongos representan una excelente alternativa porque pueden infectar diferentes estados de desarrollo de su hospedero y son de baja o nula patogenicidad para organismos benéficos y para el humano [Ferron, 1977].
Beauveria bassiana (Deuteromycetes: Moniliales) comúnmente parasita insectos de los órdenes Lepidoptera, Coleoptera y Hemiptera [Falcon, 1985; Tanada y Kaya, 1993; Humber, 1996]. Inclusive, a nivel de campo este hongo se ha desarrollado exitosamente como agente de control biológico de diversos insectos plaga como el picudo negro (Cosmopolites sordidus) [Goettel, 1992; Godonou et al., 2000], la broca del café Hypothenemus hampei [Gaitán et al., 2002] y la langosta (Schistocerca piceifrons) [Pariona et al., 2007]. B. bassiana también se ha evaluado contra huevos y ninfas de B. tabaci, donde este hongo ha mostrado diferentes grados de patogenicidad. Por ejemplo, Al-Deghairi (2008) reporta que ocasiona bajos porcentajes de mortalidad en huevos. Por el contrario, en algunos estudios en ninfas se han encontrado porcentajes de mortalidad de hasta el 96,5% [Espinel et al., 2008]. La patogenicidad se ha comprobado que depende de las características propias de los aislamientos, como lo demuestran Vicentini et al. (2001), quienes encontraron que la mortalidad de ninfas de B. tabaci varió del 6,1 a 92,3% al evaluar 50 aislamientos de B. bassiana.
En el presente trabajo se evaluó la patogenicidad y virulencia de tres aislamientos nativos y uno comercial de B. bassiana en estados inmaduros de B. tabaci, con la finalidad de encontrar agentes de control biológico efectivos y adaptados a condiciones ambientales regionales.
MATERIALES Y MÉTODOS
Los adultos de B. tabaci se colectaron en cultivos de chile habanero (Capsicum chinennse) del Instituto Tecnológico de Conkal (ITC), en Conkal, Yucatán, México. Los adultos se transfirieron al invernadero de adaptación del ITC y se colocaron en jaulas entomológicas de 1 x 0,6 x 0,6 m, hechas de malla antiáfidos y marco metálico, las que contenían plántulas de C. chinennse en macetas de plástico. Los aislamientos nativos experimentales de Beauveria bassiana (Bb-Cam, Bb-C y Bb-M) fueron aislados de mosquitas blancas por personal del Laboratorio de Reproducción de Hongos Entomopatógenos del Comité Estatal de Sanidad Vegetal del Estado de Yucatán, México. Los aislamientos se reactivaron en el Laboratorio de Fitopatología del ITC en medio artificial sabouraud-dextrosa-agar a temperatura de 27 ± 3ºC y fotoperíodo de 12:12 luz:oscuridad. La cepa comercial Bea-sin se utilizó en su presentación comercial.
Para los bioensayos se emplearon plántulas de C. chinennse con 30 días de edad como hospederas de B. tabaci.Los estados inmaduros del insecto se obtuvieron según la metodología de Muñiz y Nombela (2001). Se tomaron cinco adultos de B. tabaci con un aspirador bucal y se depositaron en una jaula pinza, sujeta a una hoja completamente extendida de la parte superior de la plántula. A las 24 h los adultos y las microjaulas fueron retirados, de tal manera que los huevos ovipositados pudieran usarse inmediatamente para los bioensayos respectivos o se esperase de cinco a siete días para los bioensayos con ninfas de primer instar. Únicamente se dejaron de 25 a 30 huevos o ninfas por hoja como unidad experimental.
Las suspensiones de conidios para los bioensayos se obtuvieron de los aislamientos cultivados en medio SDA, a los que se agregó 10 mL de agua destilada más tween 80 al 0,05% (v/v) en las placas de Petri para remover el micelio y esporas mediante raspado con un bisturí. El producto del raspado se filtró por medio de gasas estériles para obtener suspensiones de conidios puras; las que se ajustaron a 1 x 107 esporas • mL_1 con ayuda de una cámara de Neubauer y un microscopio compuesto [Alean, 2003]. Los tratamientos se aplicaron por inmersión de las hojas de C. chinennse que contenían los huevos o ninfas durante 15 s en las suspensiones de conidios ya mencionadas [Gindin et al., 2000]. El testigo se trató con agua destilada estéril más tween 80. Las plantas que contenían las hojas tratadas se mantuvieron en el Laboratorio de Fitopatología del ITC a temperatura de 27 ± 3ºC, humedad relativa del 75 ± 8% y fotoperíodo de 12:12 luz:oscuridad.
Las evaluaciones de mortalidad se realizaron diariamente durante siete días en los bioensayos con huevos y durante 10 días en los bioensayos con ninfas. Las evaluaciones se llevaron a cabo con un microscopio estereoscópico, se registró como muertos los huevos micosados, necrosados, deformes y no eclosionados [Gindin et al., 2000; Skrobek, 2001]; y en ninfas los criterios para considerar ninfas muertas fueron los cambios de coloración, brillo, forma y aspecto del cuerpo, así como el crecimiento de micelio sobre este [Dos Santos et al., 2003].
En todos los experimentos se utilizó un diseño completamente al azar con cuatro repeticiones por tratamiento. Los resultados de las pruebas de patogenicidad en huevos y ninfas se analizaron en el programa estadístico SAS ver. 8 e para Windows (SAS Institute Inc., USA), con el cual también se calculó el TL50 mediante análisis probit. El área bajo la curva de la mortalidad acumulada (ABCMA) se calculó por medio de la siguiente ecuación [Campbell y Madden, 1990]:
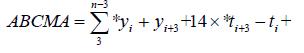
donde:
N: Número de evaluaciones
Y: Porcentaje acumulado de mortalidad
t: Número de días entre cada evaluación
La primera evaluación se llevó a cabo con t = 1 y y = 0.
RESULTADOS Y DISCUSIÓN
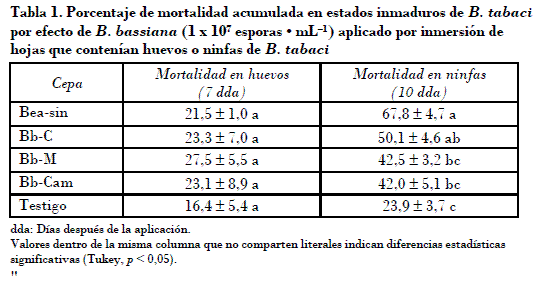
El porcentaje de mortalidad de huevos de B. tabaci por efecto de B. bassiana varió del 21,5 a 27,5% a los siete días después de la aplicación (dda). No se observó diferencia significativa (p > 0,05) entre la mortalidad producida por los aislamientos y la registrada en el testigo (Tabla 1), en el que se observó el 16,5% de mortalidad de huevos. Otros estudios han reportado muy bajos efectos ovicidas de B. basiana en B. tabaci. Al-Deghairi (2008), por ejemplo, reportó mortalidades menores al 5% al usar suspensiones de conidios similares a las evaluadas en el presente trabajo. Para efectos de comparación es preciso mencionar el trabajo de Gindin et al. (2000), quienes utilizaron Lecanicillium lecanii en concentraciones de 1 x 107 esporas • mL_1, donde se observó del 14 al 26% de mortalidad de huevos. Ese resultado fue considerado como excelente efecto ovicida.
Los porcentajes de mortalidad de ninfas de B. tabaci fueron mayores que los observados en huevos. La mortalidad de ninfas por efecto de B. bassiana varió del 42 al 67,8% (Tabla 1). El aislamiento Bea-sin, que ocasionó el 67,8% de mortalidad, presentó significativamente mayor virulencia que los aislamientos Bb-M y Bb-Cam, que ocasionaron el 42,5 y el 42% de mortalidad, respectivamente. Se considera entonces que los aislamientos nativos evaluados en este estudio presentan menor capacidad patogénica que el aislamiento comercial Beasin. Aun así el efecto de los aislamientos nativos son parecidos a los encontrados en otros estudios de patogenicidad de aislamientos nativos de B. bassiana en inmaduros de B. tabaci, como el que reporta Catie (2006), donde se encontró que los aislamientos más patogénicos causaron el 58% de mortalidad en ninfas de primer instar.
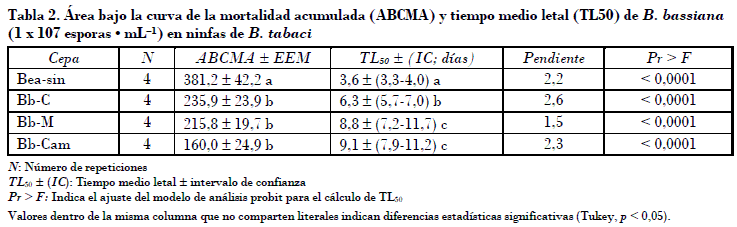
Se obtuvieron otros parámetros indicativos de la capacidad patogénica de los aislamientos evaluados como el área bajo la curva de la mortalidad acumulada (ABCMA) y el tiempo medio letal (TL50) de cada aislamiento. Al respecto se observó que Bea-sin con 381,2 presentó significativamente mayor valor de ABCMA comparado con el resto de los aislamientos que presentaron de 160 a 235,9 unidades. Por otro lado, el tiempo medio letal varió de tres a nueve días (Tabla 2). Con base en el traslape del intervalo de confianza (IC), el aislamiento Bea-sin presentó significativamente menor TL50 con 3,6 días. Valores bajos de TL50 son indicativos directos de alta capacidad patogénica de los hongos. En este contexto cabe mencionar que los efectos observados en Bea-sin están por encima de los que reportan otros autores como Vicentini et al. (2001), quienes encontraron que el tiempo medio letal era de más de siete días en un estudio de 50 aislamientos de B. bassiana bajo condiciones similares de temperatura y humedad a las prevalecientes en el presente estudio. Algunos estudios que muestran efectos mayores de B. bassiana deben tomar en cuenta las condiciones de temperatura y humedad relativa durante tales experimentos. Espinel et al. (2008), por ejemplo, encontraron hasta el 96,5% de mortalidad en ninfas, pero a temperaturas más bajas y humedad relativa más alta que las del presente estudio.
CONCLUSIONES
• Los aislamientos de B. bassiana (Bb-Cam, Bb-C y Bb-M) evaluados tienen mayor capacidad patogénica en ninfas que en huevos de B. tabaci.
• Ninguno de los aislamientos nativos mostró mayor patogenicidad que el aislamiento comercial Bea-sin, el cual causó mayor área bajo la curva de la mortalidad acumulada y menor tiempo medio letal.
• Este aislamiento podría considerarse un agente potencial de control biológico de B. tabaci, alternativa que tendría aplicación tanto en sistemas de manejo integrado de plagas como en sistemas de manejo ecológico y orgánico.
REFERENCIAS
Al-Deghairi, M. A.: «Bioassay Evaluation of the Entomopathogenic Fungi, Beauveria bassiana Vuellenim Against Eggs and Nynphs of Bemisia tabaci Gennadius (Homoptera: Aleyrodidae)»,Pakistan Journal of Biological Science 11(12):1551-1560, Pakistán, 2008.
Alean, C. I.: «Evaluación de la patogenicidad de diferentes hongos entomopatógenos para el control de la mosca blanca de la yuca (Aleurotrachelus socialis Bondar) (Homoptera: Aleyrodidae) bajo condiciones de invernadero», tesis de licenciatura, Pontifica Universidad Javeriana, Bogotá, Colombia, 2003.
Campbell, C. L.; L. V. Madden: Introduction to Plant Disease Epidemiology, Ed. John Whiley & Son., Nueva York, 1990.
Cárdenas S. E.: «Virus transmitidos por mosquita blanca», Hortalizas: plagas y enfermedades, Ed. Trillas. México, 1999, pp. 176-178. Catie: «Desarrollo de micoinsecticidas para el manejo integrado de la mosca blanca (Bemisia tabaci) en cultivos frutales y hortícolas, en zonas neotropicales», Informe técnico final de proyecto fontagro, Coorporación Colombiana de Investigación Agropecuaria (Corpoica), Colombia, 2006.
Dos Santos, R. A.; N. M. Pozo: «Alternativa para el manejo de Trialeurodes vaporariorum Westwood en tomate orgánico en Uruguay », Bol. San. Veg. Plagas 29:211-218, España, 2003.
Espinel, C.; L. Torres; E. Grijalba; L. Villamizar; A. M. Cotes: «Preformulados para control de la mosca blanca Bemisia tabaci (Hemiptera: Aleyrodidae) en condiciones de laboratorio», Revista Colombiana de Entomología 34(1):22-27, Colombia, 2008.
Falcon, L.: Development and Use of Microbial Insecticides in Biological Control in Agricultural IPM Systems, Academic Press, Londres, 1985, pp. 229-242. Ferron, P.: «Biological Control of Insect Pests by Entomogenous Fungi», Annual Review of Entomology 23:409-442, EE.UU., 1977.
Gaitán, A.; A. M. Valderrama; G. Saldarriaga; P. Vélez; A. Bustillo: «Genetic Variability of Beuveria bassiana Associated to the Coffee Berry Borer Hypothenemus hampei and Other Insects», Mycolical Research 106(11):1307-1314, Inglaterra, 2002.
Gindin, G.; N. U. Geschtovt; B. Raccah; I. Barash: «Pathogenicity of Verticillium lecanii to Different Developmental Stages of the Silverleaf Whitefly, Bemisia argentifolii», Phytoparasitica 28(3):1-11, Holanda, 2000.
Godonou, I.; K. R. Green; K. A. Oduro; C. J. Lomer; K. Afreh-Nuamah: «Field Evaluation of Selected Formulation of Beuveria bassiana for the Management of the Banana Weevil (Cosmopolites sordidus) on Plantain (Musa spp.)», Biocontrol Science and Technology 10(6):779- 788, Inglaterra, 2000.
Goettel, M.: «Fungal Agents for Biocontrol», Biological Control of Locust and Grasshoppers, CAB International, Ascot, Inglaterra, 1992, pp. 122-132.
Gutiérrez, O. M.; J. C. Rodríguez M.; C. Llanderal C.; A. P. Terán V.; A.Lagunes T.; O. Díaz G.: «Estabilidad de la resistencia a Neonicotinoides en Bemisia tabaci (Gennadius), Biotipo B de San Luis Potosí, México», Agrociencia 41:913-920, México, 2007.
Horowitza, R.; Z. Mendelson; M. Cahill, I. Deholm, I. Ishaaya: «Managing Resistance to the Insect Growth Regulator, Piriproxyfen, in Bemisia tabaci», Pesticide Science 55(3):272-276, Inglaterra, 1999.
Humber, R.: «Fungi: Identification», Manual of Techniques in Insect Pathology, Academic Press, Nueva York, 1996, pp. 153-185.
Monzón, A.: «Producción, uso y control de calidad de hongos entomopatógenos en Nicaragua» Manejo Integrado de Plagas y Agroecología 63:95-103, Costa Rica, 2001.
Muñiz, M.; G. Nombela: «Differential Variation of Development of the Band Q-Biotypes of Bemisia tabaci on Sweet Pepper Capsicum annum L. at Constant Temperatures», Environmental Entomology 30:720-727, EE.UU., 2001.
Nauen, R.; N. Stumpf; A. Elbert: «Toxicological and Mechanistic Studies on Neonicotinoid Cross Resistance in Q-Type Bemisia tabaci (Hemiptera: Aleyrodidae)», Pest Management Science 58(9):868- 875, Inglaterra, 2002.
Palumbo, J. C.; A. R. Horowitz; N. Prabhaker: «Insecticidal Control and Resistance Management for Bemisia tabaci», Crop Protection 20:739-765, EE.UU., 2001.
Pariona, N.; P. Castellanos; E. León: «Capacidad entomocida de cepas nativas de Beauveria spp. sobre Schistocerca piceifrons peruviana», Revista Peruana de Biología 14(2):253-257, Lima, 2007.
Pucheta, D. M.; A. Flores; N. Rodríguez; M. de la Torre: «Mecanismo de acción de los hongos entomopatógenos», Interciencia 31(12): 856- 860, Venezuela, 2006.
Skrobek, A.: «Investigations on the Effect of Entomopathogenic Fungi on Whiteflies» Institut für Pflanzenkrankheiten der Rheinischen Friedrich-Wilhelms-Universität Bonn. Doktorwürde der Agrarwissenschaften, http://hss.ulb.uni-bonn.de/diss_online/ landw_fack/2001/skrobek_ anke/text.pdf. 2001 (consultado en enero del 2009).
Sotero, A. M.; J. C. Rodríguez M.; C. Santillán O.; A. Lagunes T.; O. Díaz G.; J. L. Martinez C.: «Susceptibilidad a insecticidas en dos poblaciones de Bemisia tabaci (Gennadius) (Hemiptera: Aleyrodidae) biotipo B colectadas en Baja California y Sinaloa, México», Interciencia 32(4):226-269, Venezuela, 2007.
Tanada, Y.; H. Kaya: Insect Pathology, Academic Press, NuevaYork, EE.UU., 1993.
Vicentini, S.; M. Faria; R. M. Oliveira: «Screening of Beauveria bassiana (Deutomycotina: Hyphomycetes) Isolates Against Bemisia tabaci (Genn.) Biotype B. (Hemiptera: Aleyrodidae) with a Description of a New Bioassay Method», Neotropical Entomology 30(1):97-103, Brasil, 2001.














