Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009versión On-line ISSN 1818-1686
Fitosanidad v.13 n.2 Ciudad de la Habana abr.-jun. 2009
Control Biológico
Potencialidades de bacterias aerobias formadoras de endosporas para el biocontrol en plantas ornamentales
Potentials of Aerobic Endospore Forming Bacteria (AEFB) for Biocontrol in Ornamental Plants
Teresa de los Milagros Orberá Ratón, Manuel de Jesús Serrat Díaz y Zenia González Giro
Universidad de Oriente. Ave. Patricio Lumumba s/n, reparto Quintero, Santiago de Cuba, CP 90500, Apdo. 5015
RESUMEN
Se realizó la evaluación in vitro de la actividad inhibitoria del crecimiento que ejercen bacterias aerobias formadoras de endosporas (BAFE) sobre hongos fitopatógenos aislados de plantas ornamentales. La actividad biocida se determinó mediante la coinoculación de los hongos y los aislados bacterianos en placas Petri con agar papa dextrosa Biocen. Se presentan las curvas de inhibición del crecimiento para cada hongo y el control, y se calculó el porcentaje de inhibición del crecimiento radial (PICR). El 62% de los aislados bacterianos mostró la formación de una zona de inhibición del crecimiento de los hongos, y se seleccionaron cinco con actividad inhibitoria simultánea, la cual se evidencia a partir del tercer día de incubación. En las colonias de C. lunata se observó una zona de lisis interna y un engrosamiento del borde en la zona de inhibición. El PICR osciló entre el 51,6 y el 72,2%. La descripción de los aislados bacterianos basada en caracteres fenotípicos confirmó su ubicación taxonómica en el grupo de las bacterias aerobias formadoras de endosporas, Clase Bacilli.
Palabras claves: bacilli, antibiosis, plantas ornamentales
ABSTRACT
The in vitro evaluation of the growth inhibitory activity, carried out by aerobic endospore forming bacteria (AEFB) on phythopatogenic fungi, isolated from ornamental plants, was done. The biocide activity was determined by the co-inoculation of fungi and bacterial isolates on Petri dishes containing Potato Dextrose Agar, BIOCEN. There were presented the growth inhibition curves for each fungi and a control, and it was calculated the radial growth inhibition percentage (RGIP). The 62% of the bacterial isolates generate a fungal growth inhibition area, being selected five strains with simultaneous inhibitory activity, evident after the third day of incubation. In the colonies of Curvularia lunata it was observed an internal lyses area and a dimness of the colony border next of the inhibition zone. The RGIP oscillated between 51.6 and 72.2%. The bacteria isolates description based on phenotypic characteristics, confirmed their taxonomic location in the aerobic endospore forming bacteria group, Bacilli Class.
Key words: bacilli, antibiosis, ornamental plants
INTRODUCCIÓN
Las plantas ornamentales son afectadas por hongos fitopatógenos, entre los que se encuentran incluso especies oportunistas saprófitas del suelo. La susceptibilidad de estos cultivos a las enfermedades se debe a los manejos a que se someten para el mejoramiento de sus cualidades estéticas, como extirpación de tejidos y órganos de protección, además del cultivo ex situ [Dickinson, 1987].
La producción de plantas ornamentales en Santiago de Cuba está relativamente deprimida en relación con otras provincias del país. Las enfermedades causadas por hongos se tratan mayormente con productos químicos y solo se aplica Trichoderma sp. como controlador biológico.
Los géneros Bacillus y Paenibacillus se encuentran entre las bacterias aerobias formadoras de endosporas (BAFE), miembros de la Clase Bacilli que expresan actividad promotora de crecimiento en plantas. Varios productos comerciales usados como fungicidas, insecticidas, nematicidas o promotores de crecimiento vegetal genéricos se elaboran con aislados pertenecientes a ambos [McSpadden, 2004]. Se destaca la especie Bacillus subtilis, considerada entre las de mayor actividad en el control biológico de enfermedades de origen fúngico y bacteriano [Fernández-Larrea, 2001]. Entre los mecanismos que utilizan para el biocontrol se encuentran la antibiosis directa a través de la excreción de sustancias con actividad biocida, tales como subtilisina, iturinas y polimixinas [Rahman et al., 2006].
A pesar de las ventajas reconocidas para Bacillus y géneros similares, por la contribución que realizan al crecimiento y la bioprotección de especies vegetales, en el país solo la especie B. thuringiensis está incorporada al programa nacional de producción de medios biológicos, y destinada al control de insectos plaga. Un estudio previamente realizado en el jardín Las Américas, centro de referencia para el cultivo de plantas ornamentales en la provincia de Santiago de Cuba, reveló la abundancia de especies rizosféricas de Bacillus, principalmente en canteros cultivados con Dahlia sp., Rosa sp. y Polianthes tuberosa [Orberá et al., 2005]. La capacidad de este género para solubilizar fuentes de fósforo inorgánico, la actividad ureasa y nitrato reductasa, entre otras, ofrecen posibilidades de encontrar aislados con actividad antifúngica, que además contribuyan a mejorar la nutrición nitrógeno-fosforada de las plantas.
El objetivo de este trabajo es la evaluación de la actividad inhibitoria que ejercen aislados de bacterias aerobias formadoras de endosporas sobre el crecimiento de hongos causantes de enfermedades en plantas ornamentales.
MATERIALES Y MÉTODOS
La investigación se realizó en el Centro de Estudios de Biotecnología Industrial de la Facultad de Ciencias Naturales, Universidad de Oriente, Santiago de Cuba.
Se utilizaron 58 cepas de bacterias aerobias formadoras de endosporas, aisladas a partir de suelo rizosférico en el jardín de plantas ornamentales Las Américas, en la ciudad de Santiago de Cuba, en canteros cultivados con variedades comerciales de Dahlia sp. (dalia), Rosa sp. (rosa) y Polianthes tuberosa (azucena). El aislamiento fue realizado mediante una modificación al método de resistencia térmica de las endosporas, descrita por Orberá et al. (2005),la cual consiste en preincubar a 45ºC durante 24 h las muestras de suelo para inducir la esporulación de las células vegetativas presentes en el momento del muestreo. Posteriormente este se hierve durante 15 min, y se recupera un número de aislados de bacilos gram positivos endosporógenos en el orden de 103 ufc/mL [Orberá et al., 2005].
Los hongos fitopatógenos fueron aislados de plantas enfermas en el área de trabajo y donados por el Laboratorio Provincial de Sanidad Vegetal para esta investigación. Las cepas utilizadas fueron Curvularia lunata CL-20, Fusarium oxysporum FO-30, Colletotrichum sp. CH-7 y Colletotrichum sp. CH-6. Los microorganismos se conservaron por subcultivo activo a 4°C, en agar nutriente las bacterias, y en agar papa y dextrosa los hongos.
La evaluación in vitro del efecto inhibidor de las cepas de BAFE sobre los hongos fitopatógenos se desarrolló a través de la prueba de antibiosis en placas, reportada por Muhammad y Amusa (2003), que consiste en la preparación de placas Petri de 90 mm de diámetro con 10 mL de agar papa dextrosa (Biocen). Las placas se dividen en cuatro cuadrantes por medio del trazado de dos líneas perpendiculares a lo largo del diámetro, las cuales se interceptan en el centro del recipiente. En la intersección de las líneas se siembra por punción la cepa de hongo filamentoso. Las bacterias se inoculan a razón de 1 mL a una concentración de 106 ufc/mL sobre las líneas, en cuatro puntos periféricos equidistantes a 20 mm del centro de la placa. La incubación se realiza a 30oC, en posición invertida y en la oscuridad. Se prepara además un control consistente en la siembra del hongo en ausencia de bacterias. La observación y medición del crecimiento radial de las colonias se realizó cada 24 h durante 15 días. Se confecciona la curva de crecimiento de los hongos fitopatógenos correspondiente al enfrentamiento con cada bacteria y el control. Se prepararon tres réplicas para cada placa inoculada.
La determinación de la inhibición del crecimiento fúngico se realizó a los seis días de incubación por el método reportado por Ezziyyani et al. (2004a), mediante el cálculo del porcentaje de inhibición del crecimiento radial de los hongos fitopatógenos (PICR), según la siguiente fórmula:
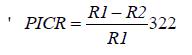
donde:
PICR: Porcentaje de inhibición del crecimiento radial (%)
R1: Valor promedio del radio de la colonia control (mm)
R2: Valor promedio del radio de la colonia inhibida por las bacterias (mm)
La descripción morfológica y fisiológica de los cinco aislados bacterianos seleccionados, para confirmar su clasificación dentro de las bacterias aerobias formadoras de endosporas, se realizó a través de las técnicas de pruebas de tinción diferencial de gram y de endosporas, motilidad, producción de enzimas catalasa, citocromo oxidasa, nitrato reductasa y ureasa, producción de indol y la fermentación y producción de gases a partir de los azúcares glucosa, sacarosa y lactosa, con la consecuente producción de sulfuro de hidrógeno. Por último, se evaluó el crecimiento en presencia de NaCl 10% v/v, a T > 55°C y a pH 3 [Norris y Ribbons, 1971].
Los datos correspondientes a la inhibición del crecimiento de los hongos fitopatógenos se procesaron mediante un análisis de varianza (Anova) de clasificación simple, con el 95% de significación estadística. La comparación de las medias se realizó por el test de comparación de rangos múltiples de Duncan, para lo que se utilizó el paquete estadístico Statgraphics Plus para Windows (Microsoft Corp 5.1).
RESULTADOS Y DISCUSIÓN
Inicialmente se evaluaron 58 aislados de bacilos gram positivos formadores de endosporas, de los cuales 36 (62%) mostraron formación de una zona de inhibición del crecimiento de al menos una de las colonias fúngicas. De estos se seleccionaron cinco ejemplares que evidenciaron actividad inhibitoria simultánea contra todos los hongos. En la Fig. 1 se muestran las alteraciones morfológicas que aparecen en las colonias fúngicas en cocultivo con las bacterias con actividad inhibitoria, tales como el engrosamiento de los bordes en contacto con la zona de inhibición del crecimiento y la formación de regiones de lisis interna, similares a la autólisis que aparece en colonias en fase de decadencia.
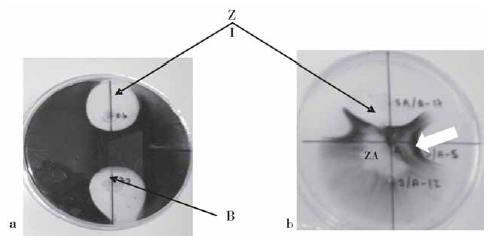
Figura 1. Cocultivo en placas de hongos fitopatógenos y bacilli (seis días de incubación). a) Colletotrichum sp. CH6; b) Curvularia lunata CL-20 (B: colonias bacterianas, ZI: zona de inhibición del crecimiento fúngico, ZA: zonas de autólisis en la colonia fúngica). La flecha blanca indica la zona de engrosamiento del borde de la colonia del hongo en la zona de inhibición del crecimiento.
Las curvas de inhibición del crecimiento de los hongos fitopatógenos frente a los cinco aislados bacterianos muestran en todos los casos durante los tres primeros días un crecimiento fúngico similar al control, el cual es inhibido posteriormente hasta el final del experimento (Fig. 2). Un efecto similar fue observado en un estudio de antibiosis en placas de las bacterias Burkholderia cepacia y Streptomyces rochei Ziyani y el hongo fitopatógeno Phytophthora capsici [Ezziyyani et al., 2004b], y en estudios involucrados con Bacillus sp., donde la aparición de la inhibición comienza a partir del segundo día [Gong et al., 2006].
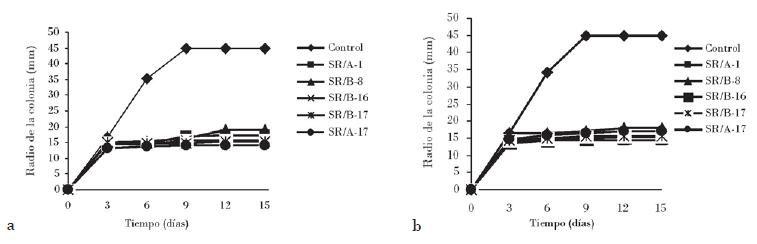
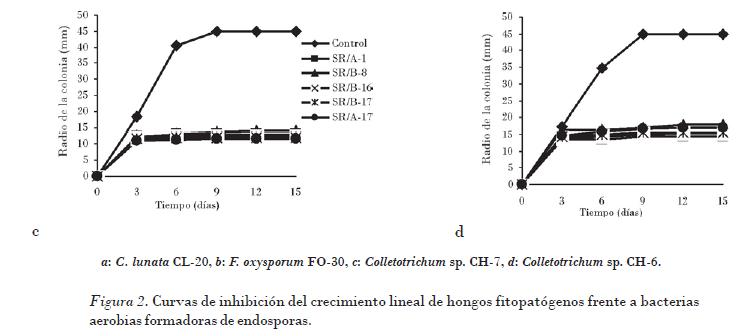
El porcentaje de inhibición de crecimiento de los hongos osciló entre el 51,69 y el 72,22%, valores alcanzados con los aislados SR/B-8 sobre Colletotrichum sp. CH-6 y SR/A-17 sobre F. oxysporum CL-20, respectivamente (Tabla 1). El PICR de todas las cepas de hongos fitopatógenos y el análisis estadístico realizado reveló que los aislados SR/A-1 y SR/B-16 poseen actividad inhibitoria estadísticamente similar y superior al resto; el segundo grupo homogéneo se conforma con las bacterias SR/B-17 y SR/A-17. El aislado SR/B-8, el cual mostró los menores valores de porcentaje de inhibición del crecimiento in vitro de los hongos, se comportó de manera independiente.
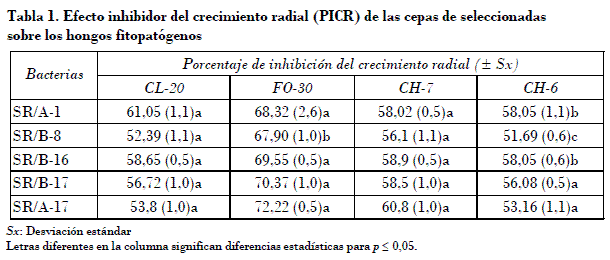
Curvularia lunata es un patógeno facultativo en plantas ornamentales, cuya incidencia se favorece por la elevada humedad y la sensibilidad de estos cultivos a las enfermedades, en los cuales produce manchas foliares negras [Dickinson, 1987]. F. oxysporum y Colletotrichum sp. atacan estos cultivos y dan lugar a la podredumbre radicular y actracnosis respectivamente [Mafia et al., 2005]. El control de C. lunata se realiza con agentes secantes, aunque se han reportado cepas de Bacillus sp. con potencialidades para el control biológico de esta especie, entre ellas Bacillus sp. BC121, aislada en la rizosfera de sorgo, la cual posee además actividad quitinolítica que le permite crecer sobre las hifas [Basha y Ulaganathan, 2002]. Numerosos aislados de Bacillus sp. muestran efecto inhibidor in vitro y controlador de enfermedades causadas por F. oxysporum en tomate, F. graminearum en maíz y F. solani f. sp. phaseoli en frijol [Rahman et al., 2006; Ding et al., 2006]. B. subtilis, B. cereus y Paenibacillus polymyxa (B. polymyxa) alcanzan más del 52% de inhibición in vitro de Fusarium sp.
debido a la excreción de subtilisina, iturina y polimixina M [Gong et al., 2006; Ding et al., 2006]. El efecto biocida por la producción extracelular de polipéptidos antagonistas se ha demostrado en el cocultivo de B. lentimorbus y C. gloesporoides [Young-Keun et al., 2005], en el tratamiento de la antracnosis en mora con B. amyloliquefaciens y en el enfrentamiento en placas de C. acutatum y B. subtilis.
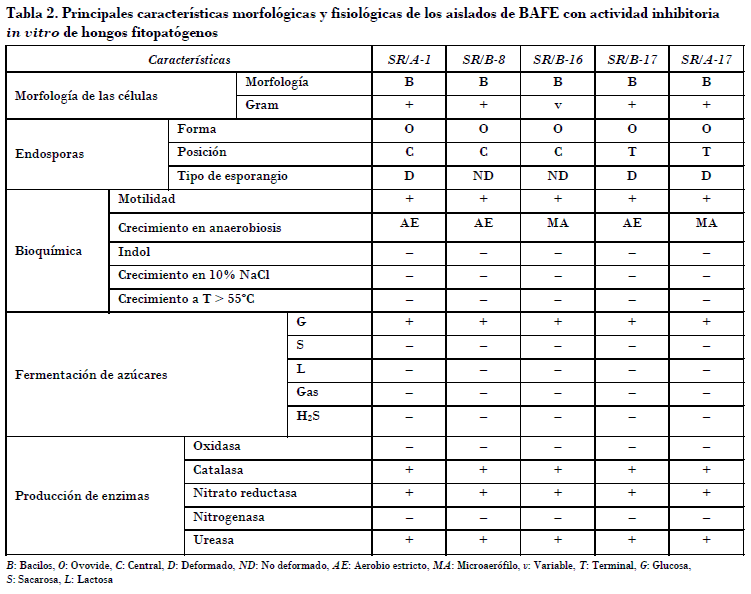
En la Tabla 2 se representan las principales características de los cinco aislados de bacterias aerobias formadoras de endosporas, que mostraron actividad inhibitoria del crecimiento in vitro de los hongos causantes de enfermedades en las plantas ornamentales objeto de estudio. Se confirman propiedades características de este grupo, como la presencia de endosporas, la forma bacilar, la producción de enzimas catalasa, ureasa y nitrato reductasa, así como la motilidad [Garrity et al., 2004].
CONCLUSIONES
• La evaluación de la actividad inhibitoria in vitro de bacterias aerobias formadoras de endosporas, aisladas a partir de rizosfera de plantas ornamentales afectadas por hongos fitopatógenos, permitieron obtener aislados con potencialidades para el control biológico de las enfermedades de origen fúngico. La descripción morfofisiológica de las bacterias confirma las características de la Clase Bacilli.
REFERENCIAS
Basha, S.; S. Ulaganathan: «Antagonisms of Bacillus Species (strain BC121) Towards Curvularia lunata», Current Science 82(12):1458- 1463, EE.UU., 2002.
Dickinson, C. H.: Patología vegetal y patógenos de plantas, Ed. Limusa, México, 1987.
Ding, N. G.; Y. J. Wang; Y. Liu; S. Chen: «Isolation and identification of nitrogen_fixing bacilli from plant rhizospheres in Beijing region», Journal of Applied Microbiology 99(5):1271-1275, Oxford, 2006.
Ezziyani, M.; C. Pérez; M. E. Requena; L. Rubio; M. E. Candela: «Biocontrol por Streptomyces rochei Ziyani, de la podredumbre del pimiento (Capsicumm annuum L.) causada por Phytophthora capsici», Anales de Biología 26:69-78, España, 2004a.
Ezziyyani, M., C. Pérez; M. E. Rquena; A. Sid; M. E. Candela: «Evaluación del biocontrol de Phytophthora capsici en pimiento (Capsium annuum L.) por tratamiento con Burkholderia cepacia», Anales de Biología 26:61-68, España, 2004b.
Fernández-Larrea, O.: «Microorganismos antagonistas para el control fitosanitario», Manejo Integrado de Plagas 62:96-100, Costa Rica, 2001.
Garrity, G. M.; J. A. Bell; T. G. Lilburn: «Taxonomic Outline of the Procaryotes», Bergey's Manual of Systematic Bacteriology, 2nd ed., Release 5.0, Springer-Verlag, Nueva York, 2004, DOI: 10.1007/ bergeysoutline200405.
Gong, M.; J. D. Wang; J. Zhang; H. Yang; X. F. Lu; Y. Pei; J. Q. Chen: «Study of the Antifungal Ability of Bacillus subtilis Strain PY-1 in vitro and Identification of Its Antifungal Substance (Iturin A)»,Acta Biochimica et Biophysica Sinica 38(4):233-240, Shanghai, 2006.
Mafia, A. R. G.; A. C. Alfenas; G. Ventura; R. Alfenas: «Antracnose em Paphiopedilum insigne (Orquidaceae) causada por Colletotrichum gloesporoides», Fitopatologia Brasileira 30:(4):436, Brasil, 2005.
McSpadden, B.: «Ecology of Bacillus and Paenibacillus spp. in Agricultural Systems», Phytopathology 94(11):1252-1258, EE.UU., 2004.
Muhamad, S.; N. A. Amusa. «In vitro Inhibition of Growth of Some Seedling Blight Inducing Pathogens by Compost Inhabiting Microbes», African Journal of Biotechnology 2(6):161-164, Niairobi, 2003.
Norris, J. R.; D. W. Ribbons: Methods in Microbiology, vol. 5A, Academic Press, Nueva York, 1971.
Orbera, T.; I. Pérez; D. Ferrer; N. Cortés; Z. González: «Aislamiento de cepas de Bacillus sp. con potencialidades para la bioprotección y la estimulación del crecimiento vegetal», Revista Cubana de Química, XVII(1):189-195, Cuba, 2005.
Rahman, M. S.; T. Ano; M. Shoda: «Second Stage Production of Iturin A by Induced Germination of Bacillus subtilis RB14», Journal of Biotechnology 18:226-229, EE.UU., 2006.
Young-Keun, L.; J. Yu-Sin; C. Hwa-Hyoung; W. H. Seok; C. A. Hye- Young: «Putative Early Response of Antifungal Bacillus lentimorbus WJ5 Against the Plant Pathogenic Fungus Colletotrichum gloesporoides, Analyzed by a DNA Microarray»,Journal of Applied Microbiology 43(3):308-312, EE.UU., 2005.














