Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009versión On-line ISSN 1818-1686
Fitosanidad v.13 n.4 Ciudad de la Habana oct.-dic. 2009
Control Biológico
Colecta de esporas de Trichoderma Harzianum Rifai cepa A34 por lecho fluidizado y ciclón dual Y por tamizaje vibratorio
Collec of Trichoderma harzianum Rifai cepa A34 Spores Using the Method os Separation by a Fluid-Bed and Dual Cyclone Machine, and Separation by Electric Vibratory Sieving
Orestes Elósegui Claro,¹ Orietta Fernández-Larrea Vega,¹ Enrique Ponce Grijuela,¹ Giovanni Borges Marín,¹ Luciano Rovesti² y Jesús Jiménez Ramos¹
¹Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, CP 11600, oelosegui@inisav.cu
²Consultor independiente. lrovesti@gmail.com
RESUMEN
Trichoderma harzianum Rifai cepa A34 se usa ampliamente en Cuba por los productores como hongo antagonista contra diferentes fitopatógenos fúngicos. Para lograr una vida en estante más prolongada se desarrollan formulaciones del hongo, para lo que es necesario realizar la separación y concentración de las esporas que se van a formular, y durante estos procesos el grado de pureza del polvo extraído puede ser muy variable, pero debe cumplir con las exigencias del formulado. En este trabajo se describe la colecta de esporas de la cepa A34 obtenidas sobre arroz y en mezcla con cáscara de arroz, por los métodos de separación por lecho fluidizado y ciclón dual, y de separación por tamizaje vibratorio. Con el primer método en 20 min se colectó el 2,2% de las esporas y un concentrado final de 3,6 x 1010 esporas · g_1. Con el tamizaje vibratorio se obtuvo el 29,7% de las esporas colectadas con un solo tamiz de 209 ìm a una concentración de 4,5 x 1010 esporas · g_1. Con los dos métodos la viabilidad de las esporas y el nivel de contaminación estuvieron dentro del rango de calidad permisible, así como el tamaño de partícula que se requiere para la aplicación de bioproductos fúngicos para la agricultura.
Palabras claves: Trichoderma harzianum, separación, esporas, control biológico
ABSTRACT
Trichoderma harzianum strain A34 is widely used by producers in Cuba as an antagonist fungus against different fungal plant pathogens. At present, research on Trichoderma formulations, to achieve a longer shelf life is on-going in Cuba. One aspect is to develop efficient methodologies for extracting and harvesting spores from the production substrate, which may produce a degree of purity very variable for the spore powder but must comply with technical formulation requirements. This paper describes the harvesting of the native strainspores, grown on rice and rice husk mixes, using the method of separation by a fluid-bed and dual cyclone, and separation by electric vibratory sieving. With the former method, after 20 minutes of harvesting, only 2.2% of the total spores were recovered, due in part to clogging of filters with rice husk. The spore extract had a 3.6 x 1010 spores · g_1 final concentration. In contrast, a final yield of 29.7% spore extraction with a concentration of 4.50 x 1010 spores · g_1 was achieved with the vibratory sieving method with 209 ìm single sieve. For every test carried out, both the spore viability and the contamination level of the final spore powder were in the quality range allowed for fungal bioproducts to be used in agriculture.
Keywords: Trichoderma harzianum, spore separation, biological control
INTRODUCCIÓN
Trichoderma harzianum Rifai cepa A34 se usa ampliamente en Cuba como antagonista fúngico de hongos fitopatógenos tales como Rhizoctonia solani, Sclerotium rolfsii y especies de Pythium y Phytophthora en diversos cultivos como tomate, col, tabaco y pimiento. Su eficacia está demostrada tanto in vitro como en condiciones de campo [Sandoval y López, 2001]. Actualmente la investigación en Cuba del uso del hongo como bioplaguicida está enfocada en obtener formulaciones viables con al menos 18 meses de vida en estante y su compatibilidad con las técnicas de aplicación convencionales.
El tipo y calidad de las esporas varían según el medio sobre el que se obtengan. Las obtenidas de sustratos sólidos son las más exitosas debido a la tolerancia mayor frente a estreses abióticos medioambientales [Bateman, 2006].
Los pasos de cosecha y poscosecha previos al empacado del bioplaguicida tienen como finalidad obtener un polvo puro de esporas apropiado para la formulación [Jenkins y Grzywacz, 2003]. Convencionalmente esto se ha logrado con cernidores manuales, lo que permite obtener un polvo con determinado tamaño de partícula según el tamaño del poro de la malla. Este método es muy laborioso y consume mucho tiempo, además de formar muchos aerosoles de esporas con riesgo respiratoriopara el personal expuesto, y no garantiza uniformidad de partículas físicas con muchas de ellas de variado tamaño obtenidas en el polvo [Sangyang et al., 2000].
Actualmente se utilizan otras alternativas para separación de esporas por la tecnología de lecho fluidizado y ciclón a partir de sustratos sólidos como arroz, trigo y otros cereales. La tecnología puede escalarse a nivel industrial para separar esporas de Metarhizium anisopliae y Beauveria bassiana de sustrato de granos de cereales de forma segura y eficiente [Bateman, 2006]; sin embargo, de acuerdo con la experiencia de los autores, estudios de laboratorio no resultaron en una eficiente separación de esporas de Trichoderma. El objetivo de este trabajo fue comparar la separación y colecta de esporas de Trichoderma harzianum cepa A34 por lecho fluidizado y ciclón con la separación y colecta por tamizaje vibratorio, en equipos que tuvieran versiones industriales para el escalado productivo.
MATERIALES Y MÉTODOS
Una suspensión de esporas de Trichoderma harzianum Rifai cepa A34 nativa fue inoculada en frascos Roux con agar papa dextrosa (PDA), e incubado el cultivo hasta su total esporulación por aproximadamente 72 h.
Las esporas se desarrollaron en contenedores metálicos (cajas metálicas con tapa) con 500 g de un sustrato compuesto por arroz partido y cáscara de arroz, según metodología de Fernández-Larrea et al. (2006). La humedad relativa final (Hr) del producto obtenido estuvo entre el 10-12% determinada en balanza analítica con aditamento analizador de humedad. En bolsas plásticas dobles de polietileno de alta densidad se vertieron 500 g del biopreparado secado, se sellaron y se refrigeraron a 4°C por no más de dos semanas hasta su uso. Se realizaron controles de calidad microbiológicos para asegurar la calidad óptima del biopreparado antes de la separación. Los ensayos realizados y sus valores aceptables fueron concentración de esporas mínima de 1 x 109 esporas · g_1, su viabilidad mayor del 90% y el nivel de contaminación menor o igual a 105 UFC · g_1, según métodos descritos por Meynell y Meynell (1965) citado por Burges y Hussey (1982) y Elósegui et al. (2005).
Se ensayaron dos métodos de extracción. El primero fue el de lecho fluidizado y ciclón dual, en un equipo de laboratorio cosechador de esporas semiautomático, y el segundo por tamizaje vibratorio en un tamizador eléctrico. Ambas máquinas fueron limpiadas y desinfectadas antes de su uso. Cada muestra a ser procesada consistió en 500 g de biopreparado de Trichoderma contenidos en bolsas previamente refrigeradas, con un tiempo de operación total de 20 min. Inmediatamente, antes de procesarse cada bolsa, el contenido se homogenizó y la concentración de esporas fue determinada.
Solamente un experimento se llevó a cabo para la separación de esporas por lecho fluidizado y ciclón a partir de que experimentos preliminares no tuvieron éxito en la separación de esporas en un solo paso, a diferencia de lo obtenido por Bateman (2006), debido a la obstrucción del filtro removible por la cáscara de arroz. Por ello se realizó una separación en dos pasos de forma que se pudieran colectar más esporas del sustrato esporulado.
En el paso 1 el equipo sin el filtro de la cámara de lecho fluidizado se operó por 10 min con 250 g del biopreparado de la bolsa de 500 g; a continuación se descartó su residuo de la cámara de lecho fluidizado y se operó otros 10 min con los restantes 250 g de la bolsa; posteriormente se descartó igualmente su residuo de la cámara de lecho fluidizado. En el paso 2 se colocó en el equipo el filtro de la cámara de lecho fluidizado y se vertieron los residuos de la cámara intermedia en la cámara separadora, con unos segundos de fluidización; luego se extrajo la bandeja colectora de esporas y con una fina brocha se quitó el polvo de esporas adherido a las paredes internas del ciclón y al borde externo del cono interno largo, que se adicionó al polvo de esporas colectado en la bandeja colectora. En este experimento los residuos consistieron en todo material procesado y generado, excepto el polvo de esporas colectado en la bandeja colectora. Para la separación de esporas por tamizaje vibratorio se ensayaron dos variantes. La primera consistió en la separación con dos tamices (un tamiz superior de 209 mm de tamaño de poro y un tamiz inferior con tamaño de poro de 35 mm), tal y como el tamiz era suministrado por el fabricante. En la segunda variante se retiró el tamiz inferior para determinar si se obtenían mejores rendimientos de polvo de esporas, sin tomar en cuenta la contaminación física en esta etapa de investigación. Los residuos consistieron en todo el material retenido en la parte superior del tamiz superior e inferior, o en el tamiz superior respectivamente.
Para el polvo de esporas obtenido y los residuos generados _producto de los métodos de separación y colecta de esporas ensayados_ se determinó la viabilidad, concentración de esporas y nivel de contaminación según métodos descritos por Elósegui et al. (2005). Para el caso de las pruebas de calidad para el polvo de esporas se pesaron 0,1 g en lugar de 1 g en balanza analítica (e = 0,001 g) y se procedió con los mismos métodos descritos por Elósegui et al. (2005). Se calcularon las unidades formadoras de colonias contaminantes por gramo de polvo de esporas (UFCt) como sigue:
![]()
donde UFCn corresponde al número de unidades formadoras de colonia en placa en la dilución decimal número n.
La eficiencia en la extracción de esporas (E) de cada prueba de separación de esporas se expresó en porcentaje de esporas recuperadas, según el número total de esporas contenidas en 500 g de biopreparado inicial antes de la separación, y el número total de esporas contenidas en el polvo de esporas. Cada prueba de separación se replicó tres veces.
RESULTADOS Y DISCUSIÓN
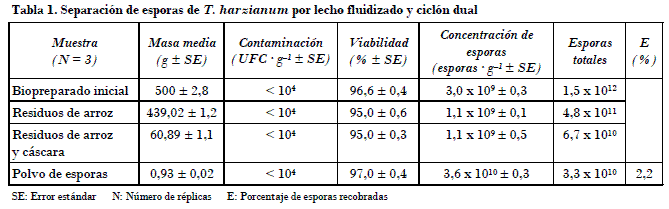
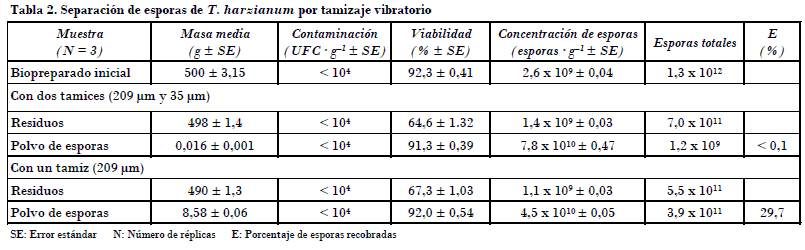
Los resultados con los dos métodos ensayados mostraron que la eficiencia de la separación por lecho fluidizado y ciclón dual fue muy baja, con solo el 2,2% del total de esporas del biopreparado original recuperadas, aunque resultó doce veces más concentradas con respecto al biopreparado de partida (Tabla 1). Para el método de tamizaje eléctrico una eficiencia baja fue obtenida cuando se emplearon los dos tamices en el equipo; sin embargo, el polvo de esporas colectados tuvo una gran pureza con una concentración treinta veces mayor que la concentración de partida (Tabla 2). En contraste, el 29,7% (E) de las esporas totales se recuperaron cuando el tamiz inferior de 35 mm se retiró, y las esporas se concentraron diecisiete veces con respecto al biopreparado original (Tabla 2).
En ambos métodos de separación ensayados, los residuos obtenidos tuvieron una concentración de al menos 1,1 x 109 esporas · g_1, al igual que niveles de contaminación aceptables, excepto la viabilidad, que fue baja (el 64,6 y 67,3%) para los residuos generados en los experimentos por tamizaje vibratorio, lo que podría deberse en parte a daño mecánico de las esporas. Los residuos pueden comercializarse y usarse como biopreparados de la forma tradicional, que consiste en el uso directo del biopreparado.
Aunque la eficiencia en el recobrado del polvo de esporas por tamizaje vibratorio (29,7%) no es buena comparada con las esporas que quedan en los residuos, estas esporas tienen la ventaja que pueden almacenarse por largos períodos con agentes desecantes como sílica gel, si se mantienen en refrigeración, lo que ahorra espacio de almacenaje. Esto es de gran relevancia como lo explican Sangyang et al. (2000) para el polvo de esporas de Metarhizium, que fue colectado y desecado con sílica gel a una Hr menor del 5%, y refrigerado a 5°C, que mostró el 90% de viabilidad luego de tres años en almacenaje. Contar además con polvo de esporas que toleren tiempos prolongados de almlacenaje permitiría disponer de ingrediente activo para estudios de formulaciones sin necesidad de realizar producciones frecuentes.
Existe poca información para uso público de los métodos para la separación de esporas a partir de sustratos sólidos y su eficiencia para productos usados en el biocontrol de plagas agrícolas. La poca información disponible no es muy útil debido a que no se brindan datos críticos del proceso, muchas veces por constituir secretos tecnológicos de los procesos de producción de bioplaguicidas.
Es significativo el sistema implementado por el programa Lubilosa, liderado por CABI, Inglaterra, y explicado en detalle por Jenkins et al. (1998) y Cherry et al. (1999) para producir asivamente por un sistema bifásico una cepa de M. anisopliae var. acridum (M. acridum), donde se usa la separación de esporas del hongo por lecho fluidizado y ciclón dual. En este sistema se obtiene un biopreparado a una concentración promedio de 1,5 x 109 esporas · g_1, que luego de ser procesado para extraer las esporas se obtiene un polvo concentrado de esporas de 4-5 x 1010 esporas · g_1. Jenkins and Grzywacz (2003) consideraron esta cantidad de esporas en el polvo como deseable para producciones de esporas de hongos y utilizarlos como biocontrol. En este artículo el polvo de esporas obtenido por tamizaje vibratorio con un solo tamiz tuvo una concentración de 4,5 x 1010 esporas · g_1 similar a la obtenida por CABI en Lubilosa para Metarhizium.
Por otra parte, Lomer y Langewald (1999) y Cherryet al. (1999) informaron para el sistema de producción de Lubilosa un promedio de 31,5 g de polvo de esporas de Metarhizium por cada kilogramo de biopreparado procesado con esporas desarrolladas sobre arroz, mediante el uso del método de separación de lecho fluidizado y ciclón. Elósegui et al. (2004) obtuvieron una buena eficiencia en la separación y colecta de esporas (85%) para biopreparados de Beauveria bassiana procesados por lecho fluidizado y ciclón en un equipo separador a escala de laboratorio.
Al menos uno de los puntos críticos de la baja eficiencia en el recobrado obtenido en este trabajo podría ser la naturaleza pegajosa que presentan las esporas de algunas especies de Trichoderma [Carmichael et al., 1980], por lo que ello puede contribuir a dificultar la separación de las esporas del sustrato donde se formaron. El disminuir la Hr del biopreparado (en este caso fue el 10-12%) podría contribuir a un despegue más fácil de las esporas del sustrato, al igual que el ensayar sustratos que sean más fáciles de procesar con las tecnologías disponibles, para de esta forma lograr mayor eficiencia en el recobrado de esporas del biopreparado del hongo.
El nivel de contaminación microbiológica y el porcentaje de viabilidad de las esporas en el polvo obtenido fueron aceptables, de acuerdo con lo recomendado por las normas nacionales de control de calidad de bioplaguicidas y los procedimientos normalizados internos del laboratorio de Bioplaguicidas del Inisav, así como de los estándares de países líderes en control biológico [NC 72-02, 1993; Jenkins y Grzywacz, 2003].
El polvo de esporas obtenido por tamizaje vibratorio con un solo tamiz mostró partículas físicas con menor uniformidad en su tamaño, con la mayor parte menor que 200 ìm. Las partículas de este tamaño correspondieron a diferentes grados de fraccionamiento de granos y cáscara de arroz, y las pocas partículas mayores de 200 ìm a cáscara de arroz. En contraste, el polvo de esporas obtenido por lecho fluidizado y ciclón mostró una mayor uniformidad en el tamaño de las partículas, con la mayor parte de las partículas menor que 10 ìm, aunque algunas partículas físicas alcanzaron 60 ìm. Aun cuando el tamaño de partícula menos uniforme para el polvo obtenido por tamizaje podría verse como una dificultad para formulaciones altamente exigentes como las usadas para aplicaciones a ultra-bajo volumen, esta formulación no es la comúnmente usada para Trichoderma, donde se usan exitosamente otras formulaciones.
CONCLUSIONES
• La separación de esporas de Trichoderma harzianum Rifai cepa A34 por tamizaje vibratorio resultó más eficiente con el 29,7% de las esporas colectadas en comparación con el método de separación por lecho fluidizado y ciclón dual, que solo logró separar y colectar el 2,2% de las esporas contenidas en el sustrato.
• La viabilidad y el nivel de contaminación microbiana para el polvo de esporas colectado por los dos métodos ensayados fueron aceptables.
Agradecimiento
Los autores expresan su agradecimiento al doctor Dave Moore de CABI-Europe UK por la revisión crítica del manuscrito y sus útiles sugerencias.
REFERENCIAS
Bateman, R.: «Mycoharvesters: Enabling Technologies for Biopesticide Development», http://www.dropdata.net/mycoharvester/ (consultado el 16 diciembre del 2006).
Burges, H. D.; N. W. Hussey: «Standardization and Assay of Microbial Insecticides»,n: Microbial Control of Insects and Mites, Fourth printing, Academic Press, Londres, 1982, pp. 591-622.
Carmichael, J. W.; W. B. Kendrick; I. L. Conners; L. Sigler:Genera of Hyphomycetes, University of Alberta Press, Edmonton, AB, Canadá, 1980.
Cherry, A. J.; N. E. Jenkins; G. Heviefo; R. Bateman; C. J. Lomer: «Operational and Economic Analysis of a West African Pilotscale Production Plant for Aerial Conidia of Metarhizium for Use as a Mycoinsecticide Against Locusts and Grasshoppers»,Biocontrol Science and Technology 9(1):35-51, Inglaterra, 1999.
Elósegui, O.; A. Carr; O. Fernández-Larrea; J. Jiménez: «Calidad microbiológica de esporas de Beauveria bassiana (Bals.) Vuill. y Trichoderma harzianum Rifai separadas mediante el extractor Mycoharvester MH-1», Memorias del V Seminario Internacional de Sanidad Vegetal, 24-28 de mayo, La Habana, 2004.
Elósegui, O.; O. Fernández-Larrea; A. Carr: «Influencia de la carga microbiana contaminante inicial del sustrato en la calidad final de biopreparados de Trichoderma harzianum Rifai y Beauveria bassiana (Balsamo) Vuillemin», Fitosanidad 9(1):51-55, La Habana, 2005. Fernández-Larrea, O.; A. Cejas; I. Sandoval; A. Carr; O. Elósegui: «Métodos artesanales alternativos para la reproducción masiva de cepas del hongo Trichoderma harzianum A34», La Habana, 2006. Jenkins, N. E.; G. Heviefo; J. Langewald; A. J. Cherry; C. J. Lomer: «Development of Mass Production Technology for Aerial Conidia for Use as Mycopesticides», Biocontrol News and Information 19:21N- 31N, 1998.
Jenkins, N. E.; D. Grzywacz: «Towards the Standardization of Quality Control of Fungal and Viral Biocontrol Agents»,Quality Control and Production of Biological Control Agents: Theory and Testing Procedures, Chapter 18, CAB International, Wallingford, Inglaterra, 2003.
Lomer, C.; J. Langewald: «Lubilosa Phase III Final Report Part 3 Programme Leaders Final Technical Report, Public version, 1999», http://ispilit.cirad.fr/text/lubilosa3a.htm (consultado el 11 diciembre del 2008).
NC 72-02: «Norma Cubana para biopreparados de entomopatógenos. Métodos de ensayo. Biotecnología Agrícola», Cuba, 1993.
Sandoval, I.; M. O. López: «Hiperparasitismo de Trichoderma harzianum, T. viride y T. pseudokoningii sobre diferentes hongos fitopatógenos», Fitosanidad 5(1):41-44, La Habana, 2001.
Sanyang, S.; H. F. van Emden; D. Moore: «Laboratory Shelf-Life of Oil- Formulated Conidia of the Locust and Grasshopper Fungal Pathogen Metarhizium flavoviridae Gams and Rozsypal, in Mixtures with the Pyrethroid Insecticide Lambda-Cyhalotrin»,International Journal of Pest Management 46(3):165-168, EE. UU., 2000.