Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009versión On-line ISSN 1818-1686
Fitosanidad v.14 n.4 Ciudad de la Habana oct.-dic. 2010
Control químico
Control químico de patógenos fungosos en piña (Ananas comosus (L.) Merrill) de vivero (II)
Chemical Control of Fungi Pathogens in Pinapple (Ananas comosus (L.) Merrill) of Nursery (II)
Alexis A. Hernández Mansilla, 1 Berta Lina Muiño García, 2 Carmen Rosón Álvarez, 3 Caridad Casola González,3 Ángela C. Porras González2 y Aliana López Mayea 1
1Grupo Científico. Centro Meteorológico Provincial de Ciego de Ávila. Calle Marcial Gómez 401, esq. a Estrada, Ciego de Ávila, Cuba, alexis.hernandez@cav.insmet.cu; ahmansilla@gmail.com
2Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.a B y 5.a F, Playa, Ciudad de La Habana, C. P. 11600, bertam@inisav.cu
3Laboratorio Provincial Sanidad Vegetal Ciego de Ávila. Carretera Central, Extremo Oeste, Ciego de Ávila, Cuba
RESUMEN
A fin de determinar la eficacia de un grupo de fungicidas sobre algunos hongos fitopatógenos que afectan el cultivo de la piña en viveros de campo, se realizó un ensayo en bloques al azar, con fracciones de tallos de la variedad Cayena Lisa Serrana, desinfectados mediante inmersión en solución de 10 L por un tiempo de 10 min, con los ingredientes activos 1-1 propamocarb a dosis de 1,04 g/L i.a. solo y 0,78 g/L i.a. en mezclas con triazoles triadimenol a 0,5 g/L i.a.; propiconazol, tebuconazol, hexaconazol a razón de 0,05 g/L i.a. solos y en mezclas con propamocarb a 0,375 g/L i.a., además de metiran a 3 g/L i.a. Durante el experimento se aisló Phytophthora nicotianae, Fusarium subglutinans y Chalara pardoxa, que demuestran la presencia de agentes causantes de enfermedades de importancia económica en el cultivo. Se comprobó que triadimenol a 0,5 g/L i.a. y la mezcla 1-1 propamocarb + triadimenol (0,78 + 0,375 g/L i.a.) ejercen buenos niveles de control sobre estos patógenos fúngicos con el 76,2 y el 80,9% de eficacia, respectivamente. Ambos tratamientos mostraron diferencias significativas ante otras variantes a prueba y el testigo sin aplicar, y brindaron una protección de 30 días.
Palabras claves: fungicidas, control químico, piña, enfermedades, hongos.
ABSTRACT
In order to determine the efficacy of a fungicide group on some plant pathogenic fungi that affect the cultivation of pineapple in field nurseries, a test was conducted in randomized blocks, with stems fractions of the variety Smooth Cayenne Serrana, disinfected by immersion in solution of 10 L by 10 minutes, with the active ingredients 1-1 propamocarb at doses of 1.04 g/L a.i. alone and 0.78 g/L a.i. in mixtures with triazols; triadimenol at 0.5 g/L a.i.; propiconazole, tebuconazole, hexaconazol a rate of 0.05 g/L a.i. alone and in mixtures with 1-1 propamocarb to 0.375 g/L a.i., besides metiran 3 g/L a.i. Phytophthora nicotianae, Fusarium subglutinans and Chalara pardoxa were isolated during the experiment, which showed the presence of agents causing diseases of economic importance in crop. It was found that triadimenol (0.5 g/L a.i.) and the mixture 1-1 propamocarb+triadimenol (0.78 + 0.375 g/L a.i.) offer good control levels on these fungal pathogens with efficiency of 76.2 and 80.9%, respectively; both treatme0nts showed significant differences to other variants tested and the control without applications and provided protection for 30 days.
Key words: fungicides, pineapple, chemical control, disease, fungus.
INTRODUCCIÓN
La piña (Ananas comosus (L.) Merrill) ocupa actualmente uno de los reglones de mayor aporte financiero dentro de la esfera agroindustrial en aquellos países productores de esta fruta a escala internacional. Su cultivo requiere esmeradas atenciones agrotécnicas, y dentro de ellas el trabajo fitosanitario es fundamental debido a las afectaciones que pueden producir los organismos nocivos, si se persigue obtener altos y estables rendimientos.
Varios e importantes organismos nocivos afectan este cultivo en diversos países que cultivan esta fruta [Bartholomew et al., 2003]. En Cuba, y con mayor relevancia económica en fase de viveros de campo y en sistemas de aclimatización de vitroplantas, se encuentran informadas las enfermedades causadas por Phytopthora nicotianea Breda de Hand, Chalara paradoxa De Seyn Sacc. y Fusarium subglutinans fsp. ananas [Hernández, 1999; Hernández et al., 2002]. Esta última especie está identificada en la actualidad como Fusarium guttiforme, según Ventura et al. (2008).
Internacionalmente el control de estas enfermedades concierne a la utilización de un grupo reducido y estable de ingredientes activos y estrategias. Se emplean tratamientos de fungicidas preventivos [Carvalho et al., 2007], además de mantener la utilización del carbendazin, preferentemente para el control de Fusarium [Rohrbach y Schmitt, 1994], captafol y fosetil-Al contra Phytophthora nicotianae [Erwin y Ribeiro, 1996], con buena efectividad en el caso de fosetil-Al, según Rohrbach y Schmitt (1994) sobre este Omycete, situación que muestra la necesidad de ampliar con nuevas opciones.
En Cuba, y específicamente en Ciego de Ávila, en los últimos años se trabaja por restablecer, consolidar e incrementar la producción de este cultivo, acciones que justifican la realización de investigaciones, dentro de las cuales son fundamentales las dirigidas a garantizar una eficiente protección fitosanitaria, que implican determinar la eficacia de ingredientes activos con diferentes mecanismos de acción sobre patógenos fungosos que afectan las plántulas en viveros de campo, objetivo fundamental de este trabajo.
MATERIALES Y MÉTODOS
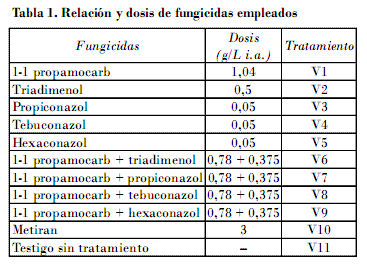
El ensayo de campo se realizó en áreas del vivero de la empresa de piña de Ciego de Ávila, a partir de la aplicación del «Sistema de obtención de posturas por fraccionamiento de tallos y coronas», de Singh y Yoden (1980) [citado por González, 1988], para lo cual se dispuso de canteros delimitados por muros de cemento de 80 m de largo, 1,5 de ancho y 1,0 de profundidad, que contenían suelo ferralítico rojo, dentro de los cuales, y conforme a un diseño de bloques al azar con 11 tratamientos con cuatro réplicas y un testigo sin aplicar, se sembraron 25 fracciones de tallos de piña de la variedad Cayena Lisa Serrana, y sembradas a una separación de 0,10 m, luego de someterse con anterioridad a un proceso de desinfección mediante inmersión por un tiempo de 10 min en solución de 10 L con diferentes ingredientes activos: derivados del ácido tiocarbámico (1-1 propamocarb), triazoles y ditiocarbamatos (Tabla 1).
El experimento se sometió a inspecciones semanales en las que se evaluó el total de tallos de cada parcela, se contaron los afectados, de los cuales se aislaron e identificaron los agentes fitopatógenos presentes para comprobación de su permanencia en el área y determinar el nivel de protección. Se determinó el porcentaje de tallos afectados por especie patógena y variantes, se tabuló una dinámica de aparición durante el ciclo de vivero basado en el total general de tallos afectados por variantes. La eficacia de los tratamientos se acreditó mediante el cálculo por la fórmula de Abbott [CibaGeygi, 1981], y a los porcentajes se les aplicó un análisis de varianza con prueba de significación de Neuman Kellus al 5% [Dagnellie, 1974], con previa trasformación mediante la función de arcsen . Finalmente se calculó el porcentaje general de propágulos afectados y sanos por tratamiento.
RESULTADOS Y DISCUSIÓN
Se comprobó en las diferentes variantes o tratamientos la permanencia de los agentes fitopatógenos F. subglutinans, P. nicotianae y C. paradoxa, los cuales mostraron una incidencia en respuesta con el modo de acción de los ingredientes sobre las clases taxonómicas presentes (Tabla 2).
La incidencia de F. subglutinans fue del 3% en el tratamiento de 1-1 propamocarb a dosis de 1,04 g/L i.a. (V1), el 1% de P . nicotianae y el 1% de C. paradoxa (Tabla 2). Los resultados se corresponden con la acción del 1-1 propamocarb que actúa específicamente sobre los procesos de biosíntesis a nivel de membrana celular de Oomycetes, no así sobre Deutromycetes [Pérez y Muiño, 1995; Lyr, 1995]. En cuanto a C. paradoxa, la baja incidencia tiene explicación a que este hongo requiere de oscuridad y presencia de materia orgánica [Zaldívar, 1983, citado por Hernández, 1999], condiciones que en vivero son difíciles de encontrar, pues aumenta la solarización y específicamente existió un bajo índice de materia orgánica, dos aspectos que limitaron el desarrollo de este hongo fitopatógeno.
Las variantes con triazoles solos mostraron una incidencia variable respecto a los hongos fitopatógenos presentes. F. subglutinans mantuvo índices entre el 1 y el 3%, no así C. paradoxa, que no sobrepasó el 2% (Tabla 2). Este hongo resultó ser ligeramente más sensible a la acción de los triazoles a prueba, situación que coincide con la respuesta que informan Muiño et al. (2000) en ensayos in vitro para la propia especie ante fungicidas de este mismo grupo, además de las limitaciones que ofrecen las condiciones de vivero para este hongo fitopatógeno señaladas con anterioridad.
P.nicotinae mostró porcentajes de incidencia entre el 2 y el 4% en las variantes tratadas con triazoles (Tabla 2). Su mayor porcentaje se observó en la variante de hexaconazol (V5), respuesta que se explica por la insensibilidad de las especies Oomycetes ante fungicidas inhibidores de la biosíntesis de ergosterol (IBE) [Lyr, 1995].
El comportamiento de los fitopatógenos presentes ante las mezclas de fungicidas (Tabla 2) expone que los tres agentes causales presentaron los menores índices de incidencia en la variante 1-1 propamocarb + triadimenol a dosis de 0,78 + 0,375 g/L i.a. (V6), seguida de la variante de 1-1 propamocarb + propiconazol a 0,78 + 0,375 g/L i.a. (V7) con la diferencia de una mayor incidencia del 2% de P. nicotianae similar a las tratadas con 1-1 propamocarb + hexoconazol a 0,78 + 0,375 g/L i.a. (V9). En cuanto a C. paradoxa los porcentajes observados fueron similares en todas las variantes; no obstante, corroboran resultados de Muiño et al. (2000) que el hexaconazol y el tebuconazol ejercen un buen control sobre este hongo fitopatógeno, aunque para este caso deben tenerse en cuenta las condiciones de vivero discutidas con anterioridad.
Respecto al comportamiento de los hongos fitopatógenos tratados con metiran a 3 g/L i.a., la respuesta se caracterizó por presentar diferencias en los porcentajes alcanzados, F . subglutinans y C. paradoxa, con menores índices en comparación con P . nicotianae, que tuvo el 4% (Tabla 2).
Es importante destacar que los resultados observados en este trabajo indican que las variantes de 1-1 propamocarb + triadimenol (V6), en primera instancias y 1-1 propmocard + propiconazol (V7) ofrecen oportunamente un espectro amplio para combatir los organismos nocivos que componen este patosistema, integrado por hongos y Oomycetes, además de la factibilidad para su introducción en las estrategias de control, con la garantía de reducir riesgos en la adquisición de resistencia de las cepas objeto de control, resultados y reflexiones que corroboran los obtenidos en otros ensayos de campo de desinfección de semillas mediante inmersión con mezclas de metalaxyl + triazoles por Hernández et al. (2010).
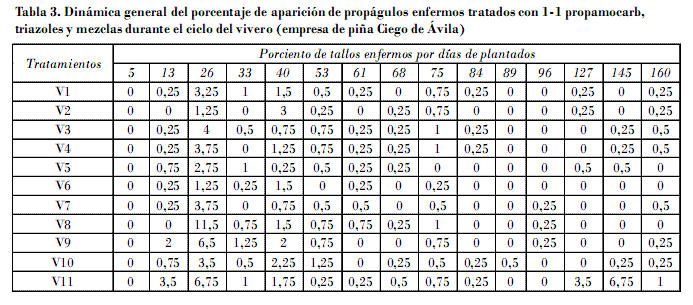
Las fracciones de tallos tratadas según dinámica de tallos enfermos muestran que las menores afectaciones se alcanzaron con triadimenol a 1,04 g/L i.a. (V2) y 1-1 propamocarb + triadimenol a 0,78 + 0,375 g/L i.a. (V6). Ambos presentaron los períodos más largos de protección con términos superiores a los 30 días; por tanto, se infiere que estos ingredientes activos mantienen protección entre 13 y 26 días de la siembra una vez aplicados en el momento de la desinfección (Tabla 3).
El triadimenol fue eficaz en Brasil para el control de la fusariosis en la piña [Choairy et al., 1997]. Otros autores refieren acerca del empleo de los triazoles de tipo I, que se distinguen por su efectividad para controlar patologías ocasionadas por hongos imperfectos, Ascomycetes y Basidiomycetes, y señalan valores de DL50 capaces de controlar con eficiencia [Muiño et al., 2000].
El ciclo total de vivero se caracterizó por la incidencia de estas tres enfermedades, las cuales alcanzaron sus valores más elevados a los 26 y 75 días de plantados en todas las variantes y el testigo a excepción del tratamiento de hexaconazol (V5), que su segundo momento ocurre a los 53 días (Tabla 3), comportamiento similar al mostrado en ensayos donde se empleó acylamidas, triazoles y ditiocarbamatos, en condiciones ambientales semejantes, realizados por Hernández et al. (2010), que indican la necesidad de sistematizar tratamientos adicionales durante todo el ciclo de vivero.
Las restantes variantes como 1-1 propamocarb y mezclas con triazoles (V1, V6, V7, V 8 y V9) mostraron una dinámica de tallos enfermos que se extiende en el tiempo superior a los 26 días de forma generalizada (Tabla 3).
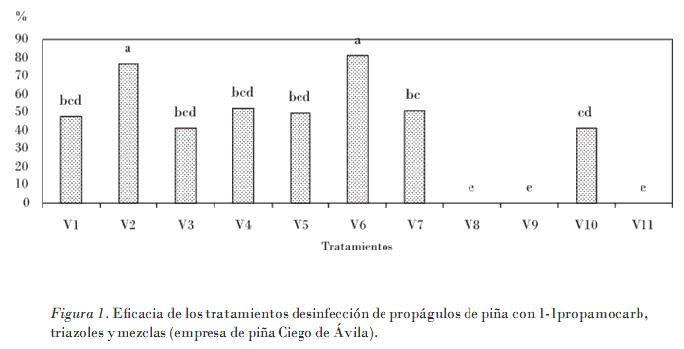
La eficacia de los ingredientes activos a prueba (Fig. 1) muestra al triadimenol (V2) con el 76,2%, y el 1-1 propamocarb + triadimenol (V6) con el 80,9% como las mejores variantes, con diferencias significativas ante las restantes. En contraste con la actividad del metiran (V10), sus valores solo alcanzaron el 41,2% de eficacia, lo cual pone en evidencia que este ingrediente activo posee pocas posibilidades para garantizar un buen estado fitosanitario en el vivero. El resto de las variantes V1, V3, V4 y V5 mostraron una eficacia media con valores porcentuales entre el 41 y el 52% con igual nivel de significación entre ellas, y sí con diferencias significativas entre los restantes tratamientos. Las variantes V8 y V9 no fueron efectivas, y resultaron de similar significación que el testigo, y sí con diferencias del resto de los tratamientos.
Los totales de posturas sanas obtenidas en cada variante (Fig. 2) están en correspondencia directa con los valores de eficacia discutidos con anterioridad; por tanto, se precisa que durante esta etapa del cultivo es necesario el empleo de ingredientes activos efectivos capaces de garantizar la reducción de las pérdidas por concepto de pudriciones del material de propagación, y así disponer de mayor cantidad de material de siembra, elementos que repercuten directamente con los niveles productivos del cultivo y su economía.
CONCLUSIONES
• Los ingredientes activos triadimenol, a dosis de 0,5 g/L i.a., y la mezcla de propamocarb + triadimenol a 0,78 + 0,375 g/L i.a., con una eficacia del 76,2 y el 80,9%, garantizan buena protección fitosanitaria contra hongos fitopatógenos como P. nicotianae, Fusarium subglutinans y Chalara paradoxa en el cultivo de la piña de viveros.
• Las mezclas de fungicidas de acción selectiva 1-1 propamocarb y triadimenol resultan promisorias para incluir en los programas de manejo integrado y controlar enfermedades en el cultivo de la piña.
REFERENCIAS
Bartholomew, D. P; R. E. Paull; K. G. Rohrbach: The Pineapple. Botany, Production and Uses. University of Hawaii, Honolulu, CABI Publishing, EE. UU., 2003.
Carvalho, R. A.; E. F. de Oliveira; J. T. de Lacerda; M. B. Neto; J. X. de Araújo: «Alternative Control of Pineapple Fusariosis», Abstracts of the VI th International Pineapple Symposium. Oral presentations. Sessión III Plant Protection, João Pessoa, Paraiba, Brasil, November 18 to 23, 2007.
Choary, S. A.; E. F. de Olivera; A. P. de Matos: «Controle químico da broca e da fusariose no fruto do abacaxizeiro», Joao Pessoa, EMEPA-PB, EMBRAPA-PB. Documentos 20, Brasil, 1997.
Ciba-Geygi: Manual de ensayos de campo, 2. a ed., Suiza, 1981.
Erwin, D. C.; O. K. Ribeiro: Phytophthora diseases Worldwide, The American Phytopathology Society, Minnesota, EE. UU., 1996.
Dagnellie, P.: «Theorical Méthodes Statistiques», Les Presses Agronomiques de Gembloux, vol. 2, Bélgica, 1974.
González, Dulce M.: «Evaluación de diferentes densidades de plantación durante la fase de aviveramiento de bulbillo en dependencia del tamaño», Trabajo de Diploma, Instituto Superior Agrícola Ciego de Ávila, Cuba,, julio de 1988.
Hernández, A.: «Determinación, epifitiología y control de los patógenos fúngicos que afectan la fase de vivero en el cultivo de la piña», tesis en opción al título académico de Máster en Microbiología. Mención en Microbiología General, Facultad de Biología, Universidad de La Habana, julio 1999.
Hernández, A.; Carmen Rosón; Aliuska Sierra; O. Concepción; Doris Escalante; Nury Pérez: «Incidence, Estimate of Losses and Management in the Control of Fungi Pathogens in Systems of Propagation of Pineapple Crops in vitro (Ananas escamosus (L.)», Proccedings Fourth International Penapple Symposium, Veracruz City, Mexico, April 16-19, 2002.
Hernández, A.; Bertha Lina Muiño García; Carmen Rosón Álvarez; Caridad Casola González; Ángela Porras González; Aliana López Mayea: «Control químico de patógenos fungosos en piña de vivero (I)», Fitosanidad 14 (1): 31-37, La Habana, 2010.
Lyr, H.: Modern Selective Fungicide: Properties, Applications, Mechanisms of Action, 2 ed., Ed. Gustav Fischer Verlag, Nueva York, EE. UU., 1995.
Muiño, B.; A. Hernández; A. Porras: «Sensibilidad de especies de hongos fitopatógenos a los inhibidores de la biosíntesis de ergosterol (IBE)», Fitosanidad 4 (3-4): 45-48, La Habana, 2000.
Pérez, L.; Berta Lina Muiño: Seminario teórico-práctico sobre fungicidas y resistencia a fungicidas, FAO-Inisav, La Habana, 1995.
Unterstenhoefer, G.: «Las bases para ensayos fitosanitarios de campo», Pflanzenschutz-Nachrichten Bayer 16 (3): 89-176, Alemania, 1963.
Rohrbach, K. G.; D. P. Schmitt: Pineapple. Compendium of Tropical Fruits Diseases, Part IV, The American Phytopathological Society, EE.UU., 1994.
Ventura, J. A.; H. Costa; M. P. Culik; P. Machado: «Pineapple Fusariosis Reserch in Brazil: Progress UPDATE», Journal of Plant Pathology 90 (3, Supplement): S3.76. Disponible en http://www.sipav.org/main/jpp/volumes/1208/020_Session8_S71.pdf (consultado el 6 de agosto del 2009).