Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009versión On-line ISSN 1818-1686
Fitosanidad v.14 n.4 Ciudad de la Habana oct.-dic. 2010
Control biológico
Métodos alternativos en la conservación de Trichoderma harzianum Rifai
Alternative Methods for Trichoderma harzianum Rifai Preservation
Dayamí Rodríguez Batista y Yohana Gato Cárdenas
Instituto de Investigaciones de Sanidad Vegetal. Calle 110 no. 514 e/ 5.ª B y 5.ª F, Playa, Ciudad de La Habana, C.P. 11600, ygato@inisav.cu
RESUMEN
Se evaluó la conservación de la cepa A-34 de Trichoderma harzianum Rifai utilizada en la reproducción masiva, en sílica gel, en agua destilada estéril y bajo una capa de aceite mineral. Durante un año se evaluó la viabilidad, los caracteres morfológicos y la capacidad antagónica. Las muestras conservadas en agua destilada estéril y en aceite mineral no mostraron variaciones durante el tiempo evaluado respecto a la cepa patrón almacenada en agar papa dextrosa a 4OC, mientras que la conservada en sílica gel se mantuvo viable solo hasta los tres meses.
Palabras claves: Trichoderma harzianum Rifai, conservación, sílica gel, agua destilada, aceite mineral.
ABSTRACT
Conservation of Trichoderma harzianum Rifai A-34 strain, used in mass production, was evaluated stored in silica gel, distilled water and under mineral oil. Viability, morphological characters and antagonist capacity had been evaluated for one year. Samples conserved in sterile distilled water and under mineral oil showed no differences from the original culture stored in potato dextrose agar at 40 C, while those conserved in silica gel were viable for three months only.
Key words: Trichoderma harzianum Rifai, conservation, silica gel, distilled water, mineral oil.
INTRODUCCIÓN
Trichoderma harzianum Rifai es un hongo filamentoso que habita en suelos, posee una amplia gama de enzimas hidrolíticas y quitinolíticas que le confieren gran capacidad para establecer relaciones de parasitismo y simbiosis con microorganismos y plantas. De ahí que estas cepas se empleen en la agricultura para el control de enfermedades fúngicas, así como bioestimulantes de plantas y biofertilizantes [Harman et al., 2004; Lorito, 2006; Martínez, 2007].
Los microorganismos tienen una tendencia inherente a mutar en cultivos de laboratorio, por lo que es muy importante el estudio de procedimientos para mantenerlos viables y estables genéticamente durante su almacenamiento. Se han establecido varios métodos de preservación de cepas con este fin, la mayoría de los cuales llevan el metabolismo a niveles basales por retención de nutrientes, agua y oxígeno; por reducción de la temperatura de conservación, o por combinación de ambos [Sly, 1992; Jenkins y Grzywacz, 2003].
En el Instituto de Investigaciones de Sanidad Vegetal (Inisav) la cepa A-34 de Trichoderma harzianum Rifai se reproduce masivamente con fines comerciales desde hace más de veinte años [Fernández-Larrea, 2007]. A pesar de la importancia económica de esta cepa, el único método empleado en el laboratorio para su conservación es el pase periódico cada seis meses en medio fresco agarizado, por lo que existe el riesgo de contaminación y cambios genéticos, además del gasto continuo de materiales y necesidad de refrigeración.
Con el objetivo de mantener de forma estable durante un año la cepa A-34 de T. harzianum, se evaluaron tres métodos diferentes para su conservación.
MATERIALES Y MÉTODOS
Como material biológico se emplearon las cepas A-34 de Trichoderma harzianum y la cepa RF de Rhizoctonia solani Kühn, pertenecientes a la colección de hongos del Inisav, cultivadas y mantenidas en medio papa dextrosa agar (PDA) a 4°C.
Se evaluaron los métodos de conservación en agua destilada estéril, en aceite mineral y en sílica gel. La conservación en agua destilada estéril se realizó según la metodología descrita por Castellani (1967), modificado por Deshmukh (2003), con la diferencia que 1 mL de la suspensión de esporas obtenida directamente del cultivo se centrifugó en tubos Eppendorf, con capacidad de 1,5 mL a 12 000 r.p.m. durante 5 min, se desechó el sobrenadante y se resuspendió el concentrado celular en 1 mL de agua destilada estéril. La cepa conservada por este método se almacenó en refrigeración a 4o C.
La conservación en aceite mineral se realizó según el protocolo descrito por Little y Gordon (1967), modificado por Deshmukh (2003), donde cultivos jóvenes esporulados de 72 h de incubación fueron cubiertos completamente con aceite mineral previamente esterilizado a 121°C durante 15 min. Los bulbos se taparon con tapa de goma y retapas metálicas, y se almacenaron en refrigeración a 4°C.
La conservación en sílica gel se realizó según el protocolo descrito por Perkinson (1962), modificado por Deshmukh (2003). Cinco gramos de sílica gel no indicadora fueron distribuidos en bulbos de cristal tapados con papel metálico, esterilizados a 180°C por 3 h. Cuando estuvieron frescos se colocaron en una bandeja de metal que contenía agua suficiente para cubrir los frascos hasta el nivel de la sílica contenida dentro de los bulbos. De esta manera las bandejas se colocaron en congeladores por 24 h. La suspensión de esporas se realizó en leche descremada estéril al 5% a partir de un cultivo fresco en medio agarizado y se dejó en refrigeración durante 24 h. En condiciones de esterilidad se agregó 1 mL de suspensión de conidios a la sílica gel para garantizar que quedara solo humedecida. A fin de mantener un bajo contenido de humedad dentro de los bulbos, se mantuvieron con tapones de algodón durante 14 días en un ambiente seco y refrigerado, luego se le colocaron tapas de gomas y retapas metálicas y se almacenaron a 4°C.
Durante un año se evaluó cualitativamente la viabilidad y las características macro y microculturales de la cepa en los diferentes métodos de conservación. A partir de los seis meses se determinó el porcentaje de viabilidad de las esporas, y al año se realizó un bioensayo, para lo cual se tomaron bulbos de cada ensayo al azar.
Para determinar la viabilidad cualitativa y características macro y microculturales se realizaron pases a medio fresco (PDA) de la cepa conservada por diferentes métodos. Posteriormente se realizaron observaciones al microscopio estereoscopio con aumento de 20X y 40X, donde se observó la forma, aspecto y color de la colonia, el patrón de esporulación y la presencia de pigmentos en el medio de cultivo, así como observaciones al microscopio óptico, aumento de 400X, de cultivos teñidos con azul de algodón y lactofenol para observar la morfología de los conidios y las células conidiógenas. Cada evaluación se comparó con la cepa patrón mantenida en PDA.
La viabilidad cuantitativa se determinó mediante la preparación de la dilución de la cepa conservada en agua destilada estéril, para lo cual se añadió 1 mL del contenido del bulbo conservado, a un tubo de ensayo con 9 mL de agua destilada estéril más Tween 80 al 0,01% (dilución 10_1). En el caso de la dilución de la cepa conservada en aceite mineral se eliminó el aceite del bulbo y se tomó un disco del medio con el cultivo libre de aceite, mediante un horadador de 4 mm de diámetro. El disco se añadió a 10 mL de agua destilada estéril más Tween 80 al 0,01%, se agitó bien, se tomó 1 mL el cual se añadió en 9 mL de agua destilada estéril (dilución 10_2).
Se agitó manualmente, de forma discontinua, al inicio vigorosamente y con el asa previamente flameada, y luego más suave con el tubo cerrado por espacio de 15 min.
Se tomó una alícuota de la dilución y se cargó la cámara de Neubauer, donde se observó bajo el microscopio con contraste de fase a 400X de forma que se observaran de 3-6 esporas de Trichoderma por campo. En caso contrario se realizó una dilución decimal adicional para ajustar a este requerimiento.
Seguidamente se tomó con una pipeta aproximadamente 0,1 mL de la última dilución, que se sembró en cámara húmeda. Se rotuló la cámara y se incubó a 30°C por 12-15 h en la oscuridad.
Pasado este tiempo se leyó en microscopio con contraste de fase a 400X. Se contaron 100 conidios y se determinó como germinado aquel en el que se observó la presencia del tubo germinativo. Se halló el porcentaje de germinación. Se realizaron dos réplicas por muestra.
Este ensayo de viabilidad por germinación se realizó según los procedimientos de calidad normalizados del Laboratorio de Hongos Biocontroladores del Inisav.
La capacidad antagónica de Trichoderma harzianum se determinó por cultivo dual con Rhizoctonia solani, según método de Faifer y Bertoni (1988), modificado por Martínez et al. (2008), para lo cual se realizaron cultivos en césped a partir de suspensiones de las esporas de T. harzianum conservadas por los diferentes métodos y del fitopatógeno R. solani; incubadas a 30°C para R. solani y 28-30°C para T. harzianum durante dos días. Transcurrido este tiempo, con un horadador de 4 mm de diámetro, se tomaron discos de agar con el cultivo de cada uno de los hongos. En uno de los extremos de la placas con PDA se depositó un disco de Trichoderma y en el otro extremo opuesto un disco del hongo fitopatógeno R. solani (cultivo dual). Cada hongo se sembró además individualmente como controles.
Las placas sembradas se incubaron por siete días a una temperatura de 28-30°C. Se evaluó el radio de la colonia de cada hongo a partir de las 24 h, y se monitoreó hasta que se completó el crecimiento. Posteriormente se midió el crecimiento radial de los hongos, tanto en el cultivo dual como el de los controles, y se realizaron observaciones al microscopio con contraste de fase a 400X. Se realizaron tres réplicas por muestra.
RESULTADOS Y DISCUSIÓN
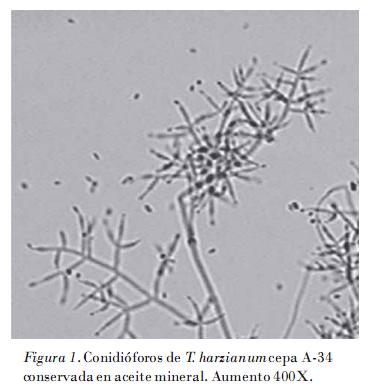
La viabilidad de la cepa A-34 de Trichoderma harzianum conservada en aceite mineral y agua destilada estéril a los 12 meses de evaluación fue de un 50%, aunque la de la cepa patrón fue del 95%. De esta manera se garantiza la recuperación del cultivo. Las características morfológicas y culturales no mostraron variaciones respecto a la cepa patrón utilizada; se observó la presencia de micelio flucoso de color blanco, que se tornó verde durante la esporulación, y presencia de pigmentación amarilla al reverso de la colonia. La observación microscópica evidenció abundantes clamidosporas de color pardo, subglobosas; conodióforos hialinos muy ramificados, con una estructura piramidal; conidios subglobosos a ovoides, subhialinos a verde pálido (Fig. 1).
Estos resultados coinciden con los obtenidos por Bueno y Gallardo (1998), quienes conservaron en agua destilada estéril otras especies de Trichoderma por un período de dos años; sin embargo, estos autores no tuvieron en cuenta el hiperparasitismo. En tal caso, este es un indicador muy importante que se encuentra incluido dentro de los parámetros del control de calidad, tanto de cepas como de bioproductos en las metodologías de producción de hongos antagonistas. Esta cepa está incluida en los procesos de producción de bioplaguicidas para el control de hongos fitopatógenos en cultivos de importancia económica [Fernández-Larrea y Elósegui, 2006].
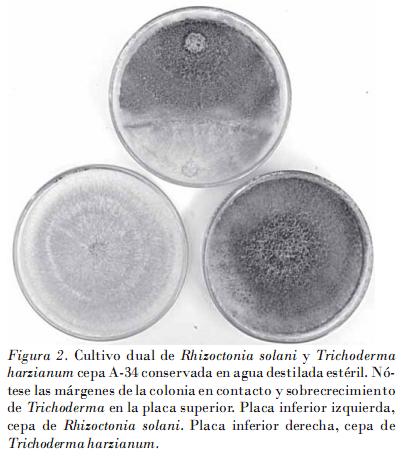
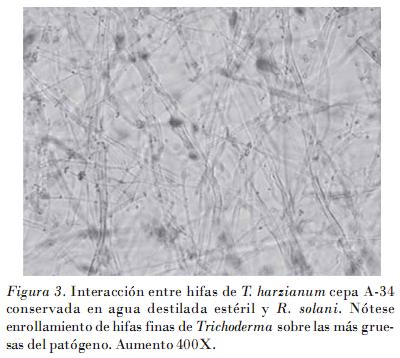
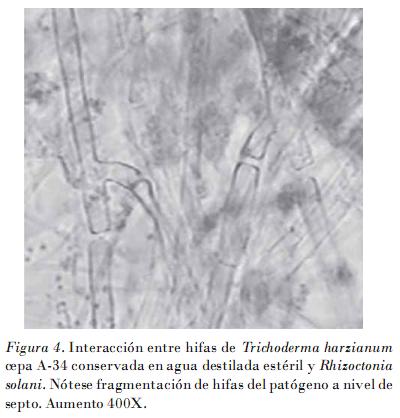
Los resultados del hiperparasitismo obtenidos en los bioensayos mostraron cómo a partir de los cuatro días existía una interacción macroscópica entre T. harzianum cepa A-34 conservada en agua destilada estéril y aceite mineral, y R. solani (Fig. 2), la que se corroboró al microscopio óptico a los siete días. Esto se manifestó mediante un enrollamiento de hifas (Fig. 3) y una fragmentación o lisis de las hifas del patógeno (Fig. 4). Los resultados fueron similares a los obtenidos con la cepa patrón, solo que con esta las interacciones hifales se observaron desde los cuatro días.
En la cepa conservada por estos métodos la pérdida del hiperparasitismo puede ser temporal y no necesariamente permanente. El que se manifieste el hiperparasitismo más tardíamente puede explicarse por la disminución del metabolismo producto de la conservación, adaptar toda la maquinaria metabólica al nuevo sustrato, lo que conlleva a mayor tiempo si se tiene en cuenta que la cepa patrón viene de cuñas de agar, donde la humedad es mayor, y por ende el metabolismo está más activado.
Estas características antagónicas de Trichoderma harzianum cepa A-34 están en concordancia con lo informado por Ezziyyani et al. (2004), Reino et al. (2008), Reyes et al. (2008), los cuales describieron el efecto antagonista de especies de Trichoderma sobre hongos de los géneros Rhizoctonia, Phytophthora, Fusarium, Sclerotium y Pythium, al actuar sobre ellos como hiperparásitos competitivos, y producir metabolitos antifúngicos y enzimas hidrolíticas, a los que se les atribuyen los cambios estructurales a nivel celular, tales como vacuolización, granulación, desintegración del citoplasma y lisis celular.
El aceite mineral se ha utilizado para la conservación de diferentes hongos entomopatógenos como Paecilomyces fumosoroseus (Wize) Brown y Smith [López et al., 2002], Metarhizium flavoviridae Gams y Rozsypal [Sanyang et al., 2000] y Beauveria bassiana (Balsamo) Vuillemin [Hong et al., 2005]; sin embargo, en la literatura consultada no se encontró referencia alguna de su utilización con Trichoderma sp., por lo que se pudiera considerar como otra alternativa de conservación de este hongo antagonista.
Las características morfológicas y culturales de la cepa A-34 de Trichoderma harzianum en sílica gel se mantuvieron como las descritas en agua destilada estéril y aceite mineral; sin embargo, la viabilidad se perdió después del tercer mes, por lo que no se continuaron las evaluaciones en este medio de conservación.
La conservación de hongos esporulados en sílica gel, protegidos con leche descremada, está recomendada por muchos autores [Raper, 1984, citado por Nakasone et al., 2004], así se mantienen viables entre cuatro y cinco años; sin embargo, los resultados no coinciden con los de estos autores.
No se tienen informes sobre la utilización de este método para Trichoderma, pero sí para la conservación de Beauveria bassiana [Fuenmayor, 1999] y Metarhizium flavoviridae [Moore y Higgins, 1997], lo que puede deberse a la estructura mucilaginosa de las esporas de Trichoderma, las cuales retienen humedad, a diferencia de las esporas de Beauveria y Metarhizium que son más polvorientas. Las estructuras más resistentes de Trichoderma son las clamidosporas [Gams y Bisset, 1998], y las suspensiones utilizadas fueron a partir de cultivo joven, donde las concentraciones de clamidosporas son bajas y prevalecen los conidios.
De manera general los resultados en agua destilada estéril y aceite mineral estuvieron en correspondencia con lo planteado por Ryan et al. (2000), quienes demostraron la factibilidad de conservación de hongos anamórficos con este tipo de método. Esos autores plantean además que si el hongo es de interés económico y científico, lo más adecuado es utilizar un método de elección (largo plazo) como liofilización y crioconservación. En este caso se comenzó por estos métodos alternativos por ser más factibles económicamente.
CONCLUSIONES
• Los métodos de conservación con agua destilada estéril y cultivo bajo una capa de aceite mineral garantizaron la viabilidad de la cepa A-34 de Trichoderma harzianum durante un año, sin sufrir cambios en su morfología y su capacidad antagónica, aunque se manifestó el hiperparasitismo más tardíamente, producto de la conservación.
• El método de conservación en sílica gel para la cepa A-34 de Trichoderma harzianum no debe emplearse por un período mayor de tres meses sin pérdida de la viabilidad.
REFERENCIAS
Bueno, L.; R. Gallardo: «Preservación de hongos filamentosos en agua destilada estéril», Rev. Iberoam. Micol. 15: 166-168, España, 1998.
Castellani, A.: «Maintenance and Cultivation of Common Pathogenic Fungi in Man in Sterile Distilled Water. Further Researches», Am. J. Trop. Med. Hyg. 70: 181-4, EE. UU., 1967.
Deshmukh, S. K.: «The Maintenance and Preservation of Keratinophilic Fungi and Related Dermatophytes», Mycoses, 46: 203-207, Alemania,. 2003.
Ezziyyani, M.; C. P. Sánchez; A. S. Ahmed; M. E. Requena; M. E Cyela: «Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum Annuum L.)», Anales de Biología 26: 35-45, España, 2004.
Faifer, G. C.; M. E. Bertoni: «Interactions Between Epiphytes and Endophytes from the Phyllosphere of Eucalyptus vinimalis III», Nova Hedwigia 47 (1-2): 219-229, Alemania, 1988.
Fernández-Larrea, O.: «Productos bioplaguicidas: Actualidad y perspectivas en Cuba», Memorias del Curso-Taller Internacional Manejo Agroecológico de Plagas en el Sistema de Producción, Instituto de Investigaciones de Sanidad Vegetal, marzo 22-25, La Habana, 2007.
Fernández-Larrea, O.; O. Elósegui: «Alternativas de producción de Trichoderma en Cuba», Fitosanidad 10 (2): 147, La Habana, 2006.
Fuenmayor, M.: «Evaluación de formulaciones y métodos de almacenamiento de aislamientos de Beauveria bassiana promisorias para el control de la broca del café», tesis de Maestría, CATIE, Turrialba, Costa Rica, 1999. Disponible en http://web.catie.ac.cr/informacion/RMIP/rmip55/tesis.htm (consultado en marzo del 2009).
Gams, W.; J. Bisset: «Morphology and Identification of Trichoderma», Trichoderma & Gliocladium. Vol. 1. , Londres, 1998.
Harman, G.; C. Howell; A. Viterbo; I. Chet; M. Lorito: «Trichoderma Species-Opportunistic, Avirulent Plant Symbionts», Nature Reviews Microbiology 2: 43-56, Inglaterra, 2004.
Hong, T. D.; S. Edgington; R. H. Ellis; M. Aquino; D. Moore: «Saturated Salt Solutions for Humidity Control y the Survival of Dry Powder and Oil Formulations of Beauveria bassiana Conidia», Journal of Invertebrate Pathology 89: 136-143, Holanda, 2005.
Jenkins, N. E.; D. Grzywacz: «Towards the Styardization of Quality Control of Fungal and Viral Biocontrol Agents», Quality Control y Production of Biological Control Agents: Theory y Testing procedures Chapter 18. Ed. J. C. van Lenteren, CAB Internacional, Inglaterra, 2003.
Little, G. N.; M. A. Gordon: «Survival of Fungal Cultures Maintained Under Mineral Oils for Twelve Years», Mycologia 59: 733-736, EE. UU., 1967.
López, C.; A. Hajek; R. Humber: «Comparing Methods of Preservation for Cultures of Entomopathogenic Fungi», Canadian Journal of Botany 80 (10): 1126-1130, Canadá, 2002.
Lorito, M.: «The Molecular Biology of the Interactions Between Trichoderma, Phytopathogenic Fungi and Plants: Oportunities for Developing Novel Disease Control Methods», Memorias del Taller Latinoamericano Biocontrol de Fitopatógenos con Trichoderma y Otros Antagonistas, hotel Panorama, marzo 28-31, , La Habana, Fitosanidad 10 (2): 139-140, La Habana, 2006.
Martínez, L. C. C.: «Estandarización del proceso de producción masiva del hongo T. koningii Th003 mediante fermentación bifásica a escala piloto», tesis de diploma, Microbiología Industrial, Facultad de Ciencias, Colombia, 2007.
Martínez, B.; Y. Reyes; D. Infante; E. González; H. Baños; A. Cruz: «Selección de aislamientos de Trichoderma spp. Candidatos a biofungicidas para el control de Rhizoctonia sp. en arroz», Rev. Protección Veg. 23 (2): 118-125, 2008, Cuba.
Moore, D.; P. M. Higgins: «Viability of Stored Conidia of Metarhizium flavoviride Gams y Rozsypal, Produced Under Differing Culture Regimes and Stored with Clays», Biocontrol Science y Technology 7: 335-343, Inglaterra, 1997.
Nakasone, K.; S. Peterson; S. Jong: «Preservation and Distribution of Fungal Cultures», Biodiversity of Fungi Inventory and Monitoring Methods, Academic Press, EE. UU., 2004.
Perkinson, D. D.: «Preservation of Neurospora Stock Cultures in Anhydrous Silica Gel», Can. J. Microbiol. 8: 591-594, Canadá, 1962.
Reino, J. L.; R. F. Guerrero; R. Hernández-Galán; I. G. Collado: «Secondary Metabolites from speciEs of the Biocontrol Agent Trichoderma», Phytochem. Rev. 7: 89-123, Springer Verlag, Berlín Heidelberg. Nueva York, 2008.
Reyes, Y.; B. Martínez; D. Infante: «Evaluación de la actividad antagónica de trece aislamientos de Trichoderma spp. sobre Rhizoctonia sp.», Rev. Protección Veg. 23 (2): 112-117, Cuba, 2008.
Ryan, M. J.; D. Smith; P. Jeffries: «A Decision-Based Key to Determine the Most Appropriate Protocol for the Preservation of Fungi», World Journal of Microbiology / Biotechnology 16: 183-186, Holanda, 2000.
Sanyang, S.; H. F. van Emden; D. Moore: «Laboratory Shelf-Life of OilFormulated Conidia of the Locust y Grasshopper Fungal Pathogen Metarhizium flavoviridae Gams & Rozsypal, in Mixtures with the Pyrethroid Insecticide Lambda-Cyhalothrin», International Journal of Pest Management 46 (3): 165-168, Inglaterra, 2000.
Sly, L.: «Mantenance and Preservation of Microbial Cultures in a Laboratory Culture Collection», Technical Note 14: 1-16, EE. UU., 1992.