Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Fitosanidad
versión impresa ISSN 1562-3009
Fitosanidad v.15 n.1 Ciudad de la Habana ene.-mar. 2011
Diagnóstico fitosanitario
Etiología de la mancha foliar del chile dulce (Capsicum annuum L.) y su control in vitro en Yucatán, México
Etiology of Bell Pepper (Capsicum annuum L.) Brown Leaf Spot and its Control in vitro in Yucatán, México
José María Tun Suárez, Marcia Elvis Castillo Peraza, Jairo Cristóbal Alejo y Luis Latournerie Moreno
División de Estudios de Posgrado e Investigación, Instituto Tecnológico de Conkal. Km 16.3, antigua carretera Mérida-Motul, Conkal, Yucatán, México, C.P. 97345, tun@colpos.mx
RESUMEN
En hojas de chile dulce con síntomas de mancha foliar se aisló e identificó al hongo Corynespora cassiicola(Berk & Curt.) Wei, el cual, a los tres días de inoculado en hojas de chile dulce (Capsicum annuum L.), chile habanero (C. chinense Jacq.) y chile xcat´ik (C. annuum L.) contenidas en cámaras húmedas, indujo manchas cafés rodeadas por un halo amarillo que con el tiempo aumentaron de tamaño; pero en las hojas de tomate (Lycopersicon esculentumMill.) se manifestaron al quinto día, en relación con las hojas control sin inocular que no presentaron síntomas. En ensayos de sensibilidad los fungicidas que indujeron los mayores porcentajes de inhibición del crecimiento micelial in vitro de C. cassiicolafueron mancozeb, oxicloruro de cobre y benomilo a una dosis de 0,1 mg • L-1 y complejo multibacterial a 100 mg • L-1con porcentajes superiores al 76%.
Palabras claves: tizón, chile dulce, Corynespora, sensibilidad, fungicidas.
ABSTRACT
The fungus Corynespora cassiicola (Berk &Curt) was isolated and identified in bell pepper leaves with symptoms of brown leaf spot, it was used three days later to inoculate bell pepper, hot habanero pepper (Capsicum chinense Jacq.) and local xcat'ik pepper (Capsicum annuum L.) contained in moist atmosphere; brown spots surrounded by a yellow ring, which grew in size in time, was induced then, however in tomato leaves (Lycopersicon esculentum Mill.) these spots appeared until day five, in relation to the control leaves without inoculation which did not show signs of spotting. In sensibility assays fungicides that most inhibited in vitro the presence of C. cassiicola micelliums were mancozeb, cuper oxicloride, and benomile at a ratio of 0.1 mg • L-1 and a multibacterial complex at 100 mg • L-1 with percentages higher than 76%.
Key words: wilt, bell pepper, Corynespora, sensibility, fungicides.
INTRODUCCIÓN
En la península de Yucatán, México, el chile dulce criollo (Capsicum annuum L.) es uno de los tres cultivares de mayor importancia por su uso como condimento en la elaboración de platillos regionales y salsas [Pech, 2006]. La superficie sembrada de tipo chiles verdes es de 419,1 ha y cosechada de 419,1 ha, con un volumen de 1603,5 t para el estado de Yucatán [INEGI, 2007]; sin embargo, la producción se ve limitada por la presencia de enfermedades foliares y de frutos por Cercospora capsici, Alternaria solani y Corynespora cassiicola, entre otros, lo cual genera disminución en la producción de fotoasimilados importantes en la formación y desarrollo del fruto. Además, inducen la abscisión, lo que deja expuestos los frutos a la luz solar que les provocan quemaduras y reducen su calidad y rendimiento con pérdidas que oscilan entre 10 y 100% [Zaletas, 2003].
Entre los inductores de manchas foliares se encuentra C. cassiicola (Hyphomycetes: Dematiceae). Este hongo presenta conidióforos erectos, simples u ocasionalmente ramificados, solitarios o en grupos rectos o ligeramente flexuosos, pálidos a café y lisos, septados, conidios solitarios o en cadenas de dos a seis muy variables en forma de clavados a cilíndricos, rectos o curvados, subhialinos o café y lisos [Mendoza, 1999]. Puede atacar diversos cultivos de importancia agrícola como tomate (Lycopersicon esculentum Mill.), pepino(Cucumis sativus L.), calabaza (Curcubita pepo L.), papaya (Carica papaya L.), chícharo (Vigna unguiculata L.), soya (Glycines max L.), jamaica (Hibiscus safdariffa L.), okra (Abelmoschus esculentus L.), cereza de Barbados(Malpighia glabra L.), salvia roja (Salvia splendens Sellow ex J. A. Shultes), chile (Capsicum annuum L.), entre otros [Cutrim y Silva, 2003; Kurt, 2005; Furukawa et al., 2008].
En hojas, tallos y frutos de chile, C. cassiicola induce manchas café oscuras de 1 a 2 mm de diámetro, que incrementan de tamaño y coalescen hasta formar grandes lesiones irregulares rodeadas por un halo amarillo [Shimomoto et al., 2008].
El control químico de C. cassiicola con mancozeb, captafol y chlorothalonil resulta efectivo en pepino(Cucumis sativus L.) [Mendoza, 1999]. La aplicación individual o en mezcla de mancozeb y benomilo inhibe el crecimiento de micelial in vitro, y el control de la enfermedad en campo es eficaz también en C. sativus[Ferrer, 2005]. Asimismo, estos productos inhiben la colonización del hongo en semilla en Sesamum indicum L. [Navas y Subero, 1995] y en Physalis ixocarpa Brot. Se recomiendan para el control preventivo de Podosphaera(Sphaerotheca) xanthii y Cercospora sp. en condiciones de campo [Félix et al., 2007].
La presente investigación se realizó con el propósito de identificar el agente causal de la mancha foliar en chile dulce en Yucatán (C. annuum L.) y evaluar la efectividad in vitro de fungicidas órgano-sintéticos (sistémicos y de contacto) y orgánicos para su control.
MATERIALES Y MÉTODOS
Diez muestras de hojas de chile dulce ( Capsicum annuum L.) cv. criolla con síntomas de necrosis foliar se colectaron en cada uno de los dos campos de cultivo de los municipios de Muxupip y Conkal, Yucatán, y trasladaron al Laboratorio de Fitopatología del Instituto Tecnológico de Conkal, donde se cortaron en fragmentos de 1 cm2 que incluyeron parte enferma y aparentemente sana, se desinfectaron con hipoclorito de sodio al 2% durante 1 min y se enjuagaron dos veces con agua destilada estéril para eliminar residuos de cloro. Posteriormente se llevaron a la campana de flujo laminar, donde las muestras se colocaron sobre papel absorbentepreviamente esterilizado para eliminar excesosde agua. Una vez secas las muestras se sembraron en medio de cultivo papa-dextrosa-agar (PDA) contenidasen placas Petri de 10 cm de diámetro y se incubaron a temperatura ambiente. Cuando se detectó crecimiento de micelio se reaisló en medio PDA y se obtuvieron doce aislamientos de cultivos puros, los cuales se utilizaron para su identificación y pruebas de sensibilidad in vitro de acuerdo con la metodología de French y Hebert (1982). La identificación del hongo se realizó con base a claves dicotómicas de Barnett y Hunter (1999).
La patogenicidad se evaluó en hojas de chile dulce (C. annuum L.), chile xcat´ic (C. annuum), chile habanero (C. chinense) y plantas de tomate (L. esculentum) desinfectadas superficialmente con hipoclorito de sodio al 2% durante 1 min, sobre las cuales se realizaron heridas y depositaron micelio del hongo, y se dejaron hojas testigo sin inocular. Las hojas inoculadas se introdujeron a cámaras húmedas elaboradas con placas Petri de 10 cm de diámetro provistas de papel absorbente humedecido con agua destilada esterilizada y se incubaron a temperatura ambiente.
Los ensayos de sensibilidad in vitro se realizaron también en medio (PDA), al cual se adicionaron los fungicidas de contacto de acuerdo con las dosis mínimas de ingrediente activo recomendadas por la casa comercial; oxicloruro de cobre 0,2 mg • L-1, captan 0,2 mg • L-1, mancozeb 0,15 mg • L-1 y sulfato tribásico de cobre 0,2 mg • L-1, más un testigo sin fungicida. Para el caso de los fungicidas sistémicos se emplearon clorhidrato de propamocarb 2,5 mL • L-1, triforine 1 mL • L-1, axozystrobin 0,02 mg • L-1 y benomilo a 0,1 mg • L-1 de ingrediente activo de producto comercial, más un testigo sin fungicida. Los ensayos se realizaron bajo un diseño experimental completamente al azar con cinco repeticiones.
Paralelamente, y de manera complementaria, se evaluaron las concentraciones de ingrediente activo de mancozeb a 0,1; 0,15; 0,2; 0,25 mg • L-1, oxicloruro de cobre a 0,1, 0.2; 0,3; 0,4 mg • L-1, benomilo 0,025; 0,05; 0,1; 0,15 mg • L-1, axozystrobin 0,02; 0,03; 0,04; 0,05 mg • L-1 y los fungicidas biológicos en dosis de producto comercial (complejo multifactorial) a base de Bacillus spp., Trichoderma spp., lixiviados de humus de lombriz, Rhizobium, Azotobacter, Quitosan, saponinas naturales, extractos de Yucca shidigera, extracto de algas marinas, ácidos fúlvicos y húmicos a 1; 1,5; 2; 2,5 y 5 mL • L-1 y n-Alkyl (C14, 60%, C16, 30%, C12,5%, C18,5%), Dimethyl Benzyl, ingredientes inertes) a 1; 1,5; 2; 2,5 y 5 mL • L-1, más un testigo sin fungicida. Se usó un análisis factorial AxB, donde el factor A correspondió al fungicida o producto y el B a las concentraciones respectivas.
Para inocular los medios de cultivo adicionados con fungicidas y los productos orgánicos; se depositó en la parte central de la placa Petri un disco de 1 cm de diámetro de la cepa pura del hongo, se sellaron con parafilm e incubaron a la temperatura ambiente del laboratorio.
La efectividad de los fungicidas sobre la inhibición del crecimiento micelial del hongo se evaluó con la medición en centímetros del diámetro de crecimiento radial del hongo cada 24 h, hasta que los testigos (sin fungicida) llenaron las placas Petri. Posteriormente se les hizo un análisis estadístico, previa transformación de los datos a porcentaje de inhibición del crecimiento micelial mediante arcoseno √x, de forma similar a lo realizado por Herrera (2004).
RESULTADOS Y DISCUSIÓN
La colonia del hongo que se aisló consistentemente de las lesiones en chile dulce (C. annuum) cv. criolla presentó un aspecto liso y algodonoso de color verde oscuro a negro. Micelio septado con conidióforos cilíndricos cortos y conidios terminales individuales o en cadenas cortas con formación acropetala, color café, multicelulares de tres a cinco con exospora gruesa incolora y una prominente cicatriz oscura, características que coincidieron con Corynespora cassiicola (Berk & Curt.) Wei [Barnett y Hunter, 1999; Kwon et al., 2001; Kwon et al., 2005; Cutrim y Silva, 2003; Shimomoto et al., 2008].
Los hospedantes inoculados chile dulce (C. annuum L.), chile xcat´ic (C. annuum), chile habanero (C. chinense) y tomate (L. esculentum) mostraron susceptibilidad a los asilamientos de C. cassiicola obtenidos en la presente investigación. En todos los casos aparecieron los síntomas característicos de la enfermedad a partir del tercer día, con manchas café, rodeadas con un halo amarillo, que con el tiempo aumentaron de tamaño y adquirieron una apariencia irregular. Este síntoma es común en diferentes cultivares de C. annuum y otras especies como L. esculentum, C. sativus, Perilla frutescens, Codiaeum variegatum (L.) A. Juss. var. bravo y Momordica charantia, inoculadas con una suspensión conidial de entre 104 a 2 x 105 conidios • mL-1 o en Glycine max y Salvia splendens con micelio, más esporas de C. cassiicola e incubadas bajo condiciones de alta humedad relativa y temperaturas de 20 a 30°C por un tiempo de 24 h a siete días. Se conoce que para C. cassicola la expresión de los síntomas varía de dos a siete días en dependencia del hospedante, período de incubación, concentración conidial y tipo de inóculo [Cabrera et al., 2006; Jayasuriya y Thennakoon, 2007; Furukawa et al., 2008; Shimomoto et al., 2008].
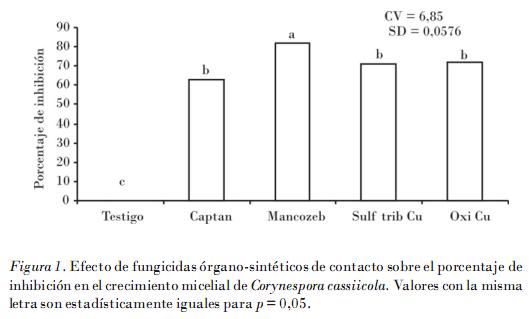
El fungicida de contacto mancozeb mostró mayor eficacia, ya que inhibió el crecimiento micelial in vitro de C. cassiicola en un 82% y resultó estadísticamente diferente (p = 0,01). Entre las diferentes concentraciones de ingrediente activo (0,1; 0,15; 0,2; 0,25 mg • L-1) de mancozeb y oxicloruro de cobre (0,1; 0,2; 0,3; 0,4 mg • L-1) no manifestaron diferencias estadísticas significativas en su efectividad inhibitoria que osciló entre un 86 y 88%, y un 72 y 76%, respectivamente (Fig. 1).
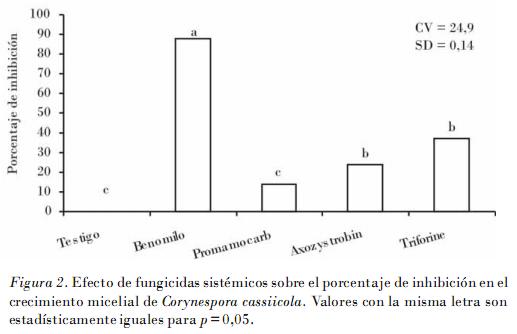
En relación con los fungicidas sistémicos, benomilo resultó el más eficiente al inhibir el crecimiento micelial in vitro de C. cassiicola en un 88%, y fue estadísticamente diferente (p = 0,01) al triforine, azoxystrobin y clorhidrato de propamocarb, con porcentajes de inhibición de un 37, 24 y 14%, respectivamente. La efectividad inhibitoria de las concentraciones de ingrediente activo de benomilo (0,025; 0,05; 0,1; 0,15 mg • L-1) y del azoxystrobin (0,02; 0,03; 0,04; 0,05 mg • L-1) no manifestaron diferencias estadísticas significativas en su efectividad inhibitoria, que fueron del 88% y menores al 40%, respectivamente (Fig. 2).
La efectividad del mancozeb y benomilo sobre C. cassiicola aplicados en forma individual o en mezcla se ha demostrado en ensayos de sensibilidad in vitro al inhibir el crecimiento de micelio a dosis de 5 mg • L-1, y el control de la enfermedad en campo a 2,0 kg • ha-1 de ingrediente activo en Cucumis sativus [Ferrer, 2005]; en Sesamum indicum benomilo a una dosis de 100 g por 100 kg de semilla inhibió el 100% de la colonización sobre la semilla y la transmisión de la enfermedad [Navas y Subero, 1995], y en Physalis ixocarpa Brot la aplicación preventiva de la mezcla de benomilo más mancozeb (500 g • ha-1 + 2,0 kg • ha-1) ejercieron un control del 88,3% para Podosphaera (Sphaerotheca) xanthii, y del 92,5% en Cercospora sp. bajo condiciones de campo [Félix et al., 2007].
El fungicida biológico complejo multifactorial a diferentes concentraciones de producto comercial (1; 1,5; 2; 2,5 y 5 mL • L-1) no manifestó diferencias estadísticas significativas en su efectividad inhibitoria del crecimiento micelial in vitro de C. cassiicola, que osciló entre el 74 y el 76%, pero superior en relación con la del n-Alkyl a diferentes concentraciones de producto comercial (1; 1,5; 2; 2,5 y 5 mL • L-1), que fue del 43 al 61%. La efectividad de complejo multifactorial en el control de enfermedades foliares inducidas por Botrytis cinerea, Collletotrichum gloeosporioides, Alternaria spp. ha sido demostrada en diferentes hortalizas a dosis de 500-700 mL • ha-1. También especies de Trichoderma (componente del complejo multifactorial), como el T. harzianum R. (cepa A-34) a dosis de 10,0 kg • ha-1 en tratamientos foliares, dio eficaz control hasta del 42% [Ferrer, 2005]. Asimismo los extractos de Lantana camara L. (filigrana o verbena morada) y Gliricidia sepium L. (piñon amoroso) tuvieron una actividad inhibitoria en el crecimiento micelial in vitro de C. cassiicola [Pérez et al., 2000].
CONCLUSIONES
• Corynespora cassiicola es el agente causal que induce la mancha foliar en chile dulce (Capsicum annuum L.).
• Los fungicidas de contacto mancozeb y sistémico benomilo a dosis de 0,1 mg • L-1 fueron los más eficientes en inhibir en el crecimiento micelial in vitro de Corynespora cassiicola, con porcentajes superiores al 82%.
• El complejo multifactorial a una concentración de 100 mg • L-1 resultó un producto orgánico alternativo a los fungicidas órgano-sintéticos al manifestar una eficiencia inhibitoria del 74% sobre el crecimiento micelial in vitro de Corynespora cassiicola.
REFERENCIAS
Barnett, H. L.; B. B. Hunter: Illustrated General of Imperfect Fungi, Burguess Publishing, Minnesota, EE. UU.,1999.
Cabrera, M. G.; M. A. Cúndom; S. A. Gutiérrez; R. E. Álvarez: «Situación de la mancha anillada (Corynespora casiicola) de la soja en provincias del NE de Argentina», Comunicaciones Científicas y Tecnológicas, Resumen A-022, Facultad de Ciencias Agrarias, Universidad Nacional del Nordeste, Argentina,. 2006.
Cutrim, F. A.; G. S. Silva: «Patogenicidad de Corynespora cassiicola a diferentes especies de plantas», Fitopatologia Brasileira 28:193-194, Brasil, 2003.
Félix, G. R.; J. A. Ávila; B. O. Valenzuela; J. A. Trigueros; R. M. Longoria: «Identificación y control químico de los agentes causales de la mancha foliar y la cenicilla del tomatillo (Physalis ixocarpa Brot.) en el norte de Sinaloa, México», Revista Mexicana de Fitopatología 25(1):1-10, México, 2007.
Ferrer, G. C. A.: «Comportamiento y control de la enfermedad tizón de fuego causada por el hongo Corynespora cassiicola (Berk & Curt) Wei. en el cultivo del pepino (Cucumis sativus L.) en sistemas de organopónicos en la provincia de Camagüey y su relación con otros patógenos fúngicos presentes en el cultivo», Fitosanidad 9(4):67, Cuba, 2005.
French, E. R.; T. T. Hebert: «Métodos de investigación fitopatológica», Instituto Interamericano de Cooperación para la Agricultura (IICA), San José, Costa Rica, 1982.
Furukawa, T.; K. Ushiyama; K. Kishi: «Corynespora Leaf Spot of Scarlet Sage Caused by Corynespora cassiicola», J. Gen. Plant Pathol. 74:117-119, Japón, 2008.
Herrera, P. E.: «Sensibilidad in vitro de Fusarium oxysporum Schletch y Alternaria solani Jones & Grout a fungicidas de contacto y sistémicos», Tesis de Licenciatura, Instituto Tecnológico Agropecuario no. 2, Conkal, Yucatán, México, 2004.
INEGI: «Anuario estadístico de Yucatán», Instituto Nacional de Estadística Geográfica e Informática, t. II. gobierno del estado de Yucatán, México, 2007.
Jayasuriya, K. E.; B. I. Thennakoon: «First Report of Corynespora cassiicola on Codiaeum variegatum (croton) in Sri Lanka», Cey. J. Sci. (Bio. Sci.) 36(2):138-141, Sri Lanka, 2007.
Kurt, S.: «Genetic Variation in Corynespora cassiicola, the Target Leaf Spot Pathogen», Pakistan Journal of Biological Sciences 8(4):618-621, 2005.
Kwon, J. H.; S. W. Kang; J. S. Kim; C. S. Park: «First Report of Corynespora Leaf Spot in Pepper Caused by Corynespora cassicola in Korea», Plant Pathol. J. 17(3):180-183, Corea, 2001.
Kwon, J. H.; H. J. Jee; C. S. Park: «Corynespora Leaf Spot of Balsam Pear Caused by Corynespora cassiicola in Korea», Plant Pathol. J. 21(2):164-166, Corea, 2005.
Mendoza, Z. C.: «Diagnóstico de enfermedades fungosas de las hortalizas », Departamento de Parasitología Agrícola, Ed. Universidad Autónoma de Chapingo, estado de México, 1999.
Navas, M.; L. J. Subero: «Efecto de cinco fungicidas sobre Corynespora cassiicola (Berk & Curt.) Wei en semilla de ajonjolí ( Sesamum indicum L.)», Rev. Fac. Agron. 21:119-127, Maracay, 1995.
Pech, M. A. M.: «Aptitud combinatoria y heterosis en germoplasma de chile dulce (Capsicum annuum L.)», Tesis de Maestría, Instituto Tecnológico Agropecuario no. 2, Conkal, Yucatán, México, 2006.
Pérez, W.; B. Bernal; A. Martín; C. Romeu: «Estudio preliminar de dos extractos vegetales para el control in vitro del hongo Corynespora cassiicola (Berk and Curt) Wei», Fitosanidad 4(1-2):43-46, Cuba, 2000.
Shimomoto, Y.; R. Adachi; Y. Morita; K. Yano; A. Kiba; Y. Hikichi; S. Takeuchi: «Corynespora Blight of Sweet Pepper (Capsicum annuum) Caused by Corynespora cassiicola (Berk. & Curt.) Wei», J. Gen. Plant Pathol. 74:335-337, Japón, 2008.
Zaletas, M. E.: «Control químico y epidemiología de la mancha foliar del chile habanero (Capsicum chinense Jacq.) en Yucatán, México», Tesis de Maestría en Horticultura Tropical, Instituto Tecnológico Agropecuario no. 2, Conkal, Yucatán, México, 2003.
Recibido: 29/11/10
Aceptado: 13/1/11
 Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons
Todo el contenido de esta revista, excepto dónde está identificado, está bajo una Licencia Creative Commons