My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Gaceta Médica Espirituana
On-line version ISSN 1608-8921
Gac Méd Espirit vol.17 no.3 Sancti Spíritus Dec. 2015
REVISIÓN BIBLIOGRÁFICA
Generalidades de los tumores de la región sacrococcígea
General aspects of sacrococcygeal tumors
Dr.C. Gretel Mosquera BetancourtI, Dr. Erick Héctor Hernández GonzálezII.
I Hospital Universitario Manuel Ascunce Domenech. Camagüey. Cuba.
II Hospital Universitario Amalia Simoni. Camagüey. Cuba.
RESUMEN
Fundamento: Los tumores que se originan en la región sacrococcígea son raros, representan del uno al siete por ciento de los tumores espinales primarios. Sin embargo, su diagnóstico y tratamiento imponen un reto para el equipo quirúrgico, por la complejidad de las relaciones anatómicas y las características biológicas de las lesiones más frecuentes.
Objetivo: Actualizar y sistematizar los conocimientos sobre las generalidades de los tumores de la región sacrococcígea.
Desarrollo: Son más frecuentes en adultos jóvenes del sexo masculino, debutan con dolor inespecífico en la espalda baja, a lo que se suman progresivamente la debilidad muscular, el déficit sensitivo y los trastornos esfinterianos. Pueden ser epidurales o intradurales, primarios o secundarios, neoplásicos o no y originarse en las partes blandas o en las estructuras óseas. La edad y la localización deben ser consideradas para evaluar el potencial de malignidad. La tomografía axial computarizada y la resonancia magnética nuclear son los estudios confirmatorios y permiten la selección del abordaje quirúrgico. Las lesiones que con más frecuencia se reportan son el cordoma, el quiste óseo aneurismático y el tumor de células gigantes. La radioterapia y la quimioterapia pueden complementar la cirugía en dependencia de la histología.
Conclusiones: El diagnóstico precoz necesita la sospecha ante síntomas inespecíficos. El tratamiento de los tumores de la región sacrococcígea debe ser multidisciplinario y multimodal, para garantizar un mejor pronóstico y mayor supervivencia de los pacientes.
Palabras clave: región sacrococcígea; neoplasias; tumores; cirugía; neoplasias de los tejidos blandos; diagnóstico; tomografía computarizada espiral, detección precoz del cáncer.
DeCS: REGIÓN SACROCOCCÍGEA/cirugía; NEOPLASIAS DE LOS TEJIDOS BLANDOS/diagnóstico; TOMOGRAFÍA COMPUTARIZADA ESPIRAL; DETECCIÓN PRECOZ DEL CÁNCER.
ABSTRACT
Background: tumors arising from sacrococcygeal region are weird and represent from one to seven percent of primary spinal tumors. However diagnosis and treatment are a challenge for the surgical staff because of the anatomic relations complexity and the more frequent lesions biological features.
Objective: a review of the literature was done to update and systematize the knowledge about general aspects of sacrococcygeal tumors.
Development: they are more frequent in male young adults, unspecific low back pain is the onset symptom and muscle weakness, sense deficit and sphincter disturbances join up later progressively. They can be epidural or intradural, primary or secondary, neoplastics or not and they could arise from soft tissues or bone structure. Age and location most be considered to evaluate malignant potential. CT scan and magnetic resonance imaging are the confirmatory tests and allow surgical approach selection. The most frequent affections are chordoma, aneurismal bone cyst and giant cell tumor. Radiotherapy and chemotherapy can support surgery according to histology.
Conclusions: precocious diagnosis needs to be suspected before unspecific symptoms. Sacrococcygeal tumors treatment most be multidisciplinary and multimodal to assure better prognosis and patient´s life expectancy increasing.
Keywords: sacrococcygeal region; neoplams; tumors surgery; soft tissue neoplasms; diagnosis; tomography spiral computed; early detection of cancer.
MeSH: SACROCOCCYGEAL REGION/surgery; SOFT TISSUE NEOPLASMS/diagnosis; TOMOGRAPHY SPIRAL COMPUTED; EARLY DETECTION OF CANCER.
INTRODUCCIÓN
La región sacrococcígea cierra la pared posterior de la pelvis menor y es sitio de inserción de músculos y ligamentos. Su estructura está conformada por las partes blandas extra raquídeas, la pared ósea del canal vertebral o conducto raquídeo, el espacio epidural con su contenido de grasa y plexo venoso, la duramadre cuya envoltura fibrosa termina en el fondo del saco a la altura de la segunda vértebra sacra, el espacio subdural con la aracnoides, el líquido cefalorraquídeo, las raíces nerviosas y el filum terminal 1,2.
El espacio pélvico extraperitoneal está relacionado con la región sacrococcígea e incluye tres zonas potenciales que se intercomunican:
- Prevesical: Está bordeado en su parte anterior por la pared abdominal infraumbilical y por detrás tiene la fascia umbilicovesical, también se conoce como espacio de Retzius.
- Perivesical: Está por debajo de la reflexión pélvico peritoneal y contiene la vejiga y el útero.
- Perirectal: Rodea al recto e incluye el espacio presacro periférico 3.
El espacio presacro es un área potencial limitada por delante por el mesorrecto y por detrás por la cara anterior del sacro. Su extensión lateral está limitada por los uréteres, los vasos ilíacos, las raíces sacras y los pilares del recto. Contiene células totipotenciales, tejido conectivo, la arteria sacra media, los vasos rectales superiores y los ramos simpáticos y parasimpáticos del sistema nervioso autónomo. Cada uno de los elementos antes mencionados puede originar tumores de interés quirúrgico, pero con un acceso complejo en relación con las estructuras neuro vasculares y los órganos que se encuentran en esta zona 4-6.
Los tumores localizados en la región sacrococcígea no son usuales. Representan del 2 al 4 % de todas las neoplasias óseas primarias y del 1 al 7 % de todos los tumores espinales primarios, con una proporción similar entre los intradurales (5 %) y aquellos con extensión epidural (4 %) 7, 8.
Los tumores sacros y pre sacros son raros y se reportan en uno de cada 40 mil ingresos. Además de los citados con anterioridad, tienen preferencia por esta región: El cordoma, el tumor de células gigantes y el sarcoma de Ewing. Cerca de la mitad de todos los tumores sacros son metástasis (pulmón, próstata, recto). Los carcinomas rectales invasivos pueden infiltrar directamente al sacro 8,10.
En la región sacrococcígea al no existir médula espinal pueden encontrarse la extensión de los tumores del cono medular donde se hallan el 14 % de las lesiones intramedulares. La edad promedio de presentación es de 38 años (con una variación de 17 años). La presentación clínica típica está caracterizada por el comienzo gradual y progresivo, con remisión intermitente de los síntomas 7.
De acuerdo con la edad, los tumores espinales benignos son un poco más frecuentes en los niños de todas las edades. En menores de seis años la mayoría son malignos como el neuroblastoma, el astrocitoma y el sarcoma. En los adultos mayores de 35 años los tumores predominantes son el adenocarcinoma metastásico, el mieloma múltiple y el osteosarcoma. Estos dos elementos clínicos: La edad y la localización deben ser considerados para evaluar el potencial de malignidad de una lesión neoformativa de la columna. La mayor parte de las series revisadas reportan mayor incidencia en el sexo masculino 9.
Los tumores intradurales extramedulares significan cerca del 51 % y la gran mayoría (84 %) son intradurales. De ellos los tumores de la vaina de los nervios, los meningiomas, los hamartomas y los sarcomas son los que con frecuencia tienen extensión extradural 7.
El diagnóstico se dificulta por las manifestaciones clínicas inespecíficas. Por lo general se diagnostican en estadíos avanzados, cuando la extensión del tumor involucra los nervios sacros y los órganos adyacentes. La complejidad anatómica de la zona y las características de las neoplasias más frecuentes exigen un tratamiento multidisciplinario y multimodal para garantizar el control de la enfermedad y por lo tanto prolongar la supervivencia de los pacientes 8.
El objetivo del presente trabajo es actualizar y sistematizar los conocimientos generales sobre los tumores de la región sacrococcígea, ya que aunque no son lesiones frecuentes, cuando aparecen representan un reto para el equipo médico.
DESARROLLO
Se realizó una revisión de la literatura en idioma inglés y español disponible en PubMed Central (PMC) de los últimos cinco años. Los buscadores empleados fueron: Tumores espinales, tumores de la región sacra, tumores de la región sacrococcígea. Se incluyeron 12 artículos, de ellos ocho revisiones sistemáticas y cuatro reportes de caso.
Se consultaron 11 libros, algunos de ellos en su totalidad (referencias 7, 11, 12, 16), que sobrepasan los cinco años pero se consideraron importantes para la revisión. Se abordaron aquellos tópicos controversiales y poco sistematizados en la literatura como son: Clasificación, diagnóstico y tratamiento.
La región sacrococcígea es el sitio donde con menos incidencia aparecen los tumores del raquis. Los mismos pueden tener gran variedad histológica e historia natural diferentes. Sin embargo, existen características generales que pueden orientar al diagnóstico, las que se describirán a continuación en diferentes tópicos.
Clasificación de los tumores de la región sacrococcígea.
1. De acuerdo con las estructuras de origen pueden ser: Primarios (se originan en el sacro, sus partes blandas y su contenido y en el cóccix) y secundarios (se originan en las estructuras adyacentes del raquis y de la pelvis menor y por continuidad afectan la región sacrococcígea).
2. De acuerdo con sus características histológicas están: Los tumores (se incluyen los quistes radiculares, óseos y la enostosis) y las neoplasias que pueden ser: Primitivas (benignas o de diferentes grados de malignidad) y metastásicas. Además se han dividido en linfoproliferativas y no linfoproliferativas.
3. De acuerdo con su localización en el raquis pueden ser 7, 11:
- Tumores epidurales que se dividen en:
Tumores de partes blandas: Por lo general son benignos y no destruyen las propiedades biomecánicas del raquis. Se desarrollan en el espacio epidural y desplazan la grasa, las venas y comprimen la duramadre. Dentro de ellos se encuentran: Quiste sinovial, quiste aracnoideo, sarcomas de partes blandas, cavernoma, hamartoma, angiolipoma, lipoma, hemangiopericitoma, pseudotumor calcificado.
Tumores de partes óseas: Distorsionan o destruyen la anatomía ósea en dependencia de la naturaleza del tumor, la mayor parte son malignos e interfieren con la estabilidad del raquis. Pueden ser primarios (osteoma osteoide, osteoblastoma, sarcoma de Ewing, linfoma, quiste óseo aneurismático, hemangioma, tumor de células gigantes y la histiocitosis X) y los tumores epidurales óseos metastásicos o secundarios.
- Tumores intradurales 7,12:
Tienen su origen en las meninges, en las raíces nerviosas y sus vainas, en el filum terminal y en restos embrionarios de la notocorda. Los tumores del filum terminal se consideran como extramedulares. Dentro de los más frecuentes se encuentran: Meningiomas, las neoplasias de las vainas de los nervios (neurofibromas y schwannomas), ependimoma mixopapilar, paragangliomas y cordomas.
Se han descrito otras lesiones intradurales que pueden afectar la médula a nivel del cono y el epicono y por continuidad invadir el canal sacro como son: Quistes aracnoideos, hamartomas, neuroblastomas, metástasis, melanocitoma, teratoma, angioblastoma, cavernoma, entre otros.
Generalidades del diagnóstico
Diagnóstico clínico
Las manifestaciones clínicas se originan por compresión o invasión de los tejidos adyacentes. La forma de presentación es casi siempre inespecífica y el síntoma más frecuente es el dolor en la espalda baja, asociado al déficit neurológico y puede aparecer deformidad espinal 9.
El dolor tiene la característica de ser persistente, de aumentar con el reposo y en el horario nocturno, no se relaciona con la actividad física y se muestra refractario al tratamiento farmacológico. Su origen en las neoplasias del raquis tiene diferentes causas: Expansión del periostio, colapso vertebral o fractura patológica, atrapamiento y compresión radicular y el dolor mecánico por inestabilidad espinal secundaria a destrucción ósea 9.
Pueden identificarse diferentes tipos de dolor en las neoplasias del raquis 11:
Dolor radicular: Localizado en el territorio de inervación cutánea (dermatoma) o grupo muscular. Produce sensación de quemazón intensa y aguda, agravada por el movimiento, la tensión o la tos. Es típico en los neurinomas.
Dolor medular: Es continuo y profundo, supera el territorio de irradiación de un dermatoma para ocupar todo un brazo, una pierna o la mitad del cuerpo, y no se modifica con el movimiento.
Dolor localizado: Aparece en la región del tumor, aumenta con los movimientos y con las maniobras de Valsalva. Se recoge que el 90 % de los ependimomas presentan un dolor local, continuo, que le impide al paciente conciliar el sueño y que aumenta con el decúbito.
Dolor mecánico. Con frecuencia asociado a inestabilidad, por lo que está relacionado con los movimientos del raquis.
El déficit neurológico en las lesiones de la región sacrococcígea se debe a la compresión de las estructuras radiculares y se pude manifestar con un cuadro de afectación de una raíz (síndrome de compresión radicular) o de múltiples raíces (síndrome de la cola de caballo). Aparece el déficit sensitivo limitado al territorio de inervación de la raíz afectada o distribuido en forma de silla de montar en las lesiones que involucran la cola de caballo y el filum terminal 9, 13.
Semiología vesical. Suele ser un síntoma tardío, a excepción de las lesiones de instauración aguda, o en las del cono medular. Al inicio aparece una retención urinaria brusca seguida por la micción por rebosamiento. Los síntomas de vejiga neurogénica sólo se producen si la lesión medular es bilateral. Menos evidente, pero igual de frecuente, es la afectación del esfínter anal y la impotencia sexual 11.
Semiología vegetativa. Es muy rara y aparece sólo en casos de instauración muy lenta. Como ejemplo, puede citarse la hipersudoración infralesional, seguido de una segunda etapa de hiposudoración y piel seca 11.
Otras manifestaciones clínicas menos frecuentes 9:
- Signos irritativos meníngeos, debido a la hemorragia subaracnoidea de origen tumoral.
- Edema de la papila, por aumento de la presión intracraneal debido al déficit de la reabsorción del Líquido Cefalorraquídeo (LCR) secundario a la hiperproteinorraquia que producen ciertos tumores.
- Nistagmo horizontal, hipotrofia muscular distal en extremidades superiores, afectación del Xl, Xll pares craneales uni o bilateral, debido a la afectación del foramen magno.
- Tortícolis y escoliosis en niños.
- Claudicación neurógena, por anclaje medular lo que da lugar a pies equinos y pies zambos en los niños.
- Tumoraciones malformativas o disembriogénicas (quiste dermoides, lipomas) se asocian a espina bífida oculta y estigmas cutáneos.
Las lesiones malignas metastásicas pueden acompañarse de síntomas sistémicos como pérdida de peso, fiebre, fatiga y deterioro progresivo del estado general.
En los tumores sacros que crecen en sentido posterior con afectación de partes blandas, puede encontrarse una masa tumoral local palpable. Los que lo hacen en sentido anterior pueden debutar con síntomas vesicales o rectales y ser detectados al tacto 9.
Diagnóstico por estudios complementarios
La evaluación de los tumores raquídeos incluye:
Estudios de laboratorio: Hematológicos y de química sanguínea con fines evaluativos del estado general del paciente y diagnósticos en las neoplasias de origen hematopoyético. No existen todavía marcadores bioquímicos específicos para los tumores espinales. Incluye el estudio citológico, citoquímico y microbiológico del LCR 9.
Estudios neurofisiológicos: En el estudio de los tumores de la cola de caballo y de la región lumbosacra pueden empleares los tres estudios básicos: Potenciales evocados somatosensoriales (PESS), potenciales evocados motores (PEM) y la electromiografía (EMG). El monitoreo electrofisiológico transoperatorio se considera mandatorio durante la cirugía de muchos de los tumores del raquis sobre todo en los intradurales 12.
Los PESS brindan una información confiable para el diagnóstico y seguimiento preoperatorio de los tumores intramedulares, al evaluar la función de los cordones dorsales y evidenciar alteraciones de las vías sensoriales que no tiene traducción clínica. Pueden ser inducidos en el nervio tibial y resultan de utilidad en el transoperatorio 14.
El monitoreo de los PEM puede ser de ayuda en los tumores de localización ventral. Por su parte la EMG es de gran valor en los tumores de la cola de caballo y de la región lumbosacra, al mostrar indicadores de afectación de la raíz nerviosa dentro de los que se encuentran: La actividad electromiográfica anormal en dos músculos separados con el mismo segmento de inervación y en los músculos para espinales, la presencia de actividad espontánea (fibrilaciones y fasiculaciones), la actividad insercional prolongada, la morfología alterada del potencial de acción de la unidad motora (aumento de la amplitud prolongado, complejo y disperso), pueden encontrarse además un pobre reclutamiento y un rango de descarga rápido 15.
Evaluación radiológica de los tumores espinales
- Radiografías estándar. Las neoplasias vertebrales pueden ser osteolíticas, osteoblásticas y mixtas. El osteoma y el osteoblastoma pueden observarse como lesiones escleróticas en los elementos posteriores de la columna con un área central lítica rodeada por tejido reactivo. La destrucción lítica de uno de los pedículos detectada en la vista antero posterior es uno de los signos tempranos más clásicos de las lesiones vertebrales malignas. Antes de que sean visibles los cambios radiológicos, el 30 al 50 % del cuerpo vertebral puede estar destruido 9,16.
- Ultrasonografía (USG) transoperatoria. El USG transdural permite la localización del proceso patológico en tiempo real y resulta muy útil en los tumores de la cola de caballo. Brinda información no solo de la localización precisa del tumor, sino además de su estructura y guía la resección del mismo 12.
- Tomografía axial computarizada (TAC). Se considera uno de los exámenes de mayor valor en el estudio de los tumores raquídeos extradurales al tener las siguientes ventajas: Es más específico para demostrar las márgenes corticales del hueso y la presencia de calcificaciones, permite una mejor visualización del grado de destrucción ósea y el diagnóstico de lesiones como el osteoma osteoide. La técnica de mielotomografía es muy útil en casos donde está contraindicada la Resonancia Magnética Nuclear (RMN), facilita la toma de muestra en las biopsias percutáneas con fines diagnósticos y resulta necesario para la planificación de la instrumentación al poder determinar las dimensiones de los pedículos y de los cuerpos vertebrales 9,13.
- Tomografía por Emisión de Positrones (TEP). Su alto costo limita su uso sobre todo en el diagnóstico de la enfermedad metastásica. Su principio se basa en el metabolismo de la fluorina-18 deoxiglucosa. El acúmulo de este trazador dentro del tejido refleja de forma directa su actividad metabólica. Las lesiones de más alto grado tienen mayores tazas metabólicas que las de bajo grado. Ha demostrado ser superior para la detección de las metástasis cerebrales que la gammagrafía. Permite determinar la parte más activa del metabolismo del tumor, detectar quistes, el grado y extensión de la necrosis y el tumor irradiado. Facilita la diferenciación entre el hueso osteoporótico y las fracturas por compresión patológicas, ya que los tumores son hipermetabólicos y las fracturas osteoporóticas son casi siempre hipometabólicas. Además puede ser utilizada para observar y cuantificar la expresión génica 9,11,12.
- Tomografía por Emisión de Fotones Simples (SPECT) con hematíes marcados. La utilización del SPECT con hematíes marcados (99 mTc-Hematíes) brinda una alternativa para el diagnóstico específico del hemangioma 9,11,12.
- Estudios de opacificación vascular espinal. La angiografía espinal se utiliza con fines diagnósticos y terapéuticos, cuando se sospechan lesiones vasculares como el quiste óseo aneurismático y el hemangiosarcoma, al poder demostrar la aferencia y los vasos de drenaje. Durante la realización del estudio puede usarse la embolización selectiva en las lesiones hipervasculares para disminuir el sangrado intraoperatorio 9.
- RMN. Se considera el estudio de elección para los tumores intrarraquídeos, al visualizar el nivel preciso de localización del tumor, el área patológica y la anatomía de los tejidos adyacentes. Ofrece una información topográfica y de las estructuras nerviosas no comparable a otras técnicas radiológicas, al definir el nivel espinal, la extensión, la infiltración del cuerpo vertebral, de los tejidos blandos para espinales (músculos y vasos), de las raíces nerviosas y el saco. Brinda una visualización óptima de los tejidos blandos para espinales y del grado de compresión del espacio epidural.
Es muy sensible para detectar alteraciones en la médula ósea pero no favorece el diagnóstico específico a excepción del hemangioma cavernoso benigno. Las técnicas de supresión de grasa permiten delinear el tumor de los componentes grasos epidurales y para espinales. Por su parte, las técnicas T2 facilitan la determinación de la extensión y grado de compresión medular. Los cortes axiales visualizan la demarcación con el tejido medular normal y la orientación del tumor dentro de la médula: Anterior, posterior, antero posterior, medial. Se define mejor la parte exofítica del tumor, así como la parte sólida y los quistes asociados.
En casos con enfermedades sistémicas como la Neurofibromatosis tipo 2 (NF-2) la RMN permite el estudio de todo el neuroaxis. El uso del gadolinio es mandatario y su captación permite diferenciar el tumor activo de los tejidos óseos y blandos adyacentes. El realce con el contraste es un indicador de la vascularización del tumor y su captación más o menos homogénea, permite hacer el diagnóstico diferencial entre ependimomas, angioblastomas y astrocitomas. La captación heterogénea es característica de los tumores malignos o anaplásicos. La RMN con técnicas de difusión pueden determinar y cuantificar el grado de necrosis tumoral después de la terapia adyuvante 9, 13, 14, 16.
- Estudios con radionucleótidos. Para la realización de la gammagrafía ósea se emplean radiofármacos derivados de los fosfatos, el más empleado es el 99mTc-metilendifosfonato (99mTc-MDP). Es muy usado en el diagnóstico inicial y seguimiento de los tumores óseos y tiene las siguientes ventajas: Permite detectar lesiones muy pequeñas (2 mm) hasta aquellas con alteración local de un 5–15 %, puede diferenciar los cambios osteolíticos y los osteoblásticos entre dos a 18 meses antes que las radiografías, facilita la determinación de las lesiones solitarias o multifocales y su extensión local. Es un método sensible pero no específico para detectar metástasis, es positivo en la mayoría de los tumores malignos y su sensibilidad disminuye para los tumores hematopoyéticos y linforeticulares 9,13,16.
En los tumores óseos primarios, la principal utilidad de la gammagrafía es valorar la agresividad de los mismos, realizar el seguimiento evolutivo o posterapéutico de los diagnosticados y la detección de metástasis óseas o recidivas locales en pacientes con lesiones malignas. A través de este estudio se puede clasificar al tumor de acuerdo con su agresividad en: Lesión inactiva, activa, agresiva o invasiva y muy agresiva o muy invasiva 9,11,13,16.
El primer grado corresponde a tumores benignos inactivos, el segundo a lesiones óseas activas, el tercero se suele ver en tumores óseos benignos agresivos y en los sarcomas de bajo grado (sarcoma parostal, tumor de células gigantes, hemangioendotelioma) y el cuarto aparece en los sarcomas de alto grado como el osteosarcoma clásico, sarcoma pos-radiación, sarcoma de Paget, condrosarcoma y sarcoma de células gigantes 9,11,13,16.
Estudio histológico
Se describen tres tipos de biopsias 8, 9,16 :
1. Biopsia percutánea por aspiración con aguja: Puede hacerse bajo control radiológico fluoroscópico o tomográfico, este último tiene mayor rango de seguridad y el margen de diagnóstico positivo está entre el 80 y el 90 %.
2. Biopsia incisional abierta: En su realización se tienen en cuenta los siguientes principios: La incisión debe ser suficiente para que pueda emplearse en la cirugía definitiva, se recomienda que la ventana ósea sea pequeña para evitar fracturas patológicas y la misma requiere el empaquetamiento óseo. Es importante evitar los hematomas posoperatorios por el riesgo potencial de diseminación del tumor a través de los planos faciales.
3. Biopsia excisional con objetivos diagnósticos y terapéuticos.
La elección de la técnica de biopsia depende de la extensión y localización del tumor. En las lesiones posteriores con o sin participación de las partes blandas, está indicada la biopsia por aspiración guiada por TAC. En las anteriores pueden emplearse las biopsias transpediculares, pero si el tumor es maligno requiere de la resección del pedículo y de las partes blandas del trayecto, para evitar la diseminación 9,16.
De manera general se recomienda la biopsia abierta por la accesibilidad del sacro, la efectividad del 81 % comparado con el 12 % asociado a los procedimientos percutáneos. En ciertos tipos de tumores sacros pueden ser de utilidad los estudios moleculares e inmunohistológicos, para evaluar la naturaleza biológica de la lesión. Por ejemplo en los cordomas se pueden encontrar alteraciones genéticas como: Anormalidades en la estructura de los cromosomas, policlonalidad e inestabilidad microsatélite 8.
Generalidades del tratamiento
El tratamiento de los tumores raquídeos independiente a su localización, está determinado por su biología, localización y extensión. Los avances en la tecnología quirúrgica relacionados con la fusión, la fijación espinal y las modalidades radioquirúrgicas han favorecido el tratamiento multimodal agresivo 9, 13.
La evaluación y el tratamiento de los tumores sacros requieren un abordaje multidisciplinario. Las complejas condiciones anatómicas y la biomecánica de la unión lumbopélvica, hacen que el tratamiento quirúrgico de las neoplasias de esta localización sea un reto en el campo de la cirugía espinal 17, 18.
Las técnicas quirúrgicas radicales como la sacrectomía parcial o total pueden garantizar el control local pero se asocian a muchos problemas graves como: Disfunción sexual, vesical o rectal, infecciones, pérdidas masivas de sangre, e inestabilidad espino pélvica 8.
Opciones de tratamiento
1. Radioterapia. Las distintas modalidades de radioterapia están orientadas para los tumores radiosensibles como el mieloma múltiple, el plasmocitoma solitario, el sarcoma de Ewing, las metástasis espinales de cáncer de mama y de células pequeñas del pulmón. También se emplean en tumores de bajo grado, en resecciones parciales y en recurrencias, en casos inoperables, pueden combinarse con las técnicas percutáneas y son de elección para tumores sacros de alto grado de malignidad. La radioterapia de intensidad modulada y la radiocirugía estereotáctica disminuyen los efectos de la radioterapia convencional sobre el plexo lumbosacro, la piel y el resto de los órganos 8, 9,13,19.
Variantes de radioterapia
- Radiocirugía estereotáctica espinal: Permite una radiación más precisa en altas dosis hipofraccionadas. Hay una dosis de radiación tumoricida con exposición mínima de los tejidos normales adyacentes. Se considera segura, con una respuesta sintomática más duradera y un control local, con independencia de la histología, además el tiempo de tratamiento es más corto. No está indicada en casos con déficit neurológico causado por compresión ósea a las estructuras neurológicas, ni en lesiones grandes.
- Radioterapia intraoperatoria o intersticial: Se ha utilizado como forma de administrar dosis elevadas sobre zonas del tumor no resecables o sobre la duramadre. Sus datos son muy escasos. No se ha encontrado superioridad clínica sobre la radioterapia convencional.
- Radioterapia de intensidad modulada: Se realiza una planificación de dosis teóricamente mejor.
- Neutrones rápidos: Modalidad poco disponible, con escasos pacientes tratados.
- Protones: Es la técnica en la que se depositan las mayores esperanzas en la actualidad, por la gran precisión en la dosificación, lo que permite dosis elevadas sobre los tumores raquimedulares con bajo riesgo de lesión medular 11,17.
2. Quimioterapia. La quimioterapia está indicada en aquellas neoplasias sensibles como el osteosarcoma, el sarcoma de Ewing, el mieloma múltiple y las metástasis. También se emplea en las recurrencias de las lesiones más agresivas. Los estudios moleculares y de las propiedades biológicas de los tumores han favorecido el desarrollo de nuevos agentes quimioterapéuticos. Los agentes quimioterapéuticos pueden clasificarse en aquellas drogas antitumorales y aquellas que minimizan los efectos secundarios del tumor como los esteroides, los bifosfonatos y los analgésicos 8, 11, 17, 19.
3. Embolización. Varios agentes como el gelfoam, el polyvinyl alcohol y los coils son empleados a través de embolizaciones percutáneas. Es una técnica de primera opción en ciertos tumores sacros y puede ser empleada como tratamiento adyuvante o no adyuvante 18.
Puede causar alivio del dolor, osificación del tumor y detención de su crecimiento así como disminución del índice de recurrencias. Puede ser única o múltiple. Se utiliza la embolización preoperatoria o arterial selectiva sobre todo en tumores hipervasculares primarios, en metástasis como tratamiento paliativo en la enfermedad metastásica avanzada y en neoplasias que no pueden ser resecadas.
4. Tratamiento quirúrgico 4, 7,11,23.
El tratamiento quirúrgico incluye las técnicas convencionales y las técnicas de mínima invasión. La resección en bloque con márgenes quirúrgicos amplios es el tratamiento de elección en la mayoría de los tumores sacros. Producto de la anatomía y la posición biomecánica del sacro, la resección en sí puede producir una severa inestabilidad lumbo pélvica.
Debe tenerse en cuenta que el eje transversal de rotación pasa por el segundo segmento sacro y este, en conjunto con el primero son los componentes principales de la estabilidad fisiológica. Estructuras ligamentosas fuertes conectan el sacro y el cóccix con la tuberosidad isquiática (ligamentos sacrotuberosos y al ilión (ligamentos sacroilíacos posteriores y sacroespinosos bilaterales), ellos juegan un importante papel en la estabilidad lumbopélvica y son una base sólida para la acción de los músculos del piso de la pelvis, de la función glútea y del complejo muscular perianal.
En la planificación quirúrgica deben tenerse en cuenta los siguientes elementos: la extensión de la lesión ósea en los segmentos sacros en sentido lateral y cráneo caudal, la localización de los componentes extraóseos, la penetración dentro del canal y la extensión lateral en los músculos glúteos. Es necesario evaluar la relación del tumor con los órganos retroperitoneales (vasos y el recto) y con los planos musculares posteriores, fascia y tejidos subcutáneos.
La cirugía está indicada en la inestabilidad espinal secundaria a destrucción ósea, cuando existe déficit neurológico progresivo, en tumores radioresistentes con aumento de tamaño, cuando hay necesidad de biopsia abierta y en casos de dolor refractario a tratamiento farmacológico. Sus objetivos son la resección amplia o en bloque del tumor y la reconstrucción espinal que permita la movilización precoz. Las técnicas quirúrgicas de acuerdo con los planos y abordajes incluyen el curetaje, la resección intralesional y en bloque.
La resección desde el punto de vista patológico puede ser: Intralesional, marginal (se diseca a través de la pseudocápsula) y amplia (se remueve la totalidad del tumor con la lámina de tejido sano adyacente). La exéresis intralesional tiene un fin paliativo y se acompaña de un alto índice de recurrencias.
Se describen diferentes abordajes al sacro 4, 20:
- Anteriores retroperitoneal y transperitoneal. El éxito de los abordajes anteriores está en ligar los vasos principales y exponer la cara anterior del tumor para ayudar a identificar el plano de clivaje.
- Posteriores. La mayoría de los autores utilizan el abordaje posterior simple para la mayoría de las resecciones altas, medias o bajas del sacro.
- Combinados. Estos últimos se prefieren en los tumores que involucran los órganos retroperitoneales, en casos de hemocorporectomía, sacrectomía total o en casos seleccionados de sacrectomías altas.
La sacrectomía completa a nivel de la primera vértebra sacra (S1) llevará consigo una pérdida inevitable de esfínteres, función sexual y alteraciones motoras. Si es unilateral se puede conservar parcialmente el control de esfínteres. La sacrectomía completa a este nivel produce una dislocación entre la columna y la pelvis, por lo que se requiere de técnicas de estabilización muy resistentes. Los sistemas más actuales son una modificación de las barras en L de Galveston utilizadas por Gokaslan, con tornillos pediculares y la conexión de un sistema de barras y tornillos pediculares a tornillos ileales (de unos 60 mm) de Jackson.
La afectación de la tercera vértebra sacra (S3) queda por debajo de la articulación sacroilíaca, puede realizarse mediante una vía combinada posterior-transperineal. En general no se asocia a déficit neurológico, no requiere estabilización, aunque puede acompañarse de disfunción sexual.
De manera general se acepta que en las lesiones por debajo de S3 o tumores sacros distales, el abordaje posterior es suficiente sin necesidad de reconstrucción, estabilización o sacrificio de la función esfinteriana. La cirugía es un poco más fácil ya que la osteotomía sacra se realiza por debajo de la unión sacroilíaca y menos invalidante porque las raíces de S3 pueden separarse.
En las lesiones por encima de S3 o tumores sacros altos se prefiere la combinación de los abordajes anterior y posterior, al permitir la exposición del contenido pélvico y la ligadura segura de los vasos iliacos internos. Esto disminuye el sangrado durante la movilización del tumor por vía posterior, además minimiza la recurrencia local. Casi siempre tienen indicación de sacrectomía completa, procedimiento que requiere cirugía vascular, gastrointestinal, plástica y reconstrucción de la articulación lumbopélvica. (Figura 1)
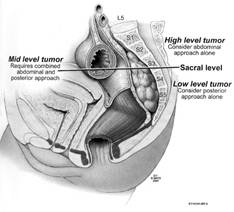
Figura 1. Relación de la localización del tumor para la selección del abordaje quirúrgico. Reproducido Hassan I 4
Durante la manipulación de las estructuras nerviosas es de utilidad el monitoreo electrofisiológico y radiológico transoperatorio 9,13.
Los tumores sacros se han dividido en dos grupos de acuerdo a su ubicación respecto a la línea media 4,9,13:
Primer grupo: Tumores de la línea media. Se subdividen de acuerdo con el nivel de las raíces afectadas en: Subgrupo bajo (sacrificio de S4), subgrupo medio: (sacrifican al menos S3 unilateral) y el subgrupo alto (sacrifican al menos S2 unilateral).
Cuando el plano de resección es alto puede realizarse sacrectomía total. Cuando el tumor se extiende del sacro a la columna lumbar, la resección extendida se llama hemicorporectomía o amputación translumbar.
Segundo grupo: Tumores excéntricos
Después de una sacrectomía parcial queda un gran defecto de tejidos blandos, con una comunicación entre la cavidad abdominal y el centro de la región glútea, que debe cerrarse para prevenir hematomas e infecciones profundas. Se han descrito múltiples técnicas para la reconstrucción de los tejidos blandos: Colgajos miocutáneos de los rectos del abdomen y adipomuscular de rotación de los glúteos máximos, así como la implantación de injertos alogenados, acelulares y de colágeno 21, 22.
Si se compromete la estabilidad espino pélvica, es necesaria la reconstrucción. Las indicaciones para la estabilización espinopélvica descritas por Gunterberg: sacrectomía total, sacrectomía parcial alta con resección de más de un 50 % de la articulación sacroilíaca a cada lado, son ampliamente aceptadas. También se recomienda después de una sacrectomía total con resección de la articulación sacroilíaca bilateral. Existen diferentes técnicas y sistemas de instrumentación para la estabilización lumbopélvica y de fusión como son: Injertos de tibia, peroné, aloinjertos o autoinjertos morselizados.
Técnicas percutáneas mínimamente invasivas 11, 23:
La vertebroplastia constituye un procedimiento alternativo en el tratamiento de determinadas lesiones neoplásicas del raquis que cursan con colapso vertebral.
Consisten en la introducción, de forma percutánea, a través del pedículo vertebral y guiada por Rx de material acrílico, efectuando en ocasiones el inflado previo de un balón en el cuerpo vertebral, de forma tal que se restituye la altura del cuerpo y la alineación sagital del raquis. Esta técnica requiere de la integridad de los elementos posteriores y de los pedículos. Se ha utilizado en las siguientes lesiones: Metástasis, mieloma, tumor de células gigantes y se reportan las siguientes ventajas: Disminuye el riesgo de colapso del cuerpo vertebral, se logra el alivio del dolor, actúan como agentes embolizantes en determinados tumores muy vascularizados y permite por la misma vía de acceso pedicular, la toma de biopsia.
Dentro de las contraindicaciones se encuentran: Discrasias sanguíneas, fracturas inestables, infecciones. Las complicaciones más frecuentes son el tromboembolismo pulmonar, la infección y la migración del cemento.
Se han empleado otros abordajes de mínima invasión como la resección laparoscópica y la microcirugía endoscópica transanal cuyos resultados están pendientes de mayor evidencia científica.
CONCLUSIONES
Los tumores que se originan de las estructuras de la región sacrococcígea no son frecuentes, por lo que no se piensa en ellos ante la aparición de síntomas inespecíficos de la espalda baja, lo que favorece el diagnóstico tardío. La resonancia magnética nuclear y la tomografía axial computarizada son los estudios confirmatorios más importantes. El cordoma, el quiste óseo aneurismático y el tumor de células gigantes, son los de mayor incidencia y generalmente alcanzan un gran tamaño, por lo que requieren de un tratamiento quirúrgico multidisciplinario. Su objetivo es lograr la resección total del tumor sin añadir mayor morbilidad. El diagnóstico histológico orienta el uso del resto de las modalidades terapéuticas. La efectividad del tratamiento multimodal puede garantizar el mejor pronóstico y la mayor supervivencia de los pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Sinelnikov RD. Estudio de los huesos, articulaciones y músculos. En: Atlas de Anatomía Humana. URSS: Editorial MIR; 1984.p:34- 39.
2. Testut L, Latarjet A. Médula espinal. En: Tratado de Anatomía Humana.España: Salvat Editores;1960.p:618- 19.
3. Brennan C, Kajal D, Khalili K, Ghai S. Solid malignant retroperitoneal masses—a pictorial review. Insights Imaging [Internet]. 2014 Feb [Cited: Jan 2015];5(1):53–65. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3948907/
4. Hassan I, Wietfeldt ED. Presacral Tumors: Diagnosis and Management. Clin Colon Rectal Surg [Internet]. 2009 May [cited: 2015 Jan];22(2):84–93. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2780241/
5. Neale JA. Retrorectal Tumors. Clin Colon Rectal Surg [Internet]. 2011 Sep [cited: 2015 Jan];24(3):149–160. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3311502/
6. Murphey MD, Andrews CL, Flemming DJ, Temple HT, Smith WS, Smirniotopoulos JG. From the archives of the AFIP. Primary tumors of the spine: radiologic pathologic correlation. Radiographics [Internet].1996 Sep [Cited: 2015 Jan ];16(5):1131-58. Available from:http://pubs.rsna.org/doi/pdf/10.1148/radiographics.16.5.8888395
7. Klekamp J, Samii M. Surgery of Spinal Tumors. Germany:Springer-Verlag;2007.
8. Varga PP, Bors I, Lazary A. Sacral Tumors and Management. Orthopedic Clinics of North America. 2009 jan [cited: 2015 Jan];40(1):105-23.Available from: http://www.sciencedirect.com/science/article/pii/S0030589808000734
9. Aebi M. Fundamentals of diagnosis and treatment. En: Boos N, Aebi M, editors. Spinal Disorders.Germany: Spinger Verlag; 2008.p:951-77.
10. Pongsthorn C, Ozawa H, Aizawa T, Kusakabe T,Nakamura T, Itoi E. Giant sacral schwannoma: A report of six cases. Ups J Med Sci [Internet]. 2010 May [cited: 2015 Jan]; 115(2):146–152. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2853793/
11. De Campos Gutiérrez JM, Vaquero Crespo J. Tumores Raquimedulares. Madrid: Editorial Universitaria Ramón Areces. Madrid; 2007.
12. Tonn JC, Westphal M, Rutka JT, Grossman SA. Neuro- Oncology of CNS Tumors. Germany: Spinger; 2006.
13. Mendel E. Tumors of the extradural spine. En: De Monte F, Gilbert MR, Mahajan A, McCutcheon I. Tumors of the brain and spine. New York:Springer; 2007. p: 274- 93.
14. Fischer G, Brotchi J. Intramedullary Spinal Cord Tumors. Germany; Thieme;1996.
15. Durrant DH, True JM. Myelopathy, Radiculopathy and Peripheral Entrapment Syndomes. New York CRC Press; 2002.p:155- 83.
16. McLain RF. Cancer in the spine. New Jersey :Humana Press; 2006.
17. Quraishi NA, Giannoulis KE, Edwards KL, Boszczyk BM. Management of metastatic sacral tumours. Eur Spine J [Internet]. 2012 Oct; 21(10):1984–93.Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3463705/
18. Nakanishi K, Osuga K, Hori S, Hamada K, Hashimoto N, Araki N, et al. Transarterial embolization (TAE) of sacral giant cell Tumor (GCT) using spherical parmanent embolic material superabsorbant polymer microsphere (SAP-MS). Springerplus [Internet]. 2013 Dec;2:666. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3866374/
19. Neale JA. Retrorectal Tumors. Clin Colon Rectal Surg [Internet]. 2011 Sep [cited: 2015 Jan]; 24(3):149–160. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3311502/
20. Bullard K. Retrorectal Tumors. Surgical Clinics of North America [Internet]. 2010 [cited: 2015 Jan];90(1):163-71. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20109640
21. Weitao Y, Qiqing C, Songtao G, Jiaqiang W. Use of gluteus maximus adipomuscular sliding flaps in the reconstruction of sacral defects after tumor resection. World J Surg Oncol [Internet]. 2013 [cited: 2015 Jan]; 11: 110. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3664623/
22. Li D, Guo W, Qu H, Yang R, Tang X, Yan T, et al. Experience with wound complications after surgery for sacral tumors. Eur Spine J [Internet]. 2013 Sep [cited: 2015 Jan]; 22(9):2069–76. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3777066/
23. Agarwal V, Sreedher G, Weiss KR, Hughes MA. Sacroplasty for Symptomatic Sacral Hemangioma: A Novel Treatment Approach. Interv Neuroradiol [Internet]. 2013 Jun [cited: 2015 Jan]; 19(2): 245–249. Available from: http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3670066/
Recibido: 2015-08-07
Aprobado: 2015-11-12
Dr.C.Gretel Mosquera Betancourt. Hospital Universitario Manuel Ascunce Domenech. Camagüey. Cuba.














