Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Gaceta Médica Espirituana
versión On-line ISSN 1608-8921
Gac Méd Espirit vol.19 no.2 Sancti Spíritus may.-ago. 2017
Universidad de Ciencias Médicas. Sancti Spíritus
REVISIÓN BIBLIOGRÁFICA
La industria farmacéutica y la promoción de los medicamentos. Una reflexión necesaria
The pharmaceutical industry and the promotion of medicines. A reflection required
Dra. Grisel Viña-PérezI, Lic. Francisco Debesa-GarcíaII.
I Departamento de Farmacoepidemiología.Dirección Nacional de medicamentos y Tecnología médica.Minsap.Ciudad de La Habana.Cuba.
II Dirección de investigaciones clínicas.Grupo de evaluación de tecnologías sanitarias.Centro de Inmunología Molecolar.Ciudad de La Habana.Cuba.
RESUMEN
Fundamento: La industria farmacéutica a nivel internacional tiene entre sus estrategias la propaganda de medicamentos directa al consumidor, para incrementar sus ganancias.
Objetivo: Valorar cómo puede influir la promoción inadecuada en el uso racional de medicamentos y como se presenta en Cuba.
Metodología: Se realizó una búsqueda de información, en fuentes primarias y secundarias, sobre promoción y uso no adecuado de los medicamentos.
Resultados: Se encontró que la propaganda realizada de manera directa al consumidor genera un aumento de las ventas de los productos anunciados, lo cual hace de la promoción una herramienta esencial de marketing para la industria farmacéutica internacional, situación que no es uniforme, sino que varía de un país a otro con un denominador común: las anomalías mayores presentes en los países en desarrollo. La Organización Mundial de la Salud en 1988 publicó los “Criterios éticos para la promoción de medicamentos”, los cuales sirven de base para elaborar regulaciones sanitarias por parte de las autoridades nacionales de salud que permitan garantizar la calidad, seguridad y eficacia de los medicamentos.
Conclusiones. El trabajo conjunto entre autoridades sanitarias, profesionales de la salud y pacientes permitirá lograr un uso adecuado de los medicamentos sin el sesgo que conllevan los mensajes promocionales.
Palabras clave: Industria farmacéutica y ética; ética farmacéutica; control de la publicidad de productos¸ publicidad de medicamentos; tecnología farmacéutica y ética; preparaciones farmacéuticas; medicamentos sin prescripción.
DeCS: INDUSTRIA FARMACÉUTICA/ética; ÉTICA FARMACÉUTICA; CONTROL DE LA PUBLICIDAD DE PRODUCTOS; TECNOLOGÍA FARMACÉUTICA/ética; PREPARACIONES FARMACÉUTICAS.
ABSTRACT
Background: The drug industry at the international level has among its strategies the promotion of medicines directly to the consumer, to increase their profits.
Objective: Value how inappropriate promotion can influence the rational use of drugs and the way it is presented in Cuba.
Methodology: An active search was conducted in primary and secondary sources of information in indexed journals on promotion and inappropriate use of medicines.
Results: It was found that the promotion carried out directly to the consumer generates an increase in sales of the products announced, which makes of promotion an essential marketing tool for the international drug industry, a situation that is not uniform, but varies from one country to another with a common denominator; the major anomalies present in developing countries. The WHO (World Health Organization) in 1988 published the "Ethical criteria for the promotion of medicines", which serve as the basis for the elaboration of sanitary regulations by the health authorities in each country.
Conclusions: Only the joint work between health authorities, health professionals and patients can achieve an adequate use of medicines without the twist that carry the promotional messages.
Keywords: Drug industry and ethics; ethics, pharmacy; products publicity control; drug publicity technology, pharmaceutical and ethics; pharmaceutical; nonprescription.
MeSH: DRUG INDUSTRY/ethics; ETHICS PHARMACY; PRODUCTS PUBLICITY CONTROL; DRUG PUBLICITY; TECHNOLOGY PHARMACEUTICAL /ethics; PHARMACEUTICAL PREPARATIONS.
INTRODUCCIÓN
Se ha observado un gran avance de la medicina con su consecuente mejora en la expectativa de vida en el siglo XX, el incremento en más de 15 años en la longevidad media en los Estados Unidos y países desarrollados de Europa, de los cuales alrededor de cinco se atribuyen a los avances en salud pública y desarrollo de nuevas tecnologías sanitarias 1, entre las que se destaca el medicamento como el insumo médico más consumido y sin techo aparente de gastos, el cual en diferentes mediciones internacionales alcanza entre el 40 y el 50% del presupuesto sanitario2, muy por encima de la tecnología diagnóstico-terapéutica y del recurso humano y con un marcado carácter comercial por parte de las grandes transnacionales de la industria farmacéutica.En 1988 la Organización Mundial de la Salud (OMS) publicó los "Criterios éticos para la promoción de medicamentos" con el propósito de garantizar que las actividades de marketing fueran compatibles con la búsqueda de la verdad y la rectitud que deben guardar la promoción y la publicidad farmacológica3. Más adelante emitió otros pronunciamientos dirigidos a fortalecer la normativa sobre la promoción de medicamentos -y su cumplimiento- así como un llamado de atención acerca de la promoción, publicidad y venta transfronteriza de productos médicos en internet, donde ya se habían detectado prácticas éticamente inaceptables4-6.
La transparencia de la promoción farmacéutica, entendida como veracidad y responsabilidad en la divulgación, busca que los consumidores estén bien informados tanto sobre los beneficios como sobre los posibles riesgos relacionados con los fármacos que se les están prescribiendo7. Tal premisa parte del supuesto que los pacientes en general no tienen conocimientos suficientes como para discernir la veracidad de un mensaje publicitario sobre medicamentos8,9.
Las restricciones a la publicidad directa de medicamentos con receta hacen que, a veces, se recurra a otras vías para llegar a los consumidores, ejemplo de ello son las campañas encubiertas de promoción de un fármaco para ser usado en indicaciones para las que aún no ha sido autorizado, campañas que se realizan mediante la divulgación de estudios, visitas médicas, conferencias de expertos, congresos y opiniones de médicos especialistas y líderes de opinión; lo cual constituye una estrategia de promoción y mercadeo usada por los grandes laboratorios farmacéuticos a nivel internacional para aumentar la prescripción y por consiguiente sus ganancias 9.
El medicamento no es un bien de consumo y su utilización debe responder a criterios científicos. También conviene tener claro que toda actuación terapéutica conlleva un gasto, sobre todo si este se realiza en un sistema con recursos limitados.
DESARROLLO
Fuente de datos
Se realizó una revisión bibliográfica y documental sobre la promoción de la industria farmacéutica, el uso racional y las regulaciones sanitarias, así como una búsqueda en internet que incluyó los sitios de la OMS/OPS y agencias reguladoras de medicamentos, empleándose para ello el modelo Big6, como modelo de competencias en el uso y manejo de la información10. Se emplearon como palabras clave para la estrategia de búsqueda: Uso racional, medicamentos, promoción de medicamentos, regulación farmacéutica sobre medicamentos, rational use, drugs, drug promotion, pharmaceutical regulation on drug.
Se revisaron las bases de datos PubMed, Cochrane, Lilacs, Ebsco y SciELO así como revistas nacionales e internacionales que publican estudios relacionados con el tema objeto de estudio con el propósito de valorar cómo puede influir la promoción inadecuada en el uso racional de medicamentos y como se presenta en Cuba.
Uso racional de medicamentos
La OMS definió desde el año 1985 el uso racional de medicamentos, entendido como la prescripción de la medicación adecuada, en dosis correspondientes a cada necesidad, durante el tiempo necesario y al menor coste posible para el paciente y para la comunidad11. Esta definición incluye aspectos clínicos, farmacológicos, sociales y económicos y tiene fuertes implicaciones éticas12.
Por otra parte, la prescripción y uso de los medicamentos es cambiante, al aparecer cada año nuevos fármacos en el mercado; pocos de ellos se consideran verdaderos avances, los cuales son en su mayoría pequeñas modificaciones de las terapéuticas existentes; en su totalidad tapados por el velo de la novedad y de los gastos de investigación, desarrollo y producción que condicionan y justifican los elevados precios9.
Si bien gran parte de las regulaciones de la industria farmacéutica establecen que la promoción y publicidad en medios de comunicación masiva deben limitarse a los medicamentos de venta libre (MVL) y las prohíben explícitamente para los de venta con prescripción médica (MVP), las ambigüedades presentes en las definiciones de promoción, publicidad y lo que constituye información médica pueden y suelen dar paso a actividades de difusión comercial masiva disimulada.13
La relación con los medicamentos puede ofrecer dos facetas contradictorias:
- Una de ellas es la bondad o el beneficio de su empleo por las razones correctas y en la forma adecuada, conocida como la relación beneficio-riesgo, donde el prescriptor debe evaluar que el balance entre la aparición de efectos adversos al tratamiento y los aspectos beneficiosos del mismo se incline más hacia los beneficios.
- La otra faceta la constituyen los daños o perjuicios que puede provocarnos el uso injustificado, no fundamentado, no indicado o en condiciones inapropiadas.
¿Qué situaciones podrían tomarse como generadoras del uso no adecuado de los medicamentos?
- El autodiagnóstico, es decir, que las mismas personas determinen cuál es el “problema de salud” que los aqueja; en este caso cualquier solución que busque cada individuo a un problema mal identificado, es una mala solución15.
- La elección de un medicamento no indicado por el médico para una dolencia bien diagnosticada; aquí el problema de origen está identificado, pero no se ha optado por la solución correcta15.
- Cuando una persona se decide por un medicamento para tratar una afección “parecida o igual a la que ha sufrido alguna persona conocida o allegada”; en este caso, se parte del supuesto que son iguales o equivalentes los pacientes y las afecciones y también sus soluciones; esto no es necesariamente así, pues como es conocido tanto el diagnóstico como el tratamiento deben ser individualizados15.
- La opción personal de realizar tratamientos preventivos sin los asesoramientos y conceptos básicos necesarios para emprenderlo con seguridad: Se evitarían posibles problemas con posibles soluciones muy poco precisas15.
- Cuando ante lo indicado por el médico los pacientes se apartan de alguno de los elementos recomendados en cuanto al cumplimiento de dosis, horario para ello, duración del tratamiento, su relación con las comidas, con otros medicamentos o medicina natural. Se manifiesta que ante una correcta identificación del problema y la propuesta de una solución o ayuda correcta, los pacientes no cumplen satisfactoriamente15.
En todos los casos vistos anteriormente el denominador común podría ser la falta de una información correcta, por lo tanto un elemento imprescindible sería satisfacer las necesidades de asesoramiento o aclaración de dudas existentes a la hora de indicar un tratamiento con medicamentos, por parte del prescriptor y del dispensador.
Las principales fuentes de obtención de información para el paciente podrían ser: 12
En una esfera muy próxima al paciente:
- El personal del sistema de salud: el médico o estomatólogo responsable de la prescripción, la enfermera responsable de la administración, el farmacéutico responsable de la dispensación, la atención farmacéutica y otros aspectos relacionados con el medicamento en los servicios de farmacia.
- La institución de salud en que se da asistencia médica.
En una esfera más general:
- Las Agencias Reguladoras Nacionales y el Ministerio de Salud Pública.
Por último y no por ello menos importante se debe considerar la influencia que sobre los pacientes ejerce la publicidad de la industria farmacéutica y los medios masivos de comunicación y las intervenciones educativas15,16.
Investigaciones en el entorno internacional
En los últimos años, investigaciones realizadas en Estados Unidos, Canadá, Australia, Nueva Zelandia, España y Brasil revelan hallazgos preocupantes relacionados con la publicidad de fármacos en los medios de comunicación masiva17-,22; también se ha señalado que la propaganda farmacológica directa al consumidor genera un aumento de las ventas de los productos anunciados23. La información difundida por estos medios, entonces, puede incidir no solo en la idoneidad de la práctica médica, sino además en la salud y el bienestar del paciente, así como en los costos de la atención, los cuales son generalmente asumidos por el gobierno o por el mismo paciente, sea mediante su cobertura médica o con dinero de su propio bolsillo 8,24, 25.
En este sentido, la publicidad farmacéutica podría violar ciertos principios éticos cuando trasmite afirmaciones falsas sobre los fármacos, suprime u olvida informaciones sobre los riesgos y efectos secundarios, proporciona beneficios materiales (viajes, regalos y otros) o financieros a los médicos para que los prescriban, y utiliza la información sobre las enfermedades para promover los medicamentos y no para promover la salud26-28. Es evidente que esta situación no es uniforme, sino que ella varía de un país a otro con un denominador común: las mayores anomalías se dan en los países en desarrollo.
La OMS establece una serie de normas para la promoción ética de los medicamentos pero las mismas no tienen una obligación legal29. Según la OMS la promoción de medicamentos debe ser precisa, veraz y demostrable, y no debe dar lugar a una utilización incorrecta o implicar riesgos innecesarios. La información sobre los medicamentos dirigida a los profesionales de la salud debe ser compatible con las pruebas y los resultados científicos demostrados y aprobados. La información proporcionada al paciente debe ser redactada en términos comprensibles y reflejar adecuadamente los conocimientos médico-farmacológicos de acuerdo con las normas éticas3. La legislación sanitaria debe tener en cuenta esta problemática con el objetivo de perfeccionar esta información dentro del respeto a los aspectos éticos de la promoción30.
En materia de riesgo, no se debe aceptar que un producto farmacéutico siga siendo comercializado si los resultados de los estudios demuestran que tiene efectos nocivos graves para la salud; es evidente que debe ser inmediatamente retirado del mercado cumpliendo con el principio de no maleficencia señalado en el artículo 4 de la Declaración Universal sobre Bioética y Derechos Humanos31.
El principio de no maleficencia debe tener en cuenta el respeto del equilibrio daño-beneficio; cuando este equilibrio se rompe en razón de un beneficio mínimo o un riesgo elevado es éticamente inaceptable. Entre los casos más conocidos están el del rofecoxib (Vioxx®) y el benflorex (Mediator®). El Vioxx® fue comercializado en 1999 y retirado del mercado en septiembre de 2004 debido a los efectos nocivos graves que provocaba. Sin embargo, sus efectos graves se conocían desde el año 2002. Según un estudio realizado en los Estados Unidos de Norteamérica, el rofecoxib ha causado entre 88 000 y 140 000 casos de enfermedades coronarias. Los pacientes tratados con este fármaco presentaron un riesgo coronario multiplicado por 1,34 en relación con aquellos tratados con analgésicos convencionales. Este riesgo se presentaba a partir del tercer mes de tratamiento con el rofecoxib. A pesar de existir estas evidencias, hubo dificultades para publicar los resultados de estas investigaciones 24.
En Francia el benflorex (Mediator®) es un anfetamínico comercializado en 1976 y retirado del mercado en noviembre de 2009. Los primeros indicios de efectos nocivos graves (lesiones graves de las válvulas cardíacas, hipertensión pulmonar) fueron publicados en 1997. Este mismo año, el benflorex fue retirado del mercado norteamericano, sin embargo, continuó su comercialización en otros países, especialmente en Francia. Esta extensa e intensa comercialización ha provocado una catástrofe sanitaria: 500 a 1000 personas fallecidas a causa de sus efectos nocivos graves24.
Otro ejemplo de esta situación fue publicado en la prestigiosa revista JAMA donde se evidencia el peligro de los antioxidantes, uno de los “grupos farmacológicos” más promocionados y de más venta en el mundo, mediante la más grande revisión sistemática publicada que abarcó 68 ensayos clínicos (E.C) con una n = 232 606 sujetos, revelando que los beta carotenos y las vitaminas A y E se asocian con un incremento de la mortalidad del 7 %, 16 % y 4 % respectivamente32 y el caso de la advertencia realizada por la Administración de Medicamentos y alimentos de los Estados Unidos (FDA) a las farmacéuticas norteamericanas Eli Lilly, Pfizer, GlaxoSmithKline (GSK), Cephalon.inc33 y la subsidiaria de Bayer en los EE.UU por estar haciendo declaraciones inexactas e incompletas al promover sus medicamentos34.
Las noticias sobre salud
El papel de los medios de comunicación es crucial en la difusión de la información sobre medicamentos y nuevos tratamientos. Toda la información que gira en torno al mundo del medicamento afecta de una u otra forma a los ciudadanos, a la industria farmacéutica, a los médicos, a las autoridades sanitarias y a otros agentes relacionados con los fármacos35.
La opinión de los ciudadanos sobre los medicamentos se basa, generalmente, en lo que leen o escuchan en los medios (incluyendo internet). A partir de esta información, los enfermos pueden llegar a tomar importantes decisiones que afectan su salud. En ocasiones, los recortes de prensa o la información de internet son el punto de partida para que el paciente valore con el médico las posibilidades terapéuticas de su enfermedad35.
Para los médicos, también los medios de comunicación son a menudo el primer punto de acceso a la información sobre los resultados de la investigación con medicamentos y las novedades terapéuticas, aunque no tanto de su especialidad como del conjunto de la medicina.
En lo que respecta a las autoridades reguladoras de medicamentos, las noticias aparecidas en los medios también pueden tener importantes efectos. En concreto, las informaciones periodísticas pueden ser utilizadas por la industria farmacéutica o las asociaciones de pacientes (muchas de ellas creadas y financiadas por la propia industria) como herramienta de presión para forzar la aprobación de una nueva indicación terapéutica o acortar los plazos de evaluación. El caso de los primeros fármacos contra el sida es un buen ejemplo; pero este problema también afecta a las vacunas, los medicamentos para el cáncer y algunos antibióticos, entre otros35.
Por su parte, para la industria farmacéutica la información sobre fármacos es un vehículo importante para el conocimiento y la difusión comercial de sus productos, aunque puede ser también un arma de doble filo cuando la noticia llama la atención sobre los posibles riesgos de algún tratamiento. Para muchos laboratorios, los medios de comunicación son una herramienta de marketing que, bien utilizada, sirve para promocionar sus productos entre los consumidores y aumentar los beneficios de la compañía36.
Desde la segunda mitad el siglo XX la noticia científica logró superar su casi permanente ubicación en revistas especializadas o su exclusiva exposición en reuniones académicas, para alcanzar con presencia creciente un lugar en los medios informativos para el gran público. En este terreno, los temas de salud podrían convertirse en una noticia que podría afectar a todos si no se lleva un rigor científico sobre lo que se publica37.
La veracidad de los datos publicados es un asunto que preocupa a varios especialistas. En un estudio de la Escuela de Periodismo y Medios de Comunicación de la Universidad de Minnesota, se analizó una muestra de la prensa norteamericana para determinar cuáles son los errores más frecuentes en la información sobre ciencia, salud y tecnología. Los resultados se expresan en la tabla 1.
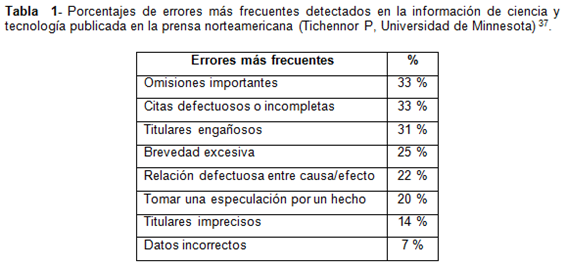
Los especialistas en comunicación afirman que la industria farmacéutica muestra claras evidencias de su interés en difundir distintos tipos de “mensajes” al público general a través de los medios masivos y que de hecho lo concretan. De esta forma, las compañías tratan de encontrar vías alternativas para promocionar sus productos, teniendo en cuenta las restricciones que existen en muchos países para publicar sobre medicamentos en revistas no médicas, sobre todo cuando se trata de medicamentos de venta bajo receta médica37.
Un grupo de médicos norteamericanos, analizó cómo se “traducen” los trabajos de investigación clínica en comunicados de prensa para convertirse potencialmente en noticias. De los 127 casos analizados, solo en el 23 % se detallaron las limitaciones del estudio, y en el 22 % se mencionó que se trataba de un estudio desarrollado por una empresa farmacéutica. Otro dato interesante es que en el 35 % de los casos los resultados alcanzados se expresaron cualitativamente, sin agregar los porcentajes o datos numéricos que permitieran cuantificar los mismos37.
Regulación y promoción farmacéutica
En general, las regulaciones de los países sobre publicidad de medicamentos toman como referencia los criterios éticos de la OMS13,38,39.
En varios estudios se ha puesto de manifiesto la ausencia de algunos criterios claves para la prevención y minimización de riesgos y protección de los consumidores, así como ambigüedades en el uso de algunos términos; por ejemplo, en algunas regulaciones las definiciones de promoción, publicidad e información médica podrían facilitar la difusión masiva de promoción de forma disimulada; esta ambigüedad ha sido identificada lo que ha dado origen a recomendaciones dirigidas al fortalecimiento del papel del Estado en el control de la publicidad y promoción (P y P) de medicamentos9,40.
Las revistas médicas, consideradas el vehículo más serio y seguro para trasmitir conocimientos médicos documentados, también han sido objeto de diversas críticas.
Un artículo publicado por el periódico Los Angeles Times en 1999, refería que la famosa revista médica New England Journal of Medicine (NEJM) había violado su propia política numerosas veces en los últimos años publicando artículos de investigadores que tenían vínculos con compañías farmacéuticas y no se habían revelado potenciales conflictos de intereses41.La propia revista NEJM había publicado en 1988 un reporte que revelaba que casi todos los investigadores que defendieron la eficacia de los bloqueadores de los canales de calcio en el tratamiento de la hipertensión arterial habían tenido vínculos con las compañías productoras de medicamentos40,41.
En el propio año de 1999 la revista Western Journal of Medicine revelaba que en un estudio realizado sobre un grupo de revistas médicas de gran prestigio y alto impacto como Journal of the American Medical Association (JAMA), NEJM y otras, se puso de manifiesto que habían recibido ingresos estimados, entre $ 715 000 y 18 millones de dólares anuales42 por concepto de anuncios farmacéuticos. Es de imaginarse el grado de dependencia que pueden tener las revistas con patrocinadores que aportan 18 millones de dólares en un año.
La promoción de medicamentos en Cuba
En el caso de Cuba la promoción de los medicamentos está regida por el reglamento para la vigilancia de medicamentos de uso humano durante la comercialización del año 2007, del Centro para el Control Estatal de los Medicamentos, Equipos y Dispositivos Médicos (Cecmed), en su condición de autoridad reguladora de medicamentos de Cuba, que en su capítulo V, artículos 19, 20 y 21, plantea43:
ARTÍCULO 19.- El Cecmed determinará y fijará los lineamientos de la política de promoción de los medicamentos de uso humano considerando a quien va dirigida, el medio de difusión utilizado, los criterios éticos para la promoción de medicamentos recomendados por la OMS y otras regulaciones afines.
ARTÍCULO 20.- El Cecmed realizará la vigilancia de la promoción de los medicamentos de uso humano durante la comercialización.
ARTÍCULO 21.- La promoción que se realice tiene que ser consistente con la información aprobada en el Registro Sanitario y las normativas vigentes sobre promoción de medicamentos. Los productos que no cuenten con su respectivo Registro Sanitario u otra forma de autorización del Cecmed que incluya la información al público en general y a personal especializado, no pueden ser objeto de promoción en ninguna de sus modalidades.
A pesar de estas regulaciones y del enfoque humanístico de la industria farmacéutica cubana, dirigida a satisfacer necesidades de un sistema de salud gratuito y universal, no se ha estado exento en los últimos años de algunas noticias que promocionan productos con indicaciones no autorizadas o fraudulentas, la inmensa mayoría fuera de Cuba.
El Cecmed mantiene un control estricto sobre este tipo de acciones tomando las medidas necesarias de comunicación y gestión de riesgo para evitar que surja en el país este tipo de publicidad44.
CONCLUSIONES
El Minsap y el Cecmed han tenido un papel muy importante en que no exista en Cuba el fenómeno de promoción de medicamentos como medio de ganancia de la industria farmacéutica, es importante que estas entidades mantengan las exigencias en sus disposiciones reguladoras y la vigilancia sobre el uso de los medicamentos.
Los profesionales y técnicos de la salud deben velar por el buen uso de los medicamentos cumpliendo con las buenas prácticas de prescripción y dispensación.
Los pacientes contrariamente a lo que muchas veces se piensa también juegan un rol esencial en el uso racional de los medicamentos, tienen la responsabilidad, como consumidores, de no automedicarse y acudir al médico ante cualquier situación de salud.
Es importante terminar haciendo énfasis en la importancia que tiene para la población la información y el conocimiento sobre los medicamentos que consume; sin olvidar la importancia de que sea un profesional capacitado quien brinde la información correcta y que esta información no debe ser recibida por los pacientes mediante la publicidad u otras personas que no están debidamente preparadas; toda información dirigida a los pacientes deberá estar basada en la definición de uso racional de medicamentos ofrecida por la OMS.
REFERENCIAS BIBLIOGRÁFICAS
1. CDC. Ten great public health achievements - United States, 1900–1999. MMWR Morb Mortal Wkly Rep [Internet]. 1999. [citada 7 may 2017];48(12):241-3. Disponible en: https://www.cdc.gov/mmwr/preview/mmwrhtml/00056796.htm
2. Cortesi MC Bioética del uso racional del medicamento. [Internet]. [Publicado: 2012 may 27; citado 18 may 2017]. Disponible en: http://farmaysalud.blogspot.com/2012/05/bioetica-del-uso-racional-del.html
3. OMS. Criterios éticos para la promoción de medicamentos (Resolución WHA 41.17). En: Serie Red PARF- Documento Técnico Nº 12. Ginebra: OMS;1988. [Internet]. [citado 18 may 2017]. Disponible en: http://apps.who.int/medicinedocs/documents/s22161es/s22161es.pdf
4. OMS. Promoción, publicidad y venta transfronterizas de productos médicos por internet (Resolución WHA 51.9). Ginebra: OMS; 1998. [citado 14 may 2017]. Disponible en: http://apps.who.int/medicinedocs/documents/s21471en/s21471en.pdf
5. Chilet-Rosell E, Llaguno MM, Cantero MT, Alonso-Coello P. Hormone replacement therapy advertising: sense and nonsense on the web pages of the best-selling pharmaceuticals in Spain. BMC Public Health [Internet]. 2010 [citado 14 de mayo de 2017];10:134 Disponible en: https://bmcpublichealth.biomedcentral.com/articles/10.1186/1471-2458-10-134
6. OMS. Uso racional de los medicamentos: progresos realizados en la aplicación de la estrategia farmacéutica de la OMS. Reunión 118 del Consejo Ejecutivo, Informe de la Secretaría (Reporte No.: EB118/6; 2006). Ginebra: OMS; 2006. [citado 14 may 2017]. Disponible en: http://apps.who.int/gb/archive/pdf_files/EB118/B118_6-sp.pdf
7. Consumers-International. La salud patentada. La perspectiva del consumidor sobre la RSE, la promoción de medicamentos y la industria farmacéutica en Europa. Londres: Consumers-International;2006. Disponible en: http://www.consumersinternational.org/media/286105 /salud_patentada.pdf
8. Martínez-Salcedo J C. Derecho comunitario europeo sobre la publicidad y su transposición al derecho español. Opinión Jurídica [Internet]. 2016[citado 17 de abril 2017];15(29):101-22. Disponible en: http://www.redalyc.org/articulo.oa?id=94545771006.
9. Vacca C; Vargas C; Cañás M; Reveiz L. Publicidad y promoción de medicamentos: Regulaciones y grado de acatamiento en cinco países de América Latina. Rev. Panam Salud Pública [Internet]. 2011 [citado 17 de abril 2017];29(2). Disponible en: http://www.scielosp.org/pdf/rpsp/v29n2/a02v29n2.pdf
10. Eduteka.Icesi.Edu [Internet]. Colombia: El modelo Big6 para la solución de Problemas de Información. [aprox. 21p.]. Disponible en: http://eduteka.icesi.edu.co/modulos/1/165/37/1OMS. Medicamentos Esenciales y Productos de Salud. Ginebra:OMS;2017. Disponible en: http://eduteka.icesi.edu.co/modulos/1/165/37/1OMS.
11. Ingmar Buffo-Sequeira I, Arroyo-Castelán E, Halabe-Cherem J, Monroy-Saint Martin M. El médico y la relación con la industria farmacéutica. Rev CONAMED [Internte].2012 [citada: 2017/04/16];17(4):182 -86. Disponible en: http://www.dgdi-conamed.salud.gob.mx/ojs-conamed/index.php/revconamed/article/view/322/596
12. Delgado Fagundes MJ, Gomes Alves Soares M, Diniz NM, Ribeiro Pires J, Volnei Garrafa. Análise bioética da propaganda e publicidade de medicamentos Ciência & Saúde Coletiva[Internte]. 2007[citada: 2017/04/16];12(1):221-9. Disponible en: http://www.scielo.br/pdf/%0D/csc/v12n1/21.pdf
13. Ministério da Saúde, Brasil. Estudo comparado regulamentação da propaganda de medicamentos. Basilia-DF: Ministério da saúde; 2005. Disponible en: http://www.ccs.saude.gov.br/visa/publicacoes/arquivos/Estudo_comparado_propaganda.pdf
14. Zevallos Escobar LE. Metaanálisis de una intervención educativa para el uso adecuado de Medicamentos, 2014. In Crescendo. Ciencias de la Salud [Internet]. 2016 [Citado 27 mar 2017]; 3(2): 30-40. Disponible en: http://revistas.uladech.edu.pe/index.php/increscendo-salud/article/view/1418/1100
15. García Milian AJ. Caracterización epidemiológica del consumo de medicamentos por la población adulta de Cuba. 2007- 2010. [Tesis presentada en opción al grado científico de doctor en ciencias de la salud]. La Habana: Escuela Nacional Pública; 2011. Disponible en: http://files.sld.cu/revsalud/files/2013/03/tesisanajuliagarcia.pdf
16. Ministerio de salud de chile. Uso racional de medicamentos: Una tarea de todos. Santiago de Chile: Minsal;2010. Disponible en: http://web.minsal.cl/portal/url/item/8da19e5eac7b8164e04001011e012993.pdf
17. Heinrich J. US Prescription drugs. FDA Oversight to direct-to-consumer advertising has limitations. Report to Congressional Requesters. Washington: GAO; 2002. Disponible en: http://www.gao.gov/new.items/d03177.pdf
18. Woloshin S, Schwartz LM, Tremmel J, Welch HG. Direct-to-consumer advertisements for prescription drugs: what are Americans being sold. Lancet [Internet]. 2001 [citado 26 mar 2017]; 358:1141–6. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/11597668
19. Cassels A, Hughes MA, Cole C, Mintzes B, Lexchin J, McCormack JP. Drugs in the news: an analysis of Canadian newspaper coverage of new prescription drugs. CMAJ [Internet]. 2003 [citado 28 mar 2017]; 168: 1133–7. Disponible en: http://www.cmaj.ca/content/168/9/1133.full.pdf+html
20. Toop L, Mangin D. The impact of advertising prescription medicines directly to consumers in New Zealand: lessons for Australia Aust Prescr [Internet]. 2006 citado 7 de mayo 2017];29:30-2. Disponible en: https://www.nps.org.au/australian-prescriber/articles/the-impact-of-advertising-prescription-medicines-directly-to-consumers-in-new-zealand-lessons-for-australia
21. Cajigas de Acosta BE. Publicidad de medicamentos. Responsabilidad frente a la Salud Pública. Revista ANDA [Internet]. 2017. [citado 25 may 2017]; 44(397). Disponible en: http://www.andacol.com/index.php/72-revista-anda/revista-anda-44/397-publicidad-de-medicamentos-responsabilidad-frente-a-la-salud-publica
22. Domosbian D. Seminario del Instituto de Investigaciones Farmacológicas. Publicidad de medicamentos en los medios: una cuestión preocupante. Disponible en: http://www.essentialdrugs.org/efarmacos/archive/200405/msg00037.php
23. Kravitz RL, Epstein RM, Feldman MD, Franz CE, Azari R, Wilkes MS, et al. Influence of patients requests for direct-to-consumer advertised antidepressants a randomized controlled trial. JAMA [Internet]. 2005 [citado 27 de abril 2017]; 293:1995–2002. Disponible en: http://jamanetwork.com/journals/jama/fullarticle/200780
24. Acción Internacional para la Salud Latinoamérica & Caribe (AIS). Conflicto de intereses: un asunto siempre presente. Perú: AIS;2007. Disponible en: http://www.aislac.org/
25. Alonso V. Consumo de medicamentos y equidad en materia de salud en el Área Metropolitana de Buenos Aires, Argentina. Rev Panam Salud Pública [Internet]. 2003; [citado 29 de abril 2017] 13(6):400–6. Disponible en: http://iris.paho.org/xmlui/handle/123456789/842
26. Raúl Pesquera-Cabezas R, López-López LM. ¿Es ética la promoción farmacéutica en el Perú? Gac Sanit [Internet]. 2016 [2017/07/24];30(2):158–162. Disponible en: http://dx.doi.org/10.1016/j.gaceta.2015.11.005
27. Rizwan Raheem Ahmed, Ahmad Saeed. Pharmaceutical Drug Promotion Practices in Pakistan:Issues in Ethical and Non-Ethical Pharmaceutical Practices.Middle-East Journal of Scientific Research [Internet]. 2014[citado 29 de abril 2017];20(11):1630-40. Disponible en: http://www.idosi.org/mejsr/mejsr20(11)14/54.pdf
28. Facua-Org. La promoción no ética de medicamentos', eje del Día Mundial de los Derechos de los Consumidores. España: Facua-.Org;2007. [Internet] [Publicado-14/3/2007]. Disponible en: https://www.facua.org/es/noticia.php?Id=1712
29. Ávila A. Determinantes relacionados con la tenencia de medicamentos y su uso racional. [Tesis doctoral]. Bellaterra: Universidad autónoma de Barcelona; 2011. [Internet]. Disponible en: http://www.tdx.cat/bitstream/hand-le/10803/48519/aa1de1.pdf?sequence=1
30. La Rosa E. Bioética, medicamentos, conflicto de intereses y control de calidad. Rev Derecho PUCP [Internet] 2012. [citado 2017 mar 25];(69). Disponible en: http://revistas.pucp.edu.pe/index.php/derechopucp/article/view/4275/4247
31. Unesco. Declaración Universal sobre Bioética y Derechos Humanos. Paris: Unesco; 2005. [Internet]. [citado 2017 mar 25]. Disponible en: http://unesdoc.unesco.org/images/0014/001428/142825s.pdf#page=85
32. La farmacéutica Cephalon pagará US$425 millones y se declarará culpable de venta de medicamentos para usos no aprobados. EE.UU : Oficial. Departamento de Justicia; 2008. [publicado: 2008/09/20]. [Internet]. Disponible en: https://www.usdoj.gov/opa/pr/2008/September/08-civ-860-spanish.htm
33. No.Gracias. [Internet]. Unión Europea: Industria farmacéutica: corrupción contra la salud y los presupuestos públicos. [Publicado: 31 Marzo 2016]. Disponible en: http://www.nogracias.eu/2016/03/31/industria-farmaceutica-corrupcion-contra-la-salud-y-los-presupuestos-publicos
34. Casino G. Los medicamentos en los medios de comunicación. Evaluación crítica de la situación actual. [Internet]. [citado 2017 mar 25]. Disponible en: https://www.upf.edu/pcstacademy/_docs/2007_casino.pdf
35. Forner S, Santos Da Silva M, Stolf Brzozowski F. Publicidad de medicamentos, automedicación y ética farmacéutica: una Tríada Farmacéutica. España: Salud y Fármacos;2012. [Internet] [publicado: 12 octubre 2012]. Disponible en: http://www.saludyfarmacos.org/lang/es/boletin-farmacos/boletines/feb2013/publicidad-de-medicamentos-automedicacin-y-tica-farmacutica-una-trada-farmacutica/
36. Barello J. ¿El Fin Justifica a los Medios? I Parte. Noticias Sobre Medicamentos y Salud No 43. [Internet] [Publicado: 21 Mar 2016]. Disponible en: http://www.www.razonypalabra.org.mx/anteriores /n43/jbarello.html
37. Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis. Jama [Internet]. 2007 Feb [cited 2017 mar 25]; 297(8): 842-57. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/17327526
38. Alessandro Liberati. Information from drug companies and opinion leaders. BMJ [Internet]. 2003 May [cited 2017 mar 25];326(7400):1156–1157.Available from: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1126036/
39. Mintzes B. Disease mongering in drug promotion: do governments have a regulatory role? PLoS Med [Internet]. 2006 [cited 2017/10/29];3:e198. Disponible en: http://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.0030198
40. Stelfox HT, Clima G, O‘Rourke, Detsy AS. Conflict of interest in the dedate overcalcium-channel antagonist. New England J Med [Internet]. 1998 [cited 2017/10/29];338:101-6. Disponible en: http://www.nejm.org/doi/pdf/10.1056/NEJM19980108338;0206
41. Gottlieb S. Medical societies acussed of being beholden to the drugs industry. British Med J 1999 [cited 2017/10/29]; 319(7221):1321. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1117068/pdf/1321.pdf
42. Cuba. Minsap. Reglamento para la vigilancia de medicamentos de uso humano durante la comercialización. La Habana: Minsap; 2007. Disponible en: http://www.cecmed.cu/sites/default/files/adjuntos/Reglamentacion/res_brps-04-2007_vigilancia_0.pdf
43. Calvo DM. Programa de uso racional de medicamentos. [Internet] [citado 17 abr 2017] Disponible en: http://www.cdfc.sld.cu/programa-de-uso-racional-de-medicamentos
44. Minchón Medina CA. Política farmacéutica nacional: Impacto en el Uso Racional de Medicamentos en el Perú. UCV Scientia [Internet]. 2010 [citad: 2017/10/29]; 2(2). Disponible en: http://revistas.ucv.edu.pe/index.php/UCV-SCIENTIA/article/viewFile/452/327
Recibido: 2017-06-30
Aprobado: 2017-07-19
Dra.Grisel Viña-Pérez. Departamento de Farmacoepidemiología. Dirección Nacional de medicamentos y Tecnología médica. Minsap. Ciudad de La Habana. Cuba.














