Introducción
La toxicidad causada por los metales pesados sobre los microorganismos depende de su disponibilidad, determinada por la especiación y concentración en que se encuentre Kim et al. (2002). Entre los efectos tóxicos provocados a las células, están los relacionados con inactivaciones enzimáticas e intercambios que realizan con cationes fisiológicamente esenciales para la vida celular, como los constituyentes de metaloproteínas. Estas afectaciones conducen a deterioros en actividades biológicas vitales que pueden resultar irreversibles en diferentes organismos. Si las reacciones catabólicas se ven afectadas, la velocidad de respiración y la velocidad de producción de biomasa se reducen y por lo tanto la velocidad de crecimiento disminuye, disminuyendo de hecho la necesidad de energía Hartmann et al. (2013).
Entre los procedimientos para la determinación de efectos inhibitorios o tóxicos y la actividad biológica en lodos activados se encuentra la respirometría Vanrollehem et al. (1994). La misma es la medición e interpretación de la velocidad de consumo de oxígeno o la velocidad específica de consumo de oxígeno (OUR: Oxygen Uptake Rate o SOUR: Specific Oxygen Uptake Rate) por parte de los microorganismos bajo estudio (biomasa microbiana) en condiciones controladas. Particularmente, la SOUR es definida como la cantidad de oxígeno consumido por la biomasa por unidad de volumen y unidad de biomasa y tiempo Gounder (2006). Este consumo está directamente relacionado con el oxígeno que consume la biomasa para la obtención de energía para su crecimiento y mantenimiento; por lo tanto depende directamente de su actividad y de la concentración en que se encuentre Oliveira et al. (2011).
La OUR tiene dos componentes: la velocidad de respiración endógena (OURend) y la exógena (OURexo) Spanjers et al.(1997). Cuando no hay disponibilidad de sustrato oxidable, los microorganismos oxidan su propia biomasa con el objetivo de generar energía para las funciones de mantenimiento celular; en este caso: OUR = OURendGounder (2006). Al agregar un sustrato determinado, los microorganismos lo oxidan observándose un aumento en la velocidad de consumo de oxígeno Contreras et al. (2003).
Las medidas respirométricas están basadas en la determinación de los cambios que se producen en la velocidad de consumo de oxígeno de los microorganismos presentes cuando son expuestos a un pulso de sustrato Contreras et al. (2003).
El balance de oxígeno durante la transferencia desde una burbuja de aire hacia el medio de cultivo y el consumo por la célula es descrito en la ecuación 1 para respirómetros cerrados.
Donde:
dC/dt: |
variación de la concentración de oxígeno en el tiempo, mgL-1seg-1. |
OURend: |
velocidad de consumo de oxígeno durante el metabolismo endógeno, mgL-1seg-1. |
OURexo: |
velocidad de consumo de oxígeno durante el metabolismo exógeno, mgL-1seg-1. |
La OUR está relacionada tanto con la concentración como con la actividad de la biomasa en el cultivo (oxígeno necesario para el mantenimiento de la biomasa) y la velocidad de producción de biomasa (oxígeno necesario para el crecimiento) Santos et al. (2006). La concentración de biomasa no es constante, pero en el tiempo en el que transcurre la medición de la OUR, se asume como constante ya que el cambio neto de la biomasa tiende a cero (Montoya 2012).
El objetivo del presente trabajo es estudiar el efecto inhibitorio que ejercen los iones metálicos de Ni (II), Zn (II), Pb (II) y Al (III) sobre los microorganismos presentes en un lodo activado.
Materiales y métodos
Puesta en marcha y operación del reactor de lodos activados
Para la puesta en marcha y operación del cultivo mixto de microorganismos (lodos activados) se emplearon reactores cilíndricos de 8 L de volumen efectivo, con aireación continua mediante bombas de acuario con difusor al extremo de la línea de aireación.
Los reactores estuvieron operando en continuo durante seis meses, con un tiempo de retención hidráulico de 24 horas para lograr el agotamiento del sustrato biodegradable. La biomasa empleada como inóculo en la puesta en marcha de los reactores, provino del sistema de lodos activados de la planta de tratamiento de una instalación hotelera.
Para los estudios se simularon edades de lodo de cinco y diez días. Estas fueron obtenidas mediante la extracción diaria de 1,6 L y 0,8 L. Posteriormente el licor mezclado fue vertido en vasos de precipitados y aireados. La temperatura de trabajo fue de 32 ± 2 ºC. Los reactores fueron alimentados diariamente según Oliveira et al. (2011) con 640 mgL-1 de peptona, 120 mgL-1 de urea, 8 mgL-1 de MgSO4·6H2O, 34 mgL-1 de K2HPO4, y 6,8 mgL-1 de NH4Cl como sustrato base, con el objetivo de mantener el equilibrio dinámico entre biomasa viva y muerta. La demanda química de oxígeno (DQO) del afluente fue de 1198 ± 11 mgL-1. El pH se controló en 7,0 ± 0,5, con la adición de H2SO4 y NaOH de concentración 0,2 y 0,5 molL-1 respectivamente.
El licor mezclado extraído fue caracterizado mediante gravimetría, determinándose diferentes categorías de sólidos:
sólidos totales, fijos y volátiles (ST, SF y SV),
sólidos suspendidos totales (SST),
sólidos suspendidos fijos (SSF) y sólidos suspendidos volátiles (SSV).
Los estudios experimentales comenzaron a realizarse una vez que el cultivo mixto alcanzó la estabilidad, considerando como tal la concentración de SSV y la DQO de efluente constante.
Todos los análisis fueron realizados por las técnicas analíticas descritas por los Métodos Normalizados para el Análisis de Aguas Potables y Residuales, de la AWWA 1989, APHA, WPCF 1992.
Determinación del tiempo de respuesta del electrodo de oxígeno disuelto
Previo a los estudios de respirometría se realizó la determinación del tiempo de respuesta del electrodo de oxígeno disuelto, introduciendo el electrodo en una solución con concentración de oxígeno disuelto igual a 0 mgL-1 (obtenida a partir de la adición de bisulfito de sodio en un recipiente con agua destilada). Al instante se introdujo el electrodo en otro recipiente con agua destilada saturada de oxígeno disuelto (por la adición de aire). El tiempo de respuesta del electrodo (τ) se determinó mediante la ecuación 2.
Donde:
OD tiempo : |
Valor de oxígeno disuelto medido en un tiempo dado, mgL-1 |
OD sat : |
Valor de oxígeno disuelto medido en la saturación con oxígeno, mgL-1 |
t: |
instante de tiempo en que se hace la lectura de oxígeno disuelto, seg. |
τ: |
tiempo de repuesta del electrodo, seg. |
Los datos experimentales fueron procesados, ajustándole el modelo no lineal descrito en la ecuación 2, mediante la herramienta SOLVER del Microsoft Excel, determinando el tiempo de respuesta del electrodo.
Estudios respirométricos
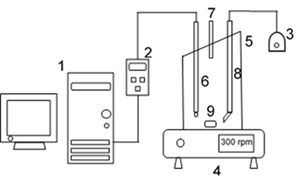
Para la realización de las pruebas se empleó un respirómetro cerrado con volumen total de 59 mL, con un difusor de aire para proporcionar el nivel de oxígeno deseado. Se empleó un medidor de oxígeno disuelto conectado a un ordenador (PC), que permitió obtener las velocidades de respiración de los microorganismos en tiempo real y su posterior procesamiento. En la figura 1 se muestra el esquema de la instalación empleada a escala de laboratorio.
Donde:
1. |
PC, |
2. |
Medidor de oxígeno disuelto, |
3. |
Bomba de aire, |
4. |
Agitador magnético, |
5. |
Respirómetro cerrado, |
6. |
Electrodo, |
7. |
Entrada de la solución de sustrato y sustrato más metal, |
8. |
Entrada de aire, |
9. |
Bala magnética. |
El procedimiento seguido para la realización de las pruebas fue: aireación hasta alcanzar la concentración de saturación de oxígeno disuelto, suspensión de la aireación y medición de la concentración de oxígeno disuelto (respiración endógena) durante dos minutos. Posteriormente se adicionaron 2 mL del pulso de sustrato o de sustrato más metal en estudio y medición posterior de la variación dela concentración de oxígeno disuelto en el tiempo, en la nueva condición.
El sustrato empleado fue glucosa con una concentración de DQO de 20 mgL-1 ± 0,1. Las concentraciones de los iones metálicos en estudios fueron 15, 10 y 5 mgL-1 respectivamente. La temperatura de trabajo fue de 32 ± 2 ºC. Los porcentajes de inhibición fueron determinados por la expresión 3.
Donde:
S o : |
Valor de la velocidad de consumo de oxígeno específico máximo (SOUR) obtenido al añadir el pulso de sustrato, mgO2L-1 seg-1. |
Si: |
Valor de la velocidad de consumo de oxígeno específico máximo obtenido al añadir el pulso de sustrato más el metal en estudio, mgO2L-1seg-1. |
Todos los estudios se realizaron por triplicado, teniendo en cuenta el tiempo de respuesta del electrodo y la concentración de la biomasa.
Diseño de experimentos
Para la determinación de la influencia estadísticamente significativa del empleo de edades de lodos sobre el porcentaje de inhibición a las tres concentraciones de los iones metálicos; se realizó un diseño de experimento 23 (edad de lodo 5 y 10 días y concentraciones 15, 10 y 5mgL-1), empleando el programa computacional estadístico Statgraphics Centurion XV.
Resultados y discusión
Caracterización del inóculo empleado para la puesta en marcha del reactor
En la tabla 1 se muestran los resultados de la caracterización realizada al inóculo empleado para la puesta en marcha de los reactores de lodos activados. El valor de los sólidos suspendidos volátiles (SSV) representó un 84,2% de los suspendidos totales (SST) lo que denota la excelente calidad del lodo empleado como inóculo para el proceso (Menéndez 2010).
Tabla 1 Composición de los sólidos del inóculo
| Parámetro | Composición, gL-1 |
|---|---|
| ST | 4,34 |
| STV | 3,53 |
| STF | 0,80 |
| SST | 4,05 |
| SSF | 0,64 |
| SSV | 3,41 |
Se consideró que los reactores, de 5 y 10 días de edad del lodo estaban operando establemente, una vez que la concentración de SSV y DQO se mantuvo constante durante todo el período de experimentación. Las concentraciones en el efluente fueron: SSV de 1373 ± 336 mgL-1 y 1606 ± 377 mgL-1 y la DQO fue de 275 mgL-1 ± 66 mgL-1 y 284 mgL-1 ± 89 mgL-1, para los reactores que simularon las edades de lodo de 5 y 10 días respectivamente.
Determinación del tiempo de respuesta del electrodo
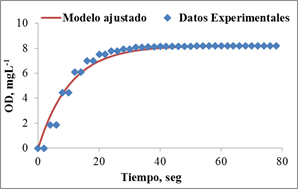
En la figura 2 se muestra el ajuste del modelo empleado (ecuación 2) a los datos experimentales para la determinación del tiempo de respuesta del electrodo, el cual fue de 10,5 segundos. Debido a que las pruebas repirométricas duraron hasta 15 minutos, se consideró a los efectos prácticos, el tiempo de respuesta del electrodo despreciable.
Estudios de respirometría. Determinación de la inhibición provocada a los microorganismos por la adición de Ni (II), Zn (II), Pb (II) y Al (III)
En la figura 3(a) se muestra un ejemplo de la influencia sobre la biomasa microbiana de la adición del pulso de sustrato y sustrato más metal sobre la velocidad específica máxima de consumo de oxígeno. Se observa como el SOUR, al añadirle el pulso de sustrato y el metal tóxico aumenta hasta alcanzar su valor máximo, correspondiente al máximo consumo de oxígeno (pulso de sustrato) y donde se logra la mayor inhibición (pulso de sustrato más metal) y luego comienza a disminuir con el agotamiento del sustrato. Se observa que la curva de sustrato más metal presenta menor SOUR, debido a la inhibición provocada por el metal sobre los microorganismos.
En la figura 3(b) se observa como al suspender la aireación, los microrganismos entran en una fase de respiración endógena, en la que comienzan un proceso de autoxidación. Al añadirle el pulso de sustrato se aprecia una disminución pronunciada del oxígeno disuelto debido al consumo de oxígeno por parte de los microorganismos (respiración exógena) y que una vez agotado el sustrato, los mismos regresan a la condición de respiración endógena (es verificado por el valor de la pendiente).
Un resultado similar se observó con la adición del sustrato más el metal. Se plantea que la biomasa es menos sensible a las sustancias tóxicas cuando está en su estado endógeno y que el tiempo entre la inyección del metal y la inyección del sustrato puede afectar el nivel de toxicidad determinado, ya que la exposición a largo plazo puede conducir a un fuerte efecto o también puede conducir a la adaptación de la biomasa. Es por ello que siempre se debe tener en cuenta el tiempo aplicado entre las inyecciones de la sustancia tóxica y el sustrato de referencia Roy et al. (2015).

Fig. 3 Comportamiento de las velocidades de consumo de oxígeno específico máximo (a) y del oxígeno disuelto al adicionarle el pulso de sustrato (b)
En la figura 4 (a, b, c y d) se muestran los porcentajes de inhibición máximos alcanzados al adicionarle 2 mL de las sales que contenían los iones metálicos de Ni (II), Zn (II), Pb (II) y Al (III) con concentraciones de 15, 10 y 5 mg/L respectivamente. Se observa, tal como era de esperar, que a medida que disminuyen las concentraciones de los iones metálicos, disminuye la inhibición provocada sobre la velocidad de respiración de los microorganismos.
En todos los estudios se obtuvo que la mayor inhibición se presentó para el cultivo mixto con edad de lodo de 10 días. Esto se debe a que a mayor edad de lodo, la actividad de la biomasa es menor respecto a la masa total (Gutiérrez 2010), afectando la presencia del metal las funciones metabólicas de los microrganismos presentes en el cultivo mixto Hartmann et al. (2013).

Fig. 4 Porcentajes de inhibición para los iones metálicos en función de su concentración: Ni (II) (a), Zn (II) (b), Pb (II) (c) y Al (III) (d)
Los valores de los porcentajes de inhibición variaron en dependencia de la edad del lodo y de las concentraciones de los iones metálicos en estudio. Para la edad del lodo de 5 días, el orden de inhibición fue: Ni (II) > Pb(II) > Zn (II) > Al (III) y para 10 días: Zn (II) > Pb(II) > Al (II) > Ni (II).
La variación en el orden del grado de inhibición está dada por la diversidad microbiológica que presenta los lodos (que puede variar según su edad) y el comportamiento de los microorganismos, las características del sistema empleado (batch, continuo, con o sin reciclaje de lodos), la edad de lodo activado, la aclimatación relativa de lodos activados a ciertos metales pesados, y finalmente los diversos métodos de medida y técnicas utilizadas por los investigadores El Bestawy et al. (2013).
Análisis estadístico en las pruebas de respirometría
En la figura 5 (a, b, c y d) se muestran los diagramas de Pareto estandarizado correspondientes al estudio de la influencia que ejerce la edad del lodo y la concentración de los iones metálicos Ni (II), Zn (II), Pb (II) y Al (III) respectivamente sobre el porcentaje de inhibición.

Fig. 5 Diagrama de Pareto estandarizado obtenido por el diseño experimental propuesto: Ni (II) (a), Zn (II) (b), Pb (II) (c) y Al (III) (d)
Para todos los iones metálicos la edad del lodo y la concentración ejercieron un efecto estadísticamente significativo sobre el porcentaje de inhibición de la biomasa. Esto sugiere que a medida que aumenta la edad de lodo el efecto inhibitorio será mayor para una misma concentración del metal, debido a que la cantidad de células vivas con respecto a la masa total disminuye (Menéndez 2010). Por tanto, un aumento de la edad de lodo puede provocar una inhibición total, sin crecimiento de nuevos microorganismos que garanticen el adecuado funcionamiento del lodo activado.
Conclusiones
Los metales pesados ejercen efectos inhibitorios sobre los microorganismos presentes en el lodo activado en las concentraciones probadas y tiempos de retención medio celular con los que se trabajó.
La variación del porcentaje de inhibición depende del tipo de metal y su concentración, así como las características de la biomasa microbiana presente en lodo activado.
De los metales seleccionados para el estudio, se obtuvo que el ion metálico de mayor porcentaje de inhibición para el rector de edad del lodo 5 días fue el Ni (II) y para el de 10 días fue el Zn (II), presentándose la mayor inhibición a esa edad del lodo.
Se evidencia que ante la presencia de metales pesados, es más apropiado operar a bajas edades de lodo. La edad del lodo y la concentración de los metales tuvieron un efecto estadísticamente significativo sobre el porcentaje de inhibición de la biomasa.