Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Cubana de Angiología y Cirugía Vascular
versão On-line ISSN 1682-0037
Rev Cubana Angiol Cir Vasc vol.19 no.2 La Habana july.-dez. 2018
Artículo de revisión
Modelos constitutivos hiperelásticos del tejido arterial y su valoración para considerar el descontrol metabólico
Hyperelastic constitutive models of arterial tissue and its assessment to consider metabolic uncontrol
Ernesto Camue Corona1
Raide Alfonso González Carbonell1
Jesús Hernández de la Torre1
Yosbel Cisneros Hidalgo2
1Grupo Investigativo de Biomecánica y Bioingeniería. Facultad de Electromecánica. Universidad de Camagüey "Ignacio Agramonte Loynaz". Camagüey, Cuba.
2Centro de Estudios de Explotación, Fabricación y Recuperación de Equipos y Pieza (CEEFREP). Camagüey, Cuba.
RESUMEN
Introducción: Las arterias elásticas se caracterizan por un comportamiento hiperelástico anisotrópico, no lineal y cuasi -incompresible, el cual depende de la contribución y distribución de los principales constituyentes. Su evaluación a través de modelos constitutivos junto con enfoques numéricos apropiados puede contribuir potencialmente al estudio de enfermedades como la aterosclerosis, así como al modelado de las intervenciones quirúrgicas o traumas por accidente.
Objetivo: Valorar los modelos constitutivos que caracterizan el comportamiento biomecánico de la pared arterial para la identificación del potencial adecuado que permita la correlación de parámetros bioquímicos y mecánicos, en condiciones de daño.
Métodos: Se realizó una revisión bibliográfica entre los años 2010-2016 en las bases de datos: Medline, Cochrane Library, Lilacs, así como en el meta-buscador Google. Se consultaron estudios de cohorte, prospectivos, retrospectivos, clínicos, epidemiológicos, revisiones bibliográficas y ensayos clínicos.
Resultados: El modelo constitutivo anisotrópico de dos familias de fibras resulta apropiado para obtener nuevas relaciones constitutivas, que aporten más información sobre las propiedades mecánicas de las arterias bajo la influencia del descontrol metabólico generado por la acción de la diabetes mellitus, en los estadios tempranos de la aterosclerosis.
Conclusiones: Los cambios en la estructura, composición y propiedades mecánicas que sufre la pared arterial, debido al descontrol metabólico, permite aseverar que la formulación de un modelo adecuado para representar esta realidad es una etapa crucial en la obtención de nuevas relaciones constitutivas, que contribuyan a una solución satisfactoria en el diagnóstico clínico no invasivo de las enfermedades vasculares.
ABSTRACT
Introduction: The elastic arteries are characterized by a hyper-elastic, anisotropic, non-linear and quasi-incomprehensible behaviour, which depends on the contribution and distribution of the main constituents. Its evaluation through constitutive models together with appropriate numerical approaches can potentially contribute to the study of pathologies such as atherosclerosis, as well as to the modelling of surgical interventions or traumas by accident.
Objective: To assess the constitutive models that characterize the biomechanical behavior of the arterial wall for the identification of the adequate potential that allows the correlation of biochemical and mechanical parameters in damage conditions.
Methods: A bibliographic review was conducted from 2010 to 2016 in databases such as: Medline, Cochrane Library, Lilacs, as well as in the metasearch engine Google. There were consulted cohort, prospective, retrospective, clinical, epidemiological studies, bibliographic reviews and clinical trials.
Results: The constitutive anisotropic model of two families of fibers is appropriate to obtain new constitutive relations, which provide of more information about the mechanical properties of the arteries under the influence of the metabolic decontrol generated by the action of diabetes mellitus, in the early stages of atherosclerosis.
Conclusions: The changes in the structure, composition and mechanical properties of the arterial wall as a consequence of the metabolic decontrol allows to assert that the formulation of a suitable model to represent this reality is a crucial stage in obtaining new constitutive relations that contribute to a satisfactory solution in the non-invasive clinical diagnosis of vascular diseases.
INTRODUCCIÓN
Es incuestionable que el enorme progreso experimentado en el sistema de salud, durante los últimos 30 años, no habría sido posible sin la aportación de avanzadas tecnologías que han permitido el desarrollo de nuevas soluciones a problemas médicos. Frecuentemente, en dicho desarrollo se utilizan logros obtenidos dentro de las investigaciones de las ciencias técnicas y exactas que, en muchos casos, están fuera del alcance de los profesionales de las ciencias médicas.
Se impone, entonces, la colaboración de científicos y especialistas en estos estudios transdisciplinarios, tales como: biólogos, médicos, ingenieros, matemáticos e informáticos, así como de la aplicación de los principios éticos que permita un nivel de compartición de conocimiento y puntos de vista mucho más intenso, lo que crea un ambiente intelectual más compacto.1
En la actualidad, una de las ramas más importantes para el análisis y predicción de la mecánica de los seres vivos es la biomecánica tisular, cuyo objetivo es formular matemáticamente y predecir el comportamiento de los tejidos biológicos como materiales y componentes estructurales, es decir, relacionar los desplazamientos, deformaciones y tensiones que sufren con las cargas y movimientos a que se les someten, ya sean fisiológicas o patológicas, así como predecir las alteraciones inducidas por enfermedades o terapias varias.2
Dentro de la biomecánica tisular es especialmente interesante el problema del análisis biomecánico del tejido biológico arterial, el cual está sometido a acciones externas e internas de origen mecánico y metabólico que conducen a procesos adaptativos, entre los que se pueden mencionar: crecimiento, remodelación, envejecimiento y atrofia.
En un intento por comprender mejor los complejos procesos de crecimiento y remodelación, varias investigaciones abordan la influencia de parámetros mecánicos en segmentos arteriales de seres humanos. En estas investigaciones se analizan y definen modelos constitutivos de todo tipo (bidimensional, tridimensional, isotrópico y anisotrópico), entre ellos, los de mayor difusión son los modelos propuestos por Humphrey y Yin3, Gasser y otros.4 A través de estos modelos se evalúa el comportamiento del tejido arterial desde un enfoque fenomenológico o microestructural.
Por otra parte, la valoración de la elasticidad de los tejidos biológicos mediante modelos constitutivos también se utiliza por la práctica médica para simular y analizar enfermedades del sistema vascular como la aterosclerosis. Esta enfermedad degenerativa es caracterizada por la pérdida de la elasticidad de la pared arterial, debido a la formación de una placa de ateroma (depósito de sustancias lípidas, células espumosas, calcio, elementos fibrosos, entre otros componentes), lo que produce estrechamiento de la luz e isquemia en los tejidos que irriga.5,6
Las alteraciones antes descritas no están asociadas a una sola causa, son el resultado de una combinación compleja de factores biológicos, químicos y mecánicos, íntimamente relacionados con los de riesgo.7 Su origen está dado en la disfunción del endotelio, zona de la pared arterial que se encuentra en contacto con la sangre.
La aterosclerosis es observada con mayor frecuencia en las regiones de bifurcación y tramos curvados de las arterias de mediano y gran calibre, por ejemplo, la carótida,8 lo que hace sospechar que los patrones de tensiones locales provocados por el flujo, influyen en su generación y evolución. Respecto a ello, existen dos teorías contrapuestas: para una la causa es la tensión tangencial máxima como responsable del desgarramiento del endotelio y el consiguiente proceso de cicatrización; y para la otra, es la tensión tangencial mínima que posibilita la adherencia de todo tipo de partículas sólidas transportadas por la sangre como las lipoproteínas de baja densidad (LDL) y las lipoproteínas ricas en triglicéridos (LPRTG).
En numerosas investigaciones7,9,10 se ha correlacionado la formación y crecimiento de la placa de ateroma con determinados estados tenso-deformacionales de la pared arterial. En otros estudios se han formulados modelos constitutivos basados en la teoría de daño, en los que el fenómeno mecánico que subyace es el fallo del biomaterial debido a la degradación de sus propiedades mecánicas, aplicación de una carga excesiva o concentración de tensiones que tiene lugar por traumas de la capa más interna.11-13
Cabe recalcar que, la formulación de un modelo en el que se pueda evaluar el comportamiento biomecánico de la pared arterial en estadios tempranos de la aterosclerosis es compleja, pues son varios los factores que se involucran, tales como: la modificación de las propiedades bioquímicas del tejido en cada ser vivo, factores de riesgo [la edad, diabetes mellitus (DM), hipertensión arterial (HTA) y otros], así como también la presencia de virus, bacterias o microorganismos. Esto ha llevado a que la investigación, formulación y posterior implementación de las relaciones constitutivas se centren en campos específicos que permitan acotar los factores antes mencionados.
Dado que el principal esfuerzo de modelación ha sido la respuesta pasiva de la pared arterial, esta es también la preocupación de la mayor parte de este artículo. Una última sección apunta hacia un área clave que necesita más atención para mejorar la comprensión de la biomecánica del biomaterial, cuando es afectado por la diabetes mellitus. Esta revisión puede ser útil para el desarrollo de modelos de daño más avanzados en los que se tenga en consideración el descontrol metabólico durante la modelación del comportamiento biomecánico de la pared arterial.
La presente revisión tiene como objetivo valorar los modelos constitutivos que caracterizan el comportamiento biomecánico de la pared arterial para la identificación del potencial adecuado que permita la correlación de parámetros bioquímicos y mecánicos en condiciones de daño.
MÉTODOS
La localización de los artículos se realizó en las bases de datos: Medline, Cochrane Library, Lilacs, así como en los meta-buscadores Google y Bing. Las palabras "modelos constitutivos", "aterosclerosis" y "descontrol metabólico" fueron siempre utilizadas como criterio de búsqueda de artículos publicados entre 2010 y 2016, fundamentalmente. El 78 % de las publicaciones consultadas se corresponde a los últimos cinco años; mientras que el 22 % de los artículos tenidos en cuenta, fuera del periodo antes acentuado, se debió a investigaciones precursoras en la temática abordada. Se consultaron estudios de cohorte, prospectivos, retrospectivos, clínicos, epidemiológicos, revisiones bibliográficas y ensayos clínicos.
RESULTADOS
Comportamiento biomecánico del tejido arterial
El comportamiento estructural y funcional del tejido arterial depende de la concentración, disposición y propiedades mecánicas de sus constituyentes, así como de su constitución en capas o túnicas. Paralelamente, se pueden señalar que la adaptación de este tejido biológico, en respuesta a las condiciones mecánicas de su entorno, tiene un rol muy importante en una serie de procesos naturales y patológicos, entre ellos se puede mencionar, por ejemplo, la aterosclerosis.
La pared arterial es un órgano activo, flexible e integrado por componentes celulares como el músculo liso, las células endoteliales y los fibroblastos. También está constituida por los no celulares, que forman una red compleja de polisacáridos y proteínas (matriz extracelular), dentro de la cual se hallan los proteoglicanos, fibras de colágeno y elásticas, fundamentalmente.14
Las fibras elásticas es una proteína que constituye el material biológico de comportamiento más lineal que se conoce; es muy flexible y capaz de recuperar su dimensión original después de sufrir deformaciones incluso mayores del 50%.9,14 Tiene una función importante en las arterias, especialmente en los vasos de gran tamaño como la aorta, ya que son las responsables de la respuesta de la pared arterial cuando las presiones son bajas o moderadas, hasta los valores correspondientes al rango fisiológico.
El colágeno es un constituyente estructural de los tejidos blandos y duros que aporta integridad, resistencia mecánica y rigidez. En la pared arterial las fibrillas onduladas de este constituyente están dispuestas en estructuras helicoidales, entrando en dinamismo una vez que han sido alineadas y orientadas durante el proceso de deformación.15 Cuanto mayor sea su contenido mayor será la rigidez de la pared arterial. Este mecanismo natural de rigidización previene el daño y evita deformaciones excesivas que pudieran romper el tejido. Por estas razones, el colágeno es el principal responsable cuando las presiones son superiores al rango fisiológico.
El músculo liso es el encargado de producir una tensión activa independiente de la deformación aplicada. Sus contribuciones a las propiedades mecánicas de la pared arterial son más bien pequeñas. Bajo condiciones fisiológicas o normales, este constituyente se encuentra parcialmente contraído dando lugar al tono muscular basal, siendo el causante de la vasomotricidad (vasoconstricción y vasodilatación) en respuesta a una señal eléctrica o química inducida por una variación de presión. Por tales razones, el musculo liso es responsable los fenómenos dinámicos y evita que la pared arterial sea distensible como la elastina o rígida como el colágeno.
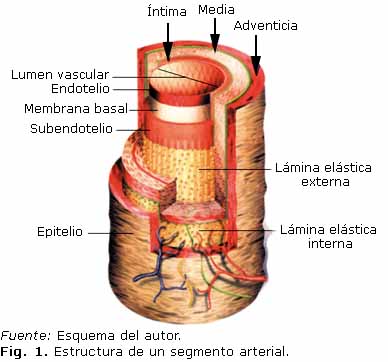
Desde el punto de vista macroscópico la pared arterial está compuesta de cilindros concéntricos dispuestos uno dentro del otro para formar tres capas claramente diferenciables: la íntima, media y adventicia (Fig. 1).
La íntima es la capa interior de la pared arterial formada por el endotelio, membrana basal y el tejido conjuntivo subendotelial, contiene fibras de colágeno y elásticas. Esta túnica se encuentra sometida a la tensión cortante del flujo sanguíneo y tiene la función de filtro selectivo que deja pasar gases, fluidos y moléculas hacia y desde la sangre, lo que permite que el fluido sanguíneo permanezca en estado líquido en contacto con ella.
En la túnica media se localizan unidades laminares elásticas, proteoglicanos, músculo liso y fibras colágenas (en mayor proporción). Es la principal responsable de las propiedades mecánicas de la pared arterial al proporcionar alta resistencia, resiliencia y la capacidad de soportar cargas en direcciones longitudinal y circunferencial.
Finalmente, la capa externa o adventicia es el tejido conjuntivo con menor cantidad de fibras elásticas y más de colágeno que las observadas en las anteriores túnicas. Sirve como anclaje del vaso a los tejidos que lo rodean. Cuando los niveles de presión son elevados, las fibras de colágeno se enderezan y la adventicia se convierte en un tubo rígido que evita un estiramiento excesivo y, por consiguiente, la no rotura de la arteria.15
La estructuración en capas que presenta la pared arterial le ofrece diversas características que la convierten en un fenómeno, cuyo modelado requiere una consideración cuidadosa de diversos aspectos; entre estas características caben citar: la cuasi-incompresibilidad debida a la fase acuosa, las grandes deformaciones incluso en condiciones fisiológicas, la variación de las propiedades mecánicas del tejido en función de la dirección a la que se apliquen las fuerzas y deformaciones (anisotropía), la fuerte no linealidad de la respuesta y heterogeneidad.
Modelos constitutivos hiperelásticos del tejido arterial
Las acciones mecánicas sobre la pared arterial se caracterizan mediante el concepto de tensión (fuerza por unidad de superficie), que produce deformaciones de éste en distintas direcciones. Ante una presión dentro de un vaso las tensiones que se generan pueden descomponerse de tres sentidos: radial, circunferencial y longitudinal. Esta última, por lo general, no se tiene en cuenta porque el cambio de longitud de un vaso sanguíneo en cada pulsación es prácticamente despreciable.
Teniendo en cuenta lo antes expuesto, se puede plantear que los resultados mecánicos fundamentales para describir el comportamiento de la pared arterial se fundamentan en la determinación de los estados de tensión y deformación. Dentro de estos, las tensiones circunferenciales y tangenciales actuantes en la pared del vaso son de suma importancia para aportar datos cuantitativos que permitan a la ciencia médica revisar las teorías existentes sobre el surgimiento y progresión de la aterosclerosis. De ahí que sea necesario la determinación de las ecuaciones matemáticas que permitan describir a los estados antes mencionados.
Un modelo constitutivo es aquella expresión matemática que caracteriza el comportamiento mecánico de cualquier material a través de una relación funcional entre las tensiones y deformaciones.12,16 En el caso específico de la pared arterial, su descripción se basa en la identificación de una función de la energía potencial que se consume durante la deformación de los cuerpos (potencial), la cual fue formulada -en un inicio- a partir de relaciones fenomenológicas hasta llegar a otras más avanzadas que incluyen alguna información de la estructura interna del biomaterial.
Una forma usualmente utilizada en algunas investigaciones es la clasificación de los modelos constitutivos en dependencia de la respuesta activa o pasiva de la pared arterial ante determinadas condiciones de carga (inflado, extensión y otros). Su respuesta activa está regida por el músculo liso, mientras que la pasiva depende de las propiedades mecánicas de las fibras elásticas y de colágeno. La mayoría de las relaciones constitutivas propuestas para caracterizar el comportamiento biomecánico de la pared arterial ha sido las de respuesta pasiva, basadas en datos experimentales que consideran a dicha pared como un sistema macroscópico incompresible reforzados con fibras.17-19
En el estudio de materiales biológicos, como el tejido arterial, también es muy habitual el uso de modelos hiperelásticos, para los que la relación tensión-deformación se deriva de una función de energía de deformación, dicho de otra forma, que no se disipa energía al deformarse. En estos modelos de paredes arteriales se plantea la existencia de una energía de deformación que describe la energía por unidad de volumen almacenada en el cuerpo elástico deformado.
Los primeros esfuerzos para la modelación de la pared arterial se centraron, principalmente, en la determinación de potenciales adecuados para representar el comportamiento anisotrópico no lineal de una arteria, considerándola como un material que no presenta una estructuración por medio de capas. Entre estos modelos hiperelásticos, puramente fenomenológico, tal vez el potencial que haya sido utilizado más extensamente es el propuesto por Fung y otros.20
En el potencial antes citado, y en los que se derivaron de él, no existe una interpretación física de los parámetros materiales adimensionales ni es posible estimar ninguna relación directa entre los mismos y la estructura del tejido arterial, por lo que sus capacidades de predicción y ajuste a las respuestas fisiológicas que presentan las arterias son limitadas. No da cuenta de la dispersión y distribución de las fibras de colágeno. Tampoco captan con precisión la respuesta tenso-deformacional de cada una de las capas de la pared arterial.
Actualmente, el modelo constitutivo más aceptado es el anisótropo de dos familias de fibras, a partir del cual se ha impulsado la modelación del tejido arterial mediante potenciales que incluyen dos direcciones para las fibras de colágeno. Se basa en el uso de los pseudo-invariantes definidos por Spencer para representar la anisotropía del biomaterial. Dentro del marco de estos modelos constitutivos, la mayoría de ellos21-23 considera que el comportamiento biomecánico se deriva de las aportaciones aditivas de los componentes isotrópicos y anisotrópicos, los cuales simulan el comportamiento de la matriz representada por las fibras elásticas, así como también de las fibras de colágeno embebidas en dicha matriz.
Es una práctica común, en la mayoría de los modelos constitutivos, considerar el componente isotrópico como un material neo-Hookeano, lo cual tiene una sólida base teórica. Esto puede justificarse, en parte, por el estudio de Gundiah24 al demostrar que dicho modelo da una descripción satisfactoria de la respuesta mecánica de las fibras elásticas. El material neo-Hookeano es una extensión a grandes deformaciones de la ley de Hooke (ley de proporcionalidad lineal entre las tensiones y las deformaciones) para materiales isotrópicos. Su potencial se expresa en la fórmula 1 como sigue:
Donde c > 0 es un parámetro que para el material neo-Hookeano puede ser identificado como el módulo tangencial (µ).
La parte anisótropa en un potencial sólo genera energía de deformación cuando el tejido se encuentra traccionado en la dirección coincidente con la alineación de la familia de fibras de colágeno; es decir, cuando se logra simular el efecto de rigidización explicado en el apartado anterior. Este hecho motiva el uso de una función exponencial para la descripción de la energía de deformación almacenada en el colágeno cuando las presiones son altas; siendo el aporte energético nulo si son bajas, dado a su desactivación.
La hipótesis fundamental del proceso de rigidización es que las fibras de colágeno no pueden soportar ningún tipo de carga a compresión; o sea, se abrocharían bajo este tipo de solicitud mecánica.25 Esto no solo se basa en razones físicas, sino también de estabilidad demostradas por Sommer y Holzapfel.26
Generalmente, la pared arterial se considera una estructura de dos capas como simplificación del modelo geométrico (Fig. 2). Cada túnica (media y adventicia) se representa por un material constituido por una matriz y dos familias de colágeno diferentes en configuraciones simétricas y espirales, a las que se le aplica la misma función de energía de deformación, solo que con parámetros de materiales diferentes. La capa íntima no se tiene en cuenta por la aportación nula que presenta a las propiedades mecánicas de la pared arterial.
Las consideraciones antes señaladas dieron lugar a toda una serie de relaciones constitutivas, entre las que se destacan las formuladas por Holzapfel y Ogden,14,28 siendo el de mayor difusión el propuesto por Holzapfel, Gasser y Ogden.27
En sentido general, los modelos apropiados para caracterizar el comportamiento mecánico pasivo de la pared arterial deben ser anisótropos no lineales, capaces de asumir grandes deformaciones. La forma funcional que mejor identifica la respuesta de este biomaterial es la exponencial, debido a que la contribución mecánica de las fibras de colágeno en el tejido se produce mediante un reclutamiento progresivo, a medida que las cadenas de estas proteínas quedan extendidas y empiezan a colaborar.
La exclusión de la influencia activa del músculo liso en los modelos hiperelásticos de respuesta pasiva es válida cuando no se tiene en cuenta los cambios permanentes de la presión arterial fuera del rango fisiológico, como es el caso de la enfermedad hipertensiva. Tales cambios dependen, entre otros factores, de la resistencia al flujo del sistema vascular donde la regulación activa (vasoconstricción y vasodilatación) de este constituyente desempeña un rol primordial.
Incidencia de la dispersión de las fibras de colágeno
Algunas investigaciones4,14,29 tienen en cuenta la dispersión de las fibras, donde se introduce el concepto de tensor generalizado (Hi) de segundo orden en el potencial. Dicho tensor caracteriza la distribución de las fibras en la configuración indeformada. Se asume, además, la existencia de una función de densidad ![]() .
.
Como cada familia de fibras está distribuida con simetría rotacional alrededor de una dirección media preferencial del vector unitario a0 (Fig. 2), se admite, entonces, un parámetro de dispersión k que representa la distribución de las fibras en un sentido integral y describe su "grado de anisotropía". La expresión en la fórmula 2 es la del potencial para un material hiperelástico anisotrópico, al tener en cuenta el tensor generalizado Hi.
De ahí que Hi dependa de la orientación media de las familias de fibras a0i y del parámetro de dispersión k. Obsérvese que el primer término se refiere al componente isotrópico que simula la respuesta de las fibras elásticas; mientras que el segundo, se refiere al comportamiento de las fibras de colágeno.
Una de las funciones de distribución de densidad ![]() empleada en algunas investigaciones14,30,31 para considerar el efecto de la dispersión de las fibras de colágeno dentro de la pared arterial es la distribución de von Mises. En la figura 3 se muestran siete maneras de distribución de las fibras de colágeno, correspondiente a k.
empleada en algunas investigaciones14,30,31 para considerar el efecto de la dispersión de las fibras de colágeno dentro de la pared arterial es la distribución de von Mises. En la figura 3 se muestran siete maneras de distribución de las fibras de colágeno, correspondiente a k.
Nótese que a medida que k aumenta de 1/3 a 1/2 la distribución de la fibra se hace cada vez más plana, se extiende hacia los ángulos periféricos y en el límite se vuelve plana. Por lo tanto, la distribución cambia de unidimensional a tridimensional y de esta última a dos dimensiones. Los estudios experimentales31,32 de la orientación de las fibras de colágeno en la capa media de las arterias carótidas de conejo, así como en las arterias ilíacas comunes apoyan la idealización bidimensional para la función de distribución de orientación.
Gasser y otros investigadores4 propusieron un modelo constitutivo (anisotrópico) en el que se consideró que las fibras de colágenos están distribuidas de acuerdo con el tratamiento estadístico de von Mises. El parámetro de dispersión k, considerado en el intervalo 0≤ k ≤0,333, corresponde a una dispersión nula y a una distribución tridimensional de la orientación de las fibras de colágeno, respectivamente. El potencial propuesto (fórmula 3), se define como:
El primer término de la fórmula 4 es una función de penalización para tener en cuenta la cuasi-incompresiblidad del biomaterial.
Las consideraciones anteriores se aplican, en primera instancia, en la modelación constitutiva del comportamiento biomecánico del tejido arterial sano, lo cual proporciona un punto de partida para comprender la biomecánica de este tejido durante el proceso de formación y progresión de enfermedades cardiovasculares como la aterosclerosis, así como el modelado de las intervenciones quirúrgicas o traumas por accidente.
Modelos constitutivos de daño para el tejido arterial
Los modelos constitutivos que describen el comportamiento biomecánico de la pared arterial, en presencia de enfermedades vasculares como la aterosclerosis, están dirigidos al diagnóstico de la formación y desarrollo de las capas de ateromas y a la predicción de la degradación de la rigidez arterial en vasos elásticos o de gran calibre, fundamentalmente. En relación con esta enfermedad, también han sido formuladas otras relaciones constitutivas para conocer la respuesta del biomaterial cuando es sometido a grandes cargas durante procedimientos quirúrgicos, como es el caso del balloon angioplasty con o sin stent.
El daño a la función mecánica del tejido arterial se manifiesta a través de la rotura o degradación de las fibras elásticas y de colágeno.21 Una forma de evaluarlo cuantitativamente es realizar ensayos mecánicos destructivos (tracción biaxial, presurización y otros) antes y después de la inducción de daño. Otra forma indirecta es valorar la integridad de la estructura del biomaterial mediante una imagen microscópica que pueda dar una idea de su composición, así como exponer las fracturas en los diferentes componentes. La mayor parte de estos estudios han sido realizados en animales.
Evidencias prácticas y éticas impiden la determinación experimental de la relación generalizada entre la carga mecánica y el daño ocasionado dentro de la pared arterial, por lo que se hace necesario favorecer el uso de simulaciones numéricas. Los fenómenos inelásticos asociados a la degradación de este biomaterial se han reproducidos numéricamente utilizando modelos de daños, los cuales se pueden dividir en tres categorías: determinísticos, probabilísticos y de daño en base a la microestructura de las fibras de colágeno.33 Los dos últimos tipos de modelos son anisotrópicos solamente.
En los modelos determinísticos presentados por autores como Waffenschmidt, Weisbecker y otros34,35 se utiliza una función de energía pseudo elástica, con la incorporación de variables de la mecánica de daño continuo para tener en cuenta el efecto de ablandamiento en tejidos blandos isotrópicos o anisotrópicos. Los modelos probabilísticos formulados en otras investigaciones 36,37 tienen en cuenta un análisis estadístico del daño mesoscópico en las fibras de colágenos, y en los que intervienen el efecto de reclutamiento de dichas fibras. En cambio, los modelos de daño en base a microestructura de fibras de colágeno analizados en otros estudios13,38,39 caracterizan el comportamiento de daño de las fibrillas de colágeno, y luego se integra en el nivel de tejido completo.
La mayoría de las investigaciones11,40 asumen que los modelos de daño se formulan a partir de las aportaciones aditivas de los componentes isotrópicos y anisotrópicos. Con un conjunto pequeño de parámetros se reproduce la degradación de la capacidad resistente tanto en la matriz extracelular como en las fibras de colágeno. Se adopta una variable de daño D (0≤D≤1) que describe el proceso de fallo inelástico del biomaterial.
Famaey y colaboradores16 consideran que el daño en la matriz afecta solo a la parte elástica isocórica de la deformación; mientras que otros investigadores como Balzani13 y Weisbecker 41tienen en cuenta el daño acumulado solamente en el término anisotrópico de la función de densidad de energía, por ejemplo, en las fibras de colágeno.
De lo expuesto hasta aquí queda claro la existencia de una serie de modelos de daño del tejido blando arterial, especialmente aquellos que tienen en cuenta la respuesta pasiva del biomaterial. El daño de los tejidos blandos reforzados con fibra puede ser tratado mediante el uso de funciones de energía actualizadas, que incluyen el reclutamiento de las fibras combinado con las variables de daño para describir el efecto de ablandamiento de la pared arterial.
Por otra parte, el modelo constitutivo anisotrópico de dos familias de fibras explica a nivel macroscópico los cambios en su forma, pero no de masa; mientras que a nivel microscópico manifiesta los cambios en la orientación de los componentes estructurales. El efecto del campo metabólico no fue tenido en cuenta, lo cual constituye una importante limitación a la hora de modelar una pared arterial sometida a transformaciones en sus propiedades mecánicas.
La comprensión de los mecanismos de daño tisular y el modelado preciso de dicho comportamiento puede contribuir al estudio de patologías como la aterosclerosis, al mejoramiento de los procedimientos quirúrgicos y al diseño de las geometrías de stent empleados en la inserción endovascular.
Incidencia del descontrol metabólico en el comportamiento bio-mecánico pasivo de la pared arterial
La diabetes mellitus (DM) es una enfermedad que se caracteriza por una elevación persistente de los niveles de glucosa en sangre. Los mecanismos por los que se producen dicha anomalía están relacionados con defectos en la secreción de insulina, resistencia a la acción de la insulina o ambas. Este riesgo se explica en parte por el descontrol metabólico de los hidratos de carbono y en el perfil lípido.42,43
El aumento persistente de la glucosa en sangre acelera la reacción entre azúcares y otras moléculas como las proteínas, los lípidos y los ácidos nucleicos, lo cual produce modificaciones por reducción de azúcares denominada glucosilación no enzimática. Esta reacción resulta en la formación de productos finales de la glucosilación avanzada, que se entrecruzan irreversiblemente con muchas macromoléculas tales como el colágeno, proteína que por su ubicación está siempre expuesta a la glucosa presente en los líquidos extracelulares, lo que la hace especialmente vulnerable a dicha glucosilación. Se producen, entonces, transformaciones estructurales que devienen alteraciones de la matriz extracelular de la pared arterial.44,45
La aparición de las anomalías antes señaladas es uno de los mecanismos más importantes implicados en el desarrollo de las complicaciones en la DM. La glucosilación del colágeno conlleva a un incremento de su contenido en la pared arterial, con una distribución más desorganizada y disfuncional. La destrucción de este constituyente contribuye al debilitamiento de la matriz extracelular, con la predisposición a mineralización por depósito de calcio y fósforo. En otras palabras, se alteran las propiedades mecánicas del colágeno con pérdida de la elasticidad y fuerza tensora al mismo tiempo que se incrementa la rigidez, lo que determina la pérdida de su funcionalidad.
Además, el patrón lipídico característico de la DM consiste en un aumento de la concentración de triglicéridos, disminución en los niveles de colesterol de las lipoproteínas de alta densidad (c-HDL), elevación moderada del colesterol de las lipoproteínas de baja densidad (c-LDL) y aumento en el número de las LDL pequeñas y densas.46-48
A partir de ciertas concentraciones plasmáticas de c-LDL ocurre también una oxidación progresiva de estas macromoléculas por medio de múltiples mecanismos, afectándose profundamente la expresión génica en las células endoteliales con su infiltración en la pared arterial, modificando de este modo la estructura y función vascular. En cambio, la glucosilación de las HDL incrementa su eliminación y con ello su vida media, que asociado a una alta respuesta de los triglicéridos favorece el aumento de la agregabilidad y adhesión plaquetaria a las células endoteliales disfuncionantes, así como al colágeno expuesto en las lesiones.
Todos los cambios descritos en la estructura de la pared arterial alteran de manera notable sus propiedades mecánicas y, por tanto, conducen a una variación en su capacidad de adaptación a las condiciones de flujo y de presión; o sea, se incrementa la rigidez arterial. Inicialmente, se muestran en la zona endotelial de la capa íntima hasta penetrar a las más internas de la pared arterial como la túnica media. Sin embargo, en la práctica clínica es difícil realizar un análisis cuantitativo que caracterice tales alteraciones.
CONSIDERACIONES FINALES
Se puede señalar, a modo de conclusiones, que las valoraciones realizadas en el presente estudio demuestran que los cambios en la estructura, composición y propiedades mecánicas de la pared arterial, debido a la acción del descontrol metabólico, requiere de la formulación de un modelo adecuado para representar esta realidad. Esto implica la necesidad de combinar variables mecánicas con parámetros bioquímicos para una mejor evaluación del riesgo cardiovascular.
Resulta claro que mediante un tratamiento estadístico se puede considerar las alteraciones de colesterol, triglicéridos y glucosa en sangre como punto de partida para analizar la influencia del descontrol metabólico en el comportamiento biomecánico de la pared arterial. Dicho tratamiento puede ser insertado en los modelos constitutivos anisotrópicos de dos familias de fibras de colágeno.
Lo antes planteado está en correspondencia con uno de los grandes retos que presenta la comunidad científica en la actualidad: el ajuste de los modelos constitutivos a las características del individuo o de una determinada población, afectados por uno o varios factores de riesgo.
La integración de la biomecánica tisular con estudios clínicos puede contribuir significativamente a un mejor conocimiento del comportamiento biomecánico de la pared arterial y, por tanto, una mejor evaluación de las enfermedades vasculares como la aterosclerosis.
Conflictos de intereses
Los autores del trabajo expresan que no hay conflictos de intereses relacionados con el artículo (económico, laboral, étnico o personal).
REFERENCIAS BIBLIOGRÁFICAS
1. González Carbonell RA, Nápoles Padrón E, Calderín Pérez B, Cisneros Hidalgo Y, Landín Sorí M. Carácter interdisciplinario de la modelación computacional en la solución de problemas de salud. Humanidades Méd. 2014;14(3):646-58.
2. Doblaré Castellanos M, Alarcón Álvarez E. Retos y oportunidades de la investigación transdisciplinar reflexión sobre el papel de la mecánica de materiales en biomedicina. Madrid: Universidad Politécnica de Madrdi; 2008. Acceso: 10/08/2017. Disponible en: http://oa.upm.es/25541/1/Retos.pdf
3. Humphrey JD, Yin FCP. A new constitutive formulation for characterizing the mechanical behavior of soft tissues. Biophys J. 1987;52(4):563-70.
4. Gasser TC, Ogden RW, Holzapfel GA. Hyperelastic modelling of arterial layers with distributed collagen fibre orientations. J R Soc Interface. 2006;3(6):15-35.
5. Campos Arias D, Rodríguez Madrigal M, Olmo Velázquez A, Palomares Ruiz JE. Determinación de la rigidez arterial empleando simulación computacional. Rev Mex Ing Bioméd. 2015;36(3):223-32.
6. Karimi A, Shojaei A, Hassani K, Faghihi Sh. Study of plaque vulnerability in coronary artery using Mooney-Rivlin model: a combination of finite element and experimental method. Biomed Eng Appl Basis Commun. 2014;26(01):1-7.
7. Camue Corona E, González Carbonell RA, Cisneros Hidalgo YA, Oropeza Rodríguez YE, Pérez Rivero EO. El tejido blando arterial y la correlación de parámetros biomecánicos con aspectos clínicos. Rev Cubana de Invest Bioméd. 2015;34(2):122-35.
8. Kamenskiy AV, Dzenis YA, MacTaggart JN, Lynch TG, Jaffar Kazmi SA, Pipinos II. Nonlinear mechanical behavior of the human common, external, and internal carotid arteries in vivo. J Surg Res. 2012;176(1):329-36.
9. Isaza López JA. Comportamiento mecánico de tejidos blandos tipo multicapa [tesis]. Medellín: Universidad Nacional de Colombia; 2013.
10. Otero Martínez D, Otero Pereiro LL. Modelos constitutivos para paredes arteriales, descripción del movimiento y estado de deformación. Ingeniería Mec. 2014;17(3):195-204.
11. Balzani D, Brinkhues S, Holzapfel GA. Constitutive framework for the modeling of damage in collagenous soft tissues with application to arterial walls. Comput Methods Appl Mech Engrg. 2012;213-216:139-51.
12. Famaey N, Sommer G, vander Sloten J, Holzapfel GA. Arterial clamping: Finite element simulation and in vivo validation. J Mechanical Behav Biomed Mater. 2012;12:107-18.
13. Balzani D, Schmidt T, Schriefl AJ, Holzapfel GA. Constitutive modeling of damage mechanisms in arterial walls and related experimental studies. Proceedings of XLI International Summer School-Conference, Adavanced Problems in Mechanics. Saint Petersburg, Russia: Conference; 2013.
14. Holzapfel GA, Ogden RW. Constitutive modelling of arteries. Proc R Soc A: Mathematic Physic Eng Sciences. 2010;466(2118):1551-97.
15. Cabrera Fischer EI, Zócalo Y, Lascano EC, Negroni JA, Wray S, Bia D. La adventicia arterial: actor olvidado del sistema cardiovascular. Rev Urug Cardiol. 2015;30(1):58-65.
16. Famaey N, Kuhl EA. Three-constituent damage model for arterial clamping in computer-assisted surgery. Biomech Model Mechanobiol. 2013;12(1):123-36.
17. Fernández Collazo G, Rodríguez Moliner T. Evolución de los modelos constitutivos de respuesta pasiva para paredes arteriales. Ingeniería Mec. 2014;17(3):234-44.
18. Bellomo FJ. Simulación numérica del comportamiento mecánico en vivo de tejidos biológicos blandos [tesis]. Argentina: Universidad Nacional de Salta; 2011.
19. kim J, Wagenseil JE. Bio-chemo-mechanical models of vascular mechanics. Ann Biomed Eng. 2015;43(7):1477-87.
20. Fung YC, Fronek K, Papitucci P. Pseudoelasticity of arteries and the choice of its mathematical expression. Am J Physiol. 1979;237(5):H620-31.
21 .Brinkhues S. Modeling and simulation of arterial walls with focus on damage and residual stresses [tesis]. Essen: Universit ?at Duisburg-Essen; 2012.
22. Nolan DR, Destrade M, Ogden RW, McGarry JP. A robust anisotropic hyperelastic formulation for the modelling of soft tissue. J Mech Behav Biomed Mater. 2014;39:48-60.
23. Khamdaengyodtai P, Vafai K, Sakulchangsatjatai P, Terdtoon P. Effects of pressure on arterial failure. J Biomech. 2012;45(15):2577-88.
24. Gundiah N, Ratcliffe MB, Pruitt LA. Determination of strain energy function for arterial elastin: Experiments using histology and mechanical tests. J Biomech. 2007;40(3):586-94.
25. Tsamis A, Krawiec JT, Vorp DA. Elastin and collagen fibre microstructure of the human aorta in ageing and disease: a review. J R Soc Interface. 2013;10(83):20121004.
26. Sommer G, Holzapfel GA. 3D constitutive modeling of the biaxial mechanical response of intact and layer-dissected human carotid arteries. J Mechan Behav Biomed Mater. 2012;5(1):116-28.
27. Holzapfel GA, Gasser TC, Ogden RW. A new constitutive framework for arterial wall mechanics and a comparative study of material models. J Elasticity. 2000;61(1-3):1-48.
28.Holzapfel GA. Ogden RW. Modelling the layer-specific tree-dimensional residual stresses in arteries, with an application to the human aorta. J R Soc Interface. 2010;7(46):787-99.
29. Kewei L. Ogden RW, Holzapfel GA. Modeling fibrous biological tissues with a general invariant that excludes compressed fibers. J Biomech Phys Solids. 2016;110(2018):38-53.
30. Schriefl A, Reinisch AJ, Sankaran S, Holzapfel GA. Quantitative assessment of collagen fibre orientations from two-dimensional images of soft biological tissues. J R Soc Interface. 2012;9(76):3081-93.
31. Schriefl AJ, Zeindlinger G, Pierce DM, Regitnig P, Holzapfel GA. Determination of the layer-specific distributed collagen fibre orientations in human thoracic and abdominal aortas and common iliac arteries. J R Soc Interface. 2012;9(71):1275-86.
32. Hill MR, Dinjie D, Gibson GA, Holzapfel GA, Robertson AM. A theoretical and non-destructive experimental approach for direct inclusion of measured collagen orientation and recruitment into mechanical models of the artery wall. J Biomech. 2012;45(5):762-71.
33.Wenguang L. Damage Models for soft tissues: A survey. J Med Biol Eng. 2016;36:285-307.
34. Waffenschmidt T, Polindara C, Menzel A, Blanco S. A gradient-enhanced continuum damage model with application to fibre-reinforced tissues at finite strains. Comput Meth Appl Mech Engrg. 2014;268:801-42.
35. Weisbecker H, Pierce DM, Regitnig P, Holzapfel GA. Layer-specific damage experiments and modeling of human thoracic and abdominal aortas with non-atherosclerotic intimal thickening. J Mech Behav Biomed Mater. 2012;12:93-106.
36. Blanco S, Polindara CA, Goicolea JM. A regularised continuum damage model based on the mesoscopic scale for soft tissue. International J Solids Structures. 2015;58:20-33.
37. Schmidt T, Balzani D, Holzapfel GA. Statistical approach for a continuum description of damage evolution in soft collagenous tissues. Comput Meth Appl Mech Engrg. 2014;278:41-61.
38. Sáez P, Alastrué V, Peña E., Doblaré M, Martínez MA. Anisotropic microsphere-based approach to damage in soft fibered tissue. Biomech Model Mechanobiol. 2012;11(5):595-608.
39. Sáez P, Peña E, Martínez MA. A Structural Approach Including the Behavior of Collagen Cross-Links to Model Patient-Specific Human Carotid Arteries. Ann Biomed Eng. 2014;42(6):1158-69.
40. Maher E, Creane A, Caitríona L, Kelly DJ. An anisotropic inelastic constitutive model to describe stress softening and permanent deformation in arterial tissue. J Mech Behav Biomed Mater. 2012;12:9-19.
41. Weisbecker H. Softening and Damage Behavior of Human Arteries. Computation in Engineering and Science. 25. Graz: Verlag der Technischen Universität Graz; 2014.
42. Wacher Rodarte NH, Gómez Díaz RA, Casas Saavedra L. Causas de descontrol metabólico en pacientes con diabetes en atención primaria en el Instituto Mexicano del Seguro Social (IMSS). Rev Invest Clin. 2014;66(4):369-78.
43. Muraira Cárdenas LC, Barrios Pérez M. Efecto del descontrol metabólico de la diabetes mellitus (DM) sobre el índice de resistencia (IR) de las arterias renales interlobares evaluado con Doppler pulsado. Gac Méd Mex. 2016;152:213-7.
44. Xue B, Zhangjie W, Chengcai H, Zhe W, Lianli C. Investigation of Non-Enzymatic Glycosylation of Human Serum Albumin Using Ion Trap-Time of Flight Mass Spectrometry. Molecules. 2012;17:8782-94.
45. Bracho Nava M, Stepenka Alvarez V, Sindas Villasmil M, Rivas de Casal Y, Bozo de González M, Duran Mojica A. Hemoglobina glicosilada o hemoglobina glicada, ¿Cuál de las dos? Rev Multidiscipl Consejo Investig Universidad de Oriente. 2015;27(4):521-29.
46. Cuevas A, Rodrigo A. Dislipidemia diabética. Rev Med Clin Condes. 2016;27(2):152-9.
47. Zeqollari A. SK, Vyshka G., Çakërri L. Lipid Profile in Diabetes Mellitus Type 2 Patients in Albania and the Correlation with BMI, Hypertension, and Hepatosteatosis. J Family Med Community Health. 2014;1(4):1018.
48. Pandeya A, Sharma M, Regmi P, Basukala A, Lamsal M. Pattern of dyslipidemia and evaluation of non-HDL cholesterol as a marker of risk factor for cardiovascular disease in type 2 diabetes mellitus. Nepal Med Coll J. 2012;14(4):278-282.
Recibido: 21/12/2017
Aceptado: 24/04/2018
Ms. C. Ernesto Camue Corona. Facultad de Electromecánica. Universidad de Camagüey "Ignacio Agramonte Loynaz". Circunvalación Norte, km 5½ s/n, entre Camino Viejo de Nuevitas y Avenida Ignacio Agramonte. Camagüey. Cuba. C.P. 74670.
Correo electrónico: ecamue2017@gmail.com














.jpg)

