Introducción
Las úlceras de miembros inferiores son el resultado final de un síndrome multilesional caracterizado por pérdida de sustancia, que llega hasta la dermis, hipoxia hística con la posterior necrosis y estasis, con poca tendencia a la curación. A menudo estas tienen un curso crónico o recidivante, sobreinfectado e irritado por los agentes externos.1,2
También constituyen una patología importante en la práctica diaria de los profesionales de la salud y en todos los niveles de asistencia, con gran prevalencia en la actividad asistencial de los angiólogos y cirujanos vasculares.3 Aunque las úlceras pueden responder a múltiples etiologías -que van desde las bacterianas, parasitarias, autoinmunes, endocrina entre otras-, la mayoría corresponden a fenómenos vasculares, ya sea arteriales o venosos. Dentro de estas últimas, las venosas o flebostáticas resultan las más frecuentes.2,4)
Aproximadamente del 75 % al 90 % de los casos corresponden a insuficiencia venosa crónica (IVC), producto a la hipertensión venosa por el reflujo, la obstrucción o la insuficiencia de la bomba muscular de la pantorrilla, lo que afecta el sistema venoso. Comúnmente se hallan en el tercio inferior de la pierna, desde la pantorrilla hasta al tobillo, o sea, por encima de los maléolos.5 De forma normal aparece en la región supramaleolar interna, aunque también puede aparecer en la zona externa o situarse ligeramente hacia arriba a la altura de media pantorrilla. El tamaño es variable y se caracteriza por la falta de dolor -excepto cuando están infectadas.3
Las úlceras venosas de la pierna constituyen una zona de discontinuidad epidérmica que persiste durante cuatro o más semanas y representan el extremo más grave de la enfermedad venosa crónica.6 El origen de las úlceras flebostáticas se debe a dos procesos principales: las várices esenciales o primarias (úlceras varicosas), que son las más frecuentes, y a la enfermedad posflebítica secundaria a una trombosis venosas profundas (TVP) (úlceras posflebíticas o postrombóticas), que aparecen con menos frecuencia -también pueden ser secundarias a traumas.7
Las úlceras primarias o varicosas se desarrollan espontáneamente como consecuencia de la hipertensión venosa. El reflujo venoso provoca una caída menos pronunciada de la presión venosa que en el ejercicio normal. Las úlceras venosas primarias no distinguen de las úlceras secundarias -por ejemplo, a un traumatismo o a una TVP- mediante la historia y la exploración física básica.7
Se cuenta con varias teorías para explicar la patogénesis de las úlceras venosas y la enfermedad venosa crónica, pero una sola no explica por completo el proceso. Algunos especialistas especulan que pueden ocurrir alteraciones en la piel, tanto porque la hipertensión venosa interfiere con el suministro de nutrientes a la piel y los tejidos subcutáneos como por la hipoxia que se produce en el tejido. Hay evidencias de capilares agrandados con depósitos de fibrina pericapilar en los tejidos vecinos a la úlcera venosa. No hay pruebas de que las deficiencias del flujo de nutrientes o de la difusión del oxígeno estén asociadas a estos cambios.8
Los estudios de la microcirculación demuestran que la hipoxia no resulta la causa de la ulceración venosa. La hipertensión venosa conduce a la extravasación de glóbulos rojos y macromoléculas, lo que a su vez conduce a la inflamación de las venas de la microcirculación venosa y a la migración de leucocitos a la dermis. Esto provoca una cascada de eventos patológicos, en los que el factor de crecimiento transformador tiene un papel importante que da lugar a la fibrosis dérmica, la lipodermatoesclerosis y, finalmente, a la ulceración.7
El diagnóstico de infección de la úlcera se asume únicamente basado en signos clínicos como: eritema periulceroso, edema, aumento de temperatura con respecto al resto de la extremidad, celulitis, incremento de exudado y cambios en su aspecto (purulento y maloliente). Además, hay reaparición de dolor en úlceras antes asintomáticas, y síntomas sistémicos como fiebre y leucocitosis. El control se realiza con el desbridamiento o la limpieza de la úlcera, y la administración de antibióticos sistémicos o tópicos, según sea el caso.8
Las úlceras venosas, como el resto de las úlceras de la piel, constituyen un medio ideal para el crecimiento bacteriano; en estas puede cultivarse también una gran variedad de otros microorganismos. Hay hallazgos que sugieren que del 80 % al 100 % de las úlceras pueden estar colonizadas por bacterias.8,9 Las úlceras crónicas pueden presentar una microbiota más compleja, que incluyen Enterococcus spp. y otras entero-bacterias, microorganismos anaerobios estrictos, Pseudomonas aeruginosa; y, en ocasiones, por bacterias gram negativas no fermentadoras. En pacientes que viven en clima cálido y húmedo como el de Cuba con frecuencia se observa también contaminación micótica, principalmente por Candida spp. El retraso en la curación se debe a la densidad bacteriana, la diversidad de microorganismos presentes y las interacciones entre ellos.8
El antibiograma constituye la pauta para la selección del antibiótico para el tratamiento específico de la infección. No obstante, en situaciones clínicas de infección evidente y grave es correcto proceder a la prescripción empírica de antibióticos, de acuerdo con el grado de infección. Los antibióticos ideales deben resultar de amplio espectro de actividad, baja generación de resistencia y baja toxicidad selectiva para humanos.10
En Estados Unidos se considera que las úlceras venosas causan una pérdida de aproximadamente 2 millones de días laborales y los costos del tratamiento se acercan a 3 billones de USD por año para más de 6 millones de pacientes.11 El pronóstico global de las úlceras venosas en las extremidades inferiores es bastante pobre: solo el 50 % cicatrizan a los cuatro meses, y el 20 % permanecen abiertas a los dos años y el 8 % a los cinco años. 12 A estos costes y pronósticos contribuyen en gran medida la presencia de infecciones en las úlceras, por lo que contar con un mapa microbiológico con los patrones de sensibilidad antibiótica en las unidades asistenciales es importante para establecer políticas de tratamientos empíricos más específicos sin que se cuente con el antibiograma en el momento de solicitar antibioticoterapia.
El objetivo del estudio fue caracterizar los gérmenes bacterianos aislados con frecuencia en las úlceras flebostáticas de los pacientes ingresados.
Métodos
Se realizó un estudio descriptivo, retrospective y de corte transversal en 60 pacientes ingresados, entre julio de 2016 y junio de 2017, en el servicio de flebolinfología del Instituto Nacional de Angiología y Cirugía Vascular por el diagnóstico de úlceras flebostáticas. En todas las historias clínicas se constató la firma del consentimiento infirmado para realizar los procederes necesarios.
Las variables de estudio fueron: tipo de úlcera flebostática, aislamiento bacteriano y patrón de sensibilidad antimicrobiana.
El grupo se dividió según el tipo de úlcera flebostática del modo siguiente:
Úlceras varicosas: las asociadas con várices o a insuficiencia venosa.
Úlceras posflebíticas o postrombóticas: que aparecen como secuela de una tromboflebitis o de una trombosis venosa.
Se tuvo en cuenta el resultado del cultivo microbiológico de la lesión para identificar los gérmenes bacterianos aislados.
Para el análisis del patrón de sensibilidad antimicrobiana de los antibióticos que se informaron en el resultado del antibiograma, se utilizó el siguiente criterio:
Sensible: cuando un antibiótico destruye una bacteria o inhibe su crecimiento in vitro.
Sensibilidad intermedia: cuando un antibiótico no destruye totalmente a la población bacteriana o no inhibe totalmente su crecimiento in vitro.
Resistente: cuando un germen impide al antibiótico su acción o la inhibición de su crecimiento in vitro.
Análisis estadístico
Se confeccionó una base de datos con los resultados de todas las variables en Microsoft Excel. Se utilizó la estadística descriptiva de las variables cualitativas mediante las frecuencias absolutas y relativas correspondientes.
Consideraciones éticas
La investigación respetó los principios bioéticos que van implícitos en los estudios con seres humanos según los planteamientos recogidos en la Declaración de Helsinki.13 Fue imprescindible e inviolable la firma del documento de consentimiento informado firmado por parte del paciente y su médico de asistencia.
Resultados
Se encontró un predominio de úlceras varicosas 67 % en relación con el total de 60 úceras flebostáticas, incluidas en este estudio, de las que el 33 % fueron de origen postrombóticas.
La tabla 1 muestra la caracterización de los cultivos microbiológicos relacionado con el tipo de lesión identificada.
Tabla 1 Características de los cultivos microbiológicos de los gérmenes aislados según tipo de úlcera

Nota: Los porcentaje se calcularon al tener en cuente el total de la muestra en cada grupo.
Fuente: Base de datos.
Se identificaron un total de 50 gérmenes, lo que representó un 83,3 % de rendimiento; de ellos 40 aislados de pacientes con úlceras varicosas y 10 de úlceras postrombóticas. Se observó una mayor frecuencia de gérmenes gram negativo (72 %). El 50 % de los aislados en las muestras fueron Pseudomonas spp., independientemente del tipo de úlcera, aunque la mayor proporción se encontró en las úlceras postrombóticas con respecto a las varicosas (60 % vs. 47,5 %). En el caso de las bacterias gran positivas, el 16 % correspondieron al Staphylococcus aureus según detalla la Tabla 2.
Tabla 2 Respuesta a la coloración de gram de los gérmenes aislados según tipo de úlcera
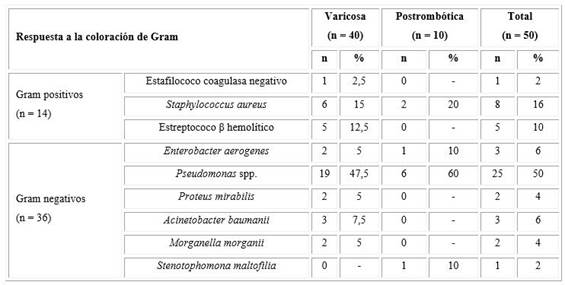
Nota: Los porcentajes se calcularon sobre la base del total de aislados identificados según el tipo de úlcera.
Fuente: Base de datos.
En la tabla 3 se muestran los patrones de sensibilidad antimicrobiana en la que se aprecia que os antimicrobianos con mayores porcentajes de sensibilidad in vitro frente a los gérmenes aislados resultaron ser: Clindamicina, Tobramicina, Ciprofloxacino, Amikacina, Co-trimoxazol, Cefepime, Doxiciclina, Cloranfenicol, Meropenem, las Penicilinas y el Aztreonam. Mientras que las combinaciones Ampicillina/Amoxicillina y Amoxacillina/Ácido clavulánico fueron resistentes para el 100 de los gérmenes aislados.
También se obtuvieron altas frecuencias de resistencia a la Eritromicina, Azitromicina, Oxacillina, Ceftazidima y la Cefuroxima. Por otra parte, se observó sensibilidad intermedia para Ampicillina/Sulbactan, Piperazilina/Sulbactan, Ceftazidima, Cefepime, Aztreonan, Ciprofloxacino y Amikacina.
Discusión
Pugliese14) planteó a las úlceras venosas de los miembros inferiores como la causa más común de las heridas crónicas de las piernas, pues representan hasta el 70 % de todas las úlceras crónicas que conllevaban una morbilidad significativa, especialmente en los pacientes de edad avanzada. Señaló también que estas eran susceptibles a la invasión microbiana y podían conducir a complicaciones graves, como el retraso en la cicatrización, la celulitis, el aumento del tamaño de la herida, el dolor debilitante y las infecciones de heridas más profundas que causan enfermedades sistémicas.
El cultivo bacteriano convencional es una herramienta ampliamente disponible para el diagnóstico de una infección bacteriana. Sin embargo, puede tener limitaciones, ya que muchos de estos microorganismos pueden producir asociaciones (bio-películas) y convivir varias especies en un mismo lugar. Exiten especies viables que no son cultivables.14
En este estudio, en el 16,7 % de pacientes se dejó de realizar el cultivo microbiológico de la lesión a pesar de que se conoce que en el tratamiento de la úlcera venosa infectada desempeñan un papel importante en la evolución de los pacientes que la padecen.
Las úlceras venosas son colonizadas con frecuencia por bacterias gram positivas y gram negativas, en su mayoría miembros de la microbiota normal de la piel, u otras que llegan al sitio de infección porque se transportan hacia allí. Hay que recordar que en el estudio Pseudomonas spp. y Staphylococcus aureus predominaron. Estos hallazgos están en correspondencia con Dos Santos y otros15 y Bessa y colaboradores,16 quienes encontraron además infección polimicrobiana en el 27,1 %. Estos autores llegaron a la conclusión de que la infección de la úlcera tiene un desempeño relevante en el desarrollo de la cronicidad de la lesión, al retrasar su curación.
En el ambiente hospitalario el interés por la resistencia de algunos de estos microorganismos a los antibióticos resulta cada vez mayor, por lo que se establecen medidas preventivas, principalmente para aquellos microorganismos multidrogo-resistentes.16)
A pesar de haber encontrado en el estudio bacterias resistentes a diferentes antibióticos e, incluso, con resistencia intermedia, no se analizó el patrón de multiresistencia, lo que se traduce en una limitación para el estudio.
Cabe señalar que, a pesar de haber encontrado un predominio de úlceras varicosas, los estudios revisados no hacen distinción entre los tipos de úlceras flebostáticas;14-19) aquí se quiso hacer la división en varicosas y postrombóticas por tener diferencias en sus características.
A pesar de haber hallado altas frecuencias de sensibilidad antimicrobiana contra los aislados donde se probaron, no se pudieron comprobar sus patrones de susceptibilidad frente a la Vancomicina y el Linezolid; Resultados que están en correspondencia con los mostrados por Bessa y otros,15 Además también son coincidentes con lo reportado por Serra y otros18, al señalar que tanto el Staphylococcus aureus y la Pseudomonas aeruginosa son las bacterias más comúnmente aisladas de las úlceras flebostáticas crónicas. Ambas pueden expresar factores de virulencia, como las proteínas de superficie, que afectan la cicatrización de la lesion; no obstante, la presencia de las dos juntas resulta más virulenta que la infección de cada una por separado.
El encontrar infección polimicrobiana en las úlceras de algunos pacientes pudo haber influido en el análisis posterior de los patrones de sensibilidad antibiótica.
Se conoce que Staphylococcus aureus y Pseudomonas aeruginosa tienen resistencia intrínseca y adquirida a los antimicrobianos, lo que hace que el tratamiento clínico de la infección sea un desafío real, particularmente en pacientes con comorbilidades. Por lo tanto, un diagnóstico correcto y rápido del agente causal de la infección requiere un conocimiento detallado de la microbiota bacteriana de la piel. Este es un requisito previo necesario para el tratamiento farmacológico personalizado, la mejora de los síntomas y la reducción de los efectos secundarios, y la resistencia a los antibióticos.
Se ha planteado que la selección de las terapias tópicas y sistémicas para el tratamiento de las úlceras venosas con signos de infección es un reto y debe ir acompañada de medidas de precaución específicas para la protección contra la contaminación cruzada en presencia de microorganismos resistentes a múltiples fármacos. Sin embargo, no hay indicadores clínicos para esta situación, y la confirmación de las cepas resistentes se produce a través del cultivo y la sensibilidad, que puede tomar hasta 14 días. Durante este período, las medidas de protección ya no pueden tomarse, lo que contribuye a la propagación de estos patógenos.15
Dos Santos y otros15 encontraron que no hubo relación entre los signos y síntomas de infección en las úlceras venosas y la presencia de Staphylococcus aureus y de Pseudomonas spp. resistentes a múltiples fármacos. Concluyeron que al tener en cuenta el porcentaje de cepas resistentes, para una atención segura, se deben implementar medidas de precaución de contacto en las salas de tratamiento, además de las precauciones estándar.
A diferencia de lo planteado hasta el momento, Ortiz y otros19) encontraron un mayor número de infecciones producidas por enterobacterias (52 %, p = 0,002) y en menor frecuencia por Staphylococcus aureus (24 %, p < 0,001); el 41 % de ellos eran meticilinresistentes (SAMR, por sus siglas en inglés). Se considera que estos resultados pudieron estar influenciados por que los autores analizaron una población de edad avanzada y encamados en su mayoría por mucho tiempo, con incontinencia fecal, por lo que pudo producirse contaminación cutánea distal debido a la microbiota entérica. Si bien en la presente investigación no se analizó la edad de los pacientes, sí se puede plantear que no eran tan longevos y podían moverse. Pero se aislaron enterobacterias en las muestras, que no constituyen microbiota normal de la piel.
En un estudio realizado en 2016, con el uso de técnicas moleculares para el análisis de los gérmenes aislados de las úlceras, se enfatizó en la compleja ecología de estas. Se encontró que la media del número de bacterias por úlcera, expresado como frecuencia relativa, tuvo un rango entre 1,6 % y 4,4 %. También se halló en el estudio que las úlceras que no tuvieron signos de infección podían presentar más de una especie bacteriana.20)
Lo anterior sugiere la importancia de tener a la mano los resultados de los cultivos microbiológicos de las úlceras, independientemente de que no se observen los signos de infección.
Georgescu y colaboradores21) informaron que la alta frecuencia de infecciones por Pseudomonas spp. se debe a que es una bacteria con un sin número de atributos patogénicos que facilitan la entrada y el establecimiento del daño. Ellos pudieron identificar toxinas formadoras de poros y enzimas que se expresan en proporciones variables, entre las que se encontraban la beta hemolisina (92,3 %), la lipasa (76,9 %) y la lecitinasa (61,5 %). Los genes de virulencia que detectaron con más frecuencia en las cepas analizadas fueron el exoT (100 %) y el algD (92,3 %), que codifican para las fosfolipasas (84,6 %) y para la proteasa IV (61,5 %).
Bui y otros22 demostraron que las úlceras con más de 10 cm2 eran las más propensas a infectarse con Pseudomonas spp. Precisamente esta representa otra limitante del presente estudio, ya que no se informan las dimensiones de las úlceras y su relación con las características de los pacientes; también, el hecho de no haber realizado un estudio de bio-películas en los pacientes, al considerar que muchos de los resultados observados pudieron deberse a la formación de estas.
Al respect, Malone y otros,23) al conducir estudios en animales de experimentación en modelos in vitro e in vivo, señalaron la presencia de bio-películas en heridas crónicas que no cicatrizan, aunque se han realizado pocos estudios de este tipo en humanos. En un meta-análisis realizado por ellos se encontró una prevalencia de bio-películas en heridas crónicas del 78,2 % (p < 0,002]), lo cual respalda suposiciones clínicas de que estas asociaciones están presentes en las heridas crónicas no curativas en humanos.
Se concluye que la Pseudomas spp. fue el germen bacteriano que más se aisló en los pacientes con úlceras varicosas y postrombóticas, y se manifestó sensibilidad a 11 de los 23 antibióticos que se probaron in vitro en más del 50 % de los aislados a los que se enfrentaron.















