Introducción
Al declararse la pandemia causada por el virus SARS-CoV-2, diversos artículos científicos resaltaron los mecanismos fisiopatogénicos que explicaban la repercusión de la “tormenta de citocina” como biomarcadores clave del daño celular y tisular desencadenado por el virus, expresado en una intolerancia inmunitaria que, con suficiente intensidad y persistencia, deviene en un factor de riesgo de mortalidad por COVID-19.1,2) La mayoría de estos enfermos tienen antecedentes de comorbilidades del eje hepato-intestinal (cirrosis hepática de etiología diversas, hepatopatías metabólicas crónicas, enfermedades inflamatorias intestinales crónica, malabsorción intestinal, etcétera), asociadas a trastornos metabólicos del colesterol y la glucemia, lo cual permite inferir que sus derivados metabólicos podrían actuar como agentes biomoleculares de la amplificación y perpetuación del proceso inflamatorio endotelial originado por el SARS-CoV-2, como en el caso de los ácidos biliares, metabolitos del destino final del colesterol hepático.3,4
Los ácidos biliares son moléculas de señalización que, por sus actividades biológicas, se reconocen con doble acción: la antiinflamatoria, en condiciones fisiológicas, y la proinflamatoria, en las no fisiológicas. En condiciones fisiológicas, estos controlan la angiogénesis;5 pero en las no fisiológicas, según estudios in vivo e in vitro, están vinculadas a la endotelitis por su asociación con la disfunción del eje hepato-intestinal resultante del descontrol homeostático de la síntesis de los ácidos biliares.6,7
La descripción de los receptores nucleares (farnesoide X: RFX) y del acoplado a la proteína G de Takeda de membranas o factor de crecimiento epidérmico 5 (RTG5), ubicados en las membranas de las células endoteliales, justifican las acciones biológicas de los ácidos biliares, al actuar como ligandos endógenos y, en el mantenimiento de la integridad endotelial. Pero, al existir una disfunción del eje hepato-intestinal, que origina el descontrol de sus propiedades físico-químicas y su homeostasis, los ácidos biliares invierten sus acciones y efectos tisulares, de modo que los hace actuar como antagonistas de los receptores y se convierten en detergentes fuertes, amplificadores de la respuesta inflamatoria; por ende, en agentes proinflamatorios e inductores de intolerancia inmunitaria.
También incrementan la secreción de otros agentes proinflamatorios como las citocinas, los eicosanoides, los neuropéptidos y el sistema del complemento, cuyas acciones tóxicas sobre el endotelio dan lugar a la endotelitis.8,9,10,11,12 Mientras, estudios recientes reportan la acción potente de los ácidos biliares sobre el receptor ACER2 (renina angiotensina 2), ubicado también en el endotelio vascular.13,14
El objetivo de este artículo fue describir las evidencias biomoleculares de la citotoxicidad de los ácidos biliares sobre el endotelio y la posible relación con la endotelitis descrita en los cortes histológicos de tejidos de fallecidos por la COVID-19, asociada o no a las comorbilidades conocidas.
Métodos
El método consistió en una revisión (en los sitios web PubMed, SciELO, Lilacs y Elservier), sistemática y crítica, en idioma español e inglés, sobre ácidos biliares y endotelitis, desde 1963 hasta 2022. Se utilizó como criterios de selección un índice de materia médica; como palabras clave: ácidos biliares, endotelio vascular, célula endotelial, SARS-CoV-2 y COVID-19; y como abreviaturas: ácido biliar (AB), endotelio vascular (EV) y células endoteliales (CE). Se citaron los hallazgos histomorfológicos del tejido pulmonar luego de examinarse las historias clínicas, los protocolos de autopsia y los cortes histológicos del pulmón en 34 fallecidos en el Hospital Militar Central “Luis Díaz Soto”. Esto se realizó en conjunto con especialistas del departamento de Anatomía Patológica del Hospital Docente Clínico Quirúrgico “Hermanos Ameijeiras”. Para el procesamiento -de rutina- de las muestras histológicas se usaron técnicas histológicas convencionales como la fijación inmediata en formol, la imbibición en parafina, y los cortes histológicos a 4 µm y su observación bajo microscopio de luz con coloración mediante hematoxilina y eosina (H&E).
Endotelio
El endotelio es un órgano verdadero, dinámico, heterogéneo y diseminado, que garantiza el equilibrio salud-enfermedad mediante la síntesis y secreción de diversos productos esenciales. Está conformado por monocapas de células unidas, denominadas células endoteliales, que forman un epitelio simple plano con espacios intercelulares, y vesículas pinocíticas y endocíticas. Las células endoteliales, al revestir los vasos sanguíneos y las cavidades cardíacas, actúan como barrera semiselectiva entre el plasma y las células tisulares con propiedades no trombogénicas por su alto contenido de sulfato de heparán, que inactivan la cascada de la coagulación, al activar las proteasas antitrombínicas. Sus acciones principales consisten en regular la permeabilidad vascular; controlar el tono vasomotor, la migración celular, la absorción de nutrientes; y mantener la fluidez sanguínea y la angiogénesis.15,16
En las membranas de las células endoteliales se han identificado receptores nucleares y el RTG5, cuyas funciones, activadas por los ácidos biliares, atribuyen al endotelio un eficaz control energético y metabólico.15,16 Estudios biomoleculares reportan que las células endoteliales expresan moléculas de adhesión intercelular 1 (ICAM-1) y de adhesión de células vasculares proteína 1 (VCAM-1), que participan en la angiogénesis; también, metabolitos lipídicos endógenos que conservan su integridad, funcionabilidad y modulan la inflamación como son: los fosfatos lipídicos derivados de la esfingosina-1-fosfato (S1P), los productos de oxidación: fosfolípidos:1-palmitoil-2-araquidonil-glicerol-3-fosforilcolina oxidado (en inglés, PO3GA2P1); y los metabolitos de la ciclooxigenasa-1 (COX1): prostaglandina D2 (PGD2).17,18,19
Las células endoteliales, por medio de la enzima óxido nítrico sintetasa 3 (eONS) citoplasmática, sintetizan y secretan el óxido nítrico (ON), molécula versátil que actúa como mensajero intracelular y transcelular en el control de las funciones de la célula endotelial como la vasodilatación vascular, la acción antiagregante plaquetaria, fibrinolítica y la síntesis de prostaciclina. Por eso, la pérdida o disminución del ON es la clave en las fisiopatogenia de la arteriosclerosis, las hepatopatías crónicas y las vasculitis, entre otras.17,19,20
Sobre los procesos inflamatorios del eje hepato-intestinal, hay reportes que señalan la liberación de diversos agentes biomoleculares, como los ácidos biliares, cuyo descontrol homeostático, de sus actividades biológicas y propiedades físico-químicas genera la circulación de los ácidos biliares primarios, secundarios, hidrofílicos, hidrofóbicos, conjugados o no con taurina o glicina. En este artículo se destaca que, al predominar los ácidos biliares hidrofílicos conjugados con taurina, al interactuar con los receptores nucleares y el RTG5, mantienen la integridad anatomofuncional del endotelio; mientras que, al predominar los ácidos biliares hidrofóbicos conjugados con glicina, como ocurre en las hepatopatías crónicas de etiología diversas, originan un efecto antagónico sobre estos receptores y, por ende, generan una disfunción endotelial.21
Disfunción endotelial
La disfunción endotelial ocurre cuando los agentes proinflamatorios provocan la ruptura de las membranas celulares e incrementan la hiperpermeabilidad vascular, lo que permite la extravasación e infiltración persistente de leucocitos, generador del edema, la retención de los factores de crecimiento, la liberación de las citocinas, los eicosanoides y la activación del sistema de complemento.19 También estos originan los desequilibrios de Ca2+, K+, GTGc y del ON intracelular, disfunciones implicadas en la secuencia de la endotelitis aguda a la crónica, que es notoria, al asociarse a comorbilidades inmunitario-metabólicas, como la diabetes mellitus tipo 2, las inmunodeficiencias, las hepatopatías crónicas de etiologías diversas y la insuficiencia renal.19 Sin embargo, los metabolitos lipídicos endógenos tensan, destruyen y retardan la angiogénesis.20,22
Ácidos biliares primarios hidrofílicos conjugados con taurina e integridad endotelial
Los ácidos biliares primarios hidrofílicos conjugados con taurina mantienen la integridad del endotelio, al efectuar sobre él acciones antiinflamatorias y de tolerancia inmune. Y la taurina no conjugada ejerce, por sí misma, ambas acciones.9,23,24
La taurina no conjugada sobre el endotelio vascular, donde se sintetiza el ON, propicia la integridad endotelial gracias al incremento de los niveles, la biodisponibilidad, la expresión y la fosforilación de la eONS, la relación L-arginina/inhibidor de la eONS dimetilarginina asimétrica (en inglés ADMA), y de los antioxidantes endosando.9 Dicha integridad también se favorece con la conjugación de la taurina y los ácidos biliares hidrofílicos en el hígado, pues facilita actuar como ligando endógeno sobre los receptores nucleares RFX, TRG5 y muscarínicos 3 (M3). Esto, a su vez, incrementa la movilización de Ca2+ intracelular, la expresión del receptor del factor de crecimiento vascular (RFGEV2), las acciones de las metaloproteinasas de matriz (MMP-9), de la proteína de adhesión cadherina endotelial vascular (Cadherina-EV) y de barrera. Además, el metabolismo energético y la tubulogénesis endotelial garantizan la integridad endotelial y la angiogénesis.4,7,24,25,26
La acción antiinflamatoria de los ácidos biliares hidrofílicos conjugados con taurina aseguran aún más la integridad endotelial, pues, al interactuar con los receptores RFX, el 2 de esfingosina-1-fosfato (en inglés, S1PR2), las moléculas de adhesión ICAM-1, VCAM-1, la E-selectina y la eONS estimulan las vías de señalización del factor nuclear kappa de células B activadas (NF-kB) y de p38 MAPK.6,27,28
Otras evidencias plantean que la circulación alta de ácidos biliares hidrofóbicos conjugados a glicina, por ser potencialmente tóxicos, detergentes fuertes y proveedores de especies reactivas del oxígeno, al actuar como antagonistas de los receptores mencionados, frenan las acciones antiinflamatorias de los hidrofílicos conjugados con taurina, y generan una disfunción endotelial,6,29,30 tal y como se expresa en las alteraciones del eje hepato-intestinal, que conforman las comorbilidades reportadas en los enfermos graves y críticos por COVID-19.4,7,11,31
Ejemplos significativos de estas acciones se describen in vivo e in vitro con el ácido quenodesoxicólico (AQDC), que, al ser un hidrofílico conjugado con taurina y actuar sobre los receptores nucleares, estimula la expresión del RFGEV2 y de MMP-9, y disminuye la expresión de cadherina-EV y de las moléculas de glucoproteínas transmembranas dependientes de Ca2+, esenciales para mantener la adhesión celular a través de cadherina, de modo que garantiza la integridad de la capa endotelial y la angiogénesis.5
Estudios in vivo reportan que en los estados de hipoxemia durante el shock hipovolémico y el fallo multiórgano, la expresión en las células endoteliales del RFGEV2 es inducida también por la estimulación de la síntesis del factor HIF1α/β (en inglés α/β hipoxia-inducible factor), el cual, unido a los receptores endoteliales, activa la vía de tirosina-quinasa e induce la angiogénesis, al ejercer las acciones descritas en el cuadro,32,33 mientras controla los procesos de angiogénesis, curación y metástasis, al estimular la MMP-9, dependiente de zinc y cobalto; y descompone el colágeno intercelular.34
Cuadro Acciones del factor de crecimiento vascular (VEGF)
| Funciones del VEGFR 2 |
|---|
|
Angiogénesis ↑ Migración, mitosis de CE ↑ Actividad de la metano monooxigenasa y de la integrina Permeabilidad de la luz vascular Creación de las fenestraciones u orificios de los vasos Quimiotáctico (macrófagos y granulocitos) Vasodilatación (liberación de ON) Promueve angiogénesis en: inflamación crónica, cicatrización y tumores Estimula la supervivencia, la proliferación y la motilidad de las CE |
Leyenda: RFGEV2: receptores del factor de crecimiento vascular 2; CE. Célula endotelial, **ON: óxido nítrico.
Otra acción del AQDC hidrofílico conjugado con taurina es el control de la migración de células endoteliales, logrado por la regulación de la dinámica de anexión entre actina/cadherina-EV y la expresión de proteínas de adhesión, al estimular las cateninas de las uniones o zónula adherens. De igual modo, al resultar agonista del receptor TGR5, estimula la vía de señal AMPc dependiente/proteína quinasa A (PKA)/Rac1, acción clave en la angiogénesis, la estabilización, la diferenciación y la polaridad del tejido endotelial, que garantiza la unión célula-célula y la función de barrera endotelial.10,35,36 Sin embargo, el AQDC hidrofóbico conjugado con glicina, como antagonista de los receptores descritos, ejerce sus acciones expresadas en disfunción endotelial.37
Ácidos biliares secundarios hidrofóbicos e integridad endotelial
Los ácidos biliares secundarios hidrofóbicos conjugados con glicina tienen un efecto de toxicidad dependiente de la presencia o no de grupos -OH en su estructura. Estudios in vitro demuestran que el ácido desoxicólico (ADC) con dos grupos -OH es insoluble, no interactúa con los receptores nucleares y permanece en la luz intestinal sin efectos tóxicos; mientras que el ácido litocólico (ALC), al poseer un solo grupo -OH, se torna soluble, atraviesa la membrana celular y antagoniza las acciones del receptor acoplado a la proteína TGR5. Por ende, este causa una pérdida de la integridad endotelial, frena la tubulogénesis y disminuye la expresión de los RFGEV2 y de la MMP-9, efectos presentes en la insuficiencia renal con niveles altos de ALC sérico.5,33,34
Estudios recientes han identificado una proteína, denominada Eph-ephrin, que promueve angiogénesis adecuada al interactuar con el RVEGF2.38) Este efecto es inhibido por el ALC hidrofóbico conjugado con glicina, al inhibir la proteína EphA2 activadora de la enzima Eph-ephrin quinasa, por antagonizar la interacción entre Eph-ephrin/RVEGF. De este modo, frena la proliferación, la migración, la integridad y la tubulogénesis, e induce la apoptosis de las células endoteliales, reportada en hepatopatías crónicas con colestasis y niveles altos de ALC hidrofóbico séricos en el endotelio renal, cardiovascular, pulmonar y neurológico.39
Ácidos biliares y angiogénesis
La angiogénesis es un proceso asociado a la migración de las células endoteliales, controlado por las acciones de estabilidad e integridad de las uniones o zónula adherens como expresión de la cadherina-EV, a su vez equilibradas por las concentraciones entre ácidos biliares hidrofílicos conjugados con taurina e hidrofóbicos conjugados con glicina. Los ácidos biliares hidrofílicos conjugados con taurina favorecen la reorganización endotelial; mientras que los hidrofóbicos conjugados con glicina, la desunión celular, pero en condiciones fisiológicas o de equilibrio, también asisten a la migración de las células endoteliales, es decir, al recambio celular normal. Al romperse el equilibrio, los ácidos biliares hidrofóbicos conjugados con glicina y predominio del ALC en enfermedades hepáticas causan pérdida de la integridad endotelial con extravasación de su contenido por sus efectos tóxicos, al tornarse su naturaleza como detergente fuerte.40
Receptor 2 esfingosina-1-fosfato (S1PR2), ácidos biliares y endotelio vascular
El receptor S1PR2 constituye un mediador lipídico pleiotrópico del metabolismo de los esfingolípidos, ubicado en las membranas celulares. Se ha reportado que al activarse por los ácidos biliares primarios hidrofílicos conjugados con taurina desatan una secuencia de efectos intracelulares, a través de segundos mensajeros, las enzimas y las proteínas quinasas efectoras como las Jun N terminal quinasa (JNK), la ERK y la Akt, favorecedoras del control de la proliferación, la migración, el reordenamiento y la adhesión celular del endotelio.41 Por el contrario, al activarse por su ligando esfingosina-1-fosfato (S1P), o por los ácidos biliares hidrofóbicos conjugados con glicina, inducen la activación del sistema NF-kB, causan un incremento de las interleucinas (IL) -1β, del factor de necrosis tumoral (TNF-α) y la expresión de las moléculas de adhesión leucocitaria-endotelial VCAM-1 e ICAM-1 en el endotelio.42,43 Estos efectos proinflamatorios que ejercen se incrementan aún más cuando son altos los niveles séricos de la lipoproteína de baja densidad oxidada (LDL-colesterol) y de la glucemia.43
Ácidos biliares y óxido nítrico del endotelio vascular
El ON es una molécula de señalización de vida media corta, sintetizada en el endotelio a partir del aminoácido L-arginina por la enzima eONS3, dependiente de Ca2+ intracelular, que resulta clave para el control de la progresión del daño endotelial.44,45
El ON mantiene la integridad endotelial a través de sus acciones de control de la vasodilatación, la respiración, la migración, la respuesta inmunitaria, la apoptosis, la síntesis de prostaciclina, y del antiagregante plaquetario; así como de la acción fibrinolítica con la síntesis y secreción del activador del plasminógeno tisular,9) ejecutadas al incrementarse los niveles de sulfuro de hidrógeno (SH2) y de la enzima guanilato ciclasa soluble (GCs), favorecedores de estas acciones descritas, que incrementan el GMPc intracelular y justifican los efectos antiinflamatorios y antitrombóticos expresados en una perfusión tisular adecuada.46,47) No obstante, según sus concentraciones séricas e intracelulares, su estado fisiológico celular y del sitio de síntesis intracelular, el ON al reaccionar con el O2 genera óxido nítrico (ONOO-), sustancia citotóxica que se ha reportado en los estados de estrés oxidativo y de deficiencia del sistema antioxidante celular.48,49
Estudios experimentales han demostrado que los ácidos biliares hidrofílicos conjugados con taurina regulan la homeostasis y las funciones del ON por estimulación de la expresión eNOS-3. Por el contrario, los ácidos biliares hidrofóbicos conjugados con glicina inhiben su síntesis y favorecen el daño endotelial que justifica la insuficiencia cardíaca en los pacientes que padecen cardiopatía cirrótica con niveles altos de ácidos biliares hidrofóbicos conjugados con glicina séricos, al dañar y atrofiar los cardiomiocitos, incitar la disfunción mitocondrial, inactivar la ATPasa, disminuir el Ca2+ y generar la fibrosis del miocardio.44,49,50,51
Ácidos biliares, Ca2 + y vasoactividad endotelial
Los ácidos biliares hidrofílicos conjugados con taurina in vitro son vasodilatadores, pero in vivo inducen hipotensión sistémica. Estas propiedades permiten calificarlos como mediadores hiperdinámicos directos e indirectos de la circulación, al controlar la vasoactividad endotelial, y activar los RFX y el TGR5 dependientes de Ca2+ y K+ intracelular, para la contractilidad muscular.52,53,54,55 La vasodilatación sostenida conlleva a la extravasación persistente de leucocitos; retención de factores de crecimiento, de citocinas; y disminución del Ca2+ y K+ intracelular.
Las evidencias por estudios in vitro e in vivo de los ácidos biliares hidrofóbicos conjugados con glicina han afirmado que mientras más hidrofóbicos sean mayor es su expresión como vasodilatadores directos, fuertes y variables, porque de esta forma inhiben y disminuyen el flujo y los niveles de Ca2+ de la reserva intracelular, la vasoconstricción por despolarización alta de K+ en la membrana, la actividad miogénica espontánea del vaso y reducen el tono basal del vaso. Es decir, la actividad vasodilatadora es independiente de su interacción con los receptores nucleares y el TGR5.56 Sin embargo, su efecto vasoconstrictor ocurre al elevar la captación y liberación del Ca2+ de las reservas intracelulares, momento en que también se torna citotóxico, tal y como se ha reportado cuando los niveles de ALC hidrofóbico conjugado con glicina se asocian con la vasoconstricción endotelial en enfermedades metabólicas.24
La acción detergente de los ácidos biliares hidrofóbicos conjugados con glicina originan su disfunción y desintegración, al cambiar la fluidez y composición de los fosfolípidos de la membrana celular endotelial.57 La diferencia de los efectos de vasocontractilidad endotelial por los ácidos biliares se relaciona con sus propiedades físico-químicas, sus efectos de ligando sobre los receptores y su acción detergente. Todos estos hechos justifican el uso en la terapéutica de las enfermedades cardiometabólicas de un hidrofílico potente: el ácido ursodesoxicólico.58
Endotelitis en fallecidos por COVID-19
Se reportan en más del 50 % de los casos con COVID-19 diversas comorbilidades. Muchas de las identificadas en estos casos se relacionan con la pérdida de la integridad endotelial. Los ácidos biliares en condiciones no fisiológicas participan junto con otros agentes metabolómicos tóxicos en la disfunción endotelial de estas comorbilidades. Los hallazgos preliminares realizados en Cuba en las autopsias mínimamente invasivas de los fallecidos infectados por SARS-CoV-2 -demostrado por estudios moleculares de los pacientes que presentaban comorbilidades inmunitarias, metabólicas y vasculares asociadas a los estadios clínicos de la COVID-19- sugieren la probable participación de los ácidos biliares en las alteraciones morfológicas del endotelio.59,60,61 En dicho estudio se reportan manifestaciones morfológicas de edema pulmonar de permeabilidad o daño alveolar difuso en 46 casos de los 50 estudiados y fue causa de muerte en 34 de ellos.62
El síndrome de dificultad respiratoria aguda del adulto se caracteriza por edema de la pared alveolar; hiperpermeabilidad de la barrera endotelial, representado por la presencia de membranas hialinas constituidas por fibrinógeno y complemento, entre otras proteínas provenientes de la circulación; y extravasación de leucocitos hacia el espacio alveolar, al existir daño endotelial no específico de los capilares. También se hallaron trombos de fibrina y plaquetas, aunque estos no son exclusivos de la COVID-19. En 10 de los 50 casos estudiados, las causas de muerte estuvieron vinculadas a enfermedades cardiovasculares, más que respiratorias.62 En sus pulmones se hallaron áreas de congestión vascular con proliferación de capilares tipo hemangiomatoide, cuyos cambios consistieron en congestión y disposición paralela en las paredes alveolares, e incremento del número de capilares de nueva formación y de morfología similar a los descritos en la angiogénesis. (Fig. A, B, C).62
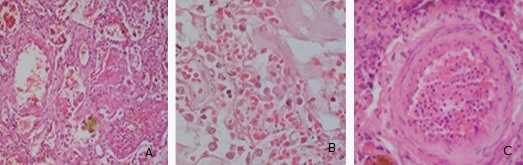 Fuente: Fotos originales de la Dra C. Virginia Capó de Paz.
Fuente: Fotos originales de la Dra C. Virginia Capó de Paz.Fig. A, B, C Microfotografía de cortes histológicos del pulmón en fallecidos por COVID-19. (A) Microfotografía de cortes histológicos de tejido pulmonar con membrana hialina (H/E, 200X), (B) cambios hemangiomatoide en paredes alveolares (H/E, 600X), (C) cambios endoteliales con formación de trombos de fibrina y presencia de neutrófilos (H/E, 200X).
Puede inferirse que los hallazgos observados se originan por la hipoxia tisular que ocurre durante la evolución clínica de los enfermos de la COVID-19 y más en presencia de las comorbilidades que cursan con alta concentración de los ácidos biliares hidrofóbicos conjugados con glicina en el suero, cuya acción antagónica sobre los receptores nucleares y, acoplados a el TGR5, potencializan o amplifican el daño endotelial causado por el SARS-CoV-2.63 Estudios recientes han demostrado la acción potente de los ácidos biliares sobre el receptor ACE2, ubicado también en el endotelio y usado por el propio SARS-CoV-2 para generar daño celular.13,14 Por eso, se hace necesario realizar investigaciones que permitan confirmar que los ácidos biliares hidrofóbicos desempeñan un papel tan importante como se estima y, a su vez, se justifique el uso del ácido ursodesoxicólico como candidato terapéutico en la COVID-19, por ser potentemente hidrofílico, modificador biomolecular de los ácidos biliares, inmunorregulador, antiiflamatorio y antifibrótico.14,64)
La novedad de este artículo consiste en que ofrece una visión integral de los efectos proinflamatorios de los ácidos biliares y la endotelitis en el contexto clínico hepato-intestinal, normal o patológico. Se citan por vez primera los hallazgos histológicos del endotelio pulmonar en fallecidos por la COVID-19 en Cuba, que podrían estar vinculados a la citotoxicidad de los ácidos biliares. Se instituyen premisas para comenzar a investigar la posible asociación entre ácidos biliares, endotelitis, SARS-CoV-2 y la COVID-19, al no existir evidencias previas de los mecanismos patogénicos que los vinculen. De surgir nuevas evidencias de los proyectos que expresen la asociación etiopatogénica, se enriquecería el marco teórico-conceptual de la patogenia de la COVID-19 y esto sentaría las bases para la prevención y el control de la integridad endotelial futuros bajo el sello de la ciencia cubana.
Conclusiones
Esta revisión permite inferir que los ácidos biliares hidrofóbicos conjugados con glicinas, por sus propiedades e incrementos séricos hallados, tanto en las comorbilidades inmunitario-metabólicas como en las enfermedades hepato-intestinales, pudieran tener un papel en la endotelitis presente en pacientes de la COVID-19 con estadios graves y críticos.
En tal sentido, la COVID-19 exige una visión integradora de su patogenia, si se trata de establecer los fundamentos de la interrelación entre los ácidos biliares, las comorbilidades y la infección por el SARS-CoV-2, que dé una explicación asertiva al progreso clínico de la COVID-19.














