Introducción
La diabetes mellitus (DM) constituye un problema de salud a nivel mundial, debido a sus crecientes y elevadas tasas de incidencia y prevalencia. Una de sus complicaciones crónicas más temidas resulta la úlcera del pie diabético (UPD) y, como consecuencia de esta, la amputación no traumática de los miembros inferiores1,2,3 que, a su vez, condiciona una carga económica y psicosocial muy elevada.4,5 Se estima que casi el 20 % de las hospitalizaciones atribuidas a la DM son el resultado de úlceras e infección del pie.6,7,8,9 El 35 % de los pacientes afectados suele evolucionar a lesiones complejas y el 40 % desarrolla una gangrena del pie.9,10,11,12 En la búsqueda de tratamientos efectivos para esta condición se obtuvo en 1994 el Heberprot-P® en el Centro de Ingeniería Genética y Biotecnología (CIGB). El principio activo de este medicamento es un factor de crecimiento humano recombinante, que se administra mediante infiltración directa en el sitio de la lesión y estimula la cicatrización local.12,13 Su acción tiene el objetivo de promover la formación de tejido de granulación útil en el lecho ulceroso, para evitar, en muchos pacientes, la amputación.13,14,15,16,17,18,19
Entre las funciones que se le atribuyen al factor de crecimiento epidérmico se encuentran: la mitogénesis, ya que estimula la proliferación celular; la fotogénesis, pues controla y estimula la migración celular; la inducción de la diferenciación celular; y la citoprotección.20
En modelos animales se ha demostrado que las acciones antes mencionadas se logran a muy bajas concentraciones del Heberprot-P® en los líquidos corporales. Su vida media en sangre es corta, se filtra a través de los riñones y se excreta por la orina.18,19,20) Por su parte, la aparición de la enfermedad renal diabética (ERD) se ha relacionado con la acción de diversos factores de crecimiento.20,21,22 Un estudio reporta que el factor de crecimiento de tejido conectivo representa un elemento clave en el inicio y la progresión de la nefropatía diabética.23 No obstante, la mayoría de los autores consideran su origen como multifactorial.24,25,26,27,28,29 y Núñez30 le atribuye un efecto nefroprotector. Por tal motivo, surgen la interrogante y la preocupación acerca de la posibilidad de que aparezca una alteración de la función renal en los pacientes tratados con Heberprot-P®.
El objetivo de este trabajo fue describir la evolución de la función renal posterior al tratamiento con Heberprot-P® en pacientes con úlcera del pie diabético.
Métodos
Se realizó un estudio descriptivo y prospectivo, que incluyó a 90 sujetos adultos con el diagnóstico de diabetes tipo 2 (DM2) y UPD, que asistieron a la consulta de Atención integral al pie diabético del Centro de Atención al Diabético (CAD) del Instituto de Endocrinología (INEN) desde enero de 2014 hasta diciembre de 2018, los cuales fueron tratados con Heberprot-P®. Se excluyeron las personas que en el año de seguimiento recibieron algún tratamiento parenteral con un posible efecto sobre la función renal.
Las variables analizadas al inicio, los 6 meses y al año de iniciado el tratamiento fueron: edad, sexo, tabaquismo, antecedente personal de hipertensión arterial (HTA), tiempo de evolución de la DM, número de aplicaciones del Heberprot-P®, antecedente de diagnóstico de enfermedad renal crónica (ERC), glucemia en ayunas, hemoglobina glucosilada (HbA1C), excreción urinaria de albúmina (EUA), creatinina, filtrado glomerular (FG) y ácido úrico.
Se definió como UPD la presencia de una lesión abierta de la piel de forma redondeada u oval, situada del tobillo hacia abajo, en la que queda expuesta el tejido celular subcutáneo u otros tejidos; y se presenta en personas con diabetes, generalmente después de un traumatismo.31
Se consideró que existía una ERC ante la presencia de un diagnóstico previo de esta alteración o la demostración de una disminución del FG, el cual se calculó por medio de la fórmula Modification of diet in renal disease (MDRD)-4: FG = 175 x (creatinina/88,4) - 1,154 x (edad) - 0,203 x (0,742, si mujer) x (1,210, si raza negra).32
Se creó una variable constructor cualitativa llamada “Evolución de la función”, la cual fue categorizada de la forma siguiente:
Evolución favorable: cuando los analitos de función renal mejoraron o no empeoraron de forma significativa en algún momento del seguimiento, con respecto al inicio.
Evolución desfavorable: cuando algún analito de función renal empeoró significativamente en algún momento del seguimiento, con respecto al inicio.
Las determinaciones se realizaron en sangre venosa, luego de un ayuno de 8 a 12 horas. La muestra de sangre se analizó empleando diagnosticadores de producción nacional de la empresa Finlay y un equipo ultraanalizador, según los procedimientos de buenas prácticas de uso habitual y actual en el laboratorio clínico del INEN.33
Análisis estadístico
Se determinaron la frecuencia relativa de las variables cualitativas (porcentaje), y la media (Ẋ) y la desviación estándar (DE) de las cuantitativas. Para comparar las medias en los tres momentos evaluativos, se utilizó la prueba de Friedman; y, en los casos de dos muestras independientes, la U de Mann-Whitney. Para determinar la posible asociación entre las variables cualitativas y la EUA, se empleó la prueba Chi cuadrado (X2) de independencia. En todos los casos se asumió un nivel de confianza del 95 % y un valor de probabilidad (p) menor que 0,05.
Aspectos éticos
La ejecución de esta investigación no puso en riesgo la vida de los sujetos en momento alguno. Se garantizó la confidencialidad de la información obtenida para ejecutarla, la cual solo se utilizó con fines investigativos y científicos. La recogida de los datos y el reporte de los resultados se realizó con respeto a la veracidad de estos.
Resultados
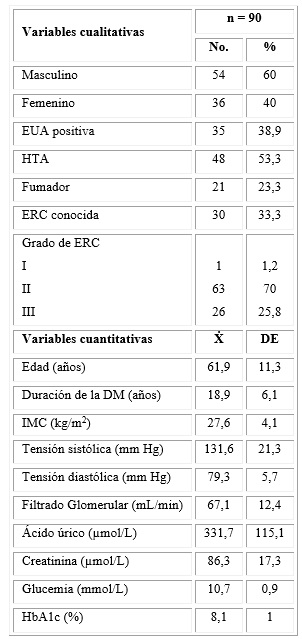
En la tabla 1 se muestra la descripción de los sujetos al inicio del estudio, en cuanto a variables cualitativas y cuantitativas. Predominaron el sexo masculino, la edad cronológica avanzada y el largo tiempo de evolución de la DM. El 53,3 % de los pacientes refirieron tener HTA; y 23,3 %, ser fumadores. La media de la tensión arterial sistólica estuvo ligeramente elevada: 131,6 mmHg. Del total de 90 sujetos, un 33,3 % refirió conocer que tenían una enfermedad renal. El valor de la media de IMC (27,6 kg/m2) estuvo incluido en el intervalo de sobrepeso corporal. Los valores medios de glucemia en ayunas y HbA1c fueron de 10,7 mmol/L y 8,1 %, respectivamente. En relación con las variables de función renal, 38,9 % de los sujetos presentaban una excreción urinaria de albumina positiva (EUA). La media del FG estuvo disminuida: 67,1 mL/min. El 70 % de los pacientes tuvieron una enfermedad renal crónica grado II, según los valores del filtrado glomerular.
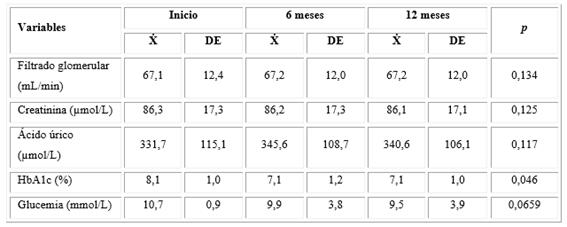
Las medias de las variables cuantitativas de función renal no variaron de forma estadísticamente significativa ni a los 6 meses ni al año de seguimiento de los sujetos tratados con Heberprot-P®. No obstante, el ácido úrico incrementó discretamente su valor medio inicial desde 331,7 hasta 345,6 a los 6 meses, y en 340 mmol/L al año de seguimiento. La media de la HbA1c, tanto a los 6 meses como al año, fue menor con respecto a su valor inicial y lo mismo ocurrió con la glucemia, aunque la diferencia no fue estadísticamente significativa en ninguna situación (tabla 2).
Tabla 2 Evolución de las variables de función renal, la glucemia y la HbA1c a los 6 meses y al año de tratamiento con Heberprot-P®
En la tabla 3 se presentan los factores asociados a la evolución de la EUA en los pacientes que inicialmente tuvieron esta prueba alterada (35 sujetos). La EUA mejoró en la mayoría de estos al final del estudio. Existió una diferencia estadísticamente significativa entre los que negativizaron la EUA y los que la mantuvieron positiva en relación con la HbA1c: 7,1 versus 9,3 %; p = 0,04. De los 11 sujetos con una EUA positiva al final del seguimiento, todos tenían una HTA; sin embargo, esta enfermedad solo se encontró en el 25 % de los que tenían una EUA negativa, diferencia que fue estadísticamente significativa (p = 0,02). Una situación similar se presentó con el tabaquismo (p = 0,046).
Tabla 3 Factores asociados con la evolución de la EUA en los sujetos que al inicio tuvieron alterada esta prueba
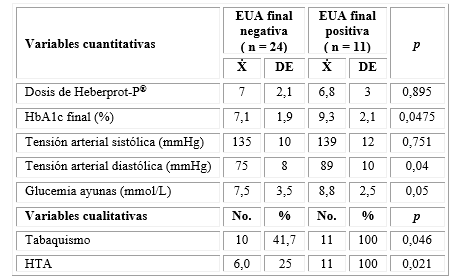
En la figura los sujetos se agrupan según la evolución de la función renal. En cuanto a esta, fue favorable en 97,8 % y desfavorable solo en dos sujetos para un 2,2 %, los cuales tenían sexo masculino, HTA y DM con más de 10 años de evolución y mal controlada, dado por una HbA1c mayor que 7 %, tanto al inicio como al final del estudio. La dosis de Heberprot-P® utilizada en estos dos casos fue de 7 y 8 aplicaciones, respectivamente: o sea, menos que 10.
Discusión
La frecuencia de las complicaciones crónicas de la DM se incrementa en la medida en que avanzan la edad y el tiempo de evolución de la enfermedad; sobre todo, en personas con un control glucémico deficiente.1,2,29 En este estudio los sujetos con una edad avanzada y un tiempo prolongado de evolución de la DM tuvieron valores elevados de HbA1c y glucemia.
Entre las complicaciones crónicas de la DM, la ERC y la UPD constituyen dos de las que más influyen negativamente en la calidad de vida de las personas con la enfermedad metabólica. En los diversos reportes acerca de DM y ERC, esta última se encuentra en uno o varios de sus estadios evolutivos, lo que depende del tiempo vivido con la enfermedad metabólica y la calidad de su atención, entre otros aspectos.34,35
En el presente trabajo predominaron los sujetos con una ERC en estadio II. En un estudio nacional se reportó que el 27 % de los pacientes con UPD antes del tratamiento con Heberprot-P® ya tenía una enfermedad renal oculta desconocida por estos.36
La microalbuminuria constituye un marcador temprano de daño renal, que se asocia con la enfermedad cardiovascular y se presenta frecuentemente en los sujetos con HTA. El aumento progresivo de su valor, incluso antes de que este pueda considerarse como anormal, también se asocia con la aparición de las enfermedades renal y cardiovascular.37,38 Por tanto, se considera como un resultado positivo de esta investigación la disminución de la EUA manifestada por algunos pacientes, que estuvo relacionada con la mejoría del control glucémico.
En una investigación nacional,29 que analizó lo ocurrido con la función renal de sujetos tratados con Heberprot-P®, se informó una mejoría del FG a las 8 semanas de tratamiento en el 53 % de estos. No se encontró otra investigación acerca de este tema para poder compararla con la presente.
Existe contradicción sobre el papel que desempeña el factor de crecimiento epidérmico humano recombinante en la aparición de la ERD. Algunos autores plantean que está implicado en la progresión del daño renal.39,40 Sin embargo, Alcázar y Albalate41 plantean que contribuye a reestablecer la adecuada función renal. Los autores de este trabajo consideran que la ERD tiene un origen multifactorial, que implica tanto a factores genéticos como ambientales; e, igual que para otros investigadores, que la hiperglucemia es uno de los integrantes más importantes de este último grupo.42 A lo largo del presente estudio, la mayoría de los sujetos tuvieron una disminución de los valores de HbA1c, lo cual se considera un resultado positivo, pues se ha demostrado que el control glucémico óptimo se asocia con una remisión parcial de la hiperfiltración e hipertrofia glomerular inicial.43
Finalmente, el factor de crecimiento que contiene el Heberprot-P® no afecta la función renal de los sujetos con una DM2.
Los pacientes con UPD tratados con Heberprot-P® no presentaron afectación de la función durante un año de seguimiento. En este período la EUA mejoró en la mayoría de las personas.