Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Médica Electrónica
versión On-line ISSN 1684-1824
Rev. Med. Electrón. vol.36 no.1 Matanzas ene.-feb. 2014
ARTÍCULO ORIGINAL
Infección por Acinetobacter spp. en Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández de Matanzas. 2011-2012
Infection by Acinetobacter spp. in the University Hospital "Comandante Faustino Pérez Hernández" of Matanzas. 2011-2012
Dra. Mónica Arnold Rodríguez
Hospital Ginecobstétrico Provincial Docente Julio Rafael Alfonso Medina. Matanzas, Cuba.
RESUMEN
Las infecciones asociadas a la asistencia sanitaria constituyen un grave problema de la salud pública a nivel mundial por su frecuencia y elevada mortalidad. El Acinetobacter spp. en la última década ha emergido como importante patógeno oportunista nosocomial. Dentro de estas especies, A. baumanii es la principal especie que se aisla hasta en 92 % de las bacteriemias nosocomiales. La mayoría de los reportes de bacteriemia nosocomial por A. baumanii (B Ab) son de brotes en unidades de cuidados intensivos de pacientes adultos. Se ha reportado el incremento de la resistencia a antimicrobianos de este germen. Se realizó un estudio observacional descriptivo transversal acerca de la infección por Acinetobacter spp. en el Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández, del municipio de Matanzas, entre los meses de octubre de 2011 a julio de 2012. Teniendo en cuenta la ausencia de un estudio anterior en Matanzas sobre infección por este microorganismo, se decidió identificar la incidencia de Acinetobacter spp. según muestra biológica y servicio de procedencia e identificar la sensibilidad/resistencia del mismo, lo cual permitirá instaurar un tratamiento eficaz a los pacientes portadores de esta bacteria atendiendo al patrón de susceptibilidad encontrado en el estudio. La especie más frecuente fue A. baumanii, fundamentalmente en secreción endotraqueal y hemocultivo, procedentes en su mayoría de UTI, siendo este servicio el que aportó más cantidad de cepas MDR. Se encontró una mayor sensibilidad a antimicrobianos no considerados de primera línea como doxiciclina, tetraciclina y trimetropim-sulfametoxazol.
Palabras clave: A. baumannii, estudios de sensibilidad, mecanismos de resistencia, multidrogo resistencia.ABSTRACT
Infections associated to the sanitary care are serious public health problems at the international level because of their frequency and high mortality. In the last ten years, Acinetobacter spp. has emerged as an important nosocomial opportunistic pathogen. Among these species, A. baumanii (B Ab) is the main isolated species covering as many as 92 % of the nosocomial bacteremias. Most of the reports of nosocomial bacteremias by A. baumanii (B Ab) are outbreaks in adult patient intensive care units. It has been reported a boost of this germ antimicrobial resistance. We carried out a cross sectional, descriptive, observational study on Acinetobacter spp. infection, in the University Hospital “Comandante Faustino Pérez Hernández” of Matanzas municipality, from October 2011 to July 2012. Taking into account the absence of a previous study in Matanzas on infections caused by this microorganism, we decided identifying the Acinetobacter spp. incidence according to biological samples and coming-from service and identifying its sensibility/resistance, allowing the instauration of the efficacious treatment of the patients who carry this bacterium, considering the susceptibility pattern found in the study. The most frequently found species was A. baumanii, mainly in endotracheal secretions and hemo-cultures, most of them coming from Intensive Therapy Units, being this service the one contributing with more quantity of multidrug resistant stocks. We found a bigger sensibility to antimicrobials that are not considered first line ones like doxycycline, tetracycline and trimetoprim-sulfametoxazole.
Key words: A. baumanii, sensibility studies, resistance mechanisms, multidrug resistance.
INTRODUCCIÓN
Uno de los problemas más preocupantes en los centros hospitalarios de todo el mundo y dentro de ellos, en las unidades de atención al paciente grave, es el relacionado con la resistencia que han adquirido numerosas especies bacterianas.(1)
Acinetobacter baumanii ha pasado, en los últimos años, de ser considerado un microorganismo de poca relevancia clínica a convertirse en un patógeno cada vez más frecuente dentro de las infecciones asociadas a la asistencia sanitaria (IAAS), constituyendo un verdadero paradigma de las infecciones nosocomiales multirresistentes. Afecta fundamentalmente a pacientes con enfermedades subyacentes graves, sometidos a cirugía, distintos tipos de manipulaciones, procedimientos invasivos, uso previo de antibióticos de amplio espectro e ingresos prolongados, incluyendo estancia en Unidades de Cuidados Intensivos/Reanimación.(2)
El éxito de A. baumannii en la infección nosocomial se debe por un lado a su resistencia en el medioambiente inanimado(2) y por otro lado a la extraordinaria rapidez y capacidad que presenta para desarrollar resistencias a los antimicrobianos por diferentes mecanismos. Se han identificado cepas resistentes a prácticamente todos los antimicrobianos comercialmente disponibles, lo que limita extremadamente sus alternativas terapéuticas.
Los factores que definen la resistencia de Acinetobacter son:
1) Enzimas inactivadoras de antimicrobianos.
2) Limitación del acceso a las dianas bacterianas.
3) Mutaciones que alteran las dianas o las funciones celulares.
La resistencia a B-lactámicos está basada fundamentalmente en enzimas inactivadoras de antimicrobianos, en limitación del acceso a las dianas bacterianas y en mutaciones que alteran las dianas o las funciones celulares como la alteración de las PBPs.(3-5)
El mecanismo más importante de resistencia a los Aminoglucósidos es la modificación enzimática del antimicrobiano con la consiguiente disminución de la afinidad del mismo por la sub unidad ribosómica 30S.mediante enzimas: fosforiltransferasas, adeniltransferasas, acetiltransferasas o nucleotidiltransferasas. Las mismas están mediadas por plásmidos o transposones que pueden jugar un rol importante en la diseminación de la resistencia.(3-6)
La resistencia a fluorquinolonas en A. baumanii se debe sobre todo a cambios estructurales en la diana de la ADN girasa y topoisomerasa IV, y a sistemas de expulsión activa o entrada al interior de la bacteria a través de porinas y por difusión a través de la membrana citoplasmática.(3)
La resistencia a la tetraciclina y tigeciclina puede estar mediada por bombas de eflujo o protección ribosomal. Estas bombas de eflujo están codificadas por el gen tet A hasta el tet E. en Acinetobacter baumannii han sido descritas las tet A y tet B.(6)
En A. baumannii la resistencia a la colistina se asocia con la expresión del gen pmrA, que conduce a modificaciones del lípido A. Además, otros mecanismos de resistencia como cambios en la expresión de ciertas porinas (OmpW) podrían contribuir a dicha resistencia.(2,3)
Definiciones de resistencia y tratamiento
Aunque no existe consenso internacional para definir la resistencia, esta investigación se adhiere a las definiciones de Peleg y colaboradores.(6) Multidrogoresistencia (AB-MDR) son aquellas cepas resistentes a más de dos de las cinco siguientes clases de medicamentos: cefalosporinas antipseudomonas (ceftazidima y/o cefepime) carbapenemes antipseudomonas (imipenem-meropenem), ampicillin-sulbactan, fluorquinolonas (ciprofloxacino-levofloxacino) y aminoglucósidos (gentamicina, tobramicina, amikacina).
Pandrogoresistencia (AB-PDR) son las cepas de Acinetobacter baumanii resistentes a todos los antimicrobianos de primera línea que tienen potencial terapéutico frente a él, lo cual incluye todos los B-lactámicos (incluidos carbapenémicos y sulbactan), fluorquinolonas y aminoglucósidos. Solo son susceptibles a polimixinas como el colistín.(6)
Antes de la década de los 70 era posible tratar la infección por Acinetobacter con un amplio rango de antimicrobianos incluidos: aminoglucósidos, B-lactámicos y tetraciclinas. Sin embargo, la resistencia a estos fármacos se ha visto incrementada reduciendo drásticamente el arsenal disponible para su tratamiento.(6)
La base microbiológica de mayor interés es el conocimiento de la sensibilidad propia de cada centro hospitalario del A. baumanii multirresistente frente a los diferentes antimicrobianos.
El tratamiento de elección no está definido por la carencia de estudios comparativos internacionales,(7) no obstante se sugieren un grupo de antimicrobianos con mejores resultados, entre los que se destacan: carbapenemes, sulbactan, tetraciclinas, glicilciclinas, polimixina, aminoglucósidos y rifampicina, cuyas pautas varían según diferentes bibliografías consultadas.
En resumen, las bases terapéuticas tienen que ajustarse a protocolos consensuados, según los denominados escalones terapéuticos, considerando el pronóstico de la enfermedad de base, la gravedad clínica inicial, los antecedentes de infecciones previas, el uso previo de antibióticos y el patrón de sensibilidad de las cepas propias de cada centro.(2)
Teniendo en cuenta la ausencia de un estudio anterior en Matanzas sobre infección por este microorganismo, se decidió identificar la incidencia de Acinetobacter spp., según muestra biológica y servicio de procedencia e identificar la sensibilidad/resistencia del mismo, lo cual permitirá instaurar un tratamiento eficaz a los pacientes portadores de esta bacteria atendiendo al patrón de susceptibilidad encontrado en el estudio.
MÉTODOS
Se realizó un estudio observacional descriptivo transversal acerca de la infección por Acinetobacter spp. en el Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández, de Matanzas, entre los meses de octubre de 2011 y julio de 2012.
El universo estuvo compuesto por las 66 cepas de Acinetobacter spp. aislados en pacientes hospitalizados en el referido hospital, durante período descrito y fueron confirmadas por el Laboratorio Nacional de Referencia de Microbiología del IPK (LNRM/IPK). Los especímenes se obtuvieron de diferentes fluidos orgánicos o productos patológicos (sangre para hemocultivo, secreción endotraqueal, secreción de herida quirúrgica, sonda abdominal, esputo, catéter intravascular, lesión piel y urocultivo).
La información fue recogida a través del libro de entrada de muestras del laboratorio y las historias clínicas de los pacientes. Los datos se vertieron a planilla de recolección de datos que incluye las variables estudiadas.
Se aplicaron diferentes técnicas de laboratorio para llegar a diagnóstico de especie y se determinó la susceptibilidad frente a 19 antimicrobianos, por el método de Kirby-Bauer, según las recomendaciones del Instituto de Estandarización para Laboratorio Clínico (CLSI, 2011), excepto para la colistina que se utilizó la concentración mínima inhibitoria (CMI) por método E-test. Los datos obtenidos fueron introducidos en una base de datos en Microsoft Excel creada para este fin. Se realizó el análisis estadístico, utilizando las medidas de resumen para variables cualitativas, utilizando frecuencias absolutas y relativas (porcentajes), Los datos fueron almacenados y procesados en el paquete de programa EPIINFO, versión 6,04.
Se utilizó en la investigación cepas de pacientes ingresados y datos obtenidos de las Historias clínicas y libro de entrada del laboratorio, no existiendo contacto directo de la investigadora con los pacientes. Consta en el proyecto de investigación, declaración de la investigadora acerca de la no utilización de las muestras o información manejada con otro fin que no sea el detalladamente expuesto y solo por el personal a cargo de la investigación (confidencialidad).
RESULTADOS
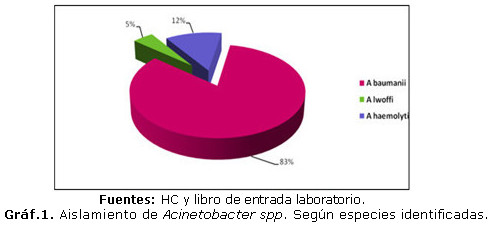
El gráfico 1 mostró los aislamientos de Acinetobacter spp. según la especie encontrada en las 66 muestras analizadas. La especie más frecuente en muestras clínicas fue A. baumani, seguido por A. haemolyticus. La menos aislada fue A. lwoffi.
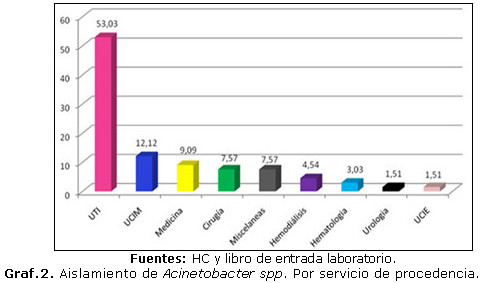
Al analizar el gráfico 2 se apreció que el servicio hospitalario que más aislamientos de Acinetobacter spp. reportó fue la unidad de terapia intensiva (UTI), con marcada diferencia de otros servicios que presentaron porcientos inferiores, como UCIE (unidad de cuidados intensivos emergentes) y servicio de urología.
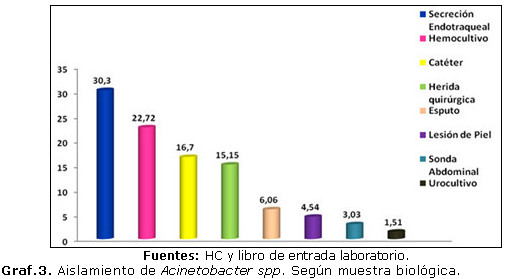
En el gráfico 3 se aprecia un aumento del número de aislamientos a expensas de la secreción endotraqueal, lo cual se debe a que en el servicio de Terapia Intensiva se tomaron muestras de este tipo de producto patológico a todo paciente ventilado con más de 3 días de estadía hospitalaria, cumpliendo el protocolo de vigilancia epidemiológica para el paciente grave; que facilita el incremento en la llegada de muestras de esa localización al laboratorio. Resultó la secreción endotraqueal la más frecuente seguido del hemocultivo. La localización menos frecuente fue el urocultivo.
La tabla 1 representó la susceptibilidad de Acinetobacter spp. frente a los β-lactámicos. Se aprecian elevados índices de resistencia, dentro de este grupo la resistencia se encuentra entre el 59,09 % y el 84,85 %.
El antimicrobiano más sensible de los testados fue el meropenem, seguido del imipenem. Los medicamentos con mayores resistencias fueron el aztreonam y la ticarcilina.
Tabla 1. Susceptibilidad de Acinetobacter spp. frente a los antimicrobianos β- Lactámicos.
Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez. Octubre 2011-julio 2012
| Antimicrobianos | Sensible | Intermedio | Resistente |
| (%) | (%) | (%) | |
| Meropenem | 40,9 | - | 59,09 |
| Imipenem | 30,3 | 1,51 | 68,18 |
| Piperacillina+Tazobactam | 28,79 | 3,03 | 68,18 |
| Piperacilina | 22,72 | 3,03 | 74,24 |
| Cefuroxima | 19,7 | 4,54 | 75,75 |
| Ceftriaxona | 15,15 | 9,09 | 75,75 |
| Ceftazidima | 9,09 | 6,06 | 84,85 |
| Cefotaxima | 7,57 | 12,12 | 80,3 |
| Ticarcilina | 3,03 | 15,1 | 81,8 |
| Aztreonam | 3,03 | 18,18 | 78,79 |
Fuentes: HC y libro de entrada laboratorio.
La tabla 2 mostró la sensibilidad de Acinetobacter spp. frente a los antimicrobianos no β-Lactámicos.
Tabla 2. Susceptibilidad de Acinetobacter spp. frente a los antimicrobianos no β-lactámicos.
Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez. Octubre 2011-julio 2012
| Antimicrobianos no β-lactámicos | Sensible | Intermedio | Resistente |
| % | % | % | |
| Colistina | 100 | - | - |
| Doxiciclina | 96,97 | 1,51 | 1,51 |
| Tetraciclinas | 89,39 | 6,06 | 4,54 |
| Trimetropim-Sulfametoxazol | 45,45 | 15,15 | 39,39 |
| Ciprofloxacino | 21,21 | - | 78,79 |
| Levofloxacino | 18,18 | 25,76 | 56,06 |
| Gentamicina | 16,67 | 1,51 | 81,82 |
| Amikacina | 15,15 | 3,03 | 81,82 |
| Rifampicina | 3,03 | 6,06 | 90,90 |
Fuentes: HC y libro de entrada del laboratorio.
El antimicrobiano más útil fue la colistina con 100 % de sensibilidad, seguido de la doxiciclina y la tetraciclina. El más resistente fue la rifampicina.
Como se puede observar en la tabla 3 los mayores porcentajes de resistencia se encuentran en UTI, con 53,03 % de cepas multidrogoresistentes (MDR), existiendo un 92,42 % de cepas MDR. No se encontraron cepas pandrogoresistentes (PDR) en el presente estudio.
Tabla 3. Clasificación de los aislamientos (n=66) como susceptibles, MDR o PDR.
Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez. Octubre 2011-julio 2012
| Servicios | Cepas | % | Cepas | % | Cepas PDR | Total | % |
| UTI | 1 | 1,51 | 35 | 53,03 | - | 36 | 54,54 |
| Servicios restantes | 4 | 6,06 | 26 | 39,39 | - | 30 | 45,45 |
| Total | 5 | 7,57 | 61 | 92,42 | - | 66 | 100 |
Fuentes: HC y libro de entrada del laboratorio.
DISCUSIÓN
Estudios realizados en España revelan que Acinetobacter spp. tiene en UTI incidencia acumulada de 1,2 episodios por 100 pacientes. La especie predominante fue A. baumannii en 87,9 %.(8) El aumento de muestras positivas de Acinetobacter spp. en unidades de terapia apreciado en el gráfico 2 es debido a la mayor realización en estos servicios de procedimientos diagnósticos y terapéuticos invasores por paciente que permiten la evasión del Acinetobacter spp. de los sitios iniciales de colonización, existiendo, además, gran resistencia de las cepas pues existe mayor presión con antimicrobianos por metro cuadrado de superficie del hospital.
Otros estudio realizado en Irán por Mahdi y colaboradores (2010) reporta un 36 % de aislamientos en servicio de UTI.(9) El trabajo en curso coincide con otro similar realizado en Hospital Clínico Quirúrgico Hermanos Ameijeiras (HCQHA), de La Habana, en el 2006, que halló 55 % de muestras procedentes de UTI.(10)
Coincidiendo con Hart M en estudio realizado en HCQHA reporta que el 48 % de cepas de A. baumanii proceden de secreción endotraqueal y 38 % de hemocultivos.(10)
Sin embargo, Lul RakaI en Kosovo, en 2009, refiere que los mayores aislamientos de A. baumanii obtenidos provienen de secreción endotraqueal en 86,6 % de pacientes ingresado en UTI.(11)
En estye estudio se aprecia un incremento de la resistencia microbiana frente a β-lactámicos, apoyado en la bibliografía revisada, Kyungwon Lee, reporta en Korea en el 2011 entre 48-51 % resistencia frente a imipenem, y entre 56–60 % en meropenem, coincidiendo la presente investigación con los valores de resistencia al meropenem hallados por Kyungwon.(12)
No coincide la presente investigación con estudio realizado en HCQHA en 2010, que reporta tasas de resistencia para meropenem de 90 % y para imipenem de 82 %.(1)
Esta investigación encontró una elevada resistencia a la piperacilina-tazobactam, coincidiendo con M Souli, que en estudio multicéntrico europeo en 2008, refiere una resistencia elevada a la piperacilina-tazobactam (70,7 %) en España,(12) no coincide con Peymani y colaboradores en hospital de Tabritz, Irán en 2011, notifican mayor resistencia a la piperacilina-tazobactam (89 %).
El presente estudio muestra cifras de resistencia similares a Kyungwon Lee para Cefotaxima (77 %) pero difiere moderadamente con la ceftazidima (66-73 %).(12)
Respecto a la susceptibilidad encontrada frente a antimicrobianos no β-lactámicos, la presente investigación encontró concordancia con la sensibilidad a la colistina en algunas literaturas revisadas. Marcia Hart halló en HCQHA, 100 % sensibilidad a colistina en el 2010.(1) Mezzatesta en Italia en 2008 encontró bajo por ciento de resistencia (1 %).(13)
La presente investigación encontró valores de resistencia para las tetraciclinas inferiores a los reportados por estudio KONSAR realizado en Korea, que refiere valores entre (50-59 %).(12)
Para tetraciclinas se notifica elevada resistencia en diferentes países como Italia (73 %), Irán (66 %) y en Bulgaria (100 %) según reporta Mezzatesta y colaboradores (2008), Mahdi y cols (2010) y Eser y cols (2009), respectivamente.(9,13,14) La autora encuentra menor resistencia frente a trimepropim-sulfametoxazol que Kyungwon Lee, el cual notifica (67 %).(12)
En estudio realizado en la India, 2011 Taneja y colaboradores reportan un 83 % de resistencia frente a trimeptropim-sulfametoxazol.(15)
En cuanto a las quinolonas los % de resistencia varían. Kyungwon Lee reporta valores de resistencia frente a fluorquinolonas entre 67-71 % (no especifica dentro de ese grupo). El presente trabajo concuerda discretamente con lo encontrado por ese autor frente a la ciprofloxacina.(12) Lim y cols en estudio de Taiwán 2010 reportan patrones similares de resistencia (69 %) frente a ciprofloxacino. La Dra. Hart refiere resistencia más elevada en HCQHA (95 %).(1,16)
Dentro de los aminoglucósidos la resistencia se comporta de manera similar para gentamicina y amikacina (81,82 %). Situación similar reporta Rahbar en Irán, con un 85 % para los mismos antimicrobianos. En contraste, Taneja y colaboradores (2011) notifican un 73 % de resistencia para amikacina en la India.(15,17)
Para la rifampicina, los valores de resistencia en el presente trabajo son altos (90,90 %), pero inferior a lo reportado por B Thapa, en Tailandia, en 2009, que notifica 100 % resistencia.(18) Algunos países incluyen a la rifampicina en combinación con otras drogas para el tratamiento de PDR Ab. Sin embargo, Thapa et al en estudio realizado en Tailandia en 2009 refiere una resistencia del 100 % a la rifampicina, de muestras clínicas previamente resistentes a carbapenemes, considerando no apta la rifampicina para tratamiento combinado frente a A baumnii.(18)
El porcentaje de aislamientos MDR en UTI (53,03 %) y en servicios abiertos (39,39 %) es consistente con lo reportado en los Estados Unidos, Bulgaria y la India, con 45 %, 41 % y 41,5 %, respectivamente,(14,15,19) mientras que en Turquía, Dizbay y colaboradores, reportan porcentaje elevados con 80,5 % en pacientes con NAV Ab y Al-Swerih y colaboradores en Kuwait, notifican 88,4 % de cepas MDR.(20,21)
La diseminación de las cepas en diferentes áreas del hospital contribuye a la rápida emergencia de A. baumannii pandrogo-resistente. El aislamiento de cepas con multidrogo-resistencia y pandrogo-resistencia limita las opciones de tratamiento. El conocimiento de las cepas de A. baumannii con multidrogo-resistencia es determinante en las estrategias de control de infecciones.
Debido a la importancia que ha cobrado el género Acinetobacter en las últimas décadas como patógeno asociado a la asistencia sanitaria, se hace necesario la vigilancia clínica, epidemiológica y microbiológica del género para evitar una mayor morbimortalidad, uso inadecuado de antimicrobianos, ocurrencias de brotes y mayores gastos. Todo lo anterior demanda un correcto funcionamiento multidisciplinario del Comité de Epidemiología Hospitalaria, Comité Fármaco-Terapéutico, los microbiólogos y personal médico en el cumplimiento de las medidas de prevención y control de estas infecciones.
REFERENCIAS BIBLIOGRÁFICAS
1. Hart Casares M, Espinosa Rivera FI, Halley Posada MC. Resistencia a antibióticos en cepas de Acinetobacter baumannii aisladas de enero a marzo del 2010 en el Hospital Clínico quirúrgico "Hermanos Ameijeiras". Rev Cubana Medicina [Internet]. 2010[citado 16 Jun 2012];49(3). Disponible en:http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232010000300001&lng=es&nrm=iso&tlng=es
2. Hernández Torres A, García Vázquez E, Yague G, Gomez Gomez J. Acinetobacter baumanii multiresistente. Situación clínica actual y nuevas perspectivas. Rev Española Quimioter [Internet] 2010[citado 16 Jun 2012];23(1):12-9. Disponible en:http://www.seq.es/index2.php?option=com_content&task=view&id=383&pop=1&page=0&Itemid=1
3. Vila J, Marco F. Lectura interpretada del antibiograma de bacilos gram negativos no fermentadores. Enferm Infec Microbiol Clin. 2010;28(10):726-36. Citado en PubMed; PMID: 20579775.
4. Navarro F, Calvo J, Cantón R, Fernández-Cuenca F, Mirelis B. Detección fenotípica de mecanismos de resistencia en microorganismos gramnegativos. Enferm Infecc Microbiol Clin. 2011;29(7):524-34. Citado en PubMed; PMID: 21696863.
5. Lee K, Yong D, Hoon JS, Chong Y. Multidrug-Resistan Acinetobacter spp.: Increasingly Problematic Nosocomial Pathogens. Yonsei Med J. 2011;52(6):879-91. Citado en PubMed; PMID: 22028150.
6. Peleg A, Seifert H, Paterson DL. Acinetobacter baumannii: Emergence of a Successful Pathogen. Clin Microbiol Rev. 2008;21(3):538-82. Citado en PubMed; PMID: 18625687.
7. Cisneros JM, Pachón G. Acinetobacter baumannii: un patógeno nosocomial de difícil control. Enferm Infecc Microbiol Clin. 2003;21(5):221-3. Citado en PubMed; PMID: 12732110.
8. Alvarez-Lerma F, Palomar M, Insausti J, Olaechea P, Cerdá E, Castillo F, et al. Infecciones por Acinetobacter spp. en pacientes críticos en UCI. Enferm Infecc Microbiol Clin. 2005;23(9):533-9. Citado en PubMed; PMID: 16324565.
9. Akbari M, Niakan M, Taherikalani M, Feizabadi MM, Azadi NA, Soroush S, et al. Rapid identification of Iranian Acinetobacter baumanni strains by single PCR assay using BLAoxa-51–like carbapenemase and evaluation of the antimicrobial resistance profiles of the isolates. Acta Microbiol Inmunol Hung. 2010;57(2): 87-94. Citado en PUbMed; PMID: 20587382.
10. Hart Casares M, Llanes Rodríguez N, Espinosa Rivera F, Halley Posada MC, Martínez Batista ML, López Suárez AL. Estudio de la sensibilidad antimicrobiana de la especie Acinetobacter baumanii en el Hospital "Hermanos Ameijeiras" 2006. Rev Cubana de Med [Internet]. 2008[citado 16 Jun 2012];47(3). Disponible en: http://www.scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232008000300007&lng=es&nrm=iso&tlng=es
11. RakaI L, KalencI S, Bošnjak Z, Budimir A, Šijak D, Mulliqi-OsmaniI G. Molecular epidemiology of Acinetobacter baumannii in central intensive care unit in Kosova teaching hospital. Braz J Infect Dis. 2009;13 (6):408-13. Citado en PubMed; PMID: 20464330.
12. Souli M, Galani I, Giamarellou H. Emergence of extensively drug-resistant and pandrug-resistant Gram-negative bacilli in Europe. Euro surveillance. 2008;13(47). pii: 19045. Citado en PubMed; PMID: 19021957.
13. Mezzatesta ML, Trovato G, Gona F, Nicolosi VM, Nicolosi D, Carattoli A, et al. In vitro activity of tigecycline and comparators against carbapenem-susceptible and resistant Acinetobacter baumannii clinical isolates in Italy. Ann Clin Microbiol Antimicrob. 2008;7(4). Citado en PubMed; PMID: 18261233.
14. Eser OK, Ergin A, Hascelik G. Antimicrobial resistance and existence of metallo-beta-lactamase in Acinetobacter species isolated from adult patients. Mikrobiyol Bul. 2009;43(3):383-90. Citado en PubMed; PMID: 19795613.
15. Taneja N, Singh G, Singh M, Sharma M. Emergence of tigecycline & colistin resistant Acinetobacter baumannii in pacients with complicated urinary tract infections in north India. Indian J Med Res. 2011;133: 681-4.Citado en PubMed; PMID: 21727671.
16. Lin YC, Hsia KC, Chen YC, Sheng WH, Chang SC, Liao MH, et al. Genetic Bacis of Multidrug Resistance in Acinetobacter Clinical Isolates in Taiwan. Antimocrob Agents Chemother. 2010;54(5):2078-84. Citado en PubMed; PMID: 20194701.
17. Rahbar M, Mehrgan H, Haji AH. Prevalencia of antibiotic-resistant Acinetobacter baumannii in a 1000-bed tertiary care hospital in Tehran, Iran. Indian J Pathol Microbiol. 2010;53(2):290-3. Citado en PUbMed; PMID: 20551535.
18. Thapa B, Tribuddharat C, Rugdeekha S, Techachaiwiwat W, Srifuengfung S, Dhiraputra C.Rifampin resistance in carbapenem-resistant Acinetobacter baumannii in Siriraj Hospital, Thailand. Nepal Med Coll J 2009;11(4):232-7. Citado en PubMed; PMID: 20635600.
19. Adams-Haduch JM, Paterson DL, Sidjabat HE, Pasculle AW, Potoski Brian A, Muto CA, et al. Genetic Basic of Multidrug Resistance in Acinetobacter baumannii Clinical isolates at a Tertiary Medical Center in Pennsylvania. Antimicrobial Agents Chemother. 2008;52(11): 3837-43. Citado en PubMed; PMID: 18725452.
20. Dizbay M, Altuncekic A, Sezer BE, Ozdemir K, Arman D. Colistin and tigecycline susceptibility among multidrug-resistant Acinetobacter baumannii isolated from ventilator-associated pneumonia. Int J Antimicrob Agents. 2008;32(1):29-32. Citado en PubMed; PMID: 18539006.
21. Al-Swerih NA, Al-Hubail MA, Rotimi Vo. Emergence of tigecycline and colistina resistence in acinetobacter species isolated from patients in Kuwait hospitals. J Chemother. 2011;23(1):13-6. Citado en PubMed; PMID: 21482488.
Recibido: 12 de septiembre de 2013.
Aprobado: 8 de diciembre de 2013.
Mónica Arnold Rodríguez. Hospital Ginecobstétrico Provincial Docente Julio Rafael Alfonso Medina. Calle Santa Cristina e/ Unión y Santa Cecilia. Versalles. Matanzas, Cuba. Correo electrónico: monica.mtz@infomed.sld.cu
CÓMO CITAR ESTE ARTÍCULO
Arnold Rodríguez M. Infección por Acinetobacter spp. en Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández de Matanzas. 2011-2012. Rev Méd Electrón [Internet]. 2014 Ene-Feb [citado: fecha de acceso];36(1). Disponible en: http://www.revmatanzas.sld.cu/revista%20medica/ano%202014/vol1%202014/tema02.htm