INTRODUCCIÓN
El cáncer de pulmón (CP) representa el tercer tipo en incidencia en el mundo, en Cuba y en Matanzas, precedido por el cáncer de piel no melanoma en ambos sexos, el de mama en la mujer, y el de próstata en el hombre. Es la primera en mortalidad, y está relacionada con el hábito de fumar.1,2 La Organización Mundial de la Salud lo divide en dos grandes grupos de forma general: carcinoma de pulmón de células no pequeñas (CPCNP) y carcinoma de pulmón de células pequeñas (CPCP).3 Las etapas clínicas que predominan al diagnóstico son las avanzadas de la enfermedad (IIIB y IV), y la supervivencia global a cinco años en estos estadios es de un 9 % para la IIIB y de 5 % en la IV sin inmunoterapia y con ella; en estudios con atezolizumab ascienden a 7,1 meses con respecto al tratamiento con la quimioterapia estándar.4,5 La inmunoterapia es el pilar de tratamiento más joven que existe en la oncología, y actúa a nivel del sistema inmune.6 Los medicamentos inmunoterápicos anti-PD-1 y anti-PD-L1, aprobados por las agencias regulatorias para el tratamiento del CPCNP en estadios avanzados, son el nivolumab, el pembrolizumab y el atezolizumab.7
En Cuba, la inmunoterapia que se utiliza se produce en el Centro de Inmunología Molecular de La Habana. Son tres los productos con indicación registrada en pacientes con CPCNP en estadios avanzados después de la primera línea de tratamiento oncoespecífico con quimioterapia (QT) o quimio-radioterapia (QT-RT), de ellos dos vacunas terapéuticas: CIMAvax-EGF y Racotumomab, y un anticuerpo monoclonal (Nimotuzumab).8 El medio diagnóstico más utilizado en el mundo para clasificar la enfermedad según T(tumor) N(ganglio) M(metástasis) y llegar al estadio es la tomografía computarizada (TC).9 Esta, a su vez, se utiliza para evaluar las respuestas frente a los tratamientos oncoespecíficos y darle seguimiento a los tumores malignos.10 La evaluación de respuesta a los tratamientos de los tumores malignos sólidos se realiza por unos criterios bien establecidos a nivel internacional (RECIST 1.1, por sus siglas en inglés).11 En sus inicios, la respuesta se evaluaba frente a los tratamientos con QT, pero desde 2017 se han introducido modificaciones al RECIST 1.1 al evaluar respuestas a los tratamientos con inmunoterapia; a estos criterios se les denominaron irRECIST.12
El objetivo de esta investigación es determinar la eficacia de la tomografía computarizada en la evaluación de la pseudoprogresión de la enfermedad en pacientes con cáncer de pulmón de células no pequeñas tratados con la inmunoterapia cubana.
MATERIALES Y MÉTODOS
Se realizó un estudio de evaluación longitudinal, retrospectivo, analítico en pacientes con CPCNP en estadios avanzados, tratados con inmunoterapia activa cubana, después de la primera línea de tratamiento con quimioterapia o quimiorradioterapia, en el período comprendido desde el primero de enero de 2013 hasta el 31 de diciembre de 2017.
El universo lo constituyeron 91 pacientes tratados con Racotumomab y CIMAvax-EGF. Las variables de estudio fueron: la etapa clínica IIIB y IV, la capacidad funcional del paciente (ECOG, por sus siglas en inglés) descrita por la escala del 1 al 4, el tipo de inmunoterapia administrada (CIMAvax-EGF y Racotumomab); los RECIST según respuesta completa (RC), respuesta parcial (RP), enfermedad estable (EE), enfermedad en progresión (EP), pseudoprogresión (PSP) y no evaluable (NE) -estos últimos fallecieron antes del tiempo de la evaluación-. La eficacia del estudio tomográfico se determinó por los resultados alcanzados en la evaluación de respuesta del tumor al tratamiento (RECIST) y la supervivencia global (tiempo transcurrido desde la fecha de diagnóstico de la enfermedad hasta la muerte del paciente, la última noticia o el cierre del estudio para el procesamiento de la información).
Los datos se obtuvieron de las historias clínicas individuales. Se incorporaron en una base de datos en Excel. El análisis estadístico se procesó con el paquete SPSS 23, y el cálculo de la supervivencia global se realizó con el método de Kaplan Meier.
El estudio se realizó respetando las regulaciones y las normas establecidas por el Ministerio de Salud Pública, y se le presentó al Comité de Ética de la investigación científica del Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández, de Matanzas. En la evaluación de los individuos para comenzar el tratamiento con la inmunoterapia, se utilizó el consentimiento informado firmado por los pacientes, familiares y médicos de asistencia, lo cual forma parte de los protocolos de tratamientos del Servicio.
RESULTADOS
De los 91 pacientes incluidos en la presente investigación, 30 se encontraban en la etapa IIIB y 61 en la IV. El 85,71 % de los individuos presentaba ECOG igual 1 en el momento que comenzaron con la inmunoterapia; el resto alcanzó el 2 de la escala, con mínimas restricciones en su vida diaria. Fueron inmunizados 27 pacientes con Racotumomab y 64 con CIMAvax-EGF. En la tabla 1 se aprecia que la EP alcanzó los mayores porcientos de respuesta en cada grupo de vacunas: 44,2 % en los tratados con Racotumumab y 67,19 % en los de CIMAvax-EGF. (Tabla 1)
Tabla 1 Evaluación de respuesta a los tres meses de tratamiento con la inmunoterapia administrada a los pacientes con CPCNP. Matanzas 2013-2016. N = 91

En la tabla 2 se muestra que de los 55 pacientes que progresaron, 33 continuaron en progresión, 4 presentaron una respuesta parcial y 4 estabilizaciones de la enfermedad.
Tabla 2 Evaluación de respuesta a los seis meses de tratamiento con la inmunoterapia de los pacientes con CPCNP que progresaron a los tres meses. Matanzas 2013-2016. N = 55

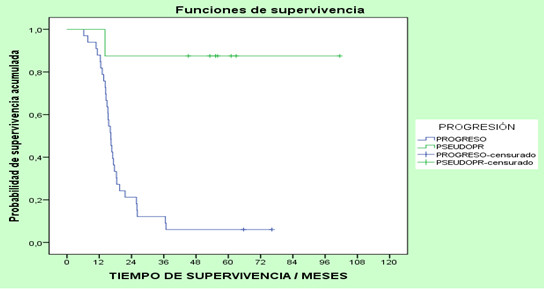
Se confirman, en el estudio, 8 pacientes pseudoprogresores (1 inmunizado con Racotumomab y 7 con CIMAvax-EGF). Al determinar los porcientos de la pseudoprogresión se describe que con Racotumomab aparece el 12,5 % de los pacientes y con CIMAvax-EGF el 28 %. En el gráfico se representa la supervivencia que alcanzaron los pacientes con CPCNP en estadios IIIB y IV, tratados con la inmunoterapia cubana Racotumomab y CIMAvax-EGF después de la primera línea de tratamiento con QT o QT-RT, según estrato de progresores o pseudoprogresores, y se observa que en los pacientes que pseudoprogresaron -a pesar de que fue una cifra menor que la de los que progresaron- se mantiene una línea recta de estabilidad de la enfermedad a partir de los 22 meses, y que alcanzan una supervivencia de 105 meses. El estrato de progresor tuvo una supervivencia de 78 meses, con estabilización a partir de los 36 meses.
DISCUSIÓN
Los fármacos convencionales de quimioterapia tienen mecanismos de acción diferentes a los de inmunoterapia. Los primeros actúan de forma directa sobre el tumor, a nivel de las diferentes fases del ciclo celular y provocan destrucción, con la consiguiente toxicidad sistémica en el organismo de los pacientes; los segundos estimulan la capacidad del sistema inmune de los individuos y hacen que este reconozca y destruya las células cancerígenas. Se postula que el nuevo mecanismo de acción de estos medicamentos, con activación inmunitaria y de células T, conduce a que en los estudios tomográficos aparezcan patrones de respuestas inusuales que se asemejan a un brote tumoral, pero son más pronunciados y más frecuentes que las respuestas antes descritas.13
La TC es el medio diagnóstico que más se utiliza en Cuba y en el mundo para diagnosticar y evaluar las respuestas a los tratamientos en el CPCNP. Este se diagnóstica con mayor frecuencia en las etapas IV de la enfermedad, cuando el pronóstico es precario, las respuestas a los tratamientos son mínimas y donde los pacientes son tributarios para ser evaluados e incluidos en ensayos clínicos. La mayoría de los individuos alcanzan un 3 o 4 en la escala de ECOG,14 lo que no coincide con los resultados de esta investigación, donde el 85,71 % se presentó con 1.
Como novedad se introduce el concepto de pseudoprogresión de enfermedad no confirmada, que deberá reevaluarse a las 4-8 semanas para su confirmación. Asimismo sugieren que ante una pseudoprogresión podría mantenerse el tratamiento si el paciente se encuentra clínicamente estable.15
La frecuencia de la pseudoprogresión relacionada con el sistema inmunitario es bastante variable: depende del sitio de la enfermedad primaria, el agente de inmunoterapia específico y el uso de combinaciones de medicamentos. En la primera localización donde se realizaron estudios de irRECIST fue en melanoma maligno metastásico. En un artículo de Wolchok et al.16 se reveló que en la pseudoprogresión en esta enfermedad bajo tratamiento con Ipilimumab (anti-CTLA-4) se produjeron respuestas terapéuticas posteriores en el 13 % de los pacientes progresistas.
Hodi et al.17 notifican pseudoprogresión en pacientes con melanoma maligno metastásico con el tratamiento de Nivolumab (anti-PD-1) en el 8 % de los pacientes, con respecto al Pembrolizumab (anti-PD-1). Se demostró una pseudoprogresión temprana con más del 25 % de aumento de la carga tumoral en la semana 12, y se confirmó como enfermedad progresiva en seguimiento posterior en el 5 % y una pseudoprogresión tardía en el 2 % de los casos, lo que equivale a una tasa total de pseudoprogresiones del 7 %. En comparación con el melanoma, los datos sobre la pseudoprogresión en CP indican tasas más bajas. En un estudio realizado en pacientes con CPCNP metastásicos tratados con terapia anti-PD-1/PD-L1, se informa la pseudoprogresión en el rango de 0-6 %, y otras investigaciones reportaron pseudoprogresión en torno al 2-5 %, pero con respuestas más duraderas y mejores cifras de supervivencia global.13,18
La pseudoprogresión reportada en esta investigación difiere de las publicadas en estudios de pacientes con CPCNP tratados con terapia anti-PD-1/PD-L1, pero es válido aclarar que en Matanzas no se cuenta con esos productos, y como se expresó con anterioridad, la frecuencia de la pseudoprogresión relacionada con el sistema inmune depende en gran medida del agente inmunoterápico específico empleado.
Los resultados de la supervivencia de los pacientes de la presente investigación son alentadores. Si se comparan con un análisis retrospectivo con 160 pacientes con CPCNP metastásico en tratamiento con anti-PD-1/PD-L1, comparando los criterios RECIST 1.1 e irRECIST, se aprecia que aquellos pacientes con respuestas atípicas (5 % pseudoprogresiones) tuvieron una supervivencia global mayor que aquellos con progresión confirmada (9,8 vs 6,1 meses; p < 0,0001). Además de los pacientes con progresión de la enfermedad, el 11 % se consideró con beneficio clínico, manteniéndose el tratamiento con inmunoterapia.19
Todos los pacientes del estudio mantuvieron el tratamiento con inmunoterapia hasta el fallecimiento, y los que se encuentran vivos aún continúan inmunizándose.
En la investigación se concluye que los pacientes con pseudoprogresión real tuvieron un beneficio general al continuar el tratamiento con la inmunoterapia cubana, y que la TC es el medio diagnóstico eficaz para evaluar la respuesta en este grupo de individuos afectados con CPCNP.