INTRODUCCIÓN
El carcinoma epidermoide, epitelioma espinocelular o carcinoma de células escamosas (CEC) es un tumor maligno, derivado de los queratinocitos epiteliales. Puede aparecer en piel o en mucosas, in situ o sobre lesiones previas. Tiene la capacidad de ser invasor, destructor, infiltrante y con posibilidad de diseminación por contigüidad, vía linfática y hemática.1 Es el segundo en orden de frecuencia del cáncer de piel no melanoma, grupo de tumores de mayor incidencia mundial, y que en los últimos años en Cuba es el más común, con 12 209 nuevos casos en 2016, según datos publicados en el Anuario Estadístico de Salud 2019.2
Este tumor es típico del sexo masculino, con una incidencia de 2.1 respecto al femenino. Suele aparecer en personas de edad avanzada, en fototipos bajos (I-II) y que se exponen al sol por tiempo prolongado sin protección adecuada.1
Entre los factores responsables se citan: la radiación solar, las alteraciones genéticas, la exposición a sustancias químicas, la presencia de procesos inflamatorios cutáneos y degenerativos crónicos, la inmunosupresión e infección viral. La exposición solar es el principal de ellos. Más del 90 % de las lesiones de este tipo aparecen en áreas fotoexpuestas por años y dañadas de manera crónica, como cara, antebrazos y manos.1
Su morfología es diversa y depende del grado de diferenciación de esta neoplasia. Existen varias clasificaciones, pero coinciden en subdividirlas en CEC intraepitelial in situ e invasivo. Los primeros son limitados a la epidermis durante un largo período de tiempo, y el momento de transformación en invasor ocurre cuando atraviesa la membrana basal y penetra a la dermis. La variante invasiva se desarrolla a partir de una lesión previa precancerosa o un carcinoma in situ. Por lo general, su crecimiento es rápido e invade planos subyacentes con capacidad metastásica, y se distinguen dos tipos: el diferenciado, que muestra signos de queratinización dentro o en la superficie del tumor, o el indiferenciado, que no muestra los signos anteriores, pero es sangrante y granulomatoso.1
Su pronóstico depende de la forma clínica e histológica, y son signos de mal pronóstico el tamaño tumoral superior a dos centímetros, la localización cefálica -en particular el labio inferior y la zona auricular-, así como las recidivas previas.1
Múltiples han sido las terapéuticas que se han empleado, cuya elección depende de las características del tumor, topografía, presencia de metástasis, tratamientos previos y estado del paciente. Los procedimientos se subdividen en quirúrgicos y no quirúrgicos. Entre los primeros, la cirugía convencional es la de elección. En los no quirúrgicos se incluyen la terapia fotodinámica, la quimioterapia y la inmunoterapia con interferón alfa 2b;1 sin embargo, son escasas las publicaciones que citan esta última modalidad.
El Centro de Ingeniería Genética y Biotecnología registró, en 2016, un medicamento para el carcinoma basocelular (CBC), que de manera compasional se ha empleado en el carcinoma epidermoide. Resultados alentadores fueron publicados por el Instituto Nacional de Oncología y Radiobiología de La Habana, pionero en Cuba de los ensayos clínicos acerca de inmunoterapia y cáncer, liderados por el Dr. Lorenzo Anasagasti y su equipo.3 El producto farmacéutico es una formulación sinérgica de interferón alfa 2b y gamma. El Policlínico Docente Comunitario Carlos J. Finlay, del municipio Colón, tiene una experiencia de ocho años en su uso y fue uno de los sitios donde se experimentó una de las fases por las que transitó el ensayo, antes de su registro.4 Con estos antecedentes se decidió realizar una investigación con el objetivo de describir la efectividad del tratamiento con HeberFERON® en el carcinoma epidermoide diagnosticado en un centro de atención primaria de salud.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, descriptivo y prospectivo en pacientes con diagnóstico histológico de CEC. Los sujetos procedían de la consulta territorial de tumores de piel del Policlínico Docente Comunitario Carlos J. Finlay, del municipio Colón, en la provincia de Matanzas. Incluyó pacientes desde el año 2017 hasta 2020. Los criterios de inclusión fueron: pacientes mayores de 18 años, con diagnóstico clínico e histológico confirmado de CEC, lesiones de cualquier subtipo clínico, localización, tamaño y fototipo de piel, con o sin tratamientos previos, con lesiones recidivantes o no. La muestra quedó formada por 33 lesiones en 29 pacientes.
Las lesiones se trataron con una mezcla sinérgica de interferones alfa 2b y gamma (HeberFERON®). Se utilizó una dosis de 7,0 y 10,5 millones de unidades internacionales (MUI) de actividad antiviral de interferón alfa 2b e interferón gamma. Cada bulbo se diluyó en un mililitro de agua para inyección y se infiltró de modo perilesional, tres veces por semana durante tres semanas. Se midieron las variables: edad, sexo, fototipo de piel, procedencia, localización de la lesión, tipo clínico, diámetros mayores y menores, estadio clínico y respuesta clínica al tratamiento a las 16 semanas de iniciado.
Para la clasificación de los resultados se adoptaron las cuatro categorías de respuesta al tratamiento según la recomendación del Comité de Criterios de Evaluación de Respuesta en tumores sólidos (RECIST),5 y se incluyeron los dos diámetros (mayor y menor). Estas categorías fueron:
Respuesta completa (RC): desaparición total de la lesión.
Respuesta parcial (RP): reducción de al menos 30 % de la suma de los diámetros.
Enfermedad progresiva (EP): aumento de al menos 20 % de la suma.
Enfermedad estable (EE): la reducción no suficiente como para respuesta parcial o incremento insuficiente como para enfermedad progresiva. Se incluyó la categoría de respuesta objetiva (RO), resultado de la suma de la RC y la RP. La evolución de las lesiones se siguió por observación clínica.
Las variables se recogieron en una historia clínica. Los datos se registraron con los programas Microsoft Excel y SPSS, y se analizaron según las medidas estadísticas de tendencia central y de dispersión. El protocolo de la investigación se evaluó y aprobó por los comités de ética de la investigación del Policlínico y de la Universidad de Ciencias Médicas de Matanzas, antes del inicio del estudio. Se cumplieron los principios de la Declaración de Helsinki.6 Se contó con el consentimiento informado de los participantes, y la documentación del estudio se conserva en el sitio.
RESULTADOS
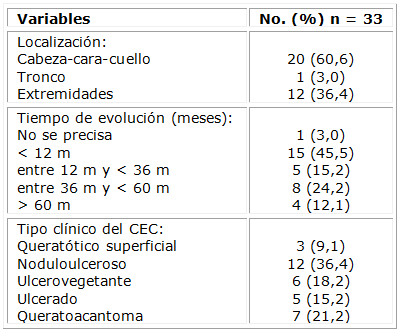
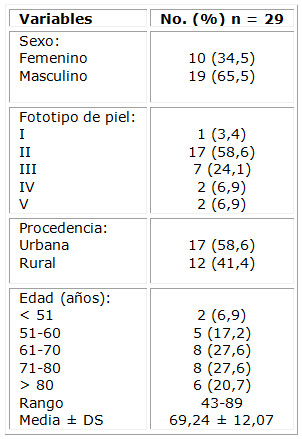
De 29 pacientes estudiados, 19 (65,5 %) fueron hombres. Al fototipo II pertenecían 17 sujetos (58,6 %) de procedencia urbana. La edad de la muestra osciló en un rango de entre 43-89 años, y los grupos etarios 61-70 y 71-80 agruparon el 55,2 %, con 27,6 % cada uno. (Tabla 1)
Tabla 1 Características epidemiológicas de los pacientes con carcinoma epidermoide tratados con HeberFERON®
La tabla 2 expone las características clínicas de los 33 tumores de piel, tipo carcinoma epidermoide, tratados con HeberFERON®; 20 de ellos se localizaron en cabeza-cara y cuello, para 60,6 %. El 45,5 % de las lesiones tenían menos de 12 meses; un 51,5 % había evolucionado por un año o más desde su aparición. Se clasificaron, por su clínica, 12 lesiones (36,4 %) como noduloulcerosas; 6 (18,2 %) fueron ulcerovegetantes y 7 (21,2 %) queratoacantomas. Estos tres grupos abarcaron el 75,8 % de la muestra estudiada.
Otras características que describen las lesiones evaluadas se aprecian en la tabla 3. Fueron epidermoides primarios 25 de las neoplasias, para el 75,8 %. Un elemento importante para determinar el estadio del tumor fue su diámetro mayor; 75,7 % del total tenían más de 20 mm de diámetro. Los estadios I y II representaron más de la mitad de los tumores con similares reportes, representados por 12 carcinomas cada uno. En el estadio I se incluyó la variante IA, que fue lesión ubicada en párpado menor de 10 mm. En dependencia de la invasión a la tarsal o al margen del párpado, la clasificación de la T del TNM (tumor, ganglios, metástasis) para esta localización especial puede oscilar desde T1a hasta T1c, todas incluidas en el estadio IA. Se destacó que 27,3 % de las lesiones se diagnosticaron con un estadio III.
Tabla 3 Otras características clínicas de los tumores evaluados
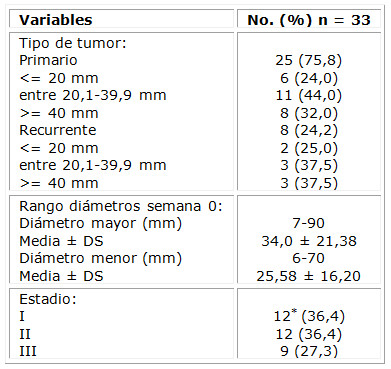
*Se incluye una lesión en párpados con estadiaje IA
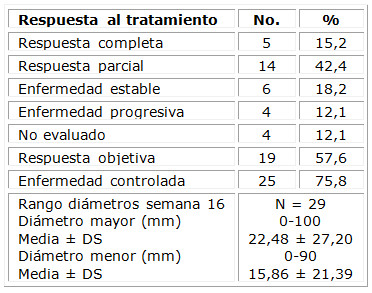
La tabla 4 muestra la respuesta del carcinoma epidermoide a las 16 semanas de iniciado el tratamiento con HeberFERON®. De los 33 CEC, 31 fueron tratados con dosis de 10,5 MUI y dos con 7,0 MUI. De los dos tumores en que se empleó la dosis menor, uno tuvo respuesta completa y otro parcial, con un 100 % de respuesta objetiva. De las 31 lesiones con dosis de 10,5 MUI, 4 (12,9 %) experimentaron respuesta completa y 13 (41,9 %) respuesta parcial, para 54,8 % de respuesta objetiva en 17 neoplasias. Independientemente de la dosis utilizada, hubo una respuesta completa en 5 lesiones (15,2 %) y parcial en 14 (42,4 %), con una respuesta objetiva en 19 (57,6 %). La enfermedad fue controlada en 25 (75,8 %) de los 33 epiteliomas evaluados.
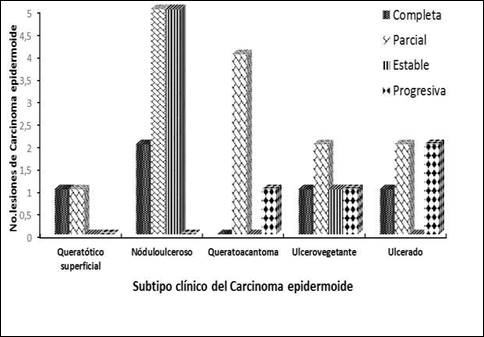
El gráfico expone la respuesta al tratamiento a las 16 semanas, según la variante clínica del carcinoma epidermoide. La variante noduloulcerosa se observó en 12 casos (34,8 %), seguida del tipo queratoacantoma y ulcerovegetante, con 7 y 6 lesiones. En todos los subtipos se apreciaron respuestas objetivas. La respuesta parcial predominó en casi la mitad de los tumores: 14 (42,4 %). Las mejores respuestas la ostentaron el queratósico superficial y el noduloulceroso, pero el queratoacantoma, el ulcerovegetante y el ulcerado presentaron lesiones con evolución progresiva.
DISCUSIÓN
Los datos epidemiológicos de los pacientes evaluados coinciden con lo revisado en la literatura nacional y foránea. En Estados Unidos, este tumor es la segunda causa de cáncer de piel, con 700 000 nuevos casos diagnosticados cada año. Su incidencia se duplica en los hombres, aparecen en mayores de 70 años y en pieles claras. Similares resultados se hallan en cuanto a localización del tumor en áreas expuestas al sol, como cabeza-cara, cuello y extremidades.7
Con el desarrollo social, la migración de la población rural a las ciudades justifica el predominio de los pobladores urbanos entre la muestra, aunque otro fundamento es que estos últimos mantienen su ocupación en el campo, se trasladan largas horas para trabajar o se encuentran bajo una exposición solar mantenida como factores de riesgo para detonar este tipo de tumor de piel.
Al analizar el tiempo de evolución de la neoplasia, los autores se percataron de que casi en la totalidad de los pacientes la lesión tenía más de un año de aparición, y comparten el criterio de que sería recomendable, en próximas investigaciones, identificar la causa de la tardanza en acudir al sistema de salud, cuando en todos los policlínicos del país existe un dermatólogo para consulta general. Además, el programa de pesquisa temprana del cáncer de piel incluye al médico de atención primaria con un papel protagónico en el diagnóstico de las lesiones malignas tempranas.
En recientes publicaciones se le otorga un valor añadido a la velocidad de crecimiento en comparación al tiempo de evolución de la lesión.8,9 Sin embargo, este parámetro no es nuevo: estudios con más de 40 años hacen referencia a este aspecto, pero ha sido poco evaluado en el CEC -aunque hay artículos que exponen, a través de evidencias clínicas, que la velocidad de crecimiento es factor de riesgo para esta variante, considerado así en la guía para el CEC.8
Cañueto et al8 comprobaron que cuando la velocidad de crecimiento es superior a 4 mm/mes se asocia a estadios tumorales mayores, a riesgo superior de metástasis y a recurrencias, aunque el seguimiento sin intervención terapéutica resulta contraproducente y es difícil que un paciente pueda aportar este dato.8
Las características clínicas de la lesión tumoral deben ser confirmadas con el estudio histopatológico. Ambas son predictivas del pronóstico y elección de la terapéutica. Deben ser recogidas en una consulta inicial, y una vez obtenido el resultado de la biopsia determinar el estadio y definir conducta. En una de las guías consultadas para el manejo del CEC,7 recomiendan como datos de información clínica: edad, sexo, recurrencia de la lesión, tamaño, historia previa del tumor y antecedentes de inmunosupresión del paciente sin incluir los detalles del subtipo clínico del tumor.10 Los autores consideran que deben ser tomados en cuenta.
El subtipo clínico del carcinoma epidermoide es una variable poco evaluada por los autores de los artículos revisados, los que con frecuencia abordan los subtipos histológicos.11,12 Algunos manejan los subtipos clínicos como superficial para los in situ e invasivos para las formas agresivas, sin detallarlas.13 Otros exponen que puede aparecer como placas eritematoescamosas superficiales que coinciden con las variantes in situ, o como nódulos infiltrados que pueden o no ulcerarse, úlceras abiertas o menos común, pero más agresivo el verrugoso o vegetante.14,15
Mientras el subtipo clínico del CBC es una variable frecuente en los estudios epidemiológicos del cáncer de piel no melanoma, las variantes clínicas del epidermoide son poco estudiadas. Por lo general, las investigaciones apuntan hacia las formas histopatológicas, los grados de diferenciación, la infiltración y la queratinización del tumor.
Para la clasificación clínica del CEC se tuvo en cuenta su morfología, aunque todas se confirmaron por la histopatología. No se incluyeron las formas intraepidérmicas dadas por la eritroplasia de Queyrat y la enfermedad de Bowen. Todas las formas clínicas observadas pertenecen a las formas invasivas, excepto el queratótico superficial. El queratoacantoma, que hasta hace poco era considerado benigno, se acepta en la actualidad como una forma de carcinoma invasor al demostrarse su riesgo de metástasis.1 El queratótico superficial se presentó en tres pacientes: en uno no se precisó el tiempo, pero los otros dos datan de más de dos años de evolución con diagnósticos histológicos de queratosis actínica que nunca resolvieron con la terapéutica habitual.
Los queratoacantomas son tumores epiteliales muy frecuentes derivados del folículo piloso y que en su evolución pasan por tres fases: de proliferación rápida, de maduración y de involución; sin embargo, hasta un 20 % pueden ser agresivos. En ocasiones, por clínica, simulan un queratoacantoma, y a la histología puede tratarse de otra variante de carcinoma epidermoide e incluso otro tipo de tumor, como carcinoma basocelular metatípico o melanoma nodular. Así se evidencia en la investigación mexicana de Villanueva et al.,16 con el objetivo de determinar la correlación clínico-patología de las lesiones con diagnóstico de queratoacantoma. Concluyen que el queratoacantoma debe ser tratado como un carcinoma epidermoide, y su estadística evidencia que esto puede ocurrir hasta el doble (40 %) de lo que se reporta en la literatura.16
La recurrencia del tumor primario se ha relacionado con un mayor riesgo de metástasis ganglionares. El CEC recurrente es más agresivo que el primario, y según investigadores del tema se ha relacionado con un mayor tamaño tumoral, como se exhibe en la muestra estudiada. Por lo general, esto coincide con un mayor riesgo de infiltración perineural y linfovascular y al tejido celular subcutáneo, aunque esta variable no fue objeto de análisis. También se ha demostrado que la recidiva local del tumor primario se asocia a la extirpación incompleta del carcinoma, aunque autores del estudio reconocen que la recidiva local se justifica por una complicidad de factores de riesgo, tanto de la lesión como por comorbilidades del paciente que la padece.8
El tamaño horizontal del tumor primario es un factor pronóstico bien conocido. Su influencia sobre el riesgo de recidiva local, de metástasis o de ambas se ha evaluado en disímiles estudios. Es un parámetro que se emplea en el sistema de estadificación. En la muestra estudiada la media tanto para el diámetro mayor como el menor de todas las lesiones antes de ser tratadas, sobrepasa los 20 mm. Esta es la medida del punto de corte entre t1 y t2, que relaciona la lesión con un riesgo tres veces mayor de recidiva local y seis veces más alto de metástasis. Al analizar este aspecto, los investigadores consideran que los pacientes incluidos en el estudio deben ser seguidos cada seis a doce meses en los primeros cinco años, y después de forma anual por el resto de su vida, por clínica y por dermatoscopia, para la identificación precoz de la recidiva.
La clasificación del TNM ha sufrido modificaciones a lo largo de los años, y en la actualidad se utiliza la octava edición de la Unión Internacional para el Control del Cancer (UICC), en la que se agrupan varias asociaciones. Esta nueva publicación del sistema de clasificación de TNM para tumores malignos contiene las reglas de clasificación y estadios que corresponden con aquellas que aparecen en la octava edición del manual del cáncer del American Joint Commitee on Cancer.17 Las regiones y sitios anatómicos en esta clasificación son listados por un número codificado en la Clasificación Internacional de Enfermedades Oncológicas, y cada localización tiene sus particularidades. En el carcinoma de piel excluye párpados, cabeza y cuello, perianal, vulva y pene. Estas localizaciones deben ser tratadas según las modificaciones de cada sitio.17
En concordancia con el tamaño de los diámetros iniciales, más de la mitad de las lesiones tratadas tuvieron medidas superiores a los 20 mm, lo que las agrupó en los estadios II y III -ambos con mal pronóstico-, tumores que deben ser tratados en la atención secundaria y llegan a la atención primaria. Un artículo coreano publicado en 2019 por la Revista de Radiología y Oncología, reporta 19 lesiones de cáncer de piel no melanoma localizadas en cabeza y cuello (10 CEC y 8 CBC), tratadas con radioterapia, en la que prevalece el estadio I en 11 lesiones (57,9 %) y el II en un 31,5 %;11 estas estadísticas son de mejor pronóstico que las del presente estudio. Un detalle de la publicación asiática es que clasifican el estadio II hasta 5 cm de diámetro mayor del tumor, cuando la UICC declara que es hasta 4 cm.17
Al revisar una referencia nacional reciente sobre neoplasias de piel, tratadas con radioterapia superficial, no utilizan la estadificación del tumor, sino que tienen en cuenta aquellos carcinomas mayores de 3 cm, que coincide con parte del estadio II y el III.18
Irribarren et al.19 realizaron en 2017 un estudio en la zona semidesértica de Chile, con un clima árido y con alta radiación ultravioleta, con el objetivo de caracterizar demográfica y clínicamente el carcinoma epidermoide. El estudio incluyó 236 lesiones con un diámetro promedio de 21,3 ± 16,4 mm, con un rango de 3 a 100 mm. El tamaño de las lesiones es menor en comparación con el diámetro menor de los tumores de la muestra que se analiza. Estas referencias hacen pensar a los investigadores que la serie de casos tratada con el HeberFERON® son de una complejidad más avanzada, al menos por sus diámetros, aunque el estadio (parámetro que se toma en cuenta) no es un punto analizado en los más de doscientos tumores estudiados en el artículo chileno.19
Como se ha apreciado en los tres artículos considerados, con menos de tres años en la red científica de revistas, el estadio del tumor no se ha tomado por esos científicos, hecho que es primordial para el pronóstico y decisión del método a emplear.
Opciones terapéuticas múltiples, quirúrgicas o no, se han aplicado para el carcinoma epidermoide de piel no metastásico. Es la escisión quirúrgica con control de márgenes (cirugía micrográfica de Mohs) la de primera elección. Entre los métodos no quirúrgicos se utilizan la electrocoagulación y curetaje, así como la criocirugía para lesiones de bajo riesgo y la radioterapia superficial para los de alto riesgo.14 También se han utilizado otras alternativas como la terapia fotodinámica, el imiquimod 5 % en crema, el diclofenaco sódico en gel, el 5-fluoracilo14,15,20 y el interferón intra o perilesional, con buenos resultados.15,21 En los casos localmente avanzados se tratan con drogas sistémicas asociadas con otras terapias. La quimioterapia sistémica se realiza a blancos terapéuticos (factor receptor de crecimiento epidérmico, PD-L1, entre otros) que se expresan en estos tumores.20,21
Los adelantos en la oncoinmunología han transformado el campo terapéutico, con resultados prometedores desde las fases tempranas de los ensayos clínicos. Entre estos avances, los interferones solos o combinados constituyen una alternativa terapéutica a emplear, incluso en los tumores de estadios avanzados. Las respuestas al HeberFERON®, combinación sinérgica utilizada en esta investigación, difieren de las estadísticas halladas por Anasagasti et al.,3 quienes infiltraron la misma mezcla, pero antes de su registro, que en aquel momento era HeberPAG. Sus resultados en cuanto a la respuesta completa fueron de 46,7 % vs. 15,2 % del estudio en cuestión, pero se comportaron de manera similar las respuestas parciales: 40,0 vs. 42,4 %. Las respuestas objetivas de ambas investigaciones fueron: 86,7 % vs. 57,6 %. Al analizar estos datos, son múltiples los factores que hacen la diferencia entre ambos estudios, que justifican los hallazgos observados. Entre ellos se citan que el investigador del Instituto de Oncología y su equipo evaluaron de manera global los carcinomas basocelulares (12 lesiones) y los carcinomas epidermoides (4 tumores);3 la dosis máxima empleada fue de 21 MUI, mientras que la dosis que se aplicó en el estudio de la atención primaria fue de 10,5 MUI. La terapia con interferones, referenciada por el prestigioso centro internacional, combinó el producto de la inmunología con el uso de quimioterapia. Todos estos parámetros hacen que la respuesta objetiva se haya obtenido en el oncológico con cifras más elevadas.
Con respecto a la quimioterapia asociada en la institución, que alcanza un nivel terciario de atención, destacan Anasagasti et al. que a pesar de que la cantidad de pacientes que recibieron quimioterapia combinada con INF fue pequeña, los resultados fueron impresionantes. Esta asociación se ha reportado que tiene efectos sinérgicos por sensibilización de las células a la apoptosis, y actúa como inmunomoduladora, lo que potencia los efectos antiangiogénicos y explica un mayor período de curación al tratar la lesión con la combinación de interferones más la quimioterapia. Este aspecto se debe tener en cuenta en aquellas lesiones que no han respondido a un primer ciclo de HeberFERON® y se han comportado como de enfermedad estable o progresiva.3
Una publicación reciente por investigadores del Instituto Oftalmológico Bascom Palmer, de Miami, Estados Unidos, compararon el uso del interferón alfa 2b (INF) y el 5-fluoracilo (5FU), en gotas oculares, como modalidades terapéuticas en el carcinoma epidermoide de la superficie ocular, con la resolución completa de las lesiones en 52 de 54 tratadas con 5FU, y en 39 de 48 que usaron INF, sin mostrar diferencias significativas entre ambas terapéuticas.22
Otro artículo con similares resultados es un estudio retrospectivo de intervención en una serie de 39 casos mexicanos con carcinoma epidermoide de la superficie ocular que fueron tratados con interferón alfa tópico e intralesional, solo o combinados con cirugía, con efectividad de un 87,1 % y bajas recidivas.23 También el queratoacantoma ha sido tratado con INF con excelentes resultados.24 Esta efectividad sustenta las investigaciones con respecto al empleo del interferón en el carcinoma epidermoide.
Se conocen antecedentes de investigaciones realizadas en Cuba sobre el uso de interferón alfa 2b en las variantes clínicas del carcinoma basocelular. En los subtipos de bajo riesgo clínico (superficial, nodular y pigmentado) un 70 % experimentan respuestas objetivas (RC 60 %, RP 10 %), mientras que en los de alto riesgo (ulceroso, esclerodermiforme y ulcerocicatrizal) solo un 10 % muestran RC.25 Similares resultados se obtuvieron con los CBC en los que se aplicó el HeberPAG a dosis de 3,5 MUI, con igual metodología que la que se implementó para evaluar la respuesta del HeberFERON® en el carcinoma epidermoide. Ante los referentes nacionales de la respuesta de los interferones en las diversas variantes clínicas del CBC, compiladas en agresivas o no, y sin hallar publicaciones que permitan la comparación de estos aspectos, en el carcinoma epidermoide los investigadores presumen que la efectividad a la terapéutica empleada debe comportarse de igual manera, en las formas menos invasivas del CEC, como el queratótico superficial y el noduloulceroso, con mejores respuestas y de forma contraria en las variantes más agresivas, aunque defienden el criterio de que la efectividad depende de múltiples factores del tumor y del individuo, que deben ser motivo de investigaciones futuras.
El carcinoma epidermoide puede ser tratado en las unidades del sistema de atención primaria de salud con una combinación sinérgica de interferón alfa 2b y gamma (HeberFERON®), aplicado por un personal entrenado. Con la dosis empleada se observó una respuesta favorable pero no completa en todos los subtipos clínicos, lo que sugiere emplear más de un ciclo de tratamiento cuando se obtengan respuestas parciales o asociar con quimioterapia en aquellas con evolución a una enfermedad estable o progresiva.