My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Cubana de Informática Médica
On-line version ISSN 1684-1859
RCIM vol.4 no.1 Ciudad de la Habana Jan.-June 2012
ARTÍCULO ORIGINAL
"ALASCLÍNICAS": Sistema de gestión de ensayos clínicos
"ALASCLÍNICAS": Clinical trial management system
Lucía Rodríguez García,I Martha Denia Hernández Ramírez,II Richard Díaz Pompa,III Erislán Martínez Jera,IV Leandro Hernández Cuello,V Landy González EnríquezVI
IApto. 28203, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 835-8854. E-mail: lrodriguezg@uci.cu
IIApto. 54102, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 837-2140. E-mail: mdhernandez@uci.cu
IIIApto. 48203, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 837-2138.
IVApto. 77206, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 837-2261. E-mail: ejera@uci.cu
VApto. 127108, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 837-3207.
VIApto. 77206, Universidad de las Ciencias Informáticas, carretera a San Antonio Km. 2½, La Lisa, Ciudad de La Habana, Cuba. Teléfono: 837-2261.
RESUMEN
Los ensayos clínicos constituyen un tipo de estudio médico que, a través de su aplicación a seres humanos, pretenden valorar la eficacia y seguridad de nuevos fármacos o tratamientos mediante un protocolo de investigación estrictamente controlado. Todos los centros científicos del país que desarrollan nuevos medicamentos necesitan la ejecución de ensayos clínicos para determinar si estos contribuirán a prevenir, detectar o tratar una enfermedad; destacándose vacunas contra el cáncer, el sida y otros padecimientos. Actualmente este proceso asociado a los ensayos clínicos, se realiza recopilando todos los datos en papel y transmitiendo la información, de los hospitales a los centros promotores y viceversa, generalmente vía correo electrónico o telefónica. Para lograr la gestión de los ensayos clínicos se han realizado varios sistemas en el mundo, entre ellos el sistema OpenClinica, el cual abarca gran parte de los procesos en la gestión de los ensayos clínicos cubanos, pero no la totalidad estos procesos. Con el objetivo de obtener un sistema que abarque todos los requerimientos necesarios, se decide adaptar OpenClinica para obtener el sistema de manejo de ensayos clínicos cubano: alasClínicas como herramienta para el control y seguimiento de toda la información asociada a los ensayos clínicos, facilitando el manejo y almacenamiento de la misma. Consta de cuatro módulos fundamentales: Administrar empresa, Gestionar estudio, Gestionar datos y Extraer datos. Este trabajo está orientado a presentar la propuesta de este sistema, mostrando sus características significativas, funcionalidades y su aporte al aumento de la calidad de vida de la sociedad cubana.
Palabras clave: datos clínicos, ensayos clínicos, gestión de ensayos clínicos, CTMS.
ABSTRACT
The Clinical Trials constitute a type of medical study that, through their application to human beings, seek to value the effectiveness and security of new medications or treatments. All the scientific centers of the country that develop new medications need the execution of Clinical Trials to determine if these will contribute to prevent, detect or treat an illness; standing out vaccines against the cancer, the AIDS and other sufferings. At the moment this process associated to the Clinical Trials, is carried out gathering all the data in paper and transmitting the information, of the hospitals to the centers promoters and vice versa, generally via electronic mail or phone. To achieve the administration of the Clinical Trials, several electronic systems in the world have been carried out, among them, the OpenClinica system, which embraces great part of the processes in the administration of the Clinical Trials in the Molecular Immunology Center in Cuba, but not the entirety of these processes. With the objective of obtaining a system that embraces all the necessary requirements, it decides to adapt OpenClinica to obtain the system of handling of clinical trials: alasClínicas like tool for the control and pursuit of all the information associated to the Clinical Trials, facilitating the handling and storage of the same one. It consists of four fundamental modules: To administer company, Negotiate study, Negotiate data and Extract data. This work is guided to present the proposal of this system, showing its significant characteristics, functionalities and its contribution to the increase of the quality of life of the Cuban society.
Key words: administration of clinical rehearsals, clinical data, clinical rehearsals, CTMS.
INTRODUCCIÓN
Los Ensayos Clínicos (EC) pretenden valorar la eficacia y seguridad de nuevos fármacos o tratamientos a través de su aplicación a seres humanos.1 Estos llevan asociada una gran cantidad de documentación, necesaria para cumplir con las buenas prácticas clínicas exigidas por todas las agencias regulatorias a nivel mundial. Esta documentación debe ser almacenada no menos de 15 años posterior al cierre del estudio, de modo que pueda ser inspeccionada en cualquier momento por las agencias regulatorias.2
El Centro de Inmunología Molecular (CIM) en Cuba, ha venido desarrollando desde sus inicios, una serie de biomoléculas para el tratamiento de diferentes enfermedades, principalmente el cáncer. El objetivo principal de las investigaciones en este centro es la búsqueda de nuevos productos para el diagnóstico y tratamiento del cáncer y enfermedades relacionadas con el sistema inmunológico. Los proyectos de investigación básica están concentrados en la inmunoterapia del cáncer; especialmente en el desarrollo de "vacunas moleculares", ingeniería de anticuerpos, ingeniería celular, bioinformática y regulación de la respuesta inmune.3
En la actualidad, los EC en el CIM y en Cuba se desarrollan de la manera clásica. Toda la información se encuentra en papel y la transmisión de información de los hospitales a los centros promotores y viceversa, se hace generalmente vía correo electrónico o vía telefónica. Un complicado proceso de monitoreo de los datos clínicos se realiza visitando periódicamente cada uno de los sitios participantes, incluyendo las provincias orientales, con el objetivo de controlar la calidad y uniformidad de los datos recogidos. Finalmente se preparan bases de datos, en versión electrónica, a partir de los Cuadernos de Recogida de Datos (CRD) llenados en los hospitales; con el objetivo de facilitar el análisis final de los resultados de cada ensayo. La generación de estas bases de datos resulta compleja para el CIM, dado la gran variabilidad de la información recogida en los hospitales y por la dificultad intrínseca del proceso de transcribir de manera fiable, información de un formato impreso a un formato electrónico.4
Teniendo en cuenta lo anteriormente explicado, el CIM tiene la necesidad de informatizar el proceso de conducción de los EC de forma que permita la transmisión remota de datos entre la Red Nacional de Hospitales y el Centro. Además de que se hace necesario la actualización constante de las bases de datos y el procesamiento de la información clínica que de estas se deriven. A raíz de esta situación problemática se estudiaron algunos de los sistemas de manejo de datos de ensayos clínicos que existen (o CTMS por sus siglas en inglés); dentro de los cuales se encuentra el software OpenClinica.
OpenClinica es un software de código abierto desarrollado por la compañía norteamericana Akaza, para captura electrónica de datos y gestión de datos de EC y estudios de investigación. El software es una aplicación Web diseñada para dar cobertura a todo tipo de estudios clínicos. El desarrollado está basado en estándares que permiten alcanzar altos niveles de interoperabilidad con otros servicios y plataformas. Su arquitectura modular, transparencia y su modelo de desarrollo colaborativo ofrecen una gran flexibilidad, a la vez que permiten desplegar soluciones de alto rendimiento y escalabilidad. Permite cumplir con los más altos estándares de calidad, seguridad y buenas prácticas clínicas según GCP (Good Clinical Practices), HIPAA (Health Insurance Portability and Accountability Act).5
El sistema OpenClinica ha sido estudiado por un grupo de estudiantes y profesores del proyecto Ensayos Clínicos de la Universidad de las Ciencias Informáticas (UCI), con el objetivo de analizar si el mismo puede ser usado para la gestión de Ensayos Clínicos en Cuba. Este estudio se ha realizado junto a especialistas del CIM vinculados al manejo de EC. Concluido el estudio, se determinó que algunas de las funcionalidades del sistema son muy similares a los procesos realizados en la conducción de EC en el centro. No obstante, existen un conjunto de requisitos que no están contemplados en el sistema, por lo que surge como problema científico a resolver: ¿cómo lograr un producto funcional que soporte los procesos realizados en la conducción de Ensayos Clínicos en el CIM, a partir del sistema OpenClinica?.
El objetivo del presente trabajo es describir la propuesta del sistema informático alasClínicas, como una versión de OpenClinica, a fin de acelerar y automatizar la conducción de EC en el Centro de Inmunología Molecular.
MÉTODOS
Metodología
Para la construcción de alasClínicas, se siguió el Proceso Unificado de Desarrollo (RUP) como metodología de desarrollo de software; siendo esta una metodología rigurosa que se adapta a la realización de proyectos grandes en cuanto a tamaño, duración y a sistemas orientados a objetos. RUP define las actividades en grupos lógicos definiéndose nueve flujos de trabajo principales: Modelado del negocio, Requerimientos, Análisis y diseño, Implementación, Prueba, Instalación, Administración del proyecto, Administración de configuración y cambios, y Ambiente. Los seis primeros son conocidos como flujos de ingeniería y los tres últimos como de apoyo. El proceso de desarrollo se divide en cuatro fases: Conceptualización, Elaboración, Construcción y Transición.6
Arquitectura
El sistema fue desarrollado sobre la base de las tecnologías Java 2 Enterprise Edition (J2EE), Java Server Pages (JSP) y Servlet. Como servidor Web ApacheTomcat 6.0, como servidor de base de datos PostgreSQL 8.2.5 y como máquina virtual de java la JDK-6-u3.
El sistema está dividido en cuatro módulos que agrupan funcionalidades de acuerdo al funcionamiento del negocio actual: Administrar Empresa, Gestionar Estudio, Gestionar Datos y Extraer Datos. Para el diseño arquitectónico, cada uno de los módulos mostrados anteriormente fueron implementados según el patrón Modelo-Vista-Controlador, que se adapta a las necesidades del negocio y se utiliza para el desarrollo de aplicaciones Web (Fig. 1).
RESULTADOS
Con los cambios introducidos en el sistema OpenClinica se obtiene un nuevo sistema informático con el nombre alasClínicas, el cual tiene como propósito acelerar y automatizar la conducción de EC en el Centro de Inmunología Molecular.
El sistema alasClínicas está formado por cuatro módulos:
- El módulo Administrar Empresa: permite gestionar los permisos y roles de los usuarios que accederán al sistema, así como la administración de direcciones IP desde las cuales se accederá al sistema.
- El módulo Gestionar Estudio: permite la creación de EC, así como la confección de CRD y la creación del Cronograma general de ejecución de cada EC. Además permite realizar la validación de las variables de un CRD a través del establecimiento de reglas de validación y derivación; permitiendo la disminución y detección de los errores que pueden cometerse al entrar los datos recogidos de los pacientes en el ensayo.
- El módulo Enviar Datos: permite generar el Cronograma de ejecución específico para cada paciente dentro de un ensayo, así como el llenado de las hojas CRD. Además permite realizar el monitoreo de los datos de los pacientes de un sitio y la creación de notas o discrepancias asociadas a cada uno de los datos monitoreados.
- El módulo Extraer Datos: permite realizar reportes a partir de los datos almacenados por pacientes en el ensayo y realizar un reporte de las trazas de auditoría asociado fundamentalmente a las variables de los modelos y a las acciones en general que realiza determinado usuario sobre los elementos del sistema. Garantiza la salida de información en diversos formatos de uso extendido: SPSS, EXCEL y HTML.
El sistema actualmente se encuentra desplegado en el Centro de Inmunología Molecular y se le están realizando pruebas pilotos con datos del ensayo: "Evaluación de la eficacia y seguridad de la vacuna NGlicolilGM3/VSSP en pacientes con cáncer de mama metastásico". Se está realizando la entrada remota de los datos desde Matanza y Villa Clara, siendo visible la aplicación desde hospitales de estas provincias. Una vez terminadas estas pruebas, será utilizado para la conducción de todos los ensayos que se gestionan en el CIM, accediéndose al sistema desde los hospitales de todo el país.
A continuación se muestran imágenes del sistema: (Fig. 2, 3, 4 y 5).
La seguridad en el sistema
La seguridad del sistema es controlada en dos etapas, una vez que el usuario se autentica:
1. Se verifica que el usuario y la contraseña sean correctos y que esté accediendo desde una PC, cuya dirección IP esté registrada en el sistema y para ese usuario.
2. Luego del paso 1, el usuario entra en la zona de trabajo que le corresponde teniendo en cuenta el rol, el sitio al que pertenece y el ensayo clínico al que tiene acceso; dependiendo de la dirección IP desde donde esté conectado.
3. Se establecen políticas que obligan a que las contraseñas deban tener más de siete caracteres de longitud, una fortaleza media o alta y a que los usuarios estén obligados a cambiarla cada 60 días como máximo.
Cada usuario tiene asignado uno o varios roles en el sistema y cada rol definido tiene niveles de acceso.
Solo pueden acceder a la aplicación, clientes a través de direcciones IP específicas y bien controladas.
Todo cambio o modificación en el sistema debe ser atribuible a un usuario particular según su autenticación, auditando todas las acciones realizadas.
DISCUSIÓN
El manejo electrónico de datos en estudios clínicos tiene su origen en los años setenta y desde entonces se han venido desarrollando, a nivel internacional, herramientas informáticas que le dan apoyo. Una referencia importante ha sido el marco regulatorio adelantado por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) de los Estados Unidos de Norteamérica, con la publicación, en marzo de 1997, de la Regulación 21 CFR parte 11 y en abril de 1999, de la Guía para Sistemas Computarizados; los cuales representan un modelo para los estándares globales de manejo de datos en investigación clínica.
En tal sentido se han desarrollados los Sistemas de Gestión de EC a nivel mundial. A continuación se mencionan algunos de estos sistemas:
DataLabsXC 4.0 (de la Compañía DataLabs basada en la tecnología de Microsoft): es una plataforma de manejo de datos clínicos que incluye módulos para el diseño de estudios clínicos, la captura electrónica y el manejo de datos de EC. Esta aplicación tiene la flexibilidad de ser un sistema basado en la tecnología Web que incluye las funcionalidades de un CTMS que reduce el tiempo y costo relacionado con la gestión de Ensayos Clínicos.7 Este sistema es utilizado por PRA International, la cual es una de las principales organizaciones de investigación clínica con más de 2.500 empleados que trabajan en sus oficinas de Norteamérica, Europa, Sudamérica, África y Australia.8
Medidata RAVE: este sistema es una solución de la Compañía Medidata Solutions (proveedor mundial de soluciones de gestión de datos clínicos en formato electrónico con clientes en 40 países9), destinada a mejorar la eficacia de los ensayos, racionalizando el proceso de recogida, verificación, consolidación y análisis de datos de investigaciones clínicas. El sistema ha sido evaluado por IBM Global Services y actualmente es usado por Bayer Healthcare AG.10 Esta última es una filial de Bayer AG, empresa alemana, líder mundial en el ámbito de la salud y la fabricación de medicamentos y productos médicos, para el diagnóstico, la prevención y el tratamiento de enfermedades.11
kbee.docs (Archivo electrónico de Documentación de Ensayos clínicos): es una solución especializada para la gestión documental segura, controlada y costo efectiva de los proyectos de EC. Ofrece beneficios de ahorro de gastos, cumplimiento efectivo de normas regulatorias, ahorro de tiempo, trazabilidad y control.12
Desventajas de estos sistemas: los sistemas vistos anteriormente además de otros como Hipócrates y Oracle ClinTrial, son sistemas propietarios a través de los cuales las compañías que los promueven solo ofrecen sus servicios online. Esto se refiere a que el cliente deberá pagar un alto precio por el servicio de conducir un ensayo en el sistema y en ocasiones el precio podría variar en dependencia de la cantidad de pacientes que serán incluidos. Así mismo, la capacitación del personal también sería otros de los gastos en los que habría que incurrir. Además del gran costo monetario que significa el uso de los servicios, la información generada en los estudios, que por su significado deberá ser de gran fiabilidad e integridad, se encontrará en servidores externos a la institución que gestiona los ensayos; lo cual no es conveniente teniendo en cuenta que los datos que se manejan podrían ser vulnerados, y estos constituyen la base de los EC y de la producción de fármacos en el país.
Además de estos sistemas se analizaron otros de código abierto:
Trial Médico Elipse III: es un sistema de la compañía Open Sistemas. Es un software libre desarrollado con tecnología jsp y flex, que permite el archivo y clasificación de fichas que recogen los datos relativos a la salud de pacientes anónimos en función de criterios especificados previamente como antecedentes médicos y tratamientos farmacológicos, según el estudio planteado en cada caso. Brinda una mayor flexibilidad y facilidad a la hora de introducir los datos de los ensayos clínicos, simplificando la monitorización y seguimiento del estudio.13
OpenClinica: es un CTMS que permite la creación de EC, el diseño de CRD, la inserción de pacientes en los ensayos; así como la recogida de los datos y la realización de reportes de los mismos. Actualmente es el líder de los CTMS "Open Source", con una comunidad de usuarios de 76 países.5
Teniendo en cuenta las ventajas de este último sistema, se decidió desarrollar alasClínicas a partir del mismo.
alasClínicas: es un sistema desarrollado en la Universidad de las Ciencias Informáticas en Cuba, abarca las funcionalidades de OpenClinica y además brinda otras como: la realización de un Cronograma de ejecución general para los ensayos y la generación del cronograma específico para cada paciente, la validación de las variables de los EC, permitiendo la disminución y detección de errores en los datos, el reporte de las trazas de las acciones realizadas en el sistema; así como la restricciones de las direcciones IP desde las cuales se puede acceder al mismo, entre otras.
Aportes del sistema:
Las principales agencias reguladoras internacionales ya han adecuado sus normativas al modo de conducción de Ensayos Clínicos en forma electrónica. Gran parte de estos procesos en el mundo ya están informatizados, lo cual, a cualquier centro que lo utilice, le garantiza:
- Reducir los costos en cuanto a transportación y material de oficina ya que se ocupará menos espacio físico al eliminar los CRD impresos.
- Respuesta rápida a problemas que en el modo tradicional tardan semanas y meses en conocerse y por consecuencia más tiempo en solucionarse.
- Facilitar la comunicación entre todos los centros que participen en la conducción de los ensayos.
- Chequear y optimizar el proceso de monitoreo que se realiza en las diferentes provincias y que no resulta factible de chequear físicamente.
- Estandarizar la información que se maneja, restringiendo a los especialistas al uso de los formatos establecidos por los entes responsables.
Sistemas de este tipo son sumamente costosos y realizados por empresas bajo licencias no libres, imposibilitando a países del tercer mundo su adquisición. Como muestra de ello se estima que el monto inicial de un software de este tipo puede llegar a tener un valor de 800 000 dólares, adicionándole a esta suma los pagos de las licencias anuales con un costo de 100 000 dólares cada una, los servicios de mantenimiento, soporte y capacitación del personal también deben ser pagados, como resultado final, el país que lo solicita tiene que pagar cifras que superan los 800 000 dólares.
La información manejada, en la mayoría de los casos, se encuentra en los servidores de las empresas que ofertan el servicio, es decir, las empresas solicitantes no tienen el control de los datos manejados, lo que no garantiza la confiabilidad de los mismos.
Cuba por ser un país bloqueado posee aún más restricciones. Además muchos de estos sistemas no están en correspondencia a los requisitos identificados en los diferentes centros de salud cubano y no ocupan todas las etapas de los ensayos clínicos.
Anteriormente el Centro de Inmunología Molecular no contaba con algún sistema que facilitara la gestión electrónica de ensayos clínicos, por tanto para este centro el desarrollo de alasClínicas:
- Facilita y agiliza el proceso de diseño y aprobación de los CRD.
- Provee mayor seguridad a la información.
- Estandariza la información manejada en los ensayos clínicos permitiendo la codificación de tratamientos y eventos adversos mediante diccionarios integrados.
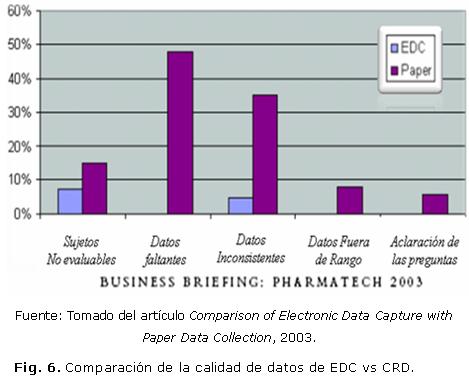
- Se elimina la doble entrada de los datos. Los datos son entrados directamente por quienes los recogen, siendo también sus responsables, lo que reduce la posibilidad de errores, los datos faltantes e inconsistentes y el número de pacientes no evaluables, según se observa en la figura 6 la calidad de la captura electrónica de datos (en inglés EDC) sobre la calidad de los cuadernos de recogida de datos.
- Permite un acceso inmediato y actualizado del estado de desarrollo del Ensayo Clínico.
- Facilita el flujo de información entre las entidades que conducen el ensayo y permite un fácil rastreo de los registros relacionados con estas comunicaciones.
- Facilita la labor del monitor ya que permitirá una optimización del proceso de monitoreo. Permitir a reducir el número de visitas requeridas a los sitios de inclusión; así como reducir el tiempo requerido en las mismas.
- Genera un ahorro significativo de capital monetario, posibilitando la adquisición de un software de desarrollo propio, sin restricciones y garantizando a su vez soporte o mantenimiento sin incurrir en grandes gastos por concepto de licencias o servicios.
- La información introducida es totalmente auditable conforme a la normativa vigente de ensayos clínicos.
- Se reduce el tiempo real de conducción de un ensayo clínico (Fig. 7), acelerando de este modo obtener fármacos en un menor tiempo y se reducirán los costos de conducción de los ensayos clínicos (Fig. 8).
Contribuye al desarrollo más certero de los ensayos, con una mayor validez en la investigación, lo que permite estimar con mayor veracidad el impacto de los mismos en la salud de los pacientes.
CONCLUSIONES
A partir de las características principales descritas del sistema alasClínicas, este podría ser capaz de cubrir la mayoría de los procesos de la gestión de ensayos clínicos en Cuba.
El sistema permite el aumento inmediato de la eficiencia en la conducción de los ensayos clínicos en los centros del polo científico cubanos, con el consecuente impacto en la aceleración del desarrollo de varios productos y por ende un aumento de la competitividad de los mismos como empresas biotecnológicas.
El sistema se integra de manera orgánica con los esfuerzos que hoy realiza el país en la informatización de la salud pública, contribuyendo a elevar la calidad de vida de sus habitantes.
REFERENCIAS BIBLIOGRÁFICAS
1. ClinicalTrials, Understanding Clinical Trials. National Institutes of Health. 2007. Disponible en: http://clinicaltrials.gov/ct2/info/understand
2. Aznar-Salatti, J. Diseño de protocolos de un estudio clínico: las denominadas "case report forms" o cuadernos de recogida de datos. Jano [revista electrónica]. 1997. Disponible en: http://www.uv.es/~docmed/documed/documed/591.html
3. CIMAher. Centro de Inmunología Molecular. 2009. Disponible en: http://www.cimaher.com/index.php?action=cim
4. Leon Monzón, K. Propuesta de proyecto de colaboración con la UCI. Departamento de Ensayos Clínicos, Centro de Inmunología Molecular. 2006.
5. Open Clinica, Open Source for Clinical Research. Akaza Research. 2007. Disponible en: http://www.openclinica.org/section.php?sid=1
6. Rational Unified Process. 2011. Disponible en: http://www.rational.com.ar/herramientas/rup.html
7. Barr, Sherold. DataLabs Introduces Single Data Management System to Unify Paper Data Entry and Electronic Data Capture. 2005. Disponible en: http://www.datalabs.com/
8. PRA International. 2011. Disponible en: http://www.prainternational.com
9. Medidata Solutions. 2011. Disponible en: http://www.mdsol.com
10. Bayer Healthcare estandariza la solución de gestión de datos clínicos Medidata So-lutions RAVE. 2011. Disponible en: http://www.prnewswire.co.uk
11. Bayer AG. 2011. Disponible en: http://www.bayer.com
12. Kbeedocs. 2011. Disponible en: http://www.kbeedocs.com
13. Trial Médico Elipse III. 2011. Disponible en: http://www.opensistemas.com/soluciones/soluciones_a_medida/
Recibido: 16 de junio de 2011.
Aprobado: 25 de diciembre de 2011.