Introducción
Para evaluar el nivel de sedación de un paciente durante una cirugía, en Anestesiología se han estudiado síntomas y signos clínicos tales como: cambios en la variabilidad del ritmo cardiaco, presión sanguínea, frecuencia de respiración, respuesta a estímulos motores y comandos verbales entre otros. Con el avance de la ciencia y la tecnología, se ha demostrado que la absorción de fármacos anestésicos en varias dosis modifica la frecuencia y amplitud de las señales del Electroencefalograma (EEG), las cuales son el resultado del registro de la actividad eléctrica de las neuronas que forman la capa de células piramidales de la corteza cerebral 1 ,por lo que el monitoreo de la anestesia general ha evolucionado con la invención de técnicas que usan como información fisiológica del paciente a las señales del EEG. Actualmente existe una gama de propuestas de niveles de anestesia definidos según el método que se utilice para su detección intraoperatoria, sin embargo, la esencia del proceso radica en evaluar el estado del paciente en tres momentos principales: despierto, sedado en un nivel de inconsciencia que permita realizar la cirugía y un estado de sedación más profunda, usando para el registro de las señales de tres a cuatro electrodos (derivaciones o canales electroencefalográficos) con localización frontopolar (en la frente del paciente). Si bien estos electrodos reflejan la pérdida y recuperación de la consciencia durante la sedación anestésica, se reporta que las señales registradas son afectadas por la excesiva actividad electromiográfica del cuero cabelludo, las señales del Electrocardiograma, así como la actividad electrooculográfica generada en el interior del globo ocular 2.
Aunque el efecto topográfico que podrían tener los agentes hipnóticos en las diferentes regiones corticales a través de los registros del EEG hasta el momento no ha sido suficientemente caracterizado, se ha demostrado que los cambios del espectro de potencia entre todos los electrodos son independientes del tipo de anestésico, pero altamente significativos entre los diferentes estados de anestesia 3. Otros estudios plantean que la base de la pérdida de la conciencia se encuentra en la reducción de la conectividad entre las regiones occipitales y frontales, con un acentuado traslado de las potencias hacia la zona frontal durante la sedación hipnótica 4,5, en consecuencia, resultaría conveniente estudiar el comportamiento de esta área cerebral en el reconocimiento de estados de sedación.
Varias técnicas de procesamiento han sido aplicadas a las señales del EEG para cuantificar el efecto de los fármacos anestésicos, entre ellas destacan: el análisis del dominio de frecuencias de la señal (QEEG: Quantitative Electroencephalography), el análisis Biespectral, Temporal, la Entropía de Estado y de Respuesta entre otros, a partir de los cuales para efectuar el reconocimiento automático de los estados de sedación se han aplicado varias técnicas de Aprendizaje Automático (Machine Learning), siendo más citadas: las Máquinas de Soporte Vectorial (SVM: Support Vector Machine) 6-8 y los Sistemas Neuro-Difusos (ANFIS: Adaptive Network Based Fuzzy Inference System) 9-11.
De la sistematización realizada, con el propósito de implementar una metodología que permita detectar automáticamente estados de sedación anestésica, el Centro de Estudios de Neurociencias, Procesamiento de Imágenes y Señales (CENPIS) ubicado en la Universidad de Oriente y el Hospital General “Juan Bruno Zayas Alfonso” ambos en Santiago de Cuba, Cuba, desarrollan un prototipo de monitor de anestesia que permita realizar el reconocimiento automático de estados de sedación, aplicando técnicas de Inteligencia Artificial a señales registradas por el canal electroencefalográfico F4, derivación frontal no usada en los monitores que se comercializan en la actualidad. Se calcularon nueve parámetros de QEEG, y se cuantificó la profundidad anestésica en una escala de tres estados de sedación: Profundo, Moderado y Ligero.
Material y métodos
Selección del canal electroencefalográfico
Algunos estudios demuestran que la pérdida de la conciencia radica en la reducción de la conectividad entre las regiones cerebrales: occipitales y frontales, reportándose que el índice de bicoherencia del espectro entre ellas es marcadamente distinto durante la sedación hipnótica, con un incremento en la actividad de la banda de frecuencia beta en la zona frontal que se extiende a la occipital con el aumento de la sedación 12. También se reporta un marcado traslado de las bandas delta y alpha hacia la zona frontal (13, 14). Se ha evidenciado además, que determinadas localizaciones de la región frontal brindan beneficios respecto a la sensibilidad a los fármacos anestésicos y la resistencia a interferencias que pueden aparecer en estas señales 15. Particularmente los registros de la derivación F4 resultan sensibles a la influencia de agentes anestésicos, fundamentalmente en el proceso de inducción y en los cambios bruscos de estados de sedación 16, por lo que en la investigación se utilizó esta derivación. Se realizó además, una revisión a los registros electroencefalográficos de este electrodo en la muestra de estudio, corroborando que las señales eran poco propensas a la interferencia de equipos de monitoreo cardiovascular, electrocoagulación, así como los cambios de posición corporal que implica la técnica quirúrgica.
Descripción de la muestra de estudio
Se utilizaron los registros de 27 pacientes (hombres y mujeres entre 18 y 72 años), sometidos a cirugía abdominal electiva de tipo video endoscópica en la Unidad Quirúrgica del Hospital General Juan Bruno Zayas Alfonso. La participación en el estudio se realizó con consentimiento informado escrito y se excluyeron a pacientes con antecedentes de epilepsia, enfermedades cerebro-vasculares y otras enfermedades neurológicas. El registro de las señales se realizó con el equipo Medicid Fénix, usando un montaje de 19 electrodos según el Sistema Internacional 10 - 20. Se utilizó la referencia en ambos mastoides y un electrodo a tierra en la derivación frontopolar media. Se usaron electrodos de superficie de plata clorurada de 3 mm de diámetro con pasta conductora de Electroencefalograma Nihon Koden. La impedancia de los electrodos fue inferior a 5 kOhm y la señal se filtró con un ancho de banda entre 0.5 y 50 Hz. La frecuencia de muestreo fue de 200 Hz. En las cirugías se aplicaron diferentes esquemas de inducción anestésica utilizando los siguientes fármacos vía endovenosa e inhalatoria: Isoflurane, Óxido Nitroso, Midazolan, Fentanil, Propofol, Halotane, Atropina, Diprivan, Pentanol, Nalozol, Vecurorio y Beraminia. En todos los casos se asociaron relajantes musculares (Succinil Colina o Atracurio).
La medición de la profundidad anestésica se realizó evaluando variables clínicas, parámetros hemodinámicos y cardiovasculares. Se utilizó una escala de ocho Niveles de Profundidad Anestésica que variaron desde el nivel 80 que representa la sedación ligera con respuesta a comandos verbales, hasta el nivel 10 que identifica el estado hipnótico muy profundo. Esta escala se agrupó en tres estados, como se puede ver en la Tabla 1: Sedación Ligera, Sedación Moderada y Sedación Profunda.
Tabla 1. Definición de los estados de sedación anestésica usados en la investigación.
| Escala | Significación clínica | Estados de Sedación |
| 80 | Sedación ligera, con respuesta a comandos verbales | Sedación Ligera |
| 70 | Sedación con movimientos, después de estímulos de dolor ligeros | |
| 60 | Sedación con movimientos, después de estímulos de dolor intensos | Sedación Moderada |
| 50 | Estado hipnótico ligero | |
| 40 | Estado hipnótico moderado | |
| 30 | Estado hipnótico profundo | |
| 20 | Estado hipnótico profundo | |
| 10 | Estado hipnótico muy profundo | Sedación Profunda |
Metodología
La metodología desarrollada para llevar a cabo el monitoreo automático de los estados de sedación en las señales electroencefalográficas registradas por la derivación frontal F4, fue la siguiente: inicialmente las señales se sometieron a una etapa de pre-procesamiento, luego se realizó el cálculo de los parámetros de QEEG a utilizar en el reconocimiento, y posteriormente se implementaron técnicas de Inteligencia Artificial para realizar la detección de los estados de sedación en las señales. A continuación se realiza una breve descripción de estas etapas.
A pesar de que los equipos de registro del EEG incluyen hardware para el filtrado de las señales, éstas debido a su bajo potencial eléctrico son propensas a ser afectadas por artefactos (interferencias) fisiológicos y electromagnéticos que modifican el trazado de la señal. En la muestra de estudio los artefactos fisiológicos detectados fueron los producidos por movimientos oculares, los cuales provocan la detección de trascendentes no estacionarias que son difíciles de distinguir de eventos epileptiformes 17; y artefactos cardiacos resultantes del complejo QRS (picos R), onda del Electrocardiograma que puede aparecer en el EEG como picos agudos con frecuencia intermitente y se transmite por el cuello 17. La etapa de pre-procesamiento consistió en la eliminación de estos artefactos mediante la reconstrucción parcial de la señal, con la aplicación de un procedimiento de corrección basado en la Descomposición en Modos Empíricos del EEG 17. Una vez culminado este proceso, se eliminaron otros artefactos teniendo en cuenta indicadores como el gradiente y la varianza. Posteriormente se calcularon nueve parámetros del QEEG, para los cuales se demostró en previos estudios su pertinencia en la cuantificación de estados anestésicos, estos parámetros fueron: Poder Absoluto en las bandas delta y theta, Poder Relativo en las bandas theta y beta, Frecuencia Media Total, Frecuencia Media en las bandas theta y alpha 15, Beta-ratio y Theta-Beta2 16. Finalmente se implementaron técnicas computacionales de Inteligencia Artificial, que permitieron realizar el reconocimiento automático (o clasificación) de los estados de sedación en las señales electroencefalográficas a partir de los algoritmos de Aprendizaje Automático: SVM y ANFIS por ser los métodos más referenciados en este tipo de problemática.
Máquinas de Soporte Vectorial y ANFIS
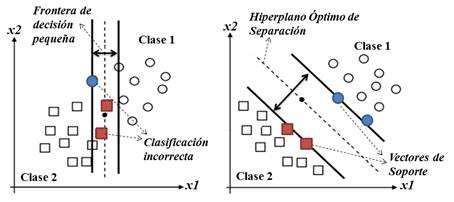
El objetivo principal de las SVM consiste en determinar (“aprender”) la frontera de decisión de dos clases distintas a partir de la descripción dada por unos datos conocidos como Vectores de Soporte: información que define el margen o frontera de decisión, como se puede ver en la Figura 1. En Inteligencia Artificial, el término clase simboliza un conjunto de datos con cierto parecido entre ellos, o sea, cada estado de sedación con sus correspondientes segmentos de señales electroencefalográficas es una clase. Aplicando la teoría matemática de Modelos de Optimización, las SVM proponen un Hiperplano Óptimo que brinde estadísticamente la mayor separación entre dos clases. Estas Máquinas de Aprendizaje minimizan el conflicto de clasificaciones erróneas en el proceso de prueba, maximizando este hiperplano de separación 16. Luego, dado un nuevo segmento de EEG, el algoritmo será capaz de reconocer a qué clase o estado de sedación pertenece, evaluando la función del hiperplano correspondiente.
ANFIS constituye una propuesta de Sistema Neuro-Difuso basado en un sistema borroso (fuzzy) de tipo Sugeno de primer u orden cero. Este algoritmo emplea una mezcla de retropropagación para aprender los parámetros antecedentes y la estimación de mínimos cuadrados para determinar los parámetros consecuentes. El procedimiento de aprendizaje consta de dos partes: primero, los patrones o datos de entrada se propagan, y los parámetros consecuentes óptimos se estiman por un procedimiento iterativo de Mínimos Cuadrados, mientras se asume que los parámetros antecedentes son fijados por el ciclo actual a través del conjunto de datos usados en el aprendizaje. En la segunda parte los patrones se propagan una vez más y la retropropagación se usa para modificar los parámetros antecedentes, mientras que los parámetros consecuentes permanecen fijos 17.
Resultados
Inicialmente el reconocimiento automático de los estados de sedación se realizó con ANFIS, en la Tabla 2 se presentan los mejores resultados del experimento obtenidos con la función de transferencia: Diferencia Sigmoidal. Los resultados fueron evaluados usando las métricas de rendimiento: Exactitud, Razón de Verdaderos Positivos, Razón de Falsos Positivos y Especificidad.
Tabla 2. Resultados del reconocimiento automático de los estados de sedación con ANFIS.
| Estados de sedación | Exactitud (%) | TPR (%) | FPR (%) | Especificidad (%) |
|---|---|---|---|---|
| Sedación Ligera | 95.45 | 10.42 | 0.11 | 99.89 |
| Sedación Moderada | 93.04 | 99.16 | 40 | 60 |
| Sedación Profunda | 96.75 | 80 | 1.06 | 98.93 |
TPR: True Positive Rate (Razón de Verdaderos Positivos o Sensibilidad)
FPR: False Positive Rate (Razón de Falsos Positivos)
Al realizar un análisis de los resultados obtenidos con ANFIS se puede advertir que la Exactitud es correcta, sin embargo, los valores de TPR y Especificidad en los estados de Sedación Ligera y Moderada presentan algunas deficiencias. En la Sedación Ligera el reconocimiento de los verdaderos positivos fue completamente desacertado al identificar sólo el 10.42% del total de muestras de ese estado; de manera contraria sucedió con los verdaderos negativos reconociendo el 99.89% de ellos. En el reconocimiento del estado Sedación Moderada los valores de Exactitud y TPR fueron acertados, pero la Especificidad resultó en un 60% provocando un valor elevado de falsos positivos (40%). En el análisis de la Sedación Profunda las métricas de rendimiento obtuvieron valores satisfactorios.
Los resultados de la clasificación de los tres estados de sedación con SVM se muestran en la Tabla 3, éstos se obtuvieron con la Función Kernel Multilayer Perceptron, el método de optimización de Mínimos Cuadrados (Least Squares), y el algoritmo de clasificación multiclase Uno-Contra-Resto (One-Againts-All).
Tabla 3. Resultados del reconocimiento automático de los estados de sedación con SVM.
| Estados de sedación | Exactitud (%) | TPR (%) | FPR (%) | Especificidad (%) |
|---|---|---|---|---|
| Sedación Ligera | 90.24 | 68.13 | 6.02 | 93.98 |
| Sedación Moderada | 90.06 | 98.69 | 36.67 | 63.33 |
| Sedación Profunda | 96.12 | 90.91 | 3.31 | 97.09 |
TPR: True Positive Rate (Razón de Verdaderos Positivos o Sensibilidad)
FPR: False Positive Rate (Razón de Falsos Positivos)
El estado de Sedación Ligera fue reconocido con una Exactitud del 90.24% respecto al total de muestras clasificadas. Se alcanzó un TPR de 0.6813, lo cual representa el 68.13% de muestras pertenecientes a este estado correctamente clasificadas. Es preciso acotar que este resultado está condicionado a la escasa cantidad de muestras que se tenían de Sedación Ligera, debido al poco tiempo de registro antes de comenzar a inducir la anestesia general, de un total de 160 muestras fueron reconocidas correctamente 109. Sólo se clasificaron incorrectamente en Sedación Ligera el 6.02% del total. El reconocimiento de los verdaderos negativos fue correcto obteniendo 93.98% de Especificidad.
En el estado Sedación Moderada se logró una Exactitud de 90.06% y se computó un TPR de 98.69%. Los valores de FPR y Especificidad mejoraron respecto a los resultados obtenidos con ANFIS (ver Tab.2) aunque aún se consideran un poco inadecuados. Este comportamiento puede ser provocado por una dispersión estadística de los datos de la muestra de estudio, debido a la subjetividad con la que se midieron los Niveles de Profundidad Anestésica, condicionados a la experticia de los Anestesiólogos a partir de la evaluación de síntomas y signos clínicos que manifestaban los pacientes.
La Exactitud en el reconocimiento de la Sedación Profunda con SVM fue 96.12% y se obtuvo un TPR de 0.9091, lo cual representa el 90.91% de muestras de este estado identificadas correctamente. Se clasificaron de manera errónea en este estado el 3.31% de las muestras y la Especificidad resultó en un 97.09%. Finalmente, al realizar una comparación visual entre las Tablas 2 y 3, se puede observar que en sentido general los resultados alcanzados con SVM fueron mejores que los obtenidos con ANFIS.
Una métrica muy usada para medir la eficacia de un clasificador es la curva ROC (ROC: Receiver Operating Characteristic), la cual se relaciona con el análisis costo/beneficio en la toma de decisiones diagnósticas. Un indicador de calidad asociado a las curvas ROC es el Área Bajo la Curva (AUC: Area Under the Curve), ésta mide la capacidad del algoritmo para evitar una predicción falsa, teniendo en cuenta los verdaderos positivos y negativos. Los porcientos de AUC calculados con los resultados obtenidos por ANFIS y SVM se muestran en la Tabla 4. Observe que los valores computados para SVM son mejores.
Tabla 4. Evaluación del reconocimiento de estados de sedación con la métrica AUC.
| Estados de sedación | ANFIS | SVM |
|---|---|---|
| Sedación Ligera | 55.16% | 81.06% |
| Sedación Moderada | 79.58% | 81.01% |
| Sedación Profunda | 89.47% | 94% |
Finalmente, para evaluar el desempeño de las SVM independientemente del conjunto de datos usados para realizar el proceso de aprendizaje de los estados de sedación en las señales registradas por el canal F4, se utilizó la técnica Validación Cruzada de k segmentos (k=5), la cual consiste en dividir aleatoriamente los datos en k subconjuntos mutuamente exclusivos de aproximadamente igual tamaño. Cada subconjunto es utilizado en el proceso de validación o prueba y los restantes k-1 son usados en el aprendizaje del algoritmo (SVM). El resultado final se obtiene calculando la media aritmética de los resultados de cada iteración 16. El valor de k se escogió de manera empírica teniendo en cuenta el tamaño de la muestra de estudio. A partir de los datos obtenidos por estos experimentos, se evaluó el reconocimiento con las métricas: TPR, Especificidad y Precisión, ver Tabla 5. Un aspecto positivo a destacar es que los valores de TPR en la Sedación Ligera y Especificidad en la Sedación Moderada aumentaron respecto a los obtenidos en la Tabla 3, esto supone que si se aumenta la representatividad de cada estado de sedación en la muestra de estudio utilizada en la investigación, los resultados del proceso de reconocimiento automático mejoren.
Tabla 5. Evaluación del rendimiento de SVM aplicando Validación Cruzada de k segmentos.
| Estados de sedación | TPR (%) | Especificidad (%) | PPV (%) |
|---|---|---|---|
| Sedación Ligera | 77.04 | 81.63 | 97.39 |
| Sedación Moderada | 81.14 | 90.83 | 76.38 |
| Sedación Profunda | 85.97 | 79.01 | 95.34 |
PPV: Positive Predictive Value (Valor Predictivo Positivo o Precisión)
TPR: True Positive Rate (Razón de Verdaderos Positivos o Sensibilidad)
En la Tabla 6 se establece una comparación entre la monitorización propuesta y el monitor BIS 18 para los estados de inconciencia (Sedación Moderada y Profunda), utilizando las métricas: Sensibilidad, Especificidad, Valor Predictivo Positivo y Negativo. Observe cómo las cuatro fueron superadas, lo cual supone que la propuesta de la investigación pudiese ser efectiva en la prevención del despertar intraoperatorio.
Tabla 6. Comparación entre la monitorización propuesta en la investigación y el monitor BIS.
| Monitor BIS | Propuesta de la investigación | |
| Sensibilidad | 90.6 % | 97.78% |
| Especificidad | 26.3 % | 89.58% |
| PPV | 55.1 % | 87.52% |
| NPV | 73.7 % | 98.18% |
PPV: Positive Predictive Value (Valor Predictivo Positivo o Precisión)
NPV: Negative Predictive Value (Valor Predictivo Negativo)
Discusión
Los tres estados de sedación definidos en la investigación fueron reconocidos automáticamente en las señales registradas por la derivación F4 con más del 90% de Exactitud usando las SVM, lo cual demostró que la señal generada por este canal electroencefalográfico es resistente a la interferencia de artefactos, y además representativo del comportamiento de fármacos anestésicos en la actividad cerebral, por lo que puede servir para monitorear diferentes estados de sedación independientemente del tipo de fármaco que se utilice, lo cual constituye un aporte relevante si se tiene en cuenta que los monitores de profundidad anestésica que existen en la actualidad, utilizan para el análisis del estado hipnótico de tres a cuatro canales electroencefalográficos sólo de localización frontopolar. Además, la correcta clasificación de los estados de sedación con los nueve parámetros seleccionados del QEEG, corroboró los resultados de Montoya y Tan 13,14, quienes proponen el uso de estos parámetros en la cuantificación de la profundidad anestésica, así como la relación que existe entre ellos fundamentalmente en la derivación F4.
Los resultados obtenidos permitieron establecer una comparación con el monitor BIS. Éste utiliza cuatro canales frontopolares al igual que el resto de los monitores que se comercializan, sin embargo, en esta distribución los sensores detectan las señales eléctricas generadas por procesos fisiológicos como la onda R del electrocardiograma que se transmite por el cuello, la actividad electromiográfica del cuero cabelludo, así como la actividad electrooculográfica 19. La derivación F4 en cambio, por la ubicación que ocupa en el área cerebral es más resistente a los artefactos, fundamentalmente a los generados por la actividad electromiográfica y electrooculográfica 13 además de su probada sensibilidad a la administración de fármacos anestésicos, así como en la captura de los cambios del estado de profundidad anestésica del paciente 13,14.
En los últimos años se ha reportado que el monitor BIS reduce la incidencia del despertar intraoperatorio entre el 77 y el 82% de los casos 20, los resultados alcanzados en esta investigación suponen que se pueda detectar con mayor efectividad el despertar intraoperatorio en pos de minimizar los efectos adversos que provoca.