Introducción
El Cuaderno de Recogida de Datos (CRD), o Case Report Form (CRF) es el “documento impreso, óptico o automatizado, diseñado para recoger y transmitir al promotor toda la información requerida en el protocolo de cada sujeto del ensayo clínico” 1. Como su definición lo indica, los CRD pueden diseñarse en formato impreso o en formato digital. En el formato impreso, luego de generado el CRD se requiere diseñarlo en un software para capturar los datos registrados en él. En el CRD en formato digital, el diseño se realiza de forma directa en el software y es el más utilizado en la actualidad por su eficiencia y seguridad, la optimización de los tiempos y el menor índice de fallos ya que permite detectar datos introducidos incorrectamente, adelantando la detección del error lo máximo posible en el tiempo y evitando así los largos procesos posteriores de localización y corrección de errores 2.
En cualquiera de sus variantes, diseñar un CRD es un proceso complejo y cada ensayo clínico requiere de un diseño específico. Sin embargo, existen diferentes datos que se utilizan en todos los ensayos con independencia del área terapéutica donde se realice o la fase de desarrollo en que se encuentre. En este sentido se han diseñado estándares básicos para su recopilación, los cuales se recogen en el documento “Clinical Data Acquisition Standards Harmonization”. Este documento constituye una guía para las organizaciones que manejan los datos de los ensayos clínicos y su utilización se recomienda por algunas agencias reguladoras 3.
En el año 2002 el Clinical Data Interchange Standards Consortium (CDISC) creó un repositorio web de CRD que permitió a sus miembros publicar y utilizar los formularios de CRF allí publicados 4. Esta acción tenía la misión de aumentar y facilitar el flujo de trabajo en los ensayos clínicos, específicamente al proporcionar y administrar un sitio web interactivo y al desarrollo de estándares adicionales que beneficiaran la industria farmacéutica 5. Además, en la actualidad existen bibliotecas de CRF como son la de OpenClinica 6 y la de la Universidad Médica de Carolina del Sur 7.
El departamento de Manejo y Procesamiento de Datos del Centro Nacional Coordinador de Ensayos Clínicos (CENCEC) de Cuba utiliza Openclinica en su versión Community desde 2015 para el diseño de los CRD. Este software es de código abierto, líder en el mundo para el desarrollo electrónico de CRD y utiliza ficheros Excel con determinada estructura, a los que denomina CRF por su nombre en inglés 8), (9 para la creación de los CRD.
Al intentar utilizar las bibliotecas de CRD en los datos de los ensayos clínicos manejados por el CENCEC se presentaban tres limitantes. Primero, en algunos casos los CRD solo podían utilizarse por las instituciones que los habían desarrollado; segundo, los de uso libre como la biblioteca de Openclinica se encuentra en idioma inglés y los ensayos clínicos cubanos y su documentación se maneja en español; y tercero, las bibliotecas no contienen todas las variables utilizadas en los ensayos clínicos realizados en el país. Estas limitantes unido a los desafíos actuales como realizar el manejo de datos de varios ensayos en curso o que el personal del centro se traslade a otras instituciones, llevándose así el conocimiento, afecta directamente el ensayo clínico en su ejecución pues requeriría el entrenamiento de un nuevo personal. Es por ello que el departamento de Manejo y Procesamiento de Datos del CENCEC se propuso desarrollar una biblioteca de plantillas en OpenClinica para el diseño del CRD de los ensayos clínicos a los cuales realiza el manejo de los datos.
Métodos
Se elaboró un equipo de trabajo formado por los Responsables de Manejo de Datos (RMD) del CENCEC, quienes tienen a su cargo el desarrollo de los manejos de datos de los ensayos clínicos. El equipo estudió el documento “Clinical Data Acquisition Standards Harmonization” (CDASH) 10. Además, se realizó la revisión de los CRD de cuatro ensayos clínicos diseñados en OpenClinica realizados en el CENCEC. El análisis del documento CDASH permitió decidir los CRD a elaborar como plantillas, las variables a incluir utilizadas comúnmente, además de obtener la estructura más adecuada para elaborar el CRD, como son el nombre y la definición de las variables, el texto que debe aparecer en la pregunta, el tipo de dato y la clasificación de la recopilación del dato en: altamente recomendable, recomendable u opcional, entre otras características. La revisión del diseño de los ensayos permitió seleccionar las estructuras más utilizadas, así como las instrucciones de validación aplicadas en cada caso de manera que se complementara con los estándares.
Se realizaron reuniones de trabajo en las cuales se discutieron los documentos analizados, se seleccionaron las preguntas a incluir y se presentaron los avances en cada plantilla. Una vez finalizado el diseño de las plantillas, se revisaron y corrigieron los errores detectados, posterior a lo cual se realizó una revisión final y se liberaron las plantillas que conformaron la biblioteca. Las plantillas se elaboraron utilizando Microsoft Excel de la suite ofimática Microsoft Office por ser el formato en que OpenClinica lee los CRD. Para ello se tomó la plantilla en blanco que tiene Openclinica y sobre ella se crearon las plantillas.
Resultados
Se elaboraron 14 plantillas. Cada plantilla elaborada es un fichero en formato Excel que contiene cinco hojas de trabajo. Las hojas “CRF”, “Sections”, “Groups” e “Items” contienen las diferentes características del CRD. La hoja “Instructions” proporciona instrucciones sobre cada uno de los diferentes elementos de la plantilla.
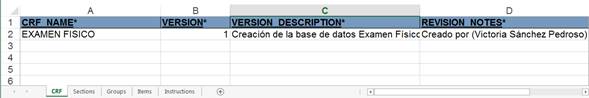
En la hoja de trabajo “CRF” (Fig. 1), se reflejó el nombre del CRD, su número de versión, una descripción de para qué se creó esa versión y notas de revisión.
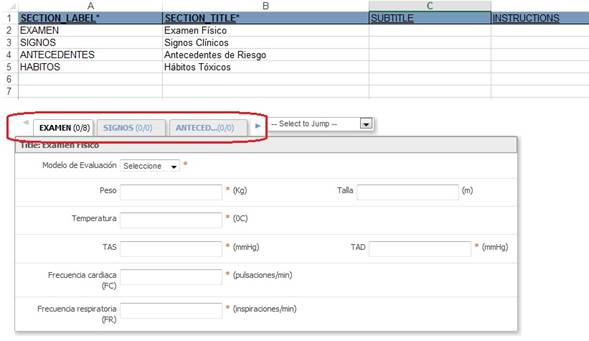
En la hoja de trabajo “Sections” (Fig. 2) se describieron las secciones a utilizar dentro del CRD. Es un mecanismo de diseño, para organizar los elementos dentro del cuaderno. Todos los elementos en una sección aparecen en la misma página del CRD. Cada sección se mostrará como una pestaña dentro del CRD. Contiene variables como título de la sección, subtítulo e instrucciones.
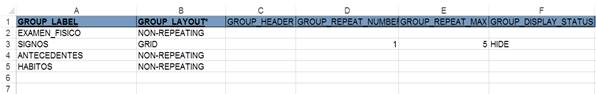
En la hoja de trabajo “Groups” (Fig. 3) se describieron los grupos a los cuales se asociarán las preguntas o ítem del CRD. Es un mecanismo para asociar lógicamente elementos dentro de un CRD. Los elementos dentro del mismo grupo pueden repetirse. Al grupo puede agregarse un encabezado, mostrar determinado número inicial de un elemento o la cantidad máxima que se puede repetir. También puede ocultarse en el CRD.
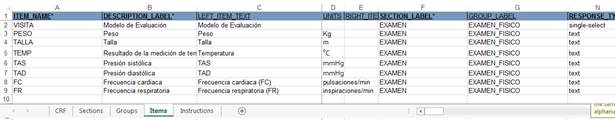
En la hoja de trabajo “Items” (Fig. 4) se describieron todas las preguntas del cuaderno. En esta hoja se utilizaron los elementos definidos en las hojas anteriores. Para cada pregunta se definió a qué Sections y Groups pertenece, su nombre, método de entrada, tipo de dato, valores a almacenar, si es obligatoria, condiciones a cumplir o si es oculta, entre otras características.
La hoja de trabajo “Instructions” contiene información adicional sobre todas las hojas anteriores. En ella se pueden encontrar consejos y buenas prácticas para ayudar a diseñar mejor el CRD. Esta hoja fue igual para todas las plantillas.
La Tabla 1 muestra las plantillas elaboradas que conforman la biblioteca a utilizar en el manejo de los datos de los nuevos ensayos clínicos. La primera columna contiene el nombre del fichero creado y la segunda columna describe la información que contiene.
Tabla 1 - Listado de plantillas elaboradas en OpenClinica.
| Nombre del fichero | Contenido |
|---|---|
| DM | Datos Demográficos |
| EF | Examen Físico |
| HM | Historial Médico |
| TC | Tratamiento Concomitante |
| DA | Responsabilidad de Medicamentos |
| DS | Disposición |
| ECG | Resultados de la prueba de ECG |
| EX | Exposición |
| LAB | Laboratorio |
| IE | Inclusión |
| DV | Desviación de protocolo |
| EA | Eventos Adversos |
| VS | Signos Vitales |
| US | Uso de Sustancias |
Discusión
La biblioteca de plantillas comenzó a utilizarse en noviembre de 2019. Se ha usado en el diseño de los CRD de tres ensayos clínicos, lo que ha contribuido a la estandarización de la recolección de los datos. En estos ensayos ha permitido:
Un inicio más rápido del manejo de los datos al proporcionar un acceso rápido a una base de datos mejor organizada.
Promover la estandarización de datos mediante la reutilización de CRD que se adhieren a los estándares abiertos de la industria.
Minimizar el tiempo de la creación del CRD y la validación para su uso en el estudio.
La creación de la biblioteca presenta una oportunidad para preservar el conocimiento histórico encerrado en los CRD. Su utilización ha permitido compartir el conocimiento entre todos los especialistas que laboran en el diseño de los CRD y beneficia al proceso de manejo de los datos de futuros ensayos clínicos.
La experiencia reciente con la biblioteca electrónica de CRF ofrece aliento y beneficios directos para los Responsables de Manejo de Datos (RMD). El esfuerzo es potencialmente sostenible debido a que los recursos son relativamente mínimos para continuar poblando la biblioteca y en un futuro no muy lejano contar con un número mucho más amplio de formularios que permitan manejar todos los ensayos clínicos. Para ello es necesario crear un programa de solicitud que incluya nuevas variables a incorporar a medida que se cierren los estudios.
La biblioteca de CRD proporciona capacidad de gestión del conocimiento para las instituciones y ayuda a impulsar la calidad y la eficiencia de la investigación clínica con el sistema de captura de datos electrónicos de código abierto OpenClinica.
Conclusiones
Para nuestro centro el uso de las plantillas CRF justifica el esfuerzo asociado de preservar y compartir la información sobre los datos recopilados en ensayos anteriores. La biblioteca ha demostrado ser útil para los RMD, en los cuales ha tenido una gran aceptación, pues permite ahorrar tiempo, logrando que se realicen un mayor número de manejos de datos en los ensayos clínicos, además de minimizar el número de errores en la creación del nuevo CRF; constituye un paso pequeño pero necesario hacia el desarrollo de un sistema maduro que incremente la calidad de los manejos de datos que se realicen por el CENCEC.