Introducción
La aplicación de las herramientas y tecnologías informáticas en la salud constituye un claro ejemplo de la importancia e impacto de las Tecnologías de la Información y las Comunicaciones (TIC) en la sociedad desde hace décadas. Esto ha permitido al sector de la salud, contar con métodos novedosos, sencillos y eficaces de gestión administrativa en consultas, hospitales y centros de investigación biomédica 1.
Cada vez son más reconocidos los centros de investigaciones científicas que tienen como objetivo la fabricación de medicamentos para el tratamiento de enfermedades recientes, crónicas e incurables, situados principalmente en países con un alto nivel de desarrollo. Para lograr la creación de cada uno de estos fármacos se realizan los ensayos clínicos (EC) o estudios clínicos como también se les conoce.
Un ensayo clínico es una evaluación experimental, planificada, realizada en humanos, de un producto, sustancia, medicamento, técnica diagnóstica o terapéutica que pretende valorar su eficacia y seguridad. Los ensayos clínicos controlados y aleatorizados son las investigaciones clínicas que más alta evidencia científica generan 2. Los EC han ido evolucionando para responder a una creciente globalización y complejidad de los estudios, así como al impacto de las novedosas tecnológicas biomédicas, las TIC y los nuevos lineamientos de la industria 3. El foco de atención está en desarrollar niveles de eficiencia y procesos de gestión de riesgos más sólidos que puedan optimizar la seguridad del paciente y la calidad de los datos en forma continua 4.
En la medida en que se avanza en el desarrollo de la tecnología, se avanza en la gestión de datos de los EC, esto trae aparejado el incremento del número de pacientes a estudiar y por consiguiente el número de hospitales que se incorporan en el reclutamiento de pacientes. La gestión de la información 5, conjunto de procesos por los cuales se controla el ciclo de vida de la información desde su obtención, por creación o captura, hasta su disposición final, archivada o eliminada, ha evolucionado considerablemente. Las compañías farmacéuticas y biotecnológicas, para lograr una gestión eficiente de los ensayos clínicos, requieren del uso de un sistema de gestión de ensayos clínicos (CTMS, por las siglas en inglés) confiable, que apoye a los científicos en el monitoreo de los datos de ensayos clínicos y a la investigación en cuanto a los efectos adversos a partir de datos clínicos.
La industria de la biotecnología cubana, donde juega un papel fundamental BioCubaFarma (BCF), realiza nuevos proyectos, desarrollo de medicamentos y ensayos clínicos en busca de productos de alta calidad que contribuyan al tratamiento de diversas enfermedades. Los centros de investigación que componen BCF, ejecutan más de un centenar de proyectos de investigación en el campo de la biomedicina, de los cuales un número significativo son innovadores con patente cubana. Varios de estos proyectos ya se encuentran en fases iniciales de ensayos clínicos en áreas terapéuticas asociadas a las principales causas de mortalidad en Cuba y la cuarta parte de dichos trabajos pueden convertirse en únicos de su clase. 6
El Centro de Inmunología Molecular (CIM), concebido como una institución biotecnológica se dedica a la investigación básica, desarrollo y fabricación de productos a partir del cultivo de células de mamíferos, productos que son desarrollados contra el cáncer y otras enfermedades crónicas no trasmisibles. Para valorar la calidad y seguridad de estos nuevos productos en los seres humanos, el centro realiza ensayos clínicos en hospitales altamente especializados.
Como medio de apoyo a la gestión de ensayos, la institución utiliza desde el 2012 el Sistema de Gestión de Ensayos Clínicos XAVIA Clínicas, desarrollado por estudiantes y trabajadores del Centro de Informática Médica (CESIM) de la Universidad de las Ciencias Informáticas (UCI) 7-10. El sistema, desarrollado a partir de la versión open source del sistema OpenClinicas 11, posee varios inconvenientes identificados a partir de la experiencia de los especialistas del CIM y de los profesionales de la salud que participaron como investigadores.
Dentro de esas limitantes se pueden mencionar:
La gestión de varios grupos de sujetos de un mismo estudio, solo es posible mediante la creación de diferentes estudios. El sistema solo gestiona un cronograma por estudio y por ende un solo grupo de sujetos.
Una vez que el diseño del estudio es aprobado por el investigador promotor y se inicia la conducción de los ensayos, no es posible agregar nuevas reglas o modificar las existentes.
La gestión de las instituciones promotoras y los centros de investigación, así como los usuarios por cada centro, requerían un alto dominio por parte de los administradores.
Por otra parte, la aplicación del sistema XAVIA Clínicas en el CIM y su empleo desde las instituciones de salud del país, ha sido relevante como proyecto de transformación digital en la industria biotecnológica y sistema de salud cubano, como consecuencia han surgido necesidades orientadas a mejorar el proceso de manejo de datos de los ensayos clínicos y los resultados de los mismos. Por estas razones, CESIM y el CIM acordaron el desarrollo de una nueva versión de un Cuaderno Electrónico de Recogidas de Datos (eCRD).
El objetivo del presente trabajo es presentar el Sistema para el manejo de datos de Ensayos Clínicos XAVIA SIDEC y su generalización en las instituciones de BioCubaFarma.
Materiales y método
El análisis de la bibliografía disponible referente al manejo de datos de los ensayos clínicos y los cuadernos de recogida de datos electrónicos, así como las normas y buenas prácticas clínicas 12,13 y las normas reguladoras que estos deben cumplir, permitieron establecer las bases necesarias para lograr el diseño y posterior desarrollo de la aplicación. En este sentido, los EC poseen dos características que los distinguen como investigaciones clínicas: planificación y monitorización.
El EC es una investigación en la que antes del inicio todo está planificado en el protocolo. El periodo de reclutamiento, los criterios de inclusión, los criterios de exclusión, los criterios de retirada, la hipótesis, las variables y los mecanismos de control de éstas, para así evitar los sesgos y las variables de confusión, todo está previamente definido y planificado.
Además, el EC debe monitorizarse. Es una característica primordial y que lo aleja de las investigaciones clínicas con menos evidencia científica. El monitor, es una persona propuesta por el promotor, que no puede pertenecer al equipo investigador, y que estará en contacto con los equipos investigadores de cada centro que participe, en caso de ser multicéntrico, y su labor es que se cumpla el protocolo y se recojan de manera homogénea los datos necesarios para el ensayo. Esta característica es muy importante, pero solo cuando los ensayos son multicéntricos.
A partir de la identificación de los flujos de trabajo relacionados con el diseño y conducción de los ensayos clínicos y las limitantes existentes con el empleo del sistema XAVIA Clínicas para cubrir todas las actividades de dichos flujos, se arribó a conclusiones que permitieron especificar las principales funcionalidades de la nueva versión del sistema, haciendo énfasis en las diferencias con la primera versión. En este sentido, la experiencia alcanzada por los proveedores de requerimientos tuvo un factor determinante.
Durante el análisis de los referentes teóricos del manejo electrónico de datos y los sistemas homólogos con más influencia en el mercado, se conoció que entre los primeros sistemas de captura electrónica de datos aplicado a la investigación clínica, estuvo un estudio de histocompatibilidad en trasplantes de riñón que fue promovido por el National Health Institute de Estados Unidos de América en 1973 14.
Según Capterra 15 servicio gratuito de ayuda a las empresas en la búsqueda de los software que más se adecuan a sus necesidades, existen más de 120 aplicaciones informáticas en la categoría CTMS. Algunos de los sistemas mejor posicionados en el mercado y que fueron evaluados 16 son: Castor's EDC 17, Clinical Trials Platform 18, Dacima Clinical Suite 19, Medrio 20 y OpenClinicas. Este último, OpenClinicas, es el CTMS más conocido en Cuba y ampliamente empleado en los centros de investigación, aunque limitado en sus funcionalidades ya que se emplea la versión libre y gratis (free y open source).
La evaluación de los sistemas mencionados y la correspondencia de estas con las regulaciones cubanas, las entrevistas realizadas a los especialistas del CIM, investigadores y otros usuarios del sistema XAVIA Clínicas, y la experiencia adquirida por el equipo de desarrolladores del sistema durante la prestación del servicio de soporte técnico, permitió generalizar las funcionalidades deseadas en el sistema XAVIA SIDEC:
Entrada de datos: debe suministrar formularios para la entrada de datos por parte de los investigadores. Estos formularios han de proporcionar la posibilidad de introducir datos de diversos tipos: textos, valores numéricos, listas, fechas, etc.
Validación de datos: debe permitir definir reglas de validación de los datos introducidos por el investigador, de tal forma que se compruebe su validez en el mismo momento de introducirlo. Implementación que garantiza la calidad de los datos recogidos.
Gestión de inconsistencias de datos o queries: normalmente las reglas descritas en el punto anterior no son suficientes para prevenir la introducción de datos incorrectos. El eCRD deberá proporcionar soluciones informáticas que permitan anotar estas inconsistencias, para que el investigador las corrija o justifique, según proceda, hasta que queden resultas.
Exportación de datos: se centra en la recogida de datos; no es una herramienta de análisis estadístico como lo puedan ser SPSS, SAS, R, etc. Sin embargo, es imprescindible que un eCRD proporcione la posibilidad de exportación completa y exhaustiva de los datos recogidos en formatos utilizables por herramientas de análisis.
Seguridad y roles: el eCRD maneja datos muy sensibles y tienen que cumplir la legislación vigente en el país. Por ejemplo, en España debe cumplir los requisitos impuestos por la Ley Orgánica de Protección de Datos para el manejo de datos de nivel 3; en EE.UU. el eCRD que se utilice para ensayos clínicos deberá cumplir la normativa de la FDA, 21 CFR Parte 11. Con el fin de garantizar la privacidad exigida, el eCRD proporciona medios para el control de acceso a los datos mediante nombre de usuario y contraseña o firma digital. El eCRD normalmente también implementa funcionalidades para cifrar el transporte y almacenaje de la información. Además, debe proporcionar roles de usuario para controlar el tipo de uso y acceso a los datos de cada usuario.
Trazabilidad: debe proporcionar trazas (logs) que registren todas las acciones y manipulaciones de los datos que se realicen con el sistema, registrando también quién las realiza y en qué momento lo hace. Este log o Audit trail como se le conoce, debe ofrecer trazabilidad total de los datos recogidos por el eCRD.
Metodología, tecnologías y herramientas para el desarrollo
Al no existir una metodología de software universal, toda metodología de desarrollo debe ser adaptada a las características de cada proyecto (equipo de desarrollo, recursos, etc.) exigiéndose así que el proceso sea configurable. Por ello se utilizó como metodología de desarrollo la variación del Proceso Unificado Ágil (AUP) para la UCI. La metodología de desarrollo AUP-UCI 21 tiene como objetivo aumentar la calidad del software que se produce, para ello se apoya en CMMI-DEV v1.3.
La metodología AUP-UCI propone para el ciclo de vida de los proyectos las fases: Inicio, Ejecución y Cierre. De igual manera propone 7 disciplinas: Modelado de negocio, Requisitos, Análisis y diseño, Implementación, Pruebas internas, Pruebas de liberación y Pruebas de aceptación. Además, esta metodología propone 4 escenarios posibles en los proyectos de desarrollo de software. En el desarrollo del sistema XAVIA SIDEC, se decidió emplear el escenario 2, que determina que los proyectos que modelan el negocio con modelo conceptual solo pueden modelar el sistema con casos de uso del sistema.
Para determinar las tecnologías y herramientas se realizó un análisis de los factores técnicos y ambientales 22. Entre los criterios técnicos considerados, fue determinante la necesidad de reutilizar el código fuente ya implementado (la seguridad física y lógica, permisos por roles y usuarios, la trazabilidad, entre otros) en el sistema XAVIA HIS, con el objetivo de minimizar el tiempo de desarrollo, reutilizar conceptos útiles como la multi-entidad, y asegurar la integración e interoperabilidad entre estos sistemas.
Para el desarrollo del sistema se utilizó la Plataforma Java Enterprise Edition 5.0 utilizando JBoss Server 4.2.2 como servidor de aplicaciones, SEAM 2.1.1, potente plataforma de desarrollo de código abierto para construir aplicaciones web utilizando Java como lenguaje de programación. Además, Java Server Faces (JSF) 1.2 que es un framework que define un modelo de componentes de interfaz de usuario y de eventos, RichFaces 3.3.1 como librería de componentes web enriquecidos, de código abierto y basada en el estándar JSF que provee facilidades de validación y conversión de los datos proporcionados por el usuario y administración avanzada de recursos como imágenes, código Javascript y CSS. El sistema está basado sobre el patrón arquitectónico Modelo-Vista-Controlador.
Se utilizó PostgreSQL 10 como sistema gestor de base de datos, e Hibernate 3.3 permitió el mapeo entre la filosofía orientada a objetos de las aplicaciones y las bases de datos de tipo entidad-relación. Se utilizó como entorno integrado de desarrollo Eclipse 3.4.2, una potente herramienta de desarrollo integrado de código abierto, portable y multiplataforma, y como herramienta de modelado Visual Paradigm, la cual proporciona un potente modelado mediante el Lenguaje Unificado de Modelado (UML).
Resultados
Solución informática desarrollada
El Sistema para el manejo de datos de Ensayos Clínicos XAVIA SIDEC v3.0 23 agiliza el diseño y conducción de los ensayos clínicos a través del eCRD. Permite configurar acciones en las reglas de validación de los CRD contribuyendo a minimizar errores en la recogida de datos. Hace posible la obtención de reportes estadísticos como soporte a la toma de decisiones. Incorpora estándares internacionales y de buenas prácticas clínicas. Facilita la integración con la Historia Clínica Electrónica (HCE) del sistema XAVIA HIS. Cuenta con cinco módulos: Configuración, Diseño, Conducción, Extracción y Estadísticas.
Configuración: Este es un módulo reutilizado de la línea base del sistema XAVIA HIS. Entre otros elementos permite la administración del sistema, posibilitando configurar las funcionalidades de cada uno de los módulos. Garantiza la seguridad de acceso al sistema, posibilitando a su vez la administración de usuarios y roles. Gestiona el diseño multi-entidad de la aplicación, los datos generales de cada institución y visionar la bitácora del sistema.
Para incorporar un grupo de funcionalidades deseadas del sistema XAVIA Clínicas, se desarrolló un submódulo Configuración-SIDEC, que permite además la gestión de permisos, por usuarios por entidades, para acceder a los estudios del sistema, rangos de direcciones IP desde los que accederán en los sitios clínicos, así como seleccionar el estudio en el cual el usuario trabajará.
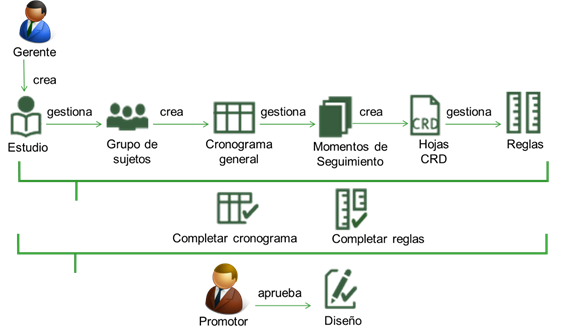
Diseño 24,25: Permite realizar el diseño del ensayo clínico a través de la gestión de los estudios y centros donde se realizan los ensayos, gestión de hojas CRD, gestión de grupos de sujetos, cronograma general, etapas y momentos de seguimiento del estudio. Permite además definir reglas para la validación de los campos de las hojas CRD. La figura 1 representa el flujo de trabajo del módulo Diseño.
Primeramente, el investigador promotor diseña el estudio, teniendo en cuenta la Guía para la Elaboración del protocolo de ensayo clínico, que contiene los datos generales del ensayo. Una vez realizado esto, el gerente de datos puede crear el estudio, así como gestionar los grupos de sujetos que participarán en el ensayo. El gerente de datos crea además el cronograma general de ejecución del estudio para cada grupo de sujetos. Luego puede gestionar los Momentos de Seguimiento (MS) para cada una de las etapas del cronograma (evaluación, tratamiento o seguimiento) y crear las hojas CRD asociadas a estos MS.
Un MS es un tipo de seguimiento (programado o no programado) que sucede durante la realización del estudio, en el cual se realizan exámenes a los sujetos. En la creación de un MS programado se planifican los momentos por visita (día de visita, que el paciente debe asistir a la consulta) o por período (cada varios días durante un período de tiempo en semanas, meses o años). En el caso de los MS no programados, se planifican una vez cuando existan los síntomas o cada vez que haya síntomas. En ambos casos, se procede a seleccionar hojas CRD para los momentos.
Las hojas CRD recogen toda la información clínica de los sujetos del ensayo y son creadas directamente en la aplicación o cargadas al sistema como un documento Excel que cumpla con el formato requerido. Posteriormente debe gestionar las reglas de validación y derivación para las variables de las hojas CRD para las visitas definidas en el cronograma de ejecución. Una vez aprobado el cronograma y las reglas de validación y derivación, el investigador promotor aprobará el diseño del estudio y se dará paso a la gestión de los datos para los sujetos.
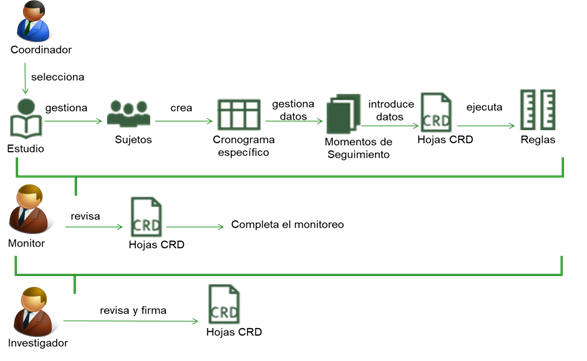
Conducción 26: Permite la gestión de los sujetos del ensayo clínico, su cronograma específico, así como la gestión de las notas relacionadas con el monitoreo de los datos de los estudios. Permite además transferir sujetos hacia otros sitios clínicos con todos sus datos. Se utiliza el CIE 10 y el diccionario de eventos adversos CTCEA para la normalización de datos. La figura 2 representa el flujo de trabajo del módulo Conducción.
El coordinador de la investigación clínica, selecciona el estudio con el que trabajará, de aquellos a los que tiene acceso según los permisos asignados. Luego gestiona los datos de los sujetos del ensayo. De acuerdo al cronograma específico del grupo en el que se encuentra incluido el sujeto seleccionado, es posible visualizar los momentos de seguimiento (MS) programados y no programados de los sujetos del estudio, así como el listado de hojas CRD asociadas a cada MS. Se realiza la captura de los datos de las hojas CRD del sistema que son automáticamente validados de acuerdo a las reglas que fueron creadas para cada dato, o grupo de variables.
Por su parte, el monitor, durante la revisión de las hojas CRD puede agregar notas para que estas luego sean revisadas y corregidas por los investigadores, que finalmente firman la Hoja CRD cuando está terminada.
Extracción: Permite obtener reportes de las trazas de auditoría, asociadas fundamentalmente a la hora, fecha, lugar, acciones realizadas y valores modificados por los usuarios del sistema. Crear conjuntos de datos, de los recogidos de las variables de los CRD, los momentos de seguimiento y los sujetos en los ensayos clínicos. Además, facilita la exportación de los conjuntos de datos a varios formatos (SPSS, XLS y PDF) para su procesamiento en aplicaciones de procesamiento estadísticos.
Estadísticas: Permite visualizar información cualitativa y cuantitativa de la conducción de los estudios, posibilitando el posterior análisis estadístico de los datos de ensayos clínicos. Entre estos reportes se encuentran: Reporte General de conducción del estudio, Reporte General de monitoreo del estudio, Reporte de Causas, Reporte de Conducción del estudio y Reporte de Monitoreo del estudio.
Pruebas de software
El Laboratorio de Pruebas de Software de la UCI, realizó en el 2017 las pruebas de software27, con el objetivo de proporcionar información objetiva e independiente sobre la calidad del producto. En este proceso de pruebas de liberación, se empleó el método de pruebas de caja negra, también llamado pruebas de comportamiento, empleando la técnica de partición de equivalencia 28. Con los 212 casos de prueba diseñados se probaron el 100% de las funcionalidades desarrolladas, por lo que el proceso de pruebas realizado evidenció el cumplimiento de las exigencias reflejadas en el levantamiento de requisitos.
Adicionalmente, fueron revisados y evaluados los manuales de usuario, e instalación y configuración de la aplicación.
Implantación y explotación del sistema
Con el objetivo de realizar la evaluación y aceptación del sistema por parte del CIM que ya realizaba el 100% de sus EC empleando el sistema XAVIA Clínicas, así como evaluar la estrategia de migración de los datos hacia la nueva versión del sistema, se realizó la implantación en los servidores de dicha institución. Aunque se implementó y probó una estrategia de migración de los datos de una versión a la otra, con la evaluación objetiva realizada por el CIM de los EC abiertos, se acordó sostener un grupo de EC que por su nivel de avance concluirían con la versión anterior del eCRD y los nuevos serían diseñados en el nuevo sistema.
En este contexto la UCI y BCF firman el Convenio marco de colaboración para el desarrollo de proyectos e investigaciones conjuntas 29, otras entidades biotecnológicas y que realizan EC se interesaron por la solución desarrollada 30. Como resultado de estos encuentros, el Centro de Ingeniería Genética y Biotecnología (CIGB), el Instituto Finlay de Vacunas (IFV) y el Centro Nacional de Biopreparados (BioCen), se sumaron al empleo del sistema XAVIA SIDEC 31 para el diseño y conducción de sus EC.
Después de múltiples intercambios entre la UCI, la Dirección de Informática y Comunicaciones (DNIC) del Ministerio de Salud Pública (MINSAP) y BCF, en enero de 2019 se acordó realizar la instalación de XAVIA SIDEC en los servidores de la Empresa de Tecnologías de la Información (ETI) de BioCubaFarma, y que se asegurara el acceso desde la red de Infomed a todas las instituciones de salud del país. Según la metodología establecida por ETI para la publicación de aplicaciones informáticas, se realizó una nueva evaluación y pruebas de seguridad informática al sistema XAVIA SIDEC. Una vez resueltas las incidencias identificadas por los especialistas de la ETI y actualizado el sistema, se notificó que el sistema estaba disponible para su explotación a nivel nacional.
Discusión
La arquitectura y característica multi-entidad de la solución implementada, permiten que varias entidades promotoras de ensayos clínicos compartan la misma instalación de la aplicación. Sin embargo, con el objetivo de aumentar la privacidad de los datos que se manejan en cada institución y comprometer a cada entidad promotora, en la conservación y protección de los respaldos de los datos del sistema, se realizaron múltiples instalaciones en la ETI para las empresas de BCF.
La generalización de la solución constituyó un importante paso de avance en la transformación digital de la conducción de ensayos clínicos en BCF. Ello es una muestra de la confianza y credibilidad alcanzada por la solución, gracias al trabajo conjunto del CIM y la UCI. Sin embargo, las necesidades de recopilación de datos específicos, diccionarios especializados para el reporte de eventos adversos, entre otros elementos, demostraron que era necesario asegurar que a cada entidad de BCF se le diera respuesta de sus necesidades, pero se garantizara la integridad de la solución como un único producto.
Con la experiencia adquirida por CESIM y la UCI como productores de aplicaciones informáticas, se decidió crear un Comité de control de cambios (CCC). Este grupo multidisciplinario congrega especialistas en el diseño, conducción, monitoreo y control de los EC del CIM, CIGB, IFV y BioCen. Adicionalmente, se sumaron especialistas de la Dirección de investigación de BCF, que monitorean el trabajo conjunto entre la UCI y BCF, así como especialistas de la DNIC.
A propuesta de las entidades promotoras, se logró incorporar especialistas del Centro Nacional Coordinador de Ensayos Clínicos (CENCEC), que recientemente se incorporó como cliente del sistema, ya que, entre otras funciones, se desempeña como promotor de ensayos clínicos y otras investigaciones en el MINSAP. Se sumaron además especialistas del Centro de Control Estatal de Equipos y Medicamentos (CECMED), entidad regulatoria en Cuba.
Este CCC, tiene la responsabilidad de monitorear el control de cambios en la configuración de la solución XAVIA SIDEC. Esta es la actividad de Gestión de Configuración más importante y su objetivo es proporcionar un mecanismo riguroso para controlar los cambios, partiendo de la base de que los cambios se van a producir.
Cuando se solicita realizar un cambio por mejora o discrepancia en el flujo de trabajo implementado en la aplicación, los expertos del CCC deben evaluar la veracidad de la solicitud. Como resultado del análisis se obtiene, entre otros elementos, la mejor variante del “deber ser” en el flujo de trabajo, el impacto sobre el resto de los elementos de configuración de la aplicación, las normas y regulaciones relacionadas a tener en cuenta. A partir de ello, se determina si es factible realizar dicho cambio en la aplicación y se determina la prioridad del cambio. Esto permite que los usuarios de la aplicación sean partícipes directos de la evolución y buen funcionamiento del sistema.
Entre otros, se pueden mencionar los siguientes beneficios que reciben las instituciones con el uso del Sistema para el manejo de datos de ensayos clínicos XAVIA SIDEC:
Facilidad y flexibilidad en el diseño y aprobación de los CRD, al permitir modificar y agregar reglas después de iniciada la conducción del ensayo, reduciendo el tiempo de desarrollo y evitando el atraso de los mismos.
Estandarización de la información manejada en los ensayos clínicos, incluyendo la codificación de tratamientos y eventos adversos mediante diccionarios integrados.
Validación de los datos entrados para cada sujeto, eliminando la doble entrada de estos, lo cual significa una disminución en los errores de los datos recogidos en cada ensayo.
Facilita el flujo de información entre las entidades que conducen el ensayo y permite el rastreo de las comunicaciones.
Optimiza el proceso de monitoreo, pues se minimizan las visitas requeridas a los sitios de inclusión.
Asegura el cambio de sujeto de una institución de salud a otra, manteniendo los datos en el caso de ser transferido el sujeto.
Gestiona las notas según las mejoras prácticas internacionales y permite resolver las discrepancias identificadas durante el monitoreo de los datos.
Proporciona un acceso inmediato y actualizado del estado de los estudios.
La disponibilidad del sistema en la red de Infomed, que abarca todo el país, facilita la extensión de los EC de la atención secundaria a la atención primaria de salud, incrementado en el tiempo la cantidad de ensayos, el número de sitios clínicos y la inclusión de pacientes.
El impacto de esta solución 32 en la industria biotecnológica y farmacéutica nacional agilizando el diseño y conducción de los EC, la reducción de costos al eliminar el uso de los CRD en papel, la soberanía tecnológica sobre el sistema informático que garantiza su funcionamiento estable y evolución, constituyen evidencias de los beneficios de la transformación digital de la industria y de la vinculación Universidad-Empresa.
Conclusiones
La elaboración de la base teórica del sistema informático desarrollado a partir del análisis de los flujos de trabajo del diseño y conducción de ensayos clínicos y de los sistemas informáticos existentes que sustentan dicha gestión, así como el análisis de las limitantes del sistema XAVIA Clínicas permitió conceptualizar e identificar las funcionalidades que posee el sistema informático desarrollado.
La reutilización de la línea base del sistema XAVIA HIS, así como las tecnologías y herramientas seleccionadas, facilitaron el desarrollo de la aplicación informática, con integración al sistema XAVIA HIS, y sin restricciones para su comercialización.
La experiencia en la implantación y explotación de la solución desarrollada por diferentes instituciones promotoras de EC, facilitó la identificación de mejoras en las funcionalidades disponibles y evidenció la necesidad de constituir un grupo multidisciplinario para la evaluación de los cambios en el sistema.