Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Anestesiología y Reanimación
versión On-line ISSN 1726-6718
Rev cuba anestesiol reanim vol.11 no.1 Ciudad de la Habana ene.-abr. 2012
REVISIONES DE TEMAS
Preemptive analgesia versus analgesia preventiva
Anticipated analgesia versus preventive analgesia
Dra. Ana Teresa Echevarría Hernández
Hospital Militar Central "Luis Díaz Soto"
Especialista de Primer Grado en Anestesiología y Reanimación. Email: anat@infomed.sld.cu
RESUMEN
Introducción: El dolor postoperatorio es un ejemplo de dolor agudo cuyo control inadecuado conduce a reacciones fisiopatológicas anormales y es un factor de retardo en la recuperación del paciente quirúrgico. El daño hístico provocado por la incisión quirúrgica provoca la entrada continua de impulsos aferentes que modifican la nocicepción y dan origen a modulaciones patológicas, la sensibilización periférica (hiperalgesia) y la sensibilización central (alodinia). La intervención quirúrgica es un tipo de agresión premeditada que nos permite anticiparnos a la aparición de dolor y actuar sobre los mecanismos fisiopatológicos que lo originan antes que se manifiesten plenamente. Objetivo: Realizar una revisión, acerca de investigaciones publicadas sobre las ventajas de la preemptive analgesia sobre la analgesia postoperatoria en el tratamiento del dolor postoperatorio. Desarrollo: En 1983 Woolf propuso el concepto de preemptive analgesia, que se basó en tratar el dolor antes que ocurriera el estímulo quirúrgico y mantener ese tratamiento mientras duraban los estímulos nocivos de alta intensidad y en el postoperatorio. La analgesia preventiva difiere de la preemptive analgesia en el momento en que se aplica la analgesia, que es después de establecida la daño, lo cual hace difícil su reversión. Conclusiones: Se han realizado numerosas investigaciones para demostrar las ventajas de la preemptive analgesia sobre la analgesia preventiva, pero los resultados no son concluyentes.
Palabras clave: preemptive analgesia, analgesia preventiva, dolor postoperatorio.
ABSTRACT
Introduction: The postoperative pain is an example of acute pain whose inappropriate control leads to abnormal pathophysiological reactions and it is a delay factor in the recovery of the surgical patient. The tissue damage provoked by the surgical incision creates the continuous entry of afferent impulses modifying the nociceptive process and leads to pathological modulations, peripheral sensitization (hyperalgesia) and central sensitization (allodynia). The surgical intervention is a type of premeditated aggression allowing us to anticipate to appearance of pain and to act on the pathophysiological mechanisms originating it before its total manifestation. Objective: To make a review on the published researches on the advantages of the anticipated analgesia on the postoperative analgesia in the treatment of postoperative pain. Development: In 1983 Woolf posed the concept of anticipated analgesia based in treatment of pain before the surgical stimulus and to maintain this treatment thoroughout the high intensity harmful stimuli and during the postoperative period. The preventive analgesia differs from he anticipated one due to the moment of analgesia's application, which after the damage's establishment which make difficult its review. Conclusions: There are many researches to demonstrate the advantages of the anticipated analgesia on the preventive one, but the results are not conclusive.
Key words: anticipated analgesia, preventive analgesia, postoperative pain.
INTRODUCCIÓN
El dolor postoperatorio (DPO) es un tipo especial de dolor agudo y se ha reconocido en los últimos años como un factor de retardo en la recuperación del paciente quirúrgico por sus consecuencias fisiopatológicas.1
Los procedimientos quirúrgicos constituyen una forma de daño premeditado. Esto nos da la posibilidad de prevenir la aparición de dolor y actuar sobre sus mecanismos fisiopatológicos, antes que estos se manifiesten plenamente.2,3
Estas ideas fueron expuestas oficialmente y por primera vez por Cirile en una edición de la revista Lancet a principios del siglo XX. 4 Durante décadas el DPO fue considerado "normal", beneficioso e incluso como un "signo valioso de alerta".
El concepto de preemptive analgesia fue planteado por Woolf en 1983, quien mostró en estudios experimentales, evidencias de la hipersensibilización de componentes centrales en el DPO.5 Posteriormente otros estudios demostraron que la aplicación de técnicas antinociceptivas antes de la agresión resultaba eficiente en la reducción de la sensibilización central cuando se compararon con la aplicación de estas después de la daño.6-9
Preemptive es un vocablo en inglés sin traducción literal al español, que significa: con derecho preferente o emprender algo para impedir que ocurra un hecho o situación, habitualmente displacentera; apropiarse o actuar por uno mismo antes que otros. No es estrictamente sinónimo de preventive, que significa preventivo; es decir, prepararse de de antemano para una cosa, tomar medidas o precauciones.5
Woolf 5, definió la preemptive analgesia como la administración de un analgésico antes que aparezca el estímulo doloroso con el objetivo de proteger al sistema nervioso central y periférico (SNC y SNP) de señales nociceptivas aferentes para prevenir modulaciones patológicas relacionadas con la transmisión del dolor. Sin embargo, la analgesia se mantiene durante el intra y postoperatorio.6-9
Kissin puntualizó que la preemptive analgesia es la prevención de un bombardeo masivo nociceptivo al SNC provocado por un proceder quirúrgico con el fin de reducir el DPO.10 Hizo referencia a un artículo de Wall, en el cual planteó que el bombardeo masivo nociceptivo provoca un estado de hiperexitabilidad sostenida por varios mecanismos dentro de la médula espinal la cual responde de forma exagerada a impulsos aferentes que podrían no ser dolorosos si esta no estuviera previamente sensibilizada.11 Kissin sugirió la sustitución del termino preventive analgesia por el de preemptive analgesia para limitar la parte del tratamiento preventivo que comienza antes del procedimiento quirúrgico.10
La analgesia preventiva es la posible prevención del dolor después de cualquier proceder quirúrgico. Estos términos se suelen confundir, pues se interpreta la analgesia preventiva como la traducción de preemptive analgesia, cuando en realidad son dos estrategias que difieren fundamentalmente en cuanto al momento de su aplicación. En el caso de la preemptive analgesia, las intervenciones analgésicas ocurren antes de la incisión quirúrgica y su objetivo está bien definido: evitar la sensibilización central y periférica y la posible evolución a dolor crónico. La analgesia preventiva es aplicada después de la daño hístico donde es muy probable que ya se hayan establecido los mecanismos de sensibilización, antes mencionados.10 No obstante, es un método que no se debe descartar ante situaciones de dolor agudo donde se accede al tratamiento luego de producidoa la agresión, como es el caso del paciente quemado o del lesionado complejo, donde a pesar de no poder aplicar una terapia capaz de impedir modulaciones patológicas del dolor, se pueden utilizar los conceptos fisiopatológicos y la experiencia clínica para evitar o revertir según el caso, el proceso de sensibilización a fin de reducir las respuestas de hiperexitabilidad o "memoria" de dolor en el sistema nervioso.11,12
Constituye el objetivo realizar una actualización, acerca de las investigaciones publicadas y las ventajas de la preemptive analgesia sobre la analgesia postoperatoria en el tratamiento del dolor postoperatorio.
DESARROLLO
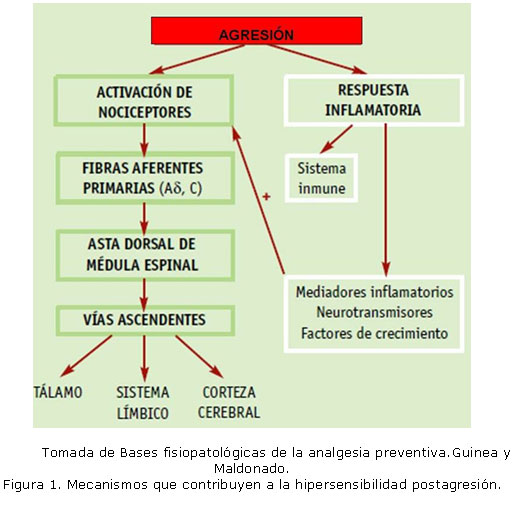
El daño hístico provoca la entrada continua de impulsos aferentes que pueden modificar la nocicepción (Figura 1). La lesión del tejido periférico genera una "sopa" compleja de mediadores inflamatorios y otros químicos, capaces de alterar las propiedades transductoras de los nociceptores, que podrán ser activados por estímulos de baja intensidad.13
Guinea y Maldonado
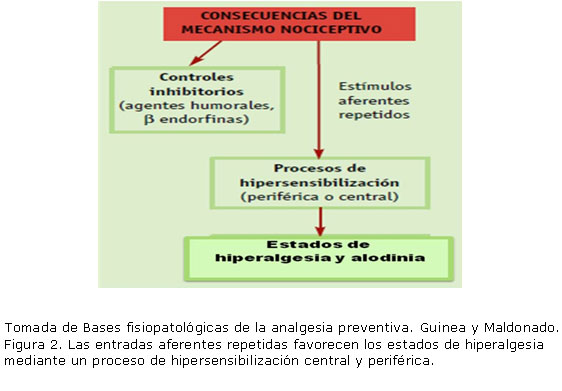
La inflamación del sitio lesionado puede además, inducir la expresión de ciertos genes cuyo resultado es el aumento de la síntesis de receptores y la sensibilización de los nociceptores periféricos existentes. Esto provoca que la respuesta a nuevos estímulos sea exagerada, produzca hiperalgesia y se desencadene a partir de un umbral menor sin ninguna función protectora, un fenómeno conocido como sensibilización periférica.14 (Figura 2).
Guinea y Maldonado
La hiperalgesia es la intensificación de la sensación de dolor en el sitio de la lesión (hiperalgesia primaria) o en el tejido circundante no dañado (hiperalgesia secundaria). En estas condiciones, la activación de fibras Aâ; que en condiciones normales no son nociceptivas y promueven sensaciones inocuas por estímulos térmicos y mecánicos, puede ser percibida como dolor.14
En este proceso se modifica la respuesta de las neuronas del asta dorsal medular que se vuelven más sensibles a los estímulos repetidos y aumenta además la exitabilidad de las vías de transmisión nociceptiva. El mecanismo por el que las neuronas se vuelven más sensibles a los estímulos previamente aplicados se conoce como sensibilización central. 15 Se considera que la activación de los receptores NMDA (N-metil- D-aspartato) por el glutamato, contribuye a inducir y mantener la sensibilización central.15,16
Los cambios en el procesamiento de la estimulación sensitiva por parte del sistema nervioso se conocen como neuroplasticidad. Se le considera como la capacidad de las neuronas para sufrir cambios dependientes de su propia actividad y se propone como la explicación del dolor que persiste aun después que se haya resuelto el daño periférico.17
Desde el punto de vista clínico, la sensibilización se manifiesta como un aumento de la magnitud y la duración de la respuesta a estímulos nocivos subsecuentes y como un incremento de la respuesta a estímulos de bajo umbral. También se puede producir la alodinia (dolor provocado por un estimulo que habitualmente no lo causa).16 En el caso del dolor quirúrgico, la hipersensibilización central y periférica conduce a un estado de sensibilidad postoperatoria que se extiende más allá del sitio de la lesión. El dolor postoperatorio obedece al efecto acumulativo de los estímulos dolorosos preoperatorios e intraoperatorios y a la inflamación postoperatoria. Debido a que estos fenómenos son los responsables de la inducción de la hipersensibilización central y periférica, el uso de analgesia antes, durante y después de cualquier intervención quirúrgica contribuye a minimizar la excitabilidad de las vías nociceptivas. Cuando ya se ha establecido el mecanismo de dolor, una dosis de analgésico es menos efectiva debido a la hipersensibilización central. La hiperalgesia prolongada y los consecuentes espasmos musculares contribuyen a que el dolor pueda persistir durante días o semanas luego de la cirugía.16-18
En los modelos de daño quirúrgica se consideran dos fases. La Fase1 es producida por la incisión y el trauma de la cirugía. La Fase 2 se debe a la inflamación secundaria, comienza en el momento de la incisión, hace pico en el periodo postoperatorio, y continua de manera decreciente a lo largo del periodo de cicatrización de la herida. La sensibilización central puede iniciarse durante ambas fases.18,19
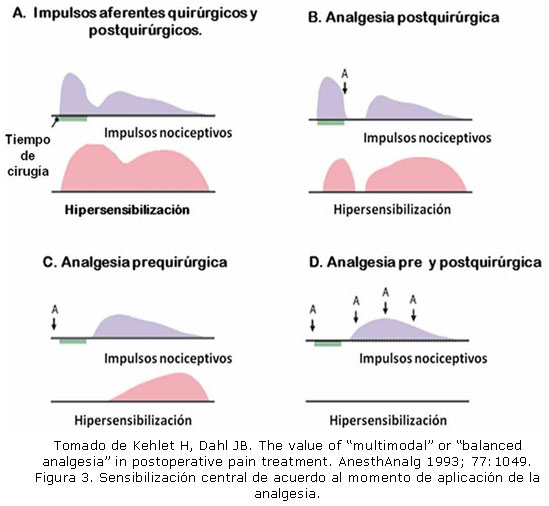
Las terapias limitadas solamente a los periodos preoperatorio e intraoperatorio pueden ser insuficientes para prevenir la hipersensibilización. Esto se debe a que las reacciones inflamatorias provocadas por el daño hístico durante la agresión quirúrgica pueden inducir sensibilización postoperatoria, aun cuando esta se haya prevenido durante el procedimiento (Figura 3). La base de la preemptive analgesia es la intervención analgésica durante todo el periodo que duren los estímulos noxiosos de alta intensidad.18
Es interesante considerar que el potencial de sensibilización existe aun en el paciente inconsciente, que parece ser clínicamente indiferente al estímulo quirúrgico. Por ello, la práctica de mantener una anestesia con agentes que aporten escasa analgesia residual (por ejemplo propofol e isofluorano) no protege la médula espinal de la entrada continua de impulsos nociceptivos que provienen del estímulo quirúrgico, aunque se haya alcanzado un adecuado nivel de anestesia general.18
Las estrategias de la preemptive analgesia involucran una serie de intervenciones en uno o más sitios a través de las vías de conducción del dolor (Figura 4). Estas estrategias incluyen la infiltración de la piel con anestésicos locales, bloqueos nerviosos, bloqueo epidural, subaracnoideo, analgésicos intravenosos, antagonistas del NMDA y drogas antiinflamatorias.
Dos enfoques se han utilizado para esclarecer la preemptive analgesia. Uno de ellos para demostrar una disminución de la intensidad del dolor postoperatorio y/o analgesia más allá de la presencia del fármaco en la biofase.
Este se basa en un estudio cuyo diseño compara dos grupos, uno con tratamiento preoperatorio y otro sin tratamiento en ningún momento del perioperatorio (PRE VS NO). El otro enfoque es para probar que un tratamiento aplicado en el preoperatorio es más efectivo en el control del dolor postoperatorio que el mismo tratamiento administrado al final de la cirugía (PRE VS POST).12 El diseño PRE VS NO fue comúnmente utilizado en los estudios clínicos iniciales sobre la preemptive analgesia, el PRE VS POST fue introducido más tarde convirtiéndose en el diseño más utilizado por los investigadores. Muchas revisiones de estudios clínicos con estos diseños concluyeron que el concepto de preemptive analgesia no es relevante en la clínica. 3, 9 Esta visión fue cuestionada a partir de dos artículos publicados en la revista Anesthesia & Analgesia, uno de McCartney con un diseño PRE VS NO y otro de Ong, un meta-análisis con diseño PRE VS POST.20,21
McQuay 9, publicó un editorial donde analizó conceptos y criterios propios y de 15 artículos publicados entre 1987 y 1994, fundamentalmente ensayos clínicos. Estableció que la dosis de analgésicos dada antes de producir el estímulo previene la excitabilidad de la médula espinal y resulta más eficaz que la misma dosis dada posteriormente. Sin embargo no se demostró efecto preemptive con AINES y anestésicos locales. 9
Kelly en el año 2001 realizó una revisión de 24 artículos publicados entre 1984 y 2000 donde examinó específicamente PRE VS POST, la influencia del tiempo de administración de opiodes y AINES. Fue incapaz de hallar evidencia convincente a favor de la preemptive analgesia y concluyó que la analgesia multimodal resultó más efectiva en la prevención del DPO.22
Moiniche y colaboradores en el año 2002 revisaron 80 estudios basados en el diseño PRE VS POST. 3 Incluyeron un total de 3700 pacientes. La conclusión más importante a la que arribaron fue que el tiempo no influyó en la calidad del DPO. La preemptive con AINES, ketamina y opiodes no aportó beneficios adicionales. La analgesia epidural continua fue cuestionable y difícil de interpretar, al igual que la inyección intratecal y la infiltración de la herida con anestésicos locales. En 7 de 11 ensayos una dosis única de analgesia epidural con opioides, anestésicos locales solos o combinados, mejoró el control del DPO (disminuyó la demanda de analgésicos en el postoperatorio).3
Katz y colaboradores 23, estudiaron 141 pacientes intervenidas de cirugía mayor ginecológica en el 2003 bajo anestesia general combinada con analgesia epidural. 23 Las pacientes fueron distribuidas aleatoriamente en 3 grupos. Al grupo 1 se le administró antes de la incisión una mezcla de opioides con anestésicos locales, al grupo 2 la misma mezcla post incisión y un tercer grupo recibió solución salina. El grupo PRE disminuyó el dolor en las primeras 24 horas del postoperatorio al igual que el grupo POST al compararse con el grupo control, disminuyó el consumo de morfina sin diferencias significativas entre los grupos PRE y POST. 23
Al año siguiente este mismo autor estudió, 142 pacientes intervenidos de prostatectomía radical bajo anestesia general orotraqueal. El grupo 1 recibió pre incisión fentanil y dosis bajas de ketamina. El grupo 2 recibió igual mezcla post incisión y un tercer grupo se le administró solución salina. No se encontraron diferencias entre el grupo 1 y 2 en cuanto al DPO ni en el consumo de morfina hasta 72 horas después.24
McCartney y colaboradores revisaron un total de 40 ensayos controlados al azar, publicados entre 1989 y 2003, en los que se emplearon antagonistas de los receptores NMDA en el control del dolor perioperatorio y se evaluó el consumo de analgésicos. Incluyeron ketamina en 24 de ellos, dextrometorfán en 12 y 4 con sulfato de magnesio. Se encontró efecto preemptive con dextrometorfán en 67 % de los estudios y con ketamina en 58 %, con marcada diminución del consumo de analgésicos. No se obtuvo ninguna evidencia con el sulfato de magnesio.20 Llama la atención, que estos autores utilizaron el término analgesia preventiva, cuando realmente se refirieron a preemptive analgesia.
Bong y colaboradores en el año 2005 revisaron 6 artículos publicados entre 1996-2003, en el que se probó el impacto preemptive de la analgesia epidural torácica en la prevención del dolor postoracotomía. Se utilizó por esta vía un anestésico local solo o combinado con opioides y concluyó que la analgesia peridural, en ambos casos, se asoció con disminución significativa del dolor agudo durante la primeras 24 horas del postoperatorio; sin embargo, no encontró significativa reducción en la evolución a dolor crónico25.
Ong y colaboradores en el 2005 realizaron un meta-análisis con 66 estudios donde relacionan 5 grupos de tratamiento: analgesia epidural con opioides, anestésicos locales periféricos, antagonistas NMDA sistémicos, AINES sistémicos y opioides sistémicos incluyendo diseños PRE VS POST. Se encontró marcado efecto preemptive con la analgesia epidural, el uso de anestésicos locales y AINES. Se obtuvo una disminución impresio
nante del consumo analgésicos (mayor de 50%) y un mayor tiempo de administración del primer analgésico (first time analgesic, FTA), con altos niveles de significación estadística. Con los opioides y los antagonistas NMDA los resultados fueron equívocos21.
En el meta-análisis realizado por Ong se demuestra que la preemptive analgesia es clínicamente significativa, a pesar de varios factores que podrían enmascarar su efecto:
- Con el diseño PRE VS POST la plasticidad producida por dolor en las primeras horas del postoperatorio elude la comparación. En el grupo con pre-tratamiento, los estímulos nociceptivos después de la cirugía bajo ciertas circunstancias pueden desencadenar una marcada hipersensibilización y como resultado la diferencia entre grupos disminuye.
- La diferencia del tiempo de administración del medicamento en ambos grupos provoca una diferencia en la concentración del medicamento en la biofase durante las primeras horas del postoperatorio, debido a la farmacocinética de las drogas, así el efecto analgésico puede ser más marcado en el grupo POST12.
En un estudio realizado en el Hospital ¨Reina Elizabeth¨ de Barbados a 80 pacientes intervenidas de cirugía mayor abdominal ginecológica se probó el efecto preemptive de la administración PRE VS POST de la infiltración de la herida quirúrgica con anestésico local y aunque las diferencias entre grupos no fueron significativas si se logró una disminución del consumo de analgésicos durante las primeras 24 horas del post operatorio en el grupo PRE26.
Estudios más frecuentes como los de Iqbel y Carmona evalúan el rol de la preemptive analgesia en cirugía laparoscópica. Iqbel y colaboradores comparan PRE VS POST la utilidad del diclofenaco sódico por vía rectal, con marcada disminución del DPO según la escala visual análoga en el grupo Pre 27. Carmona y colaboradores evalúan el efecto analgésico de la bupivacaína intraperitoneal en este tipo de cirugía, con igual diseño PRE
VS POST sin obtener diferencias significativas entre grupos en cuanto al alivio del dolor y el consumo de analgésicos 28. Tampoco Navarro y colaboradores obtuvieron efecto preemptive mediante el empleo de ketamina preincisional por vía endovenosa (0.25 mg/Kg), en un ensayo clínico controlado, aleatorizado a doble ciego29.
Un estudio realizado en México por García y Olivares en el año 2006 evalúa el efecto preemptive de la dexmedetomidina endovenosa en la hernioplastia inguinal con resultados favorables, que incluyen disminución de la intensidad del DPO y el consumo de analgésicos en el postoperatorio 30.
También los gabapentoides (gabapentina y pregabalina) nos ofrecen una nueva herramienta para el alivio del DPO, disminuyendo el consumo de opioides y sus efectos secundarios, según Restrepo y colaboradores 31.
Se concluye que la provisión de un adecuado alivio del DPO debe seguir siendo una prioridad en nuestro plan anestésico diario. Lo más importante es aportar una protección al paciente en el que se espere tenga dolor postoperatorio significativo. Debido a que el impulso aferente puede provocar alteraciones prolongadas dentro del SNC, el tratamiento óptimo del dolor agudo debería enfocarse a evitar la sensibilización periférica y prevenir el establecimiento de la sensibilización central que pudiera perpetuar el dolor postoperatorio e incluso cronificarlo. No obstante, muchos más estudios clínicos son necesarios y estos necesitan ser rigurosamente controlados y los pacientes seguidos por un tiempo suficiente, de manera que pueda obtenerse información confiable.
REFERENCIAS BIBLIOGRÁFICAS
1. Gil KM. Psychologic aspects of acute pain. Anesthesiology Rep 1990; 2:246-255.
2. Rowligston JC. Advances in acute pain management. IARS 2000, Review Course Lectures, pag. 65-72.
3. Møiniche S, Kehlet H, Dahl JB. Preemptive Analgesia for Postoperative Pain Relief. The Role of Timing of Analgesia. Anesthesiology 2002; 96:725-41.
4. Cirile WG. The Kinetic theory of shock and its prevention through anociassociation (shokless operation). Lancet. 1913; 185: 7-16.
5. Woolf CJ. Evidence for a central component of post-injury pain hypersensitivity. Nature 1983; 306: 686-8.
6. Woolf CJ, Chong M-S: Preemptive analgesia: Treating postoperative pain by preventing the establishment of central sensitisation. Anesth Analg 1993; 77: 362-79
7. Coderre TJ, Catz J, Vaccarino AL, Melzack R: Contribution of central neutoplasticity to pathological pain: Review of clinical and experimental evidence. Pain 1993; 52:259-85.
8. Dahl JB, Kehlet H: The value of pre-emptive analgesia in the treatment of postoperative pain. Br J Anaesth 1993; 70:434_9
9. McQuay HJ: Pre-emptive analgesia: A systematic review of clinical studies. Ann Med 1995; 27:249-56
10. Kissin I. Preemptive analgesia: Terminology and clinical relevance. Anesth & Analg. 1994; 79: 880-18.
11. Wall PD. The prevention of postoperative pain (Editorial). Pain 1988; 33:289-90.
12. Kissin I. Editorial Preemptive Analgesia at the Crossroad. Anesth Analg 2005; 100:754-6.
13. Carr D, Guodas L. Acute Pain. The Lancet. 1999, 353: 2051-2058.
14. Treede RD, Meyer RA, raja SN. Peripheal and central mechanisms of cutaneous hyperalgesia. Prog Neurobiol 1992; 38: 397-421.
15. Sandkûhler J, Ruscheweyh. Opioids and central sensitisation: I. Pre-emptive analgesia. European Journal of Pain. 2005; 9: 145-148.
16. Velázquez Suárez R, Plancarte Sánchez R. Analgesia preventiva. PACII. 2010. Disponible en: http://www.fmca.org.mx
17. Terry R, Brodie E, Niven C. Exploring the Phenomenology of Memory for Pain: Is Previously Experienced Acute Pain Consciously Remembered or Simply Known? The Journal of Pain. 2007 June; 8 (6): pp 467-475. Disponible en: http://www.sciencedirect.com
18. Gottschalk A, Hopkins J. New Concepts in Acute Pain Therapy: Preemptive Analgesia. Family Physician. 2001 Mayo 15; 63(10). Disponible en: http://www.aafp.org/afp
19. Woolf CJ. Evidence for a central component of post-injury pain hypersensitivity. Nature {London) 1983; 306: 686-688.
20. McCartney CJL, Sinha A, Katz J. A qualitative systematic review of the role of N-methyl-d-aspartate receptor antagonists in preventive analgesia. Anesth Analg 2004; 98:1385-400.
21. Ong KS, Lirk P, Seymour RA. The efficacy of preemptive analgesia for acute postoperative pain management: a metaanalysis. Anesth Analg 2005; 100:757-73.
22. Kelly D J. Ahmad M, Brull SJ. Preemptive analgesia I: physiological pathways and pharmacological modalities. Can J Anesth. 2001; 48 (10): 1000-10.
23. Katz J. Timing of treatment and preemptive analgesia. In:Rowbotham DJ, Macintyre PE, eds. Acute pain. London: Arnold, 2003:113-62.
24. Katz J, Schmid R, Snijdelaar DG et al. Pre-emptive analgesia using intravenous fentanyl plus low-dose ketamine for radical prostatectomy under general anesthesia does not produce short-term or long-term reductions in pain or analgesic use. Pain 2004; 110:707-718.
25. Bong CL, Samuel M, Ng JM et al. Effects of preemptive epidural analgesia on post-thoracotomy pain. Journal of Cardiothoracic and Vascular Anesthesia. 2005; 98:1449-1460.
26. Hariharan S, Moseley H, Kumar A, Raju S. The effect of preemptive analgesia in postoperative pain relief- A prospective double-blind randomized study. Pain medicine. 2009;10(1).
27. Iqbal M, Mehmood Z, Malik S et al. Role of preemptive analgesia in laparoscopic cholecystectomy. Journal of surgery Pakistan (International). 2009 Jule-Sept; 14(3).
28. Carmona J, Mikly D. Efecto analgésico de la bupivacaína intraperitoneal en la colecistectomía laparoscópica. Revista venezolana de cirugía. 2008; 6(3).
29. Navarro JR, Barragán G, Rincón D. Analgesia preventiva en mujeres programadas para esterilización definitiva con electrofulguración de trompas por laparoscopia. Rev col de anestesia. 2008; 36: 25-32.
30. García R y cols. Analgesia preventiva postoperatoria con dexmedetomidina en hernioplastia inguinal. Gac med mex. 2006; 142(1).
31. Restrepo García y cols. Gabapentina y pregabalina: ¿cuál es su papel en el perioperatorio? Rev Soc Esp Dolor. 2007; 432-36.
Recibido: 2 de junio de 2011.
Aprobado: 20 de agosto 2011.