Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Cubana de Anestesiología y Reanimación
versión On-line ISSN 1726-6718
Rev cuba anestesiol reanim vol.12 no.3 Ciudad de la Habana sep.-dic. 2013
ARTÍCULO ORIGINAL
Ketamina como medicamento coadyuvante en el control del dolor perioperatorio en la cirugía abdominal mayor
Ketamine as a co-adjuvant drug in perioperative pain control in major abdominal surgery
Dr. Zhachel Alejandro Redondo Gómez
Instituto Nacional de Oncología y Radiobiología. La Habana, Cuba.
RESUMEN
Introducción: la combinación de ketamina con morfina disminuye tanto el dolor como el consumo de esta última durante el período postoperatorio. Sin embargo la dosis óptima y la duración de la ketamina aún están por determinar.
Objetivos: evaluar el efecto de la administración de ketamina en el consumo postoperatorio de morfina, reducción del dolor, y efectos adversos de la ketamina en la cirugía abdominal mayor.
Método: se realizó un estudio prospectivo, aleatorio, doble ciego, en 75 pacientes programados para cirugía abdominal mayor divididos en tres grupos: (1) Grupo PERI: recibió ketamina intraoperatoria y postoperatoria 48 horas después de la cirugía (2 ìg/kg/min después de un bolo de 0,5 mg/kg); (2) Grupo INTRA: recibió solamente ketamina en el intraoperatorio (2 ìg/kg/min después de un bolo de 0.5 mg/kg); (3) Grupo CTRL: recibió placebo. Se evaluó el consumo de morfina, la escala análoga visual y los efectos adversos en las primeras 48 horas.
Resultados: el consumo acumulativo de morfina 24 horas después del proceder anestésico quirúrgico fue significativamente menor en el grupo PERI (27 mg ± 17) que en el INTRA (48 mg ± 40,5) y en CTRL (50 mg ± 22) [p < 0.005]. La escala análoga visual fue significativamente menor en los grupos PERI e INTRA que en el CTRL (p < 0.002). Una mayor incidencia de náuseas se observó en el grupo CTRL comparado con el PERI (41 % vs. 8 %, [p = 0.005]).
Conclusiones: bajas dosis de ketamina mejora la analgesia postoperatoria con una disminución del consumo de morfina cuando es administrada por 48 horas en el postoperatorio con baja incidencia de efectos adversos.
Palabras clave: ketamina, postoperatorio, consumo de morfina, cirugía abdominal mayor.
ABSTRACT
Introduction: the combination of ketamine with morphine decreases both pain and the consumption of the latter drug during the postoperative period. However the optimal dose and duration of ketamine are yet to be determined.
Objectives: to evaluate the effect of ketamine administration on postoperative morphine consumption, pain reduction, and adverse effects of ketamine in major abdominal surgery.
Method: a prospective, randomized double-blind study was made in 75 patients scheduled for major abdominal surgery and divided into 3 groups: (1) PERI Group: received ketamine intraoperatively and postoperatively 48 hours after surgery (2 ug / kg / min after a bolus of 0.5 mg / kg); (2) INTRA Group: received only intraoperative ketamine (2 mg / kg / min after a bolus of 0.5 mg / kg), (3) CTRL Group: received placebo. Morphine consumption, visual analogical scale and the adverse effects in the first 48 years were evaluated.
Results: cumulative morphine consumption 24 hours after the surgical anesthetic procedure was significantly lower in the PERI group (27 mg ± 17) than in the INTRA (48 mg ± 40.5) and CTRL (50 mg ± 22) [p <0.005]. The visual analogical scale was significantly lower in PERI and INTRA groups than in CTRL (p<0.002). A higher nausea incidence was observed in the CTRL group compared to the PERI one (41 % vs. 8 %, [p = 0.005]).
Conclusions: low doses of ketamine improve postoperative analgesia with a reduction in morphine consumption when it is administrated for 48 years in the postoperative phase with low adverse effects incidence.
Keywords: ketamine, postoperative, morphine consumption, major abdominal surgery.
INTRODUCCIÓN
La administración de morfina es la piedra angular en la terapéutica contra el dolor, pero la tolerancia aguda después de la exposición al opiode se describió tan tempranamente como es el período postoperatorio inmediato.1,2 La tolerancia y la hiperalgesia tardía a la exposición de opiodes están asociadas con la activación de receptores de N-metil-d-aspartato (NMDA) del sistema nervioso central.3-5 La ketamina, un antagonista competitivo del receptor de NMDA, previene experimentalmente la hiperalgesia inducida por los opiodes y en combinación con la morfina disminuye tanto el dolor como el consumo de esta última durante el período postoperatorio.6-9 Sin embargo, la dosis óptima y la duración de la administración de ketamina está aún por determinar. Bajas dosis de ketamina induce a un efecto ahorrador de morfina cuando su administración está limitada al período intraoperatorio 10 o extendida al período postoperatorio 11,12 pero muy pocos artículos han comparado la administración intravenosa (IV) de ketamina solo durante el intraoperatorio versus su administración intraoperatorio y postoperatorio. Estos diversos resultados con el uso de la ketamina nos permiten exponer la hipótesis que este medicamento ocupa un lugar en el alivio del dolor postoperatorio y que este efecto está muy relacionado con el tiempo de administración del mismo. El presente estudio se condujo con el objetivo de evaluar el efecto ahorrador de morfina, reducción de dolor y efectos adversos de la ketamina en la cirugía abdominal mayor cuando fue aplicada solamente durante el período intraoperatorio o se continuó por 48 horas durante el postoperatorio.
MÉTODOS
La Comisión Científica y el Comité de Ética del hospital aprobaron el protocolo de investigación. Todos los pacientes dieron su consentimiento informado. Se seleccionaron de manera aleatoria 78 pacientes que estaban programados para cirugía abdominal mayor acorde a un estudio doble ciego y se asignaron a tres grupos: (1) Grupo INTRA, recibió un bolo de ketamina 0,5 mg/kg 10 minutos previos a la incisión, seguido de una infusión intravenosa (IV) de 2 ìg/kg/min de ketamina durante el proceder quirúrgico y una infusión IV de 50 ml de solución salina por 48 horas en el postoperatorio. (2) Grupo PERI recibió el mismo bolo inicial de ketamina previa a la incisión, como en el grupo anterior, seguida de la infusión IV pero la misma continuó 48 horas en el postoperatorio y (3) Grupo control (CTRL) recibió bolo de 10 ml de solución salina antes de la incisión y una infusión IV de 50 ml de solución salina durante la cirugía y mantenida por 48 horas en el postoperatorio.
Los criterios de inclusión fueron: paciente mayor de 18 años y programado para cirugía abdominal mayor y urológica. Los criterios de exclusión fueron: historia de dolor crónico, autoadministración de opiodes, desórdenes psiquiátricos. Los criterios de salida fueron: decisión expresa del enfermo a salir del estudio, alergia a los medicamentos y/o condición clínica del paciente que contraindica la cirugía o no permita el uso de las drogas que están propuestas en la investigación.
Procedimiento
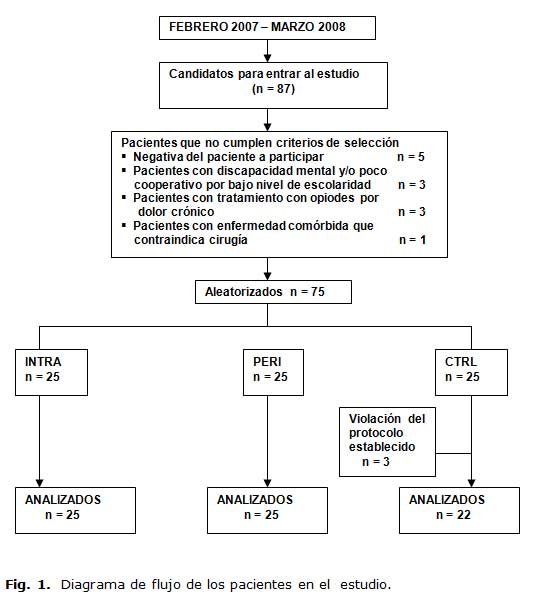
La asignación de los pacientes a los grupos se hizo de forma estrictamente aleatoria con el empleo de una tabla diseñada a tales efectos y por métodos estadísticos. En la figura 1 se muestra el diagrama de flujo de los pacientes que participaron en el estudio.
El día previo a la intervención quirúrgica se instruyó a todos los pacientes en el empleo del dispositivo para la analgesia controlada por el paciente (ACP) (PCA Freedom 5 Vygon, Francia, [ref. 7301]) para analgesia postoperatoria, así como en el uso de la escala análogo visual (EAV). Se le administró preoperatoriamente a todos los pacientes midazolán 0,03 mg/kg por vía IV, 30 minutos previos al proceder.
La anestesia se indujo con fentanilo 2 mcg/kg, propofol 1,5 mg/kg y atracurio 0,5 mg/kg y fue mantenida con isoflurano inhalado en una mezcla de 60 % N2O/O2; atracurio y fentanilo según necesidades clínicas. Todos los pacientes recibieron 1g IV de dipirona 30 minutos antes de concluir el proceder quirúrgico. En la Unidad de Cuidados Intensivos (a la cual se trasladaron todos los pacientes por protocolo de esta institución). Cuando el paciente indicó un puntaje en la EAV = 40, se le administró una dosis de carga de morfina de 3 mg, seguido de otra dosis de 3mg, cinco minutos más tarde si era necesario, hasta que se alcanzará un puntaje = 40 en la EAV. Fue entonces cuando el dispositivo de la bomba de APC se inició en los tres grupos. La misma contenía 1 mg/ml de morfina y 2,5 mg/ 50ml de droperidol. El tiempo de lockout fue de 7 minutos sin dosis límite o infusión basal previa. Este régimen de ACP fue continuado por 48 horas.
Variables de respuesta
- La variable de evaluación primaria fue el consumo acumulativo de morfina 48 horas después del proceder quirúrgico.
- Las variables de evaluación secundaria fueron: evolución de la EAV, escalas de sedación y náuseas-vómitos y desórdenes psiquiátricos.
- El uso de la morfina en la UCI y los requerimientos de morfina en la ACP a las 4, 24 y 48 horas fue recogido. La escala para la EAV (rango de 0-100) se recogió en el mismo intervalo de tiempo.
- Se diseñó una escala para la sedación y otra para náusea-vómito y se recogió los datos de las mismas a las 24 y 48 horas del postoperatorio. La escala para la sedación utilizada fue:
no-sedación; despierto; sedación ligera; se despierta con estimulación verbal; sedación moderada; se despierta con múltiples estimulaciones verbales; sedación profunda, se despierta sólo con estímulos dolorosos. La escala utilizada para las náuseas-vómitos fue: no-náusea; náusea moderada; náusea severa; vómito. - Pesadillas, desórdenes psiquiátricos tales como alucinaciones, disforia y otros efectos adversos psicomiméticos fueron recogidos cuando estos se presentaron.
Estadísticas
Se emplearon estadígrafos descriptivos para las variables demográficas edad, sexo, peso, clasificación ASA, procedimiento y tiempo quirúrgicos.
Para comparar el consumo de morfina y el puntaje de la EAV se utilizó el análisis de la varianza de mediciones repetidas.
Para contrastar las variables cuantitativas fueron usados el test de Kruskal-Wallis y la prueba de t de Student.
Para las variables nominales o dicotómicas se obtuvieron los porcentajes respectivos y las posibles diferencias se demostraron mediante la prueba de Chi cuadrado de comparación de proporciones.
Se consideraron significativos los valores de p inferiores a 0.05 para ambas pruebas.
RESULTADOS
Se designó de manera aleatoria setenta y cinco pacientes en el estudio y tres de ellos fueron excluidos debido a violación del protocolo (recibieron tratamiento analgésico adicional). Los tres pacientes estaban designados al grupo CTRL por lo tanto quedaron elegibles para la evaluación setenta y dos pacientes: 22 en el grupo CTRL, 25 en el INTRA y 25 en el PERI. Las características demográficas, duración de la intervención y tipo de proceder quirúrgico se comparan en la tabla 1.
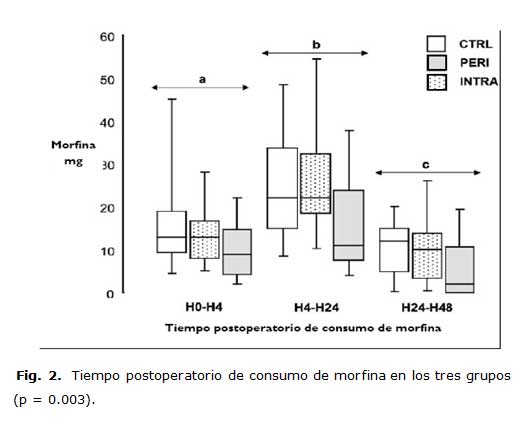
Concerniente a la variable de respuesta primaria de este estudio, el consumo acumulativo de morfina fue significativamente menor en el grupo PERI (p = 0.009) comparado con los otros dos grupos: grupo PERI 27mg ± 17 vs. 48mg ± 40,5 en el INTRA y 50 mg ± 22 en el CTRL. No se observó diferencias en el consumo de morfina entre los grupos INTRA y CTRL. Una diferencia significativa en el tiempo del consumo de morfina se observó entre los tres grupos (p = 0.003) como se aprecia en la figura 2.
Resultados expresados en áreas delineadas donde la barra es el valor medio; los límites superiores e inferiores de cada área son los percentiles entre 25 y 75 y los extremos superiores e inferiores los percentiles 10 y 90. (a) Menor consumo de morfina a las 4 horas en el grupo PERI que en el CTRL (p = 0.05). (b) Menor consumo de morfina entre las horas 24 y 48 en el grupo PERI que en el CTRL (p = 0.01) y en el INTRA (p = 0.02) (c) Menor consumo de morfina entre hora 24 y 48 en el grupo PERI que en el grupo CTRL (p = 0.02).
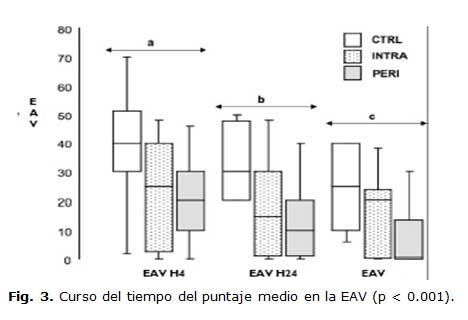
El curso del tiempo del dolor de la EAV (figura 3) fue significativamente diferente entre los tres grupos (p = 0.003). El puntaje de la EAV fue significativamente menor en los grupos INTRA y PERI que en el CTRL a la hora 4 (p = 0.003), hora 24 (p = 0.002), hora 48 (p = 0.003).
Resultados expresados en áreas delineadas donde la barra es el valor medio; los límites superiores e inferiores de cada área son los percentiles entre 25 y 75 y los extremos superiores e inferiores los percentiles 10 y 90. (a) EAV a las 4 horas significativamente mayor en el grupo CTRL que en el INTRA y el PERI (p = 0.004). (b) EAV a las 24 horas significativamente mayor en el grupo CTRL que en el INTRA y el PERI (p = 0.0001). (c) EAV a las 48 horas significativamente mayor en el grupo CTRL que en el INTRA y el PERI (p = 0.001).
Los principales efectos adversos de la analgesia operatoria están indicados en la tabla 2.
No se observó diferencias en la escala de náusea- vómito a la hora 24 y hora 48. Sin embargo una diferencia significativa se observó en el por ciento de pacientes que experimentaron náuseas o vómitos entre los tres grupos (p = 0.02). Los pacientes del grupo PERI experimentaron de manera significativa menor náusea o vómito que los del grupo CTRL (p = 0.003). No se observó diferencias en la escala de sedación entre los grupos ni a la hora 24 ni a la hora 48. No se reportó desórdenes psiquiátricos, pesadillas, alucinaciones u otros trastornos del sueño en los grupos.
DISCUSIÓN
El valor de la ketamina es generalmente considerado limitado por sus efectos adversos, pero esto no está apoyado por los resultados en el tratamiento del dolor agudo postoperatorio, el cual está asociado con ninguno o solamente efectos adversos menores.8,13 En un meta-análisis, Bell et al observaron que la ketamina redujo las náuseas y vómitos postoperatorios (NVPO). 6 Esto pudiera estar relacionado con el efecto ahorrador de morfina o a otros factores aún no bien establecidos. En ésta investigación, una diferencia significativa se observó entre los grupos PERI vs. CTRL para los efectos adversos de la morfina tal como las náuseas y vómitos a pesar de la administración sistémica de manera profiláctica de droperidol en todos los pacientes directamente a través del dispositivo de la ACP de morfina. El droperidol es una droga antiemética útil que probablemente minimiza NVPO.14 Este estudio no está diseñado para dar respuesta a esta observación.
Uno de los resultados sorprendentes de este trabajo fue la similar reducción de los niveles de dolor observados en los dos grupos que recibieron ketamina a pesar del consumo significativamente menor de morfina en el grupo PERI. Muchos estudios han sugerido que la administración perioperatoria de ketamina pudiera resultar útil para el control del dolor postoperatorio pero los resultados son difíciles de comparar debido a los diferentes regímenes de dosis usadas.6,8 La dosis óptima de ketamina resulta controversial. En nuestro estudio usamos ketamina en bolo inicial 0,5 mg/kg IV seguido por una infusión 2 mcg/kg/min para obtener una concentración plasmática teórica en el rango de 100 ìg/ml descrito por Clements y Nimmo15 y también usado por Adriaenssens et al.16 Esta dosis induce concentraciones plasmáticas de ketamina muy bajas con ningún signo significativo de acumulación.17 Esta baja dosis de ketamina (comparada con la de un estudio realizado por Edwards et al. que usó dosis de 7,8 ìg /kg/min18) también evita los efectos psicomiméticos. Ningún efecto psicomimético se observó con la infusión de bajas dosis de ketamina aún cuando esta se continuó por 48 horas en el grupo PERI. Sin embargo, la discrepancia entre la disminución del consumo de morfina y la falta de efectos en los cambios de la EAV puede ser debido a otra causa. La ketamina, en dosis subanestésica, afecta profundamente el comportamiento y el estado emocional en individuos saludables.19,20 La disminución en el consumo de opiodes pudiera ser, al menos en parte, como resultado de sus efectos sobre el comportamiento que no se refleja en la intensidad del dolor. Sin embargo su uso a bajas dosis < 2,5 ìg/kg/min en pacientes postoperados fue publicado como seguro, sin alucinaciones o fallas en el funcionamiento cognitivo.9, 21
Otro tema controversial es el tiempo de administración de la ketamina. Algunos estudios informan el efecto ahorrador de morfina y la reducción del dolor cuando la ketamina fue administrada sólo en el intraoperatorio,10,22-25 mientras que otros estudios reportan resultados similares con la administración postoperatoria de la misma.7,11,12,16 En el presente estudio se observó una disminución del dolor, en grado similar, tanto en los grupos INTRA y PERI comparado con el grupo CTRL. Sin embargo la reducción del dolor no estuvo asociada con el efecto ahorrador de morfina en el grupo INTRA comparado con el grupo CTRL. El menor consumo de morfina se observó sólo cuando la ketamina se administró en el intraoperatorio y el postoperatorio lo que sugiere la hipótesis que el proceso de sensibilización central puede ser inducido, no solamente durante la cirugía sino también en el postoperatorio por otros mecanismos del dolor: daños inflamatorios, la incisión, el dolor neuropático agudo debido al daño del nervio, entre otros. 22,26,27 Esto pudiera explicar porque el efecto ahorrador de morfina sólo se observó con la administración postoperatoria de ketamina por 48 horas, debido a la corta vida media de la misma. La administración de ketamina limitada al período intraoperatorio pudiera resultar insuficiente para el control del dolor durante un proceso inflamatorio prolongado, como lo sugieren los requerimientos de morfina en el grupo INTRA para grados de dolor postoperatorio similares. El óxido nitroso usado en nuestro régimen de anestesia pudiera resultar en un factor de confusión. Este puede elevar la inhibición del receptor de NMDA producido por la ketamina pues se reporta que el óxido nitroso tiene propiedades de antagonismo de NMDA.28 En adición a la inhibición de la sensibilización de las vías nociceptivas, la prevención de la activación de sistemas prononiceptivos relacionados con opiodes y la tolerancia a opiodes pueden ser otros mecanismos de prevención del dolor ejercido por la ketamina.21 Sin embargo, la exploración de estos efectos no eran objetivos en nuestro estudio.
Esta investigación no fue diseñada para evaluar un posible efecto "preemptive" analgésico de la ketamina motivo por el cual el bolo de ketamina fue administrado al mismo tiempo (antes de la incisión) en dos grupos. Estudios anteriores han comparado la administración pre- y postincisional de ketamina para investigar este efecto de "preemptive"analgesia, pero la mayo ría han fallado en demostrar alguna diferencia significativa en el efecto ahorrador de morfina.23,29-31 McCartney et al. sugirieron que el término "analgesia preventiva" proporciona un concepto mucho más amplio, clínicamente relevante, en el cual la administración de una droga en cualquier momento del período perioperatorio y la presunta reducción asociada con la sensibilización central pudiera reducir el dolor, consumo analgésico o ambas, más allá de la actividad enmarcada de la droga.32
Se concluye que este estudio logra demostrar el valor de la administración de la ketamina durante las primeras 48 horas postoperatorias en combinación con la morfina para el control del dolor postoperatorio después de la cirugía abdominal mayor. La disminución del consumo de morfina fue asociada con una reducción de sus efectos adversos a la vez que bajas dosis de ketamina no estuvo asociada con algún efecto psicomimético. Los efectos a largo plazo en el dolor postoperatorio restan por ser evaluados.
REFERENCIAS BIBLIOGRÁFICAS
1. Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C,Alfonsi P, Fletcher D, Chauvin M. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology 2000;93:409-17.
2. Hansen EG, Duedahl TH, Romsing J, Hilsted KL, Dahl JB.Intra-operative remifentanil might influence pain levels in the immediate post-operative period after major abdominal surgery. Acta Anaesthesiol Scand 2005;49:1464-70.
3. Dickenson AH. Spinal cord pharmacology of pain. Br J Anaesth 1995;75:193-200.
4. Petrenko AB, Yamakura T, Baba H, Shimoji K. The role of N-methyl-d-aspartate (NMDA) receptors in pain: a review.Anesth Analg 2003;97:1108-16.
5. Woolf CJ, Chong MS. Preemptive analgesia_treating postoperative pain by preventing the establishment of central sensitization.Anesth Analg 1993;77:362-79.
6. Bell RF, Dahl JB, Moore RA, Kalso E. Peri-operative ketamina for acute post-operative pain: a quantitative and qualitative systematic review (Cochrane review). Acta Anaesthesiol Scand 2005;49:1405-28.
7. Bilgin H, Ozcan B, Bilgin T, Kerimoglu B, Uckunkaya N, Toker A, Alev T, Osma S. The influence of timing of systemic ketamine administration on postoperative morphine consumption. J Clin Anesth 2005;17:592-7.
8. Elia N, Tramer MR. Ketamine and postoperative pain_a quantitative systematic review of randomised trials. Pain 2005;113:61-70.
9. Schmid RL, Sandler AN, Katz J. Use and efficacy of low-dose ketamine in the management of acute postoperative pain: a review of current techniques and outcomes. Pain 1999;82:111-25.
10. De Kock M, Lavand'homme P, Waterloos H. `Balanced analgesia' in the perioperative period: is there a place for ketamine? Pain 2001;92:373-80.
11. Snijdelaar DG, Cornelisse HB, Schmid RL, Katz J. A randomised, controlled study of peri-operative low dose s(+)-ketamine in combination with postoperative patient-controlled s(+)-ketamine and morphine after radical prostatectomy. Anaesthesia 2004;59:222-8.
12. Webb AR, Skinner BS, Leong S, Kolawole H, Crofts T, Taverner M, Burn SJ. The addition of a small-dose ketamine infusion to tramadol for postoperative analgesia: a double-blinded, placebo-controlled, randomized trial after abdominal surgery. Anesth Analg 2007;104:912-7.
13. Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. Cochrane Database Syst Rev 2006:CD004603
14. Culebras X, Corpataux JB, Gaggero G, Tramer MR. The antiemetic efficacy of droperidol added to morphine patient controlled analgesia: a randomized, controlled multicenter dose-finding study. Anesth Analg 2003;97:816-21.
15. Clements JA, Nimmo WS. Pharmacokinetics and analgesic effect of ketamine in man. Br J Anaesth 1981;53:27-30.
16. Adriaenssens G, Vermeyen KM, Hoffmann VL, Mertens E, Adriaensen HF. Postoperative analgesia with i.v. patient controlled morphine: effect of adding ketamine. Br J Anaesth 1999;83:393-6.
17. Stubhaug A, Breivik H, Eide PK, Kreunen M, Foss A. Mapping of punctuate hyperalgesia around a surgical incision demonstrates that ketamine is a powerful suppressor of central sensitization to pain following surgery. Acta Anaesthesiol Scand 1997;41:1124-32.
18. Edwards ND, Fletcher A, Cole JR, Peacock JE. Combined infusions of morphine and ketamine for postoperative pain in elderly patients. Anaesthesia 1993;48:124-7.
19. Anand A, Charney DS, Oren DA, Berman RM, Hu XS, Cappiello A, Krystal JH. Attenuation of the neuropsychiatric effects of ketamine with lamotrigine: support for hyperglutamatergic effects of N-methyl-d-aspartate receptor antagonists. Arch Gen Psychiatry 2000;57:270-6.
20. Micallef J, Tardieu S, Gentile S, Fakra E, Jouve E, Sambuc R, Blin O. Effects of a subanaesthetic dose of ketamine on emotional and behavioral state in healthy subjects. Neurophysiol Clin 2003;33:138-47.
21. Himmelseher S, Durieux ME. Ketamine for perioperative pain management. Anesthesiology 2005;102:211-20.
22. Katz J, Cohen L, Schmid R, Chan VW, Wowk A. Postoperative morphine use and hyperalgesia are reduced by preoperative but not intraoperative epidural analgesia: implications for preemptive analgesia and the prevention of central sensitization. Anesthesiology 2003;98:1449-60.
23. Katz J, Schmid R, Snijdelaar DG, Coderre TJ, McCartney CJ, Wowk A. Pre-emptive analgesia using intravenous fentanyl plus low-dose ketamine for radical prostatectomy under general anesthesia does not produce short-term or long-term reductions in pain or analgesic use. Pain 2004;110:707-18.
24. Menigaux C, Fletcher D, Dupont X, Guignard B, Guirimand F, Chauvin M. The benefits of intraoperative small-dose ketamine on postoperative pain after anterior cruciate ligament repair.Anesth Analg 2000;90:129-35.
25. Roytblat L, Korotkoruchko A, Katz J, Glazer M, Greemberg L, Fisher A. Postoperative pain: the effect of low-dose ketamine in addition to general anesthesia. Anesth Analg 1993;77:1161-5.
26. Kissin I, Bright CA, Bradley EL Jr. The effect of ketamine on opioid-induced acute tolerance: can it explain reduction of opioid consumption with ketamine-opioid analgesic combinations? Anesth Analg 2000;91:1483-8.
27. Pogatzki-Zahn EM, Zahn PK, Brennan TJ. Postoperative pain_clinical implications of basic research. Best Pract Res Clin Anaesthesiol 2007;21:3-13.
28. Jevtovic-Todorovic V, Todorovic SM, Mennerick S, Powell S,Dikranian K, Benshoff N, Zorumski CF, Olney JW. Nitrous oxide (laughing gas) is an NMDA antagonist, neuroprotectant and neurotoxin. Nat Med 1998;4:460-3.
29. Adam F, Libier M, Oszustowicz T, Lefebvre D, Beal J, Meynadier J. Preoperative small-dose ketamine has no preemptive analgesic effect in patients undergoing total mastectomy. Anesth Analg 1999;89:444-7.
30. Hogan QH. No preemptive analgesia: is that so bad? Anesthesiology 2002;96:526-7.
31. Moiniche S, Kehlet H, Dahl JB. A qualitative and quantitative systematic review of preemptive analgesia for postoperative pain relief: the role of timing of analgesia. Anesthesiology 2002;96:725-41.
32. McCartney CJ, Sinha A, Katz J. A qualitative systematic review of the role of N-methyl-d-aspartate receptor antagonists in preventive analgesia. Anesth Analg 2004;98:1385-400.
Recibido: Febrero 10, 2013.
Aprobado: Marzo 15, 2013.
Dr. Zhachel Alejandro Redondo Gómez. Instituto Nacional de Oncología y Radiobiología. La Habana, Cuba. E-mail: zhachel@infomed.sld.cu