Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
MediSur v.8 n.1 Cienfuegos ene.-feb. 2010
Artículos Originales
Revista Científica de las Ciencias Médicas en Cienfuegos
Seguimiento evolutivo mediante estudio endoscópico-histológico e infección por Helicobacter pylori en pacientes con úlcera gástrica
Marcos Félix Osorio Pagola,1 Antonio Moré Pérez,2 Libán Álvarez Cáceres,3 Juan Luis de Pasos Carrazana,4 Anagalys Ortega Alvelay,5
Resumen
Fundamento: el seguimiento endoscópico evolutivo de la úlcera gástrica hasta su cicatrización es muy importante, debido a la posibilidad de neoproliferación. La infección crónica más frecuente en el mundo es la causada por Helicobacter pylori y se asocia a enfermedad gastroduodenal. Objetivo: determinar la evolución endoscópico-biópsica y precisar la frecuencia de infección por Helicobacter pylori en pacientes con úlcera gástrica. Métodos: estudio observacional, descriptivo y prospectivo realizado en el Hospital Universitario ?Arnaldo Milián Castro? que incluyó 96 pacientes con úlcera gástrica a los que se les diagnosticó mediante endoscopia y que cumplieron con los criterios de selección. Se practicó endoscopia y biopsia de mucosa gástrica para estudio histológico de las úlceras gástricas y diagnóstico de infección por Helicobacter pylori, mediante coloración de hematoxilina-eosina y de giemsa respectivamente. Resultados: se observó que 89 pacientes (92,7 %) lograron la cicatrización de la úlcera en los primeros tres meses de seguimiento. Hubo 5 pacientes con diagnóstico histológico de úlcera maligna (5,2 %). Se tomó como conducta la cirugía en los dos pacientes cuyas úlceras no curaron (2,1 %). El 67,7 % de los pacientes estaban infectados por la bacteria. Se evidenció una mayor frecuencia de pacientes infectados con H.pylori, con ulcus tanto benigno como maligno (93,8 % y 6,2 %) respectivamente. Conclusiones: la evolución de las úlceras benignas fue favorable, casi todas cicatrizaron durante tres meses de seguimiento. Cinco pacientes presentaron úlceras malignas, dos de ellos diagnosticados en la segunda endoscopia. Más de la mitad de los pacientes estaban infectados por Helicobacter pylori.
Palabras clave: Úlcera gástrica;helicobacter pilory;infecciones por helicobacter;enfermedades gastrointestinales;endoscopia gastrointestinal;
Summary
Follow up through Endoscopical ? Histological Studies and Helicobacter Pylori Infections in Patients Suffering from Gastric Ulcers
Background: Endoscopic follow up of gastric ulcers until healing has a great important due to the possibility of a new proliferation. The commonest chronic infection worldwide is caused by Helicobacter pylori and it is associated to gastro duodenal diseases. Objective: To determine the endoscopic-biopsic follow up and to set the frequency of infection due to Helicobacter pylori in those patients who suffer from gastric ulcers . Methods: observational, descriptive and prospective study carried out at the University Hospital ?Arnaldo Milián Castro?. It included 96 gastric ulcer sufferers diagnosed endoscopically and who fulfilled with the selection criteria. Endoscopy and biopsy of the gastric mucosa was done for the histological study of the gastric ulcers and for the diagnosis of infection due to Helicobacter pylori through hematoxiline-eosine and giemsa stains respectively. Results: 89 patients (92,7 %) healed their ulcers in the first three months of follow up and 5 patients underwent a histological diagnosis of malignant ulcers (5,2 %). Surgery was done on the two patients whose ulcers did not heal. (2,1 %). 67,7 % had been infected with the bacteria. There was a greater frequency of patients infected with Helicobacter pylori, either with benign or malignant ulcus (93,8 % y 6,2 %) respectively. Conclusions: the follow up of benign ulcers was good , almost all of them healed in a three-month follow up. 5 patients suffered from malignant ulcers, being 2 of them diagnosed in their second endoscopy. More than half of the patients were infected with Helicobacter pylori.
Key words: Stomach ulcer;helicobacter pilory;helicobacter infections;gastrointestinal diseases;endoscopy, gastrointestinal;
INTRODUCCIÓN
La úlcera gástrica (UG) era la forma más común de úlcera péptica en el siglo pasado. Sin embargo, en la actualidad su incidencia anual es muy inferior a la de la úlcera duodenal (UD), pues su frecuencia oscila entre 0,3 y 0,4 por cada 1 000 habitantes.(1)
El predominio de la úlcera péptica ha disminuido durante décadas como lo confirman varios estudios de series de casos en diferentes latitudes, lo que puede ser atribuido a la disminución de la infección por Hp.(2-4) Sin embargo, en China un reciente estudio muestra el incremento de la prevalencia con la edad, tanto de la úlcera gástrica como duodenal y de la prevalencia de estas enfermedades en pacientes infectados por Hp respecto a los no infectados por Hp.(5)
Hay que destacar que más del 90 % de pacientes con UD y entre 70 a 90 % de pacientes con UG alojan al Hp en el estómago. (6,7) Es un factor de riesgo mayor para el cáncer gástrico. (8-12) No todos los pacientes con infección por Hp desarrollan úlcera péptica y esta puede ser la consecuencia de una deficiencia en la producción endógena de secretina causada por el Hp. (13)
El comportamiento evolutivo de las UG hasta su cicatrización no ha sido motivo de estudio en el territorio central. Revisamos la publicación de un trabajo en nuestra provincia que aborda la infección por Hp en niños así como otro realizado en pacientes con úlcera gástrica donde se caracteriza la infección por Hp, (14) y queremos precisar dicha infección en pacientes de la provincia Villa Clara con ulcus gástrico. Todo lo anterior nos incentivó a la realización de este trabajo con el objetivo de determinar la evolución endoscópico-biópsica y precisar la frecuencia de infección por Helicobacter pylori en pacientes con úlcera gástrica.
MÉTODOS
Se realizó un estudio observacional, descriptivo y prospectivo tomándose como universo los pacientes a los que se les practicó estudio endoscópico superior en el Servicio de Gastroenterología del Hospital Provincial ?Arnaldo Milián Castro? de Villa Clara.
La muestra fue seleccionada después de aplicar los siguientes criterios para entrar en el estudio: úlcera gástrica única o múltiple de cualquier tamaño, UG diagnosticada endoscópicamente por primera vez, ausencia de complicaciones de la úlcera gástrica en el momento del diagnóstico, pacientes sin antecedentes de alergia a las drogas anti ulcerosas o que no referían enfermedad o condición que contraindicaran su uso, pacientes sin antecedentes de: gastrectomía tipo Billroth I, Billroth II, vaguectomía y piloroplastia, síndrome de Zollinger-Ellison, enfermedad de Crohn y de enfermedades crónicas que requieren tratamiento con antiinflamatorios no esteroideos; pacientes que recibieron tratamiento con antibióticos, drogas bloqueadoras de la bomba de protones (omeprazol, pantoprazol, lanzoprazol), antiinflamatorios no esteroideos, simeticona o citoprotectores del tipo bismuto en el último mes antes de la endoscopia.
Los pacientes que abandonaron el seguimiento endoscópico-biópsico quedaron excluidos del estudio, al no poderse concluir la evolución de sus lesiones ulcerosas.
Las variables estudiadas fueron: evolución endoscópica de la úlcera gástrica, diagnóstico histológico (benigno o maligno) de la úlcera gástrica y el diagnóstico de la infección por Helicobacter pylori.
Para el diagnóstico de las UG se utilizó un endoscopio OLIMPUS GIF XK-10, se tomaron biopsias (de 4 a 6 muestras) de los bordes de la úlcera, incluyendo el fondo, para determinar su carácter histológico (benigno o maligno) y dos muestras del antro y cuerpo para el diagnóstico del Helicobacter pylori.
Las muestras se procesaron en el departamento de Anatomía Patológica, se empleó la tinción de giemsa para el diagnóstico del Helicobacter pylori y la de hematoxilina y eosina para el diagnóstico histológico de la úlcera.
Una vez realizada la primera endoscopia diagnóstica, y en espera del resultado de las biopsias, a cada paciente se le impuso tratamiento anti ulceroso y posteriormente fue citado a consulta evolutiva donde se le indicó tratamiento frente al Helicobacter pylori, de ser necesario. La evolución endoscópica de las úlceras fue realizada a la cuarta semana de efectuada la endoscopia diagnóstica y cada cuatro a seis semanas hasta el tercer mes de evolución, se realizó un seguimiento estrecho de cada paciente por consulta mensual. Al diagnosticarse malignidad histológica o no existir evidencias de cicatrización del ulcus, el paciente fue remitido a consulta de Cirugía General y excluido del estudio.
La evolución endoscópica de las úlceras se clasificó en:
Cicatrización: desaparición completa del nicho ulceroso.
En vías de cicatrización: disminución del tamaño y profundidad del cráter en más de un 50 %
de sus dimensiones iniciales.
No cicatrización: disminución del tamaño y profundidad del cráter en menos de un 50 % del
tamaño inicial.
Se revisaron los informes de endoscopia y de biopsias para obtener el dato primario sin causar perjuicio a los pacientes y familiares pues las endoscopias del tracto digestivo superior y las biopsias se realizaron con el consentimiento de cada paciente.
Los resultados se presentan en tablas y gráficos con números absolutos y porcentajes.
RESULTADOS
Durante el período de estudio se realizaron 2299 gastroduodenoscopias, de las cuales 548 arrojaron el diagnóstico de úlceras gastroduodenales (23,83 %). Fueron diagnosticadas un total de 407 UD y 141 UG, lo que representa un índice de 17,7 % y 6,1 % respectivamente.
Cumplieron los criterios de selección 96 pacientes de 30 y más años de edad, 23 del sexo femenino y 73 del masculino, con un promedio de edad de 58,6 años.
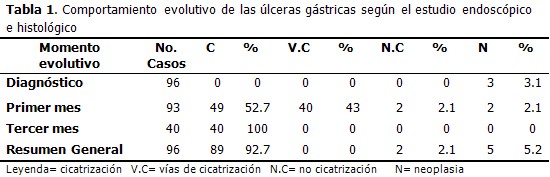
Del total de 96 pacientes con criterios de inclusión en el estudio, 3 tenían el diagnóstico histológico de úlcera gástrica maligna en el momento inicial, por lo que al primer mes se mantenían en el estudio 93 casos con diagnóstico de benignidad; 49 de los cuales (52,7 %), tenían su úlcera curada. En los próximos dos meses 40 pacientes más curaron sus lesiones, por lo que en 89 pacientes (92,7 %), se logró la cicatrización en los primeros tres meses de seguimiento. En la segunda endoscopia fueron diagnosticadas como malignas las úlceras de dos pacientes más, para un total de 5 pacientes con diagnóstico histológico de UG maligna (5,2 %).
Se tomó conducta quirúrgica con las dos únicas úlceras que no curaron (2,1 %), cuatro semanas después de su diagnóstico, una vez conocido el resultado de la endoscopia y biopsia evolutivas, pues, además de no cicatrizar, presentaban alteraciones histológicas: uno atipia con células en anillo de sello en el borde de la úlcera y no en profundidad, lo que bien pudiera tratarse de un cáncer en su estadio inicial, y el otro displasia severa e hiperplasia linfoide. (Tabla 1)
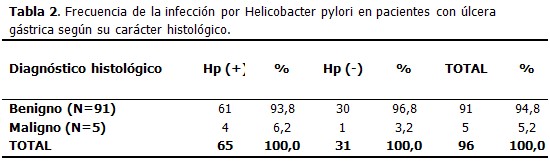
En el momento del diagnóstico de las ulceraciones 65 pacientes (67,7 %) estaban infectados por Helicobacter pylori y 31 (32,3 %) no presentaban la infección.
Se evidenció una mayor frecuencia de UG-Hp positivas tanto benignas como malignas (93,8 % y 6,2 %) respectivamente. Es de resaltar la alta frecuencia de infección por esta bacteria en los pacientes con diagnóstico de malignidad; sólo una úlcera maligna (3,2 %) fue Hp negativa. (Tabla 2)
DISCUSIÓN
Los resultados de este estudio relacionados con un 92,7 % de cicatrización de las UG a los tres meses están en concordancia con los citados por Hirschiwitz y otros (15) al referirse a varios estudios controlados donde la curación de la UG, a los tres meses, fue del 88 al 90 %. Otros autores ejemplifican el rango en que puede variar la cicatrización de estas lesiones partiendo de sus experiencias. Okada y otros (16) obtuvieron 30,4 % en cuatro semanas y 87 % en ocho semanas de seguimiento. Por su parte Takemoto y otros (17) al realizar el seguimiento de pacientes con úlceras gástricas gigantes reportaron en cuatro semanas 16,7 % y en 12 semanas 87,5 % de cicatrización. En este sentido Meining y otros (18) obtuvieron 92,8 % de cicatrización, cifra similar a los resultados de esta investigación, pero en un tiempo de evolución inferior (ocho semanas). Moreto y otros (19) reflejaron 78 % durante un período de seguimiento de seis meses.
El seguimiento por endoscopia y biopsia de las úlceras del estómago es de vital importancia para definir su posible carácter histológico. Tal es así, que de los 5 pacientes con UG maligna en el presente estudio, dos necesitaron una segunda endoscopia un mes después de habérseles diagnosticado la úlcera por esa misma vía. Esto no constituyó una sorpresa y se explica por la cantidad de muestras tomadas de las úlceras durante cada estudio endoscópico (cuatro a seis), lo que puede provocar que áreas donde se encuentre la neoplasia queden sin ser analizadas por la biopsia y tengan que detectarse en un estudio posterior. Varas Lorenzo (20) obtuvo 2,8 % de pacientes con adenocarcinoma gástrico diagnosticado después de una segunda endoscopia. Moreto y otros (19) obtuvieron 4,5 % de pacientes con cáncer gástrico seis meses después de realizado el diagnóstico, en seis de estos persistía la úlcera, mientras que Ramírez Ramos y otros (21) gracias a esta conducta encontraron 7,07 % de adenocarcinomas.
Todos estos hallazgos refuerzan la idea de que el paciente con UG debe mantenerse en estrecho contacto con el gastroenterólogo, y que el seguimiento endoscópico biópsico es vital. (21)
A pesar de que el Hp fue descubierto hace más de 25 años y que el Premio Nóbel en Medicina y Fisiología fuera entregado a sus descubridores, la infección es aún un reto para médicos e investigadores.(22-24)
La infección por Hp de 67,7 % de los pacientes estudiados muestra la distribución que ha alcanzado esta bacteria en la población y se aproxima a la estimada en relación con la UG entre 70-90 %.(6,7) En tres trabajos realizados, uno en Cienfuegos, (14) otro en Perú (25) y uno en el Instituto de Gastroenterología de nuestro país el resultado obtenido fue inferior. (26)
El método empleado para el diagnóstico de la bacteria puede marcar la diferencia en los resultados obtenidos en las diferentes investigaciones. En este sentido se reportan cifras variables de infección en individuos con UG que oscilan en el rango de 35 % en un estudio de 26 casos, (27) a 95 % en un estudio de 27 casos. (28) En el estudio realizado en Santo Domingo (29) se empleó el método serológico y en los pacientes con UG la prevalencia asciende hasta un 92,8 %. Por ello la diferencia entre los resultados de este estudio y el rango variable con que se presenta la infección por Hp puede tener explicación en las características demográficas y socioculturales de la muestra de cada autor, las que corresponden a distintas poblaciones, así como a que no se empleó siempre el mismo método para diagnosticar la infección.
En Perú (25) se realiza un trabajo donde se obtiene 55,4 % de infección por Hp en pacientes con UG, resultado inferior al nuestro. En dos estudios desarrollados en el Instituto de Gastroenterología de la Habana (IG) se obtiene 91 % de pacientes con UG infectados por la bacteria, porcentaje elevado (26), y en el otro con un diseño retrospectivo, como el presente, los pacientes con UG mostraron 39,2 % de infección por Hp (30), resultado que lo asemeja al observado en países desarrollados, el único método diagnóstico empleado fue el histológico pero utilizando la tinción de hematoxilina y eosina que tiene una sensibilidad y especificidad inferior a la de giemsa.
Está bien establecido que la infección persistente por el Helicobacter pylori está asociada con un riesgo aumentado para las malignidades gástricas. (31)
La infección por la bacteria en pacientes con UG malignas obtenida en este trabajo fue de 6,2 %. Un similar resultado se reporta en otros estudios (30,32), mientras que en una investigación realizada por de la Vega y otros (33) dicha frecuencia fue superior, al llegar a un 11,8 %. Sin embargo, un estudio en la India no demostró que la frecuencia de infección por Hp empleando la endoscopia y las pruebas serológicas fuera superior entre los pacientes con neoplasia gástrica maligna comparado con el grupo control. (34)
Aproximadamente un 15 % de las neoplasias malignas a nivel mundial se atribuye a infecciones crónicas. Otros tumores son iniciados por inflamación crónica de origen no infeccioso. (35)
La colonización de la mucosa gástrica con el Hp, invariablemente produce el desarrollo de gastritis crónica, y para un subconjunto de pacientes, progresión de gastritis crónica a úlceras o al cáncer. (36) El Hp juega un importante papel en la carcinogénesis por el desarrollo y la progresión de células cancerosas en múltiples pasos. (37) La metaplasia intestinal a nivel del estómago que está asociada a Hp ha sido considerada una condición premaligna en humanos. (38)
El Hp se ha asociado con el aumento del riesgo de cáncer no cardial. (35,39-41) En los últimos 30 años, en Europa, ha existido un cambio en la distribución de cánceres gástricos, con un aumento en la incidencia de tumores cerca de la unión gastroesofágica y una disminución en la incidencia del cáncer antral. (42)
No está aclarado por qué del 1 % a 3 % de la población infectada desarrolla a lo largo de décadas un cáncer gástrico distal. (35) Otros plantean que menos del 1 % de todos los sujetos infectados llega a desarrollar cáncer gástrico y estos pacientes, incluso cuando son Hp-negativos en el momento del estudio diagnóstico, se pueden haber infectado por esta bacteria antes del ataque de la enfermedad, lo que puede ser confirmado por seropositividad de CagA y de VacA.(43)
La utilidad de la erradicación del Hp con vistas a prevenir el CG es motivo de controversia entre los científicos. Dos estudios en China sí lo consideran, país donde el CG ocupa la segunda causa más común de cáncer. (44,45)
Se puede plantear que en este estudio la evolución de las úlceras benignas fue favorable, casi todas cicatrizaron durante tres meses de seguimiento. Cinco pacientes presentaron úlceras malignas, dos de ellos diagnosticados en la segunda endoscopia. Más de la mitad de los pacientes estaban infectados por Helicobacter pylori.
Referencias bibliográficas
1. Sáinz Samitier R, Mearín Manrique F, Piqué Badia JM, Saperas Franch E, Lanas Arbeola A, Borda Celaya F. Enfermedades del estómago y del duodeno. En: Farreras R. Tratado de Medicina Interna. 14a ed. Madrid: Harcourt; 2000.
2. Smith BR, Stabile BE. Emerging trends in peptic ulcer disease and damage control surgery in the H. pylori era. Am Surg. 2005; 71(9):797-801.
3. Nervi G, Liatopoulou S, Cavallaro LG, Gnocchi A, Dal Bó N, Rugge M, et al. Does Helicobacter pylori infection eradication modify peptic ulcer prevalence? A 10 years? endoscopical survey. World J Gastroenterol. 2006; 12(6):2398-401.
4. Gisbert JP. Ulcera péptica, epidemiología, patogenia, diagnóstico y conceptos generales sobre tratamiento. Medicine. 2004; 9(2):64-74.
5. Wu HC, Tuo BG, Wu WM, Gao Y, Xu QQ, Zhao K. Prevalence of Peptic Ulcer in Dyspeptic Patients and the Influence of Age, Sex, and Helicobacter pylori Infection. Dig Dis Sci. 2008; 53(10):2650-56.
6. Bahmanyar S, Zendehdel K, Nyrén O, Ye W. Risk of oesophageal cancer by histology among patients hospitalized for gastroduodenal ulcers. Gut. 2007; 56(4):464-8.
7. Williams JG, Roberts SE, Ali MF, Cheung WY, Cohen DR, Demery G, et al. Gastroenterology services in the UK. The burden of disease, and the organization and delivery of services for gastrointestinal and liver disorders: a review of the evidence. Gut. 2007; 56:1-113.
8. Das JC, Paul N. Epidemiology and pathophysiology of Helicobacter pylori infection in children. Indian J Pediatr. 2007; 74(3):287-90.
9. Crew KD, Neugut AI. Epidemiology of gastric cancer. World J GastroenteroL. 2006; 12(3):354-62.
10. O?Br?en SJ, Halder SLS. GI epidemiology:infection epidemiology and acute gastrointestinal infections. Aliment Pharmacol Ther. 2007; 25(6):669-74.
11. Malaty HM. Epidemiology of Helicobacter pylori infection. Best Pract Res Clin Gastroenterol. 2007; 21:205-14.
12. Suzuki H, Hibi T, Marshall BJ. Helicobacter pylori: present status and future prospects in Japan. J Gastroenterol. 2007; 42(1):1-15.
13. Love JW. Peptic ulceration may be a hormonal deficiency disease. Med Hypotheses. 2008; 70(6):1103-7.
14. Osorio Pagola M, Olivert Cruz M, de Pasos Carrazana JL, Quiñones Ceballos A, Vega Galindo M, Ortega Alvelay A. Caracterización de la infección por Helicobacter pylori en pacientes con úlcera gástrica. MediSur [revista en la Internet]. 2009[ cited 2 Feb 2010]; 7(6): [aprox. 9p]. Avaidable from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1727-897X2009000600002&lng=es.
15. Hirschiwitz BI, De Luca V, Graham D, Lober S, Bright-Asare P, Katon R. Treatment of benign chronic gastric ulcer with ranitidine. J Clin Gastroenterol . 1986; 8(3 Pt 2):371-6.
16. Okada M, Yao T, Okada Y, Sakamoto K, Date H, Fuchigami T. Cimetidine vs a combination of antiacid and anticholinergic for hospitalized patients with gastric ulcer. J Gastroenterol(Japón). 1985; 20(1):1-5.
17. Takemoto T, Sakaki N, Tsuneoka K, Namiki M, Ishikawa M, Oshiba S. Clinical usefulness of Ranitidine in giant gastric ulcer. J Clin Gastroenterol. 1984; 6(5):413-7.
18. Meining A, Hochter W,Weingart J, Summer A, Klanin H, Simon T, et. al. Double-blind trial of Omeprazole and Amoxicillin in the cure of helicobacter pylori infection in gastric ulcer patients. Scand J Gastroenterol. 1998; 33(1):49-54.
19. Moreto M, Barturen A, Zaballa M, Tánago JG, Usobiaga J, Ibañes S, et al. Valor del seguimiento endoscópico de las úlceras gástricas en el despistage del cáncer de estómago. Gastroenterol Hepatol. 1984; 7:548-59.
20. Varas Lorenzo MJ. Una aproximación a la historia natural de la úlcera gástrica crónica. Rev Esp Enf Ap Dig. 1987; 72(6):687-94.
21. Ramírez Ramos A, Galarza Cotera J, Makino Makino R,Cueto Duthurburu A, Valladares Alvarez G. Control endoscópico de úlceras gástricas pépticas crónicas. GEN . 1997; 32(1):103.
22. Talley NJ, Richter J. Nobel Prize in Medicine awarded to a gastroenterologist in 2005. Am J Gastroenterol. 2006; 101(2):211.
23. Mégraud F. A humble bacterium sweeps this year?s Nobel Prize. Cell. 2005; 123(6):975-6.
24. Zetterstrõm R. The Nobel Prize in 2005 for the discovery of Helicobacter pylori: implications for child health. Acta Paediatr. 2006; 95:3-5.
25. Montes Teves P, Salazar Ventura S, Monge Salgado E. Epidemiological changes in peptic ulcer and their relation with Helicobacter pylori. Hospital Daniel A Carrion 2000-2005. Rev Gastroenterol Peru. 2007; 27(4):382-8.
26. González-Carbajal Pascual M, Sevilla Mederos LF, Grá Oramas B. Alteraciones histológicas de la mucosa gástrica y prevalencia del Helicobacter pylori en pacientes dispépticos. Rev Panam Infectol. 2004; 7(1):8-15.
27. Goodwin CS, Blincow Ed, Warren JE, Waters TE, Sanderson CR, Easton L. Evaluation of cultures techniques for isolating Campylobacter pyloridis from endoscopic biopsies of gastric mucosa. J Clin Pathol. 1985; 38(10):1127-31.
28. Tytgat EAJ. Campylobacter pyloridis. The Amsterdam study. Dig Dis Sci. 1986; 31(Suppl):129.
29. Gutiérrez B, Vidal T, Valmaña C, Camou C. Infección por Helicobacter pylori en Santo Domingo, República Dominicana. Rev Cubana Invest Biomed [revista en Internet]. 2006[ cited 12 Sep 2009]; 25(4): [aprox. 7p]. Avaidable from: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-03002006000400002&lng=es&nrm=iso&tlng=es .
30. González-Carbajal Pascual M, Rojas Zurita F, Grá Oramas B, Ávalos García R. Prevalencia de la infección por Helicobacter pylori en pacientes dispépticos. Rev Panam Infectol. 2004; 6(4):8-14.
31. Fischbach W, Chan AOO, Chun-Yu Wong B. Helicobacter pylori and Gastric Malignancy. Helicobacter. 2005; 10(1):34-9.
32. Piñol Jiménez F, Salvador Prato JC, Paniagua Estévez M, Borbolla E. Características de la infección por Helicobacter pylori en pacientes con adenocarcinoma gástrico. Rev Cuban Med. 2005; 44:5-6.
33. de la Vega RB, de la Vega RB, González WJ, Stupka SE. Relación entre neoplasia gástrica maligna, Helicobacter pylori y otros factores asociados. Rev Posg VIa Cát Med. 2006; 162:8-10.
34. Ghoshal UC, Tiwari S, Dhingra S, Pandey R, Ghoshal U, Tripathi S, et al. Frequency of Helicobacter pylori and CagA antibody in patients with gastric neoplasm and Controls: the Indian enigma. Dig Dis Sci. 2008; 53(5):1215-22.
35. Aravena E. Helicobacter pylori y cáncer gástrico. Gastr Latinoam. 2007; 18(2):129-132.
36. Malfertheiner P, Sipponen P, Naumann M, Moayyedi P, Megraud F, Xiao SD, et al. Helicobacter pylori eradication has the potential to prevent gastric cancer: a state of the art critique. Am J Gastroenterol. 2005; 100(9):2100-15.
37. Graham DY, Malfertheiner P, Mégraud F, Michetti P, Sipponen P. On behalf of the European Helicobacter Study Group. The year in Helicobacter. Helicobacter. 2006; 11(Suppl 1):1-20.
38. Elfvin A, Bolin I, Von Bothmer C, Stolte M, Watanabe H, Fandriks L, et al. Helicobacter pylori induces gastritis and intestinal metaplasia but no gastric adenocarcinoma in Mongolian gerbils. Scand J Gastroenterol. 2005; 40(11):1313-20.
39. Hansen S, Vollset SE, Derakhshan MH, Fyfe V, Melby KK, Aase S, et al. Two distinct aetiologies of cardia cancer; evidence from premorbid serological markers of gastric atrophy and Helicobacter pylori status. Gut. 2007; 56(7):918-25.
40. Kamangar F, Dawsey SM, Blaser MJ, Perez-Perez GI, Pietinen P, Newschaffer CJ, et al. Opposing risks of gastric cardia and noncardia gastric adenocarcinoma associated with Helicobacter pylori seropositivity. J Natl Cancer Inst. 2006; 98(20):1445-52.
41. Brenner H, Arndt V, Stegmaier C, Ziegler H, Rothenbacher D. Is Helicobacter pylori infection a necessary condition for noncardia gastric cancer?. Am J Epidemiol. 2004; 159:252-8.
42. Keighley MR. Gastrointestinal cancers in Europe. Aliment Pharmacol Ther. 2003; 18(Suppl 3):7-30.
43. Suriani R, Colozza M, Cardesi E, Mazzucco D, Marino M, Grosso S, et al. CagA and VacA Helicobacter pylori antibodies in gastric cancer. Can J Gastroenterol. 2008; 22(3):255-8.
44. Yang L. Incidence and mortality of gastric cancer in China. World J Gastroenterol. 2006; 12(1):17-20.
45. Cheung TK, Wong BCY. Treatment of Helicobacter pylori and prevention of gastric cancer. Dig Dis. 2008; 9(1):8-13.
Recibido: 21 de septiembre de 2009. Aprobado: 17 de febrero de 2010.
Seguimiento evolutivo mediante estudio endoscópico-histológico e infección por Helicobacter pylori en pacientes con úlcera gástrica. Facultad de Ciencias Medicas Cienfuegos. Calle 51A y Avenida 5 de Septiembre. Cienfuegos, Cuba. CP 55100. Email: marcos.osorio@gal.sld.cu
1Especialista de I Grado en Gastroenterología. Especialista de I Grado en Medicina General Integral. Profesor Asistente. Hospital General Universitario "Dr. Gustavo Aldereguía Lima". Cienfuegos.
2Especialista de II Grado en Gastroenterología. Profesor Asistente. Hospital Provincial Universitario "Arnaldo Milián Castro". Villa Clara.
3Especialista de I Grado en Gastroenterología. Especialista de I Grado en Medicina General Integral. Profesor Instructor. Hospital General Universitario "Dr. Gustavo Aldereguía Lima". Cienfuegos.
4Especialista de I Grado en Medicina Interna. Especialista de I Grado en Medicina General Integral. Profesor Instructor. Hospital General Universitario "Dr. Gustavo Aldereguía Lima" Cienfuegos.
5Especialista de I Grado en Medicina General Integral. Policlínico Área II. Cienfuegos.