Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.9 no.3 Cienfuegos mayo-jun. 2011
ARTÍCULO ESPECIAL
Protocolo para la alimentación- nutrición en la atención integral al paciente con enfermedad de Parkinson
Nutrition Protocol in General Care for Patients with Parkinson Disease
Ligia Maria Marcos PlasenciaI , Arnoldo Padrón SánchezII
I Instituto de Neurología y Neurocirugía, Ciudad de La Habana, La Habana, Cuba
II Centro Internacional de Restauración Neurológica, Ciudad de La Habana, La Habana, Cuba
RESUMEN
La Enfermedad de Parkinson (EP) es un proceso neurodegenerativo de presentación esporádica. Fue descrita por James Parkinson en 1817. De causa multifactorial, siendo los principales factores etiológicos de naturaleza genética y ambiental. Hasta el momento sólo se dispone de "tratamiento paliativo" mediante medicamentos como la levodopa, la cual restaura los niveles de dopamina cerebral y pueden mejorar los síntomas por un tiempo. Como factores responsables directos de la pobre calidad de vida de los pacientes parkinsonianos están los síntomas no motores, variados, frecuentes y de impacto infravalorado. Los enfermos son propensas a la pérdida de peso y la desnutrición. Los movimientos involuntarios resultan en un gasto de energía creciente y los síntomas de la enfermedad como los efectos secundarios del tratamiento pueden limitar el consumo de alimentos. Es necesaria una atención integral para minimizar sus limitaciones y mejorar así su calidad de vida y la de su familia. Dentro de una atención integral, el aspecto de la alimentación-nutrición es cardinal por lo que se ofrece aquí un protocolo de trabajo para la intervención nutricional al enfermo de Parkinson
Palabras clave: nutrición en salud pública, enfermedad de Parkinson, atención integral de salud, dietoterapia, necesidades nutricionales, nutrición de grupos vulnerables.
ABSTRACT
The Illness of Parkinson (EP) is a process neurodegenerativo of sporadic presentation. It was described by James Parkinson in 1817. Of cause multifactorial, being the main factors etiológicos of genetic and environmental nature. Until the moment he/she only has palliative" "treatment by means of medications like the levodopa, which restores the levels of cerebral dopamina and they can improve the symptoms for a while. The symptoms non motors are as responsible direct factors of the poor quality of life of the patient parkinsonianos, varied, frequent and of undervalued impact. The sick persons are prone to the loss of weight and the malnutrition. The involuntary movements are in an expense of growing energy and the symptoms of the illness like the secondary effects of the treatment can limit the consumption of foods. It is necessary an integral attention to minimize their limitations and to improve this way their quality of life and that of their family. Inside an integral attention, the aspect of the feeding-nutrition is cardinal for what offers a work protocol here for the nutritional intervention to the sick person of Parkinson.?
Key words: nutrition, public health, Parkinson disease, comprehensive health care, risk groups nutrition, nuritional requeriments.
Colaboradores
Lic. Marta Gorris González - CIREN
Lic. Marta Beatriz Pérez Santana - INN
Dra. Ivón Pedroso Ibáñez - CIREN
Dr. Mario Álvarez Sánchez - CIREN
Dr. Lázaro Álvarez González - CIREN
Dr. Enrique Michel Esteban Hernández - INN
Lic. Deimy Reconde Suárez - CIREN
Lic. Yolanda Aguilera Martínez - INN
Lic. Maribel Caballero Riverí - INN
Dra. Gloria Lara Fernández - INN
Dr. Alexis Soto Lavastida - INN
Dra. Yamilet M López Pérez- INN
Dedicatoria:
Para los enfermos de Parkinson:
-Joven aún me miro en ti y adivino tu pensamiento joven también, pero preso en la celda de la desolación, atado por la incomunicación, cuando aún podías dar al futuro tus brillantes ideas, llenas de experiencia y sabiduría.
A la memoria:
-del profesor John Gay
Lo conocí próximo al declive de su existencia pero a tiempo de ver la brillantez de su inteligencia y la bondad de su corazón.
Ligia
INTRODUCCIÓN
La enfermedad de Parkinson (EP) es un trastorno neurodegenerativo, crónico y lentamente progresivo del Sistema Nervioso Central (SNC), caracterizado desde el punto de vista clínico por trastornos motores como disminución y lentitud de los movimientos, rigidez muscular, temblor en reposo e inestabilidad postural, además de trastornos neurovegetativos. Los síntomas motores comienzan con temblores y pueden llegar a provocar parálisis corporal. (1) En la enfermedad de Parkinson primaria existe una pérdida de neuronas pigmentadas de la sustancia negra, el locus coeruleus y otros grupos celulares dopaminérgicos del mesencéfalo cerebral que se traduce en la sintomatología motora típica de la enfermedad. Se plantea la necesidad de avanzar en la creación de marcadores de detección precoz para la enfermedad puesto que "en el momento del diagnóstico clínico, el paciente ya ha perdido una gran parte de esas neuronas." (1) De igual forma es necesario el apoyo con una atención integral al paciente para hacer más llevaderas sus limitaciones y mejorar así su calidad de vida y la de su familia. Como factores responsables directos de la pobre calidad de vida de los pacientes parkinsonianos están los síntomas no motores, que son variados, frecuentes y cuyo impacto está, en general, infravalorado y buena parte de su tratamiento es empírico. La ciencia de la nutrición trata de la naturaleza y la distribución de los nutrimentos en los alimentos, de sus efectos (metabólicos) en un sistema vivo y de las consecuencias de la ingesta (insuficiente o en exceso) de alimentos. La nutrición influye sobre la práctica clínica en todas las ramas de la medicina y es importante en todas las etapas de la vida. La nutrición clínica es la aplicación de los principios de la ciencia de la nutrición en la práctica médica, tanto para el diagnóstico, tratamiento como la prevención de la enfermedad humana causada por deficiencia, exceso o desequilibrio metabólico de los nutrimentos. Los nutriólogos, nutricionistas y dietistas tienen un papel principal en ayudar a pacientes con EP para optimizar su estado nutricional y mitigar los síntomas relacionados con la alimentación y los efectos secundarios del tratamiento. Para asumir este papel, se debe tener conocimientos sobre la EP y sus consecuencias nutricionales, así como sobre las estrategias para tratar los síntomas que afectan el fenómeno de alimentación y nutrición.
La EP es el síndrome parkinsoniano más común. Es más frecuente en varones, con una edad media de comienzo de 55 años y afecta alrededor del 1% de las personas mayores de 65 años y al 0,4 % de los mayores de 40 años. Puede iniciarse en la infancia o la adolescencia (parkinsonismo juvenil). (1) Es la segunda enfermedad neurodegenerativa más frecuente, después del Alzheimer.
Su etiología es desconocida, pero se han implicado diferentes factores como causantes, entre ellos se citan: (2)
Hasta el momento sólo se dispone de un "tratamiento paliativo" mediante medicamentos como la levodopa, la cual restaura los niveles de dopamina cerebral y puede mejorar los síntomas por un tiempo, pero no detiene la muerte progresiva de estas neuronas, por lo que la enfermedad es incurable en la actualidad.
Dentro de una atención integral, el aspecto de la alimentación-nutrición es cardinal. La nutrición está comprometida en muchas enfermedades neurológicas, a veces con efectos graves para su pronóstico y curación.
El estado nutricional de un individuo vivo es el estado fisiopatológico resultante de la disponibilidad y utilización de energía y nutrimentos a nivel celular. Está condicionado por un balance entre el ingreso y el gasto. (3-5) La evaluación del estado nutricional es un ejercicio clínico, que se basa en la medición o exploración de indicadores alimentarios-nutricionales-metabólicos relacionados con el estado de salud, para identificar la posible ocurrencia, naturaleza y extensión de las alteraciones del estado nutricional, las cuales pueden ir de la deficiencia o carencia, a los excesos o toxicidad. (4,5)
Las personas con EP son particularmente propensas a la pérdida de peso y a la desnutrición. Los movimientos involuntarios relacionados con la enfermedad provocan un gasto de energía creciente, por otra parte, tanto sus síntomas como los efectos secundarios del tratamiento pueden limitar el consumo de alimentos. Además, los pacientes con la enfermedad pueden correr el riego de seguir terapias nutricionales poco convencionales, que exacerban la desnutrición. (6)
En muchos centros asistenciales en el mundo existen los grupos de apoyo nutricional (GAN) que se encargan de abordar los aspectos relacionados con el fenómeno de alimentación, nutrición y metabolismo en las distintas enfermedades que padece el humano, e interactuar con el resto de las disciplinas clínico-quirúrgicas para lograr una atención integral del paciente. (7,8) Por tanto, los trastornos relacionados con la alimentación-nutrición de pacientes con EP deben ser abordados por el GAN en interacción con el resto de las disciplinas médicas-quirúrgicas que deben integrar el equipo multidisciplinario de atención a esta enfermedad.
ASPECTOS TEÓRICOS
Cuadro clínico de la EP El trastorno comienza de forma insidiosa (en 50 a 80 % de los pacientes), con temblor en reposo, de frecuencia de 4 a 8 Hz, generalmente en una mano y en forma de "rodar píldoras". El temblor es máximo en reposo, disminuye con el movimiento y desaparece con el sueño; se intensifica con la tensión emocional o la fatiga. Generalmente afecta más las manos y le siguen en orden los brazos y las piernas. En muchos pacientes sólo existe rigidez y el temblor está ausente. Es siempre progresiva. Los movimientos se hacen lentos (bradicinesia), disminuyen (hipocinesia) y se inician con dificultad (acinesia). La rigidez y la hipocinesia pueden contribuir a los dolores musculares y la sensación de fatiga. (9) Síntomas gastrointestinales La relación entre disfagia y duración de la enfermedad es controvertida. El hecho de que la levodopa sólo mejore el síntoma en un subgrupo de enfermos, también cuestiona su relación con la gravedad de la enfermedad y con el déficit dopaminérgico. La disfagia está asociada con un incremento de la morbimortalidad relacionada con la EP y es causa de aislamiento social. Es imperioso adecuar a la realidad del paciente, lo que debe comer y en qué momento hacerlo, para disminuir las consecuencias de este problema. Pérdida de peso Anatomopatología
También pueden estar afectados la mandíbula, la lengua, la frente y los párpados. Nunca se afecta la voz, aunque el habla se hace hipofónica, con una disartria característica, monótona y dificultosa. La cara se hace inexpresiva (facies en máscara) con la boca abierta y disminución del parpadeo, por lo que puede confundirse con la depresión. (10)
La postura se vuelve inclinada y el paciente presenta dificultad para empezar a caminar; la marcha se hace con pasos cortos y arrastrando los pies, los brazos se mantienen flexionados a la altura de la cintura y no se balancean con cada paso. Los pasos pueden hacerse rápidos de forma repentina y el paciente puede empezar una "carrera" para evitar caerse (festinación). La tendencia a caer hacia delante (propulsión) o hacia atrás (retropulsión) cuando se desplaza el centro de gravedad, se produce por la pérdida de los reflejos posturales. En la exploración se detecta rigidez plástica mantenida "en tubería de plomo", con el movimiento pasivo de los miembros; el temblor sobreañadido puede dar a la rigidez un carácter "en rueda dentada". La fuerza muscular suele ser normal aunque la capacidad para realizar movimientos rápidos sucesivos suele estar afectada. Los reflejos se mantienen normales, pero en ocasiones difíciles de obtener si es marcado el temblor o la rigidez. (12)
La hipocinesia y la alteración del control postural de la musculatura distal dan lugar a micrografía y dificultad progresiva en las actividades de la vida diaria. La demencia afecta aproximadamente al 50 % de los pacientes y la depresión es común. (11)
La exploración sensitiva en general es normal. Otros subsistemas también son afectados por este trastorno neurovegetativo, como son: la función de la vejiga urinaria, la sexualidad, las glándulas exocrinas (salivales, digestivas, sudoríparas, sebáceas) y el subsistema cardiovascular. También pueden existir signos de disfunción del sistema nervioso autónomo (por ejemplo: seborrea, sialorrea, rinorrea, estreñimiento, dificultad para la micción, hipotensión ortostática), también llamados síntomas no motores (SNM) de la EP.
La implicación de la EP en el sistema digestivo va desde alteraciones a nivel bucofaríngeo, como la sialorrea marcada; la disfagia tanto ante sólidos como líquidos, con relación directa sobre el peso corporal y el riesgo de broncoaspiración, hasta trastornos a niveles inferiores del tracto como el reflujo gastroesofágico, gastroparesia y enlentecimiento del intestino delgado, que puede conllevar a un sobrecrecimiento bacteriano y por tanto a un síndrome de mala absorción. El enlentecimiento del tránsito provoca la presencia de constipación de diferentes grados de severidad. (12)
Disfagia
La dificultad para tragar ocurre desde estadios muy tempranos de la enfermedad y aun en casos presintomáticos. Se manifiesta por el escape de saliva por las comisuras labiales, presencia de residuos de comida en la boca, mala formación del bolo alimenticio, lentitud de la retropulsión del bolo alimenticio por la lengua y del tránsito faríngeo, reflejo de deglución retrasado, residuos de comida en los senos piriformes, hasta la aspiración de líquidos y sólidos.
Si a este trastorno se le suma el inadecuado uso de los cubiertos con trozos de comida de tamaños inapropiados; mal manejo de los vasos con líquido, debido al temblor, rigidez y bradicinesia, por lo cual vierten de forma inapropiada su contenido en la boca, este problema adquiere creciente importancia clínica. Existe la broncoaspiración silente que precede al reconocimiento del síntoma.
Sialorrea
La sialorrea se define como la imposibilidad de controlar la secreción de saliva con la deglución y el tono muscular de labios y carrillos, con una acumulación anormal de esta en la orofaringe. En casos graves, este proceso puede provocar la incapacidad de mantenerla dentro de la boca, por lo que sale al exterior por la comisura labial. La sialorrea puede estar presente en diferentes procesos neurológicos que ocasionan dificultad para tragar, ya sea por disfunción neuromuscular, hipersecreción, postura anormal, rigidez y bradicinesia de los músculos de la deglución, así como por problemas estructurales como las anormalidades anatómicas y la edentulia.
El 78 % de los pacientes con enfermedad de Parkison experimenta sialorrea como síntoma muy temprano, problema que surge de la combinación de una inadecuada deglución de la saliva, dificultad para mantener la boca cerrada y una postura anormal, más que de una excesiva producción de aquella. Constituye uno de los problemas más molestos de los pacientes con Parkinson, causa aislamiento social, incrementa la depresión y es una de las principales causas de broncoaspiración y neumonías. El uso aislado de tratamiento farmacológico, rehabilitación oromotora o cirugía, no ha sido efectivo universalmente. No obstante, con la optimización de la terapia antiparkinsoniana en combinación con algún fármaco específico de efecto anticolinérgico, se puede encontrar cierto beneficio. Otra buena opción explorada en los últimos años es la aplicación de toxina botulínica. (14)
Estreñimiento o constipación
La constipación puede preceder a los síntomas motores por muchos años. (13-15) Como parte del estudio Honolulu Heart Program,(15) se encontró que los hombres que reportaron menos de una defecación diaria tenían un riesgo 2,7 veces mayor de desarrollar EP que los que defecaban, al menos, 1 vez por día. La constipación se explica por depósitos de cuerpos de Lewy y de alfa-sinucleína en el núcleo dorsal del vago y el plexo entérico, precediendo a su existencia en el Sistema Nervioso Central (SNC).
El estreñimiento es uno de los síntomas no motores (SNM) más comunes de la EP. Si bien la afectación "no dopaminérgica" estaría implicada en el estreñimiento, también aquellos pacientes con imposibilidad de defecar durante el período de ausencia de efecto dopaminérgico pueden hacerlo con la ayuda de apomorfina subcutánea. Se ha reportado un paciente con íleo paralítico, en el que esto se revirtió por el uso de apomorfina,(14) lo que sugiere que la afectación de los plexos de Auerbach y Meisner con cuerpos de Lewy podría estar relacionada con un trastorno de la motilidad colónica. El uso indiscriminado de laxantes en estos pacientes, en lugar de ayudar, perpetúa el megacolon adquirido por el estreñimiento crónico y empeora el problema.
Rinorrea
La rinorrea es cinco veces más común en pacientes con EP que en controles normales, afecta a más del 50 % de los enfermos y es igualmente prevaleciente en mujeres que en hombres. No existen evidencias del efecto de la levodopa sobre ella, pero sí de la apomorfina, a diferencia del resto de los agonistas dopaminérgicos. Tampoco se ha observado relación entre la rinorrea y la hiposmia. La rinorrea se produce por una disminución del tono simpático en la mucosa nasal, lo que provoca un desequilibrio a favor del tono parasimpático que estimula la secreción nasal.
Los pacientes con EP frecuentemente pierden peso, con una incidencia del 52-65 %. Esta pérdida de peso es más prominente en mujeres que hombres, y es muy marcada en pacientes con enfermedad avanzada. La pérdida de peso se debe primariamente a pérdida de grasa y no de masa muscular. Básicamente, se debe, por un lado, a una inadecuada ingesta de energía, relacionada con la pérdida del apetito provocada por los trastornos gastrointestinales y disfagia, y por otro, al incremento de gasto energético que surge de la rigidez, el temblor y las discinesias. La levodopa puede incrementar el metabolismo de la glucosa. La pérdida de peso tiene una fuerte correlación con la demencia, la depresión y las complicaciones médicas, como es el caso de la neumonía que surge por la enfermedad.
La lesión fundamental de la EP recae en la parte compacta de la sustancia negra (SN)* que forma parte de los ganglios basales (GB)**. Se produce una desaparición progresiva de las neuronas dopaminérgicas del sistema nigroestriado con despigmentación y gliosis, que afecta sobre todo a la porción compacta de la sustancia negra y al locus coeruleus mesencefálico. El marcador anatomopatológico más característico, aunque no exclusivo, son los cuerpos de Lewy (CL)***. Hay degeneración axonal de las neuronas afectadas con disminución de la secreción y liberación de dopamina y por tanto de la transmisión dopaminérgica.(2) (Tabla 1)

Diagnóstico y diagnóstico diferencial
El diagnóstico de la EP es esencialmente clínico y los estudios paraclínicos, como la analítica y las neuroimágenes, sirven, en gran medida, para descartar el resto de los potenciales parkinsonismos.
La EP es la forma más común de parkinsonismo, se plantea que alrededor del 75 % de los casos vistos en consulta de un especialista por trastornos del movimiento son pacientes afectados de EP.
Su diagnóstico positivo es una combinación de posibles elementos precoces no motores: hiposmia, constipación, entre otros, y aspectos característicos de los síntomas motores tales como comienzo unilateral de la enfermedad, buena respuesta inicial a la estimulación dopaminérgica y la ausencia de signos neurológicos atípicos, los cuales, en el caso de aparecer, orientan a la búsqueda de los diagnósticos de los parkinsonismos plus o parkinsonismos secundarios que en determinados casos sí pueden tener signos orientadores neurológicos o no que apoyen estas enfermedades neurodegenerativas y que en algún momento pueden inducir confusión. (Figura 1).
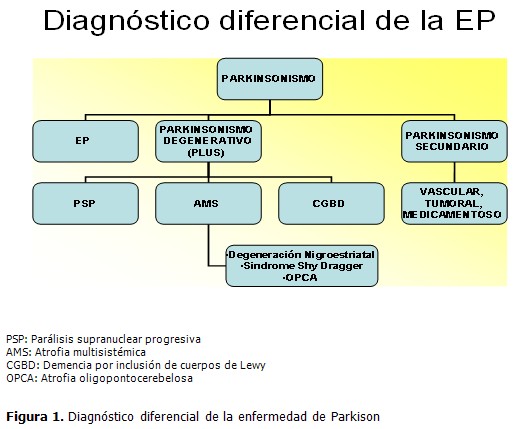
Aunque en el momento actual no existe un marcador que determine el diagnóstico preciso de EP, sí hay indicios de que en un futuro cercano estudios de neuroimágenes y test genéticos contribuyan poderosamente a esclarecerlo.
Pero debe recalcarse que existen criterios recientes que plantean que los cambios que ocasionalmente aparecen en el diagnóstico de EP en casos individuales pueden reflejar la heterogeneidad patológica de este desorden y el hecho de que la EP pudiera no ser una simple enfermedad.
Por otra parte debe enfatizarse en el diagnóstico preclínico de la EP, ya que estudios actuales sugieren que ahora es posible identificar la EP en su forma naciente, cuando las manifestaciones cardinales son mínimas o incluso estén ausentes.
Se ha propuesto el termino "Parkinson Associated Risk Síndrome" (PARS) para describir individuos que tienen marcadores identificables que marcan un alto riesgo de desarrollar EP o quien puede encontrarse en estadios tempranos de la enfermedad, término que ya se utiliza cotidianamente.
JUSTIFICACIÓN
En la EP las discinesias, la rigidez y temblor sobreañaden un gasto de energía extra al metabolismo del enfermo, lo que repercute en su estado nutricional. En el subsistema digestivo aparece una variedad de trastornos e incompetencias funcionales relacionadas con la motilidad, desde las primeras etapas del fenómeno alimentario (aprehensión, masticación y la deglución) (13) donde las contracciones de la musculatura faríngea presentan debilidades e incoordinaciones. Seguido, el avance del bolo alimenticio se enlentece, debido a un insuficiente peristaltismo en todos los tramos del tubo digestivo, con el consecuente retardo del vaciamiento gástrico, la posibilidad de reflujo gastroesofágico, la incompetencia del cardias y la hipomotilidad de los diferentes segmentos del intestino. El tratamiento con fármacos no es suficiente para mitigar tales trastornos y se hace necesario aplicar medidas relacionadas con las técnicas de alimentación y con la selección y elaboración de alimentos propiamente. (14) General: Específicos:
Se añade además, que el tratamiento farmacológico específico para la enfermedad (levodopa) puede sufrir afectaciones en el momento de la absorción en el intestino delgado, si no se tiene en cuenta una adecuada secuencia entre la ingestión del medicamento y la alimentación.
Este protocolo pretende orientar el trabajo para el seguimiento del paciente con EP que contemple los aspectos alimentarios, nutrimentales y metabólicos y de esta forma orientar su influencia en la evolución y pronóstico del enfermo.
Objetivos
DESARROLLO
La atención alimentaria-nutrimental comprende todas aquellas acciones que tiendan a mejorar la calidad nutricional de la dieta alimentaria, su adecuación a las características individuales, la orientación individual, familiar e incluso comunitaria, si el caso lo requiere, para de esta forma lograr el bienestar de los individuos y la mejor calidad de vida posible. Requisitos para realizar las mediciones: A. Para determinar el peso 1. Usar balanza doble romana. Capacidad hasta 140 kg. Alternativas para calcular el peso Para aquellos pacientes que estén imposibilitados de mantenerse en bipedestación se le realizará la medida de la circunferencia del brazo (CB), circunferencia de pierna (CP) y otras medidas alternativas que permitan conocer el estado nutricional del paciente mediante ecuaciones de predicción. (20,21) Estimación del peso a partir de otras medidas antropométricas Puntos de corte de la circunferencia braquial (CB) * Clasificación Valor de la CB (en cm) B. Para determinar la talla Expresar la medida en metros. Los pacientes con EP muchas veces no pueden erguirse en bipedestación para mantener la posición erecta. En este caso hay que tomar la estimación de la talla por ecuaciones de predicción. Talla. Rango de error Varones ± 7,84 cm. en 95 % de pacientes 3. Medición de la talla a partir de la extensión de un brazo (hemibraza) C. Parámetros bioquímicos de interés (22,26) Los parámetros bioquímicos se recogerán en el modelo de historia clínica nutricional, donde existen columnas para el dato en cuatro momentos diferentes de la evolución del paciente. La hiperinsulinemia, una consecuencia directa de la intolerancia a la glucosa, es un factor de riesgo independiente para la enfermedad coronaria. La intolerancia a la glucosa en adultos mayores, causada por insulino-resistencia, tiene varias causas. Los cambios en la composición corporal, especialmente con la acumulación de grasa visceral, se asocian con niveles de insulina más altos. Un adecuado aporte de hidratos de carbono complejos en la dieta y la reducción de peso y grasa corporal mejoran la sensibilidad a la insulina en esos sujetos. Muy importante es la mejoría en la acción de la insulina, que se alcanza con el entrenamiento físico. Por lo tanto, el entrenamiento muscular y una adecuada nutrición, mejoran la sensibilidad a la insulina en los adultos mayores y reduce sus consecuencias adversas.
En la atención alimentaria nutrimental a los pacientes con EP, el equipo asistencial debe comenzar por una caracterización de los casos, tomar los datos de identidad y antecedentes afines que serán recogidos en un modelo de historia clínica nutricional y de inmediato realizar las acciones correspondientes a la evaluación del estado nutricional.
El GAN es el equipo asistencial que en una unidad clínico-quirúrgica identifica a los pacientes que necesitan apoyo nutricional, determina su estado de nutrición, recomienda dietas alimentarias/nutrimentales terapéuticas y proporciona seguimiento a corto, mediano y largo plazo.(15)
Para lograr el objetivo 1: Realizar la evaluación del estado nutricional de los pacientes, en la captación y en el seguimiento
La evaluación del estado nutricional debe formar parte de cualquier evaluación general de la salud, e incluye historia clínica nutricional, exploración física y antropométrica, pruebas seleccionadas de laboratorio clínico, historia dietética e incluso aspectos socioeconómicos. Con esta evaluación se llega al diagnóstico de las necesidades reales y particulares del individuo y se identifican elementos que estén influyendo negativamente en dicho estado nutricional y en la salud en general.
Para realizar la evaluación de estado nutricional antropométrico se realizarán las mensuraciones de peso (kg) y de talla (m) y con ellas se determina el índice de masa corporal (IMC). (16) Las técnicas para la medición responderán a las normas del Programa Biológico Internacional (PBI). (17) Para los adultos de menos de 60 años se determina el estado nutricional antropométrico utilizando el IMC según los puntos de corte del estudio de la población cubana hasta los 59 años. (18-23) Para los sujetos mayores de 59 años, los puntos de corte del IMC para la evaluación del estado nutricional tienen modificaciones, según los criterios de la OMS para el adulto mayor. (19) (Tabla 2)
• Privacidad
• Ausencia de ruidos
• Iluminación adecuada
• Instrumentos en buen estado técnico, verificados y estandarizados
2. La medición debe tomarse en Kg (con una sola fracción decimal).
3. Individuo de pie, con ropa interior o con bata liviana, sin zapatos y sin medias.
4. No debe portar yesos, ni aparatos ortopédicos.
5. Ubicarse en el centro de la plataforma de la balanza.
6. En casos que se pesen con ropa por falta de privacidad, clima frío u otros, restar el peso de las prendas, del peso total obtenido.
7. Persona en silla de ruedas: usar báscula móvil para silla de ruedas. El sujeto debe mantenerse en el centro de silla.
8. Si no existen básculas especiales y el sujeto no puede mantenerse de pie, deben usarse alternativas para el cálculo del peso. Ver a continuación. Cálculo: ecuaciones de predicción para el peso según circunferencia de la pantorrilla (CP), del brazo (CB), altura de rodilla (AR) y pliegue subescapular (PSE):
Peso masculino= (0.98 x CP) + (1.16 x AR) + (1.73 x CB) + (0.37 x PSE) - 81.69
Peso femenino= (1.27 x CP) + (0.87 x AR) + (0.98 x CB) + (0.4 x PSR) - 62.3
La CB por sí sola puede ser un criterio más para evaluar el estado nutricional
bajo <21
normal 21 a <22
alto 22 y más
*OMS. El estado físico: Uso e Interpretación de la Antropometría. Ginebra: OMS; 1995. Modo de mensurar:
Altura de rodilla (AR):
Circunferencia braquial (CB):
Circunferencia de la pantorrilla (CP):
Pliegue cutáneo subescapular (PSE):
Alternativas para calcular la talla
Estimación de talla cuando el sujeto no puede mantener la bipedestación
1. Medición de la talla a partir de edad y la altura de rodillaCálculo: ecuaciones de predicción para la talla según edad y altura de la rodilla (AR):
Talla masculina = 64,19 – (0,04 x edad) + (2.02 x AR)
Talla femenina = 84,88 – (0,24 x edad) + (1.83 x AR)
Mujeres ± 8,82 cm. en 95 % de pacientes
2. Medición de la talla a partir de la extensión de brazos (brazada)Cálculo según la brazada: Se correlaciona directamente con la talla del adulto cuando era joven. Modo para tomar la brazada:
Cálculo: ecuaciones de predicción para la talla según la hemibraza tomada:
Talla masculina (cm)
Estatura = 66.3842 – 0.1139 x edad + 1.2197 x HBD
Estatura = 64.0247 – 0.1225 x edad + 1.2513 x HBI
Talla femenina (cm)
Estatura = 55.5955 – 0.0266 x edad + 1.2289 x HBD
Estatura = 55.1242 – 0.0331 x edad + 1.2375 x HBIModo para tomar la hemibraza:
Hemoglobina
Se evaluará usando los patrones de referencia OMS (deficiente si < 130mg/dL para hombres y < 120 mg/dL para mujeres).
Albúmina
Se considerará albuminemias bajas si <3,5 g/dL o muy bajas si <3 g/dL. Niveles de albúmina menores a 3,5 g/dL tienen un valor significativo como indicador nutricional, cuando no miden otros factores patológicos. Aunque la albúmina sérica no es un indicador muy específico, ni muy sensible de las proteínas corporales, es un buen indicador del estado de salud en el anciano.
Perfil lipídico
Indicador de riesgo cardiovascular que predice enfermedad coronaria en adultos jóvenes y adultos de la segunda y tercera edad. La mejoría o corrección de factores de riesgo cardiovascular en los adultos mayores, disminuye el riesgo de enfermar y morir por esta afectación. Se considerarán patológicos valores de colesterol total superiores a 200 mg/dL, como también valores de colesterol-HDL inferiores a 40 mg/dL y de triglicéridos superiores a 150 mg/dL. En pacientes con alto riesgo coronario, pero plenamente funcionales, el tratamiento de la hipercolesterolemia puede ser tan útil como los tratamientos para corregir la hipertensión o el tabaquismo. La hipocolesterolemia (<160 mg/dL) es muy importante como factor de riesgo de mortalidad, en particular asociada a cáncer. En presencia de desnutrición, sugiere que se debe a causas inflamatorias (desgaste), más que a baja ingesta.
Glucemia e hiperinsulinemia
Los cambios metabólicos que se producen con la edad pueden iniciar una secuencia de alteraciones de la homeostasis. Entre ellos, la intolerancia a la glucosa tiene influencia adversa sobre los lípidos plasmáticos y la presión arterial.
MEDICIONES INMUNOLÓGICAS
Diversas funciones inmunológicas son afectadas por la malnutrición. Los niveles de inmunoglobulinas, producción de anticuerpos, función fagocítica, respuestas inflamatorias, función del complemento, inmunidad secretoria de mucosa y otros mecanismos inmunológicos, pueden ser afectados en ausencia de nutrientes esenciales. Se ha demostrado una recuperación de la competencia inmune con relación a la repleción nutricional. Los antecedentes o no de enfermedades infecciosas como: infecciones respiratorias altas, neumonías, infecciones urinarias o diarrea en el anciano, constituyen un buen reflejo de las defensas corporales. En la malnutrición se observan valores por debajo de 1500 linfocitos/mm3. En la modificación de este indicador participan otras variables, de modo que su interpretación como indicador nutricional requiere de una correcta valoración. Aspectos generales del tratamiento de la EP
Otro indicador de función inmune es el recuento total de linfocitos (CTL) en sangre periférica, pues en la desnutrición, el timo, la primera estructura del sistema inmune y estructuras secundarias como el bazo y nódulos linfáticos, se alteran marcadamente en tamaño, peso, arquitectura y componentes celulares. En la sangre se hace evidente la depresión de linfocitos, disminuyendo su número total. Se puede medir de dos formas:
Para lograr el objetivo 2: Brindar un adecuado soporte alimentario, nutrimental y metabólico a los pacientes con enfermedad de Parkinson
Los expertos consideran que el tratamiento farmacológico en la EP está bien concebido y que el quirúrgico (estimulación cerebral profunda o lesión) permite mejorar la calidad de vida de pacientes en quienes los fármacos no son suficientemente eficaces (ver anexo). Por ello, "el reto más apremiante hoy es el diagnóstico precoz para detener su progresión". (23)
Las estrategias terapéuticas en la EP se han modificado progresivamente en las últimas décadas e incluyen no sólo el control de los síntomas motores clásicos, sino también el de los síntomas y signos no motores. Estos han cobrado mayor importancia al demostrarse, por estudios repetidos, (24-29) que constituyen una fase prodrómica o premotora de la enfermedad, que precede por años al cuadro clínico florido. Se habla ya incluso de un síndrome de riesgo de la EP, el llamado "PD at Risk Syndrome" (PDRS). (25,26)
Dentro de estos síntomas no motores están los trastornos gastrointestinales y la relación de estos con el peso corporal, más la competencia de la levodopa con la proteína ingerida en la dieta y la ingesta de micronutrimentos, que hacen del manejo dietético un aspecto a considerar para un adecuado soporte alimentario, nutrimental y metabólico del paciente, en la contribución a una mejor calidad de vida. (27) Sin embargo, se constatan escasas investigaciones con relevancia sobre el tema y más bien se hace sobre bases de una evidencia indirecta o especulación.
Por la influencia en la evolución del paciente, es que se hace necesario abordar el manejo nutricional de la EP bajo un enfoque integral, lo que permite optimizar la terapéutica farmacológica y, por tanto, su repercusión en la mejoría clínica de los pacientes.
Como los trastornos disautonómicos en la EP se atribuyen a alteraciones patológicas en neuronas autonómicas, tanto centrales como periféricas, puede ser agravada por la terapia dopaminérgica. Los síntomas gastrointestinales son comunes en la EP, especialmente la constipación, que se plantea puede verse en el 58 % de los pacientes. (31)
Por otra parte, la levodopa sigue siendo parte esencial en el tratamiento farmacológico, y el hecho de haber demostrado la interacción de los aminoácidos de la dieta en la farmacocinética del medicamento, que provocan una deficiente absorción del mismo, con empeoramiento de las fluctuaciones motoras y una respuesta clínica subóptima, (32) reafirma el papel de la nutrición como uno de los aspectos terapéuticos a desarrollar en la EP.
En la casi totalidad de estos síntomas su tratamiento con fármacos u algún proceder quirúrgico es ciertamente limitado. En el caso de la constipación, el uso de la lactulosa, de los laxantes irritativos u otras opciones como supositorios o enemas evacuantes, resuelven en escasa medida el problema.
Para la disfagia no existe una formulación medicamentosa que contribuya a su mejoramiento. Sucede igual con el enlentecimiento intestinal, ya que de los procinéticos de uso común, la metoclopramida o la cisaprida están contraindicados en la EP y solamente la domperidona (Motilium) ha dado algunos resultados.
El paciente con EP presenta un cortejo de síntomas ya referidos en este protocolo que se relacionan a continuación de forma esquemática (Figura 2) para facilitar el planeamiento de las acciones. Se señalan las alteraciones funcionales que repercuten en el fenómeno alimentario desde sus primeras etapas, de tipo conciente y voluntaria, hasta la finalización del proceso donde predominan los trastornos neurovegetativos. Todas estas alteraciones conllevan, como resultado final, al deterioro acelerado del enfermo por la anorexia persistente y la pérdida de peso marcada, con emaciación y sarcopenia.
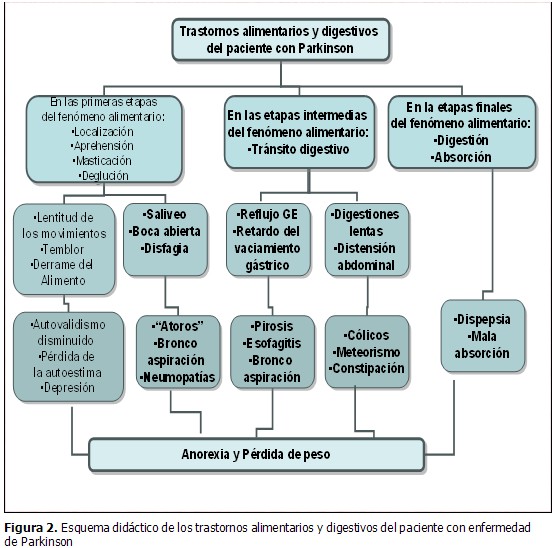
La disfagia puede llevar, en casos severos, a una gastrostomía, como vía de garantizar una alimentación adecuada y segura.
Para cada una de las instancias con dificultades en el fenómeno alimentario, debe existir una medida correctora o paliativa que ayude a la subsistencia del individuo enfermo e intente mejorar la calidad de su vida. Estas medidas forman parte del soporte alimentario, nutrimental y metabólico (SANM) que reúne un grupo de acciones dentro de la intervención al paciente.
De todo esto se infiere que el abordaje nutricional, tanto a nivel evaluativo como a nivel de procedimientos, constituye una arista en la optimización del tratamiento de los pacientes portadores de EP, pero primeramente se impone una evaluación del estado nutricional que permita medir su situación actual.
Después de realizar la evaluación del estado nutricional (referido en el objetivo 1) se inician las conductas en relación con el soporte alimentario, nutrimental y metabólico para todos los pacientes con EP, independiente de la fase en que se encuentren:
Soporte alimentario nutrimental y metabólico
A. Indicación de las recomendaciones nutricionales:
Para los fines de este trabajo debe recordarse que las recomendaciones nutricionales son guías para grupos de la población con exigencias particulares, constituyen valores de referencia para la evaluación nutricional de las encuestas de consumo de alimentos (a nivel macroeconómico e individual) y para la elaboración de las guías de alimentación. (5,33)
Estas recomendaciones en términos de energía y nutrimentos deben garantizar el mantenimiento de un peso adecuado y un nivel de actividad física aceptable incluyendo la fisioterapia, así como cubrir el gasto energético adicional impuesto por el estado de temblor y rigidez que presenta el paciente. (28-34)
La energía se obtiene de los nutrimentos energéticos. Los nutrimentos son compuestos químicos contenidos en los alimentos que se absorben y utilizan para mantener la salud. Algunos son esenciales porque el organismo no puede sintetizarlos y por ello tienen que ser obtenidos de la dieta, como vitaminas, minerales, aminoácidos esenciales, ácidos grasos esenciales y cierta cantidad de hidratos de carbono como fuentes de energía. Los no esenciales son aquellos que el organismo puede sintetizar a partir de otros compuestos, aunque también pueden obtenerse de la dieta. Todos son indispensables para mantener la salud y contrarrestar procesos mórbidos. (Tablas 3 y 4)

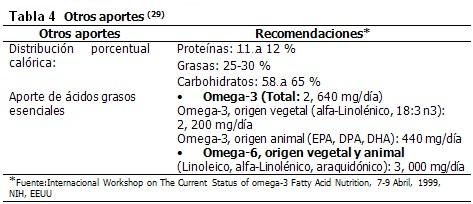
Aporte de líquidos*
| Un mínimo de 1,500 ml de líquido (ciertas condiciones como la fiebre, las fístulas, o las heridas exigentes pueden incrementar la necesidad para fluidos; mientras otros como insuficiencia renal o insuficiencia cardiaca congestiva pueden reducirlas) |
B. Medidas acompañantes
Medidas que forman parte del soporte alimentario, nutrimental y metabólico (SANM)
- Información a paciente y al familiar del ajuste dietético y su fundamento e importancia.
- Definir actividad física habitual y adicional (fisioterapia).
- Control periódico de peso corporal y su registro en la historia clínica nutricional.
- Indicar las técnicas de alimentación específicas para amortiguar las limitaciones físicas que presenta el enfermo:
a) Uso de soportes individuales (en inglés: doily) de superficie antideslizante, para colocar la vajilla sobre la mesa.
b) Uso de cubiertos de mangos o empuñaduras grandes y gruesos
c) Uso de tazas con asas amplias y si es posible de dobles asas.
d) Usos de platos hondos.
e) Uso de servilletas como baberos.
f) Uso de pitillos o absorbentes para líquidos, si lo desea el paciente.
g) Disponer de suficiente tiempo para comer.
h) No comer acompañado de personas que coman demasiado rápido.
i) No hablar durante la comida.
j) Comer en una mesa y silla cómoda que le de seguridad y que lo mantenga en posición erecta, con la espalda pegada al respaldar.
k) Llevar a la boca pequeños bocados de cada vez, intentando masticar bien y percatándose de si cerró la boca.
l) Esperar que la boca esté vacía para introducir un nuevo bocado.
m) Si al deglutir se percata de que han quedado residuos en la boca, debe deglutir de nuevo, una o dos veces si fuera necesario.
n) Al beber, después de cada sorbo debe colocar la taza en su lugar y hacer una pausa para repetir la operación.
o) Realizar 6 frecuencias de comidas diarias de pequeño volumen.
p) Después de comida debe permanecer sentado, no menos de 30 min.
q) Evitar estrés y ambiente de tensiones a la hora de comer.
5. Elaboración y presentación de los alimentos de manera que permitan la ingestión y digestión más adecuada en este tipo de enfermo. Son importantes los consejos en relación con la selección de alimentos así como el modo de elaboración y presentación de estos. Debe estar en correspondencia con el grado de disfagia.
- En relación con la consistencia:
- Dieta blanda: preparar los alimentos con consistencia blanda y fáciles de masticar como son los puré, cremas, batidos, picadillos, pastas de carnes, huevos.
- Espesamiento de las formulaciones líquidas en el caso de la disfagia marcada. Utilice espesantes como la maicena (almidón de maíz) para alimentos líquidos como sopas, caldos y leche.
- En relación a la presentación (para estimular el apetito):
- Ofrecer alimentos variados en una misma frecuenta alimentaria, con diferentes presentaciones, sabores, olores y colores.
- Utilice abundantes hierbas aromáticas y condimentos naturales para intensificar el sabor de los alimentos.
6. Composición energética de los alimentos:
- Utilice espesantes como la maicena (almidón de maíz) para alimentos líquidos como sopas, caldos y leche. Además de mejorar la consistencia y la presentación del plato, en una importante fuente de energía.
- Use solo la grasa necesaria, sin excesos, como contribuyente energético de la dieta y vehículo de vitaminas liposolubles.
7. Otras acciones en caso de disfagia:
- Aumentar el tiempo del efecto dopaminérgico.
- Comer durante el tiempo del efecto dopaminérgico
- Gastrostomía para alimentación: si no es posible mantener una ingesta suficiente por vía oral, se administra la nutrición enteral o parenteral que sea precisa. La alimentación por sonda enteral puede utilizarse en pacientes con un tracto gastrointestinal funcional para suplementar la alimentación oral o reemplazarla del todo. Esto último está indicado en pacientes que necesitan un aporte proteico y calórico intenso o en quienes no pueden o no quieren tomar el suplemento oral. La nutrición enteral es más segura y barata que la nutrición parenteral total y es la vía preferida cuando la integridad del tracto gastrointestinal está conservada. (30,31)
8. Si el paciente tiene nauseas y vómitos:
Se usa la domperidona (Motiliumâ, Dopeidona Gamirâ, Nauzelinâ). Se comercializa en solución (jarabe) y en comprimidos de 10 mg. Se administra 15-20 minutos antes de las principales comidas, evitando la intolerancia gástrica. Bloquea los receptores D2 en el área postrema del suelo del IV ventrículo. No atraviesa la barrera hematoencefálica (BHE), por lo que no produce parkinsonismo, como la metoclopramida. Indicada para los efectos sistémicos tanto de la levodopa como de los agonistas dopaminérgicos. Puede ser útil en el tratamiento de la hipotensión ortostática, ya que inhibe la vasodilatación renal producida por la dopamina periférica y aumenta el tono simpático.
9. Para la constipación:
- Ingestión de al menos 1,5-2 litros de líquidos durante el día
- Ingerir como mínimo 30-35 gramos de fibra diariamente
- Modificación de la dieta: aumento de la cantidad ingerida de líquidos, fibra y volumen
- Aumento de la actividad física
- Suspender anticolinérgicos
- Laxantes suaves (leche magnesiada) y enemas: reservar para el estreñimiento refractario
- Inyección de apomorfina: puede ser útil para los pacientes con severo estreñimiento en los periodos de no efecto dopaminérgico.
10. Para la malabsorción de la proteínas:
Establecer horarios de las comidas alejadas como mínimo 45 minutos de la administración de la Levodopa.
11. Considerar y establecer medidas individuales en caso de:
- Régimen de alimentación especial en pacientes diabéticos, dislipidémicos, obesos, hipertensos u otra enfermedad metabólica asociada que así lo requiera.
- Redistribución calórica en pacientes sometidos a períodos de neurorehabilitación intensiva.
- Dieta de redistribución proteica en pacientes con fluctuaciones motoras simples y empeoramiento de la respuesta a la Levodopa. Consiste en restringir la proteína total de la dieta en el día, a solo un 15 % de esta en desayuno y almuerzo y el resto (85 %) en horario de la cena.
- Suplementos de micronutrimentos en pacientes con sospecha de su déficit.
12. Evaluación inicial y periódica (período mínimo de 4 semanas).
En general, hay acuerdo en la idea de que un tratamiento sintomático se debe comenzar cuando el paciente comienza a experimentar incapacidad funcional. El objetivo no es eliminar todos los síntomas y signos, lo cual puede no ser posible, o requerir altas dosis de medicación, sino mantener una situación funcional aceptable.
Hay gran cantidad fármacos que se pueden usar en el tratamiento sintomático de la EP. (Tabla 5)
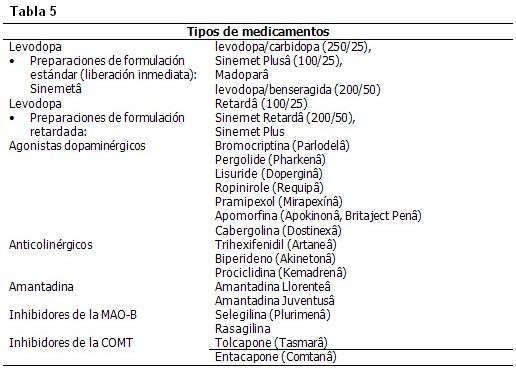
Las intervenciones al paciente con un carácter integral de todas las disciplinas médicas necesarias, se observan a continuación en la figura 3.
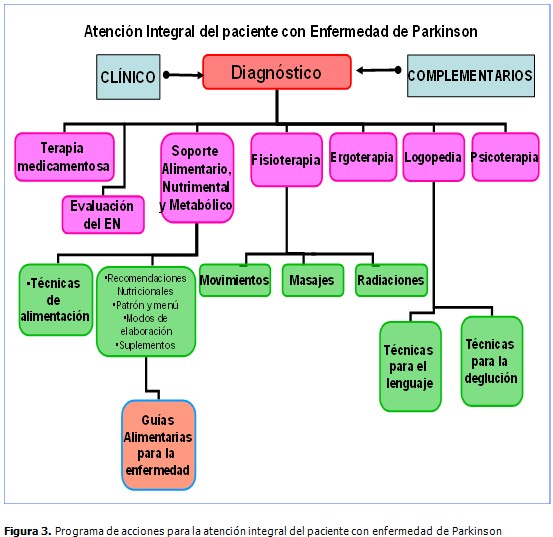
Para lograr el objetivo 3: Brindar educación alimentaria y nutrimental a pacientes y cuidadores
Para lograr este objetivo se diseñó un plan educativo para brindar orientaciones, mensajes y experiencias a enfermos y cuidadores que mejoren su preparación y así tengan un mejor afrontamiento al proceso de la enfermedad. En el diseño del plan se tomaron en cuenta aspectos y principios bioéticos para no dañar la integridad del paciente.
"Plan educativo sobre aspectos de alimentación-nutrición dirigido a enfermos de Parkinson y cuidadores"
Propósito del plan:
- Lograr una participación positiva y efectiva del cuidador y la familia en la vigilancia del estado nutricional de los enfermos de Parkinson.
- Integrar a cuidadores y familiares al manejo adecuado del enfermo de Parkinson.
Objetivos específicos del plan:
a) Explicar significación y manejo de los patrones alimentarios y menús, acorde a las recomendaciones nutricionales de los pacientes.
b) Promover educación alimentaria-nutrimental dirigida a cuidadores y familiares.
Modos para la ejecución del plan
El desarrollo de este plan no es posible con la única participación de un solo profesional, el nutricionista. Para lograr su ejecución se necesita el concurso de varios profesionales como el nutriólogo, enfermera, fisioterapeuta, logopeda y psicólogo, que logren la capacitación en materia de alimentación-nutrición, desde lo concerniente a las etapas cefálicas y concientes del fenómeno alimentario con todas su mecanismos inhibidores y facilitadotes, hasta las afectaciones más complejas de los mecanismos digestivos y absortivos que puedan ser susceptibles de mejoras con acciones terapéuticas.
El plan educativo se bebe ejecutar en forma de conferencias, dinámicas de grupo y clases prácticas. El comunicador debe procurar siempre una forma amena y con lenguaje claro que llegue a los cuidadores y a los propios pacientes cuando sean ellos a quienes estén dirigidos los mensajes.
Tareas a desarrollar en el plan
- En relación con el objetivo específico a) Explicar significación y manejo de los patrones alimentarios y menús, acorde a las recomendaciones nutricionales de los pacientes.
La alimentación de los pacientes debe responder a patrones de alimentación acordes a las recomendaciones nutricionales para las edades comprendidas, sexo y estado nutricional actual, así se decidirá el porcentaje extra de energía acorde a la gravedad de sus trastornos motores y de las indicaciones de fisioterapia. Esto garantiza ofrecer no más de la energía alimentaria recomendada, evitar los excesos y defectos, garantizar aportes adecuados de proteínas, grasas y carbohidratos. De igual forma se garantiza el cumplimiento del aporte de micronutrimentos (vitaminas y minerales) y de fibra.
Estos patrones de alimentación deben comprender las frecuencias alimentarias necesarias y que no interfieran con la ingestión de medicamentos (Levodopa). Se ejemplifican dichos patrones con diferentes menús que se divulgan entre los cuidadores, con el fin de que puedan ser cumplidos con la cooperación de la familia.
Estos patrones deben ser confeccionados por nutricionistas o dietistas calificados.
Los pacientes se analizan de manera individual para indicarles patrones personalizados y dirigidos acordes a las enfermedades acompañantes y es estos casos, deberán recibir atención particularizada por un especialista en nutrición.
- En relación con el objetivo específico b) Promover educación alimentaria-nutrimental dirigida a cuidadores y familiares
Para lograr el éxito en la disminución y prevención de la mala nutrición por defecto es necesaria la activa participación de cuidadores y familiares. Esto sólo es posible con la transmisión de conocimientos sobre alimentación-nutrición y su relación con la actividad física fisioterapéutica que se podrá alcanzar con una correcta orientación en relación con estos temas, que les permita aplicarlos en la práctica. Estas medidas de capacitación tienen como base la realización de cursos para los cuidadores con el doble propósito de que reciban conocimientos sobre alimentación y nutrición, además de convertirlos en instructores de estos temas para el resto de la familia, solo así podrá lograrse elevar el nivel de conocimientos de todos en relación con la alimentación y la nutrición del enfermo de Parkinson.
La capacitación está formada por:
I. Capacitación de los cuidadores:
Con ellos puede usarse el modo de conferencias y dinámicas de grupos. Las materias a impartir y discutir deben abarcar las formas de cómo alimentar, pero sin olvidar incluir el modo de elaboración de los alimentos.
La alimentación tiene entre sus requerimientos la preparación de los alimentos por personas con los conocimientos necesarios para elaborar productos alimenticios saludables, para lo cual deben conocer las características de los alimentos de acuerdo con su composición y las medidas necesarias para garantizar la protección sanitaria de los mismos. (Tabla 6)
II. Capacitación de los pacientes:
Ellos deben recibir la capitación en clases prácticas y es factible unir estas clases al momento de la fisioterapia, poniendo en práctica las técnicas de alimentación. Deben estar presentes los cuidadores para lograr un intercambio dinámico y ejemplificante. Debe evitarse el cansar al paciente, abochornarlo o provocar algún sentimiento de culpa. (Tabla 7)
Conclusiones generales de esta propuesta de intervención
Este protocolo de intervención pretende abarcar la casi totalidad de las problemáticas presentes en la atención al enfermo de Parkinson en lo concerniente al proceso de alimentación-nutrición y su determinante papel en el estado nutricional del enfermo y por tanto en su calidad de vida y la evolución del enfermedad. Múltiples incongruencias y dificultades pueden surgir en el transcurso de su puesta en práctica, pero solo con la ejecución de este se podrá lograr su perfeccionamiento, con la contribución de todos surgirán ideas renovadoras hasta llegar a la cercanía de una atención de excelencia al enfermo de Parkinson.
Se concluye que:
- El soporte alimentario-nutrimental al enfermo de Parkinson debe ser protocolizado y para ello se propone este instrumento que facilitará su ejecución y generalización.
- El deterioro nutricional del enfermo de Parkinson evidencia la necesidad de incrementar la educación alimentaria-nutrimental a enfermos y cuidadores.
- El individuo enfermo y su familia peden ser objeto de malos hábitos de alimentación desde etapas previas a la manifestación de la enfermedad, lo cual agrava el manejo en el complejo enfermo-cuidador-familia y hace más necesaria una intervención profesional.
---------------------------------------------------------------------------------------------------------------------------------------
*Los GB están formados por el cuerpo estriado (constituido por el caudado y putamen, que son contiguos), globo pálido (GP), sustancia negra (SN), núcleo subtalámico de Luys (NST), y tálamo óptico (TO), que no se incluye estrictamente como GB, pero tiene íntimas conexiones con estas estructuras. El GP y el putamen forman el núcleo lenticular. Tienen como función el mantenimiento de la postura del cuerpo y de las extremidades, la producción de movimientos espontáneos (como parpadeo) y automáticos que acompañan a un acto motor voluntario (como el balanceo de brazos al andar). Se sabe que existen fibras de la corteza motora que van a estos GB y fibras desde los GB a la corteza motora.2
**La SN está situada en el mesencéfalo; su rasgo histológico distintivo y específico es la existencia de gránulos de pigmento (melanina) esparcidos por el protoplasma de las grandes neuronas. La SN se compone de dos partes, una posterior muy oscura, en la que las neuronas con melanina se encuentran en gran cantidad y están juntas (pars compacta) y otra anterior, más clara, que ocupa mayor espacio y con muchas menos neuronas (pars reticulada).2
***Los CL son inclusiones intracitoplasmáticas eosinófilas rodeadas por un halo periférico menos densamente teñido, que derivan de elementos del citoesqueleto neuronal alterado en neuronas supervivientes y se tiñen con anticuerpos frente a ubiquitina.2
REFERENCIAS BIBLIOGRÁFICAS
1. Beers M, Berkow R, editores. El Manual Merck de diagnóstico y tratamiento. t.1. 10ma. ed. Madrid: Harcourt; 1999
2. Kulisevsky Bojarski J. Enfermedad de Parkinson. Guía terapéutica de la Sociedad Catalana de Neurología [Internet]. Cataluña: Fundación de la Sociedad Catalana de Neurología; 1999 [citado 12 Mar 2010]. Disponible en: http://www.sld.cu/galerias/pdf/sitios/rehabilitacion/enfermedad_de_parkinson.pdf
3. James WP. Introduction: The challenge of adult chronic energy deficiency. Eur J Clin Nut. 1994;48 Suppl 3:1-9
4. Santana Porbén S. Evaluación nutricional. En: Simposio " Nutrición Asistida: ¿Cómo, cuándo y por qué?". IX Congreso Latinoamericano de Nutrición Parenteral y Enteral. La Habana: Sociedad Cubana de Nutrición Clínica, Asociación Chilena de Nutrición; 2003. Disponible en: http://www.nutricionclinica.sld.cu/Congreso2003/SimposioBBraun/SimposioBBraun.htm
5. James WP, Francois P. The choice of cut-off points for distinguishing normal body weights from underweight or chronic energy deficiency in adults. Eur J Clin Nut. 1994;48 Suppl 3:179-84
6. Organización Mundial de la Salud (OMS). Dieta, nutrición y prevención de enfermedades crónicas. Serie de informes técnicos 797. Ginebra . 1990
7. Barreto Penié J, Santana Porbén S, Martínez González C, Salas Ibarra AM. Grupo de Apoyo Nutricional Hospitalario: Diseño, composición y programa de actividades. Rev Cubana Aliment Nutr. 2000;14(1):55-64
8. Barreto Penié J, Santana Porbén S, Martínez González C. Implementación del grupo de apoyo nutricional en el Hospital clinico-quirúrgico "Hermanos Ameijeiras", Ciudad de La Habana. Rev Cubana Aliment Nutr. 2000;14(2):134-40
9. Slaughter JR, Slaughter KA, Nichols D, Holmes SE, Martens MP. Prevalence, clinical manifestations, etiology, and treatment of depression in Parkinson’s disease. J Neuropsychiatry Clin Neurosci. 2001;13:187-96
10. Dujardin K, Sockeel P, Devos D, Delliaux M, Krystkowiak P, Destee A, et al. Characteristics of apathy in Parkinson’s disease. Mov Disord. 2007;22(6):778-84
11. Brooks DJ, Doder M. Depression in Parkinson’s disease. Curr Opin Neurol. 2001;14:465-70
12. Edwards L, Quigley EM, Hofman R, Pefeiffer RF. Gastrointestinal symptoms in Parkinson Disease: 18 months follow-up study. Mov Disord. 1993;8(1):83-6
13. Gonzáles Pérez TL, Marcos Plasencia LM. Fenómeno alimentario y fisiología del subsistema digestivo. Ciudad de La Habana: Editora Política; 2008
14. Brenner M, Zifko U. Alimentación correcta en la enfermedad de Parkinson. Frankfurt: Merz, Co.GmbH & Co. P.O. Box; 1999
15. Barreto Penié J. Creación y desarrollo de un grupo de nutrición clínica aplicado a las instituciones hospitalarias. Ciudad de La Habana: INHA, MINSAP; 1996
16. Berdasco A. Body mass index values in the Cuban population. Eur J Clin Nutr. 1994;48 Suppl 3:155-64
17. Weiner JS, Lourie JA. Human biology. A guide to field method. International Biological Program. Handbook No. 9. Oxford: Blackwell Scientific Publications. LTD; 1969
18. Berdasco Gómez A. Evaluación del estado nutricional del adulto mediante la antropometría. Rev Cub Aliment Nutr. 2002;16(2):146-52
19. Albala C, Bunout D, Carrasco F. Evaluación del estado nutricional en el anciano. En: Castillo CL, Uauy RD, Atalah N. Guías de alimentación para el adulto mayor. Santiago de Chile: INTA, Universidad de Chile; 1998: p. 37-52
20. James WPT, Mascie-Taylor GCM, Norgan HG, Bistriam BR, Shetty PS, Ferro-Luzzi A. The value of arm circumference measurements in assessing chronic energy deficiency in Third World adults. Eur J Clin Nutr. 1994;48(12):833-94
21. Berdasco A, Romero JM. Características físicas de los adultos cubanos de zonas urbanas y rurales: circunferencia del brazo, pliegues grasos tricipital y subescapular. Rev Cubana Alim Nutr. 1992;6(1):32-43
22. Kennedy RL, Chokkalingham K, Srinivasan R. Obesity in the elderly: who should we be treating, and why, and how?. Curr Opin Clin Nutr Metab Care. 2004;7(1):3-9
23. Científicos internacionales apuestan por combinar genética y neuroimagen contra el Parkinson [Internet]. Pamplona: Centro de Investigación Médica Aplicada; 2007 [citado 12 Mar 2010]. Disponible en: http://www.cima.es/comunicacion/noticia/114
24. Miller N, Noble E, Jones D, Burn D. Hard to swallow: dysphagia in Parkinson’s Disease. Age and Ageing. 2006;35:614-18
25. Truong D, Wolters EC. Recognition and management of Parkinson`s disease during the premotor (prodromal) phase. Expert Rev Neurother. 2009;9(6):847-57
26. Stephenson R, Siderowf A, Stern M. Premotor Parkinson’s Disease: Clinical Features and Detection Strategies. Mov Disord. 2009;24 Suppl 2:665-70
27. Merello M. Trastornos no motores en la enfermedad de Parkinson. Rev Neurol. 2008;47(5):261-70
28. Barichella M, Cereda E, Pezzoli G. Major nutritional issues in the management of Parkinson´s disease. Mov Disord. 2009;24(13):1881-92
29. Miller N, Noble E, Jones D, Burn D. Hard to swallow: dysphagia in Parkinson’s disease. Age Ageing. 2006;35(6):614-8
30. Crawford M, Galli C, Visioli F, Renaud S, Simopoulos AP, Spector AA. Role of plant-derived omega-3 fatty acids in human nutrition. Ann Nutr Metab. 2000;44(5-6):263-5
31. Vivanti P, Campbell KL, Suter MS, Hannan-Jones MT, Hulcombe JA. Contribution of thickened drinks, food and enteral and parenteral fluids to fluid intake in hospitalised patients with dysphagia. J Hum Nutr Diet. 2009;22(2):148-55
Recibido: 14 de mayo de 2010.
Aprobado: 18 de mayo de 2011.
Ligia Maria Marcos Plasencia. Especialista de I Grado en Pediatría. Especialista de II Grado en Nutrición. MSc en Nutrición. Investigadora Auxiliar. Instituto de Neurología y Neurocirugía. Ciudad de La Habana. Correo electrónico: ligiamarcos@infomed.sld.cu













