Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.9 no.4 Cienfuegos jul.-ago. 2011
REVISIÓN BIBLIOGRÁFICA
Enfoque actual del empleo de corticoesteroides en la terapéutica ocular.
Current Approach of Corticosteroids Use in Ocular Therapy.
Dayamí Pérez Gómez , Ivonne González Parra , Francisco García González
Hospital Clínico Quirúrgico "Hermanos Ameijeiras", Ciudad de La Habana, La Habana, Cuba
RESUMEN
Los corticoesteroides son un grupo de fármacos ampliamente usados en oftalmología por vía tópica, intraocular, periocular o sistémica, esto se debe a dos de sus principales funciones: la acción antinflamatoria y la inmunosupresora. En este estudio se realiza una revisión sobre este tipo de medicamentos, fundamental en el área de la oftalmología. El objetivo es profundizar en los conocimientos acerca de este grupo de fármacos, en aras de hacer un uso más idóneo de ellos. Se plantean aspectos relacionados con las formas de administración de los corticoesteroides y con las posibles reacciones adversas e interacciones medicamentosas.
Palabras clave: corticoesteroides/farmacología uso oftálmico, servicios oftalmológicos, tratamiento, vías de administración de medicamentos.
ABSTRACT
Corticosteroids are a group of drugs widely used in ophthalmology through topical, intraocular, periocular or systemic administration. This wide use is caused by two of its major functions: anti-inflammatory and immunosuppressive actions. This study presents a review on this type of drugs, primarily in the area of ophthalmology. The goal is to deepen knowledge on this group of drugs, in order to make a best use of them. Aspects related to the type of administration of corticosteroids and the possible adverse reactions and drug interactions are included.
Key words: adrenal cortex hormones/ pharmacology, eye health services, therapeutics, drug administration routes.
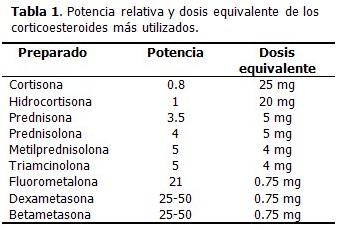
INTRODUCCIÓN En 1949, cuando Kendall, Hench y colaboradores publicaron los buenos resultados obtenidos con la utilización de la cortisona en enfermos de artritis reumatoidea, (1) se abrió una nueva era en el tratamiento de un grupo de enfermedades que constituían un reto para la práctica médica. Desde entonces, este grupo de medicamentos no ha dejado de desarrollarse y su uso se ha extendido a casi todas las ramas de la medicina. En oftalmología son un pilar esencial para el control de la inflamación postoperatoria y en enfermedades como las uveitis y las neuritis, pues apoyan en gran medida, la preservación de la función visual. La vía tópica es la más empleada, pero algunos procesos necesitan inmunosupresión profunda, lo que solo se consigue mediante la administración intra y periocular o sistémica. En la práctica diaria, los oftalmólogos tienden a fijar la atención en el órgano visual, relegando a un segundo plano los efectos sistémicos de los medicamentos empleados. Esta revisión tiene el objetivo de profundizar en las propiedades farmacológicas, las formas de uso, las ventajas y los efectos a corto y largo plazo de los corticoesteroides en el contexto de los servicios oftalmológicos. DESARROLLO Los esteroides son componentes de las membranas celulares, metabolitos de las grasas, hormonas y fármacos terapéuticos. Existen dos tipos de corticoesteroides naturales, los gluco corticoesteroides y los mineralo corticoesteroides. El principal gluco corticoesteroide es el cortisol y la aldosterona es el más importante mineralo corticoesteroide. Se sintetizan en la corteza suprarrenal a partir del colesterol, todos tienen el mismo esqueleto esteroideo, y solo se diferencian en los grupos unidos al carbono 17 o en la posición que adopta este grupo en el espacio. A partir del esteroide natural cortisol se han obtenido numerosos derivados sintéticos mediante la modificación de la estructura química a través de la introducción de dobles enlaces que disminuyen la actividad mineralo corticoesteroide. El número de derivados sintéticos es muy amplio, así como las vías de administración. Su potencia depende de los radicales que presenten, entre ellos los grupos amino, carboxilo y fosfatos; así como de la concentración del principio activo, el vehículo o excipiente y la integridad o el tipo de tejido, por ejemplo: la penetración aumenta cuando hay alteración del epitelio corneal y las mucosas muestran mayor absorción de los corticoesteroides. (2) Mecanismo de acción Uno de los mecanismos de acción primarios ocurre en el metabolismo del ácido araquidónico, al disminuir la síntesis de prostaglandinas, endoperoxidasas y tromboxano, involucrados en el proceso inflamatorio. Los corticoesteroides interactúan con proteínas receptoras específicas en tejidos diana para regular la expresión de genes con capacidad de respuesta a corticoesteroides, lo cual modifica las cifras y la disposición de las proteínas sintetizadas por diversos tejidos blanco. Como consecuencia del tiempo necesario para que haya cambios en la expresión de genes y en la síntesis de proteínas, casi ninguna de las acciones de los corticoesteroides es inmediata. Este hecho tiene importancia clínica porque regularmente se observa un período de latencia de varias horas antes de que se manifiesten los efectos beneficiosos del tratamiento con corticoesteroides. En contraste con estos efectos sobre la expresión de genes, estudios recientes han detectado la posibilidad de que algunas acciones de los corticoesteroides sean inmediatas y estén mediadas por receptores unidos a la membrana celular. Los mecanismos de acción pueden distinguirse a nivel tisular, celular e intracelular. En el ojo, los receptores de gluco corticoesteroides se encuentran en el iris, cuerpo ciliar, cornea y esclera. (2) Un concepto importante en la función de los corticoesteroides, es su acción fisiológica y su acción farmacológica. La primera se refiere a las cifras normales de producción diaria y sus efectos sobre el organismo, y la segunda está relacionada con los efectos que estos producen en el organismo con dosis que exceden la producción diaria normal. Las acciones de los corticoesteroides están relacionadas de manera compleja con las actividades de otras hormonas, así como en el metabolismo de las grasas, proteínas, lípidos, etc.; acciones concertadas con otros reguladores hormonales donde ellos potencian la función de estos y a su vez modifican la capacidad de reacción de los tejidos. (2) Acciones de los corticoesteroides: Los corticoesteroides se usan principalmente para suprimir padecimientos inflamatorios y alérgicos (uveítis aguda, conjuntivitis alérgica, coroiditis, retinitis, neuritis óptica), para reducir la inflamación postraumática después de operaciones oftálmicas, para retrazar la cicatrización al disminuir la proliferación de fibroblastos, y más recientemente, se ensayan tratamientos contra la proliferación fibro-vascular del polo posterior. En las enfermedades superficiales del ojo y en las del segmento anterior se emplean mayormente soluciones de colirios, mientras que para las afecciones del segmento posterior se requiere la vía oral, la periocular, la intraescleral y la intravitrea; las dosis y la duración del tratamiento están en relación con el tipo y la gravedad de la afección. (2-7) Penetración ocular: La córnea sana es atravesada por moléculas de polaridad bifásica. Esto significa que poseen cierto grado de solubilidad en medio lipídico y acuoso. El epitelio corneal es lipofílico, también lo es el endotelio, por lo que a través de ellos difunden fácilmente moléculas liposolubles, mientras que el estroma corneal es hidrofílico, y es atravesado por moléculas hidrosolubles. Existen diversos aditivos capaces de aumentar la penetración de los corticoesteroides. Las formas fosfatos tienen alta solubilidad en medio acuoso (estroma) y las formas acetato/alcohólicas baja solubilidad en medio acuoso, pero al ser bifásicas, son más penetrantes. Las formas acetato han mostrado ser las de mayor capacidad antiinflamatoria por su mayor penetración, siendo las más potentes de todos los preparados comerciales. En capacidad antiinflamatoria, le sigue la forma alcohólica. La presencia de fosfatasa en la córnea es un elemento importante, porque puede convertir un derivado fosfato de los corticoesteroides en formas alcohólicas más activas. (2-10) La potencia de los diferentes corticoesteroides varía dependiendo de sus características intrínsecas. En la siguiente tabla se especifican las potencias relativas de cada uno, y la correlación de las dosis, administrados por vía general. La hidrocortisona es considerada de potencia 1 y con ella se comparan los demás, así el cortisol, esteroide natural, tiene menor potencia, con valor 0.8. Estas consideraciones en relación a la potencia no han sido obtenidas en experimentación ocular tópica, por lo que estos valores no deben ser considerados de forma absoluta sino orientadora. (4,5,9)
Usos de los corticoesteroides en oftalmología
Uso de corticoesteroides tópicos
Potencia relativa de los corticoesteroides comúnmente usados
Tipos de vehículos (10,11)
- Suspensiones: Tienen mayor permanencia de partículas del medicamento en el fondo de saco conjuntival.
- Soluciones: Menor permanencia del medicamento en la superficie ocular aunque la atraviesan mejor que una suspensión.
- Gel: Mantiene hasta cuatro horas el medicamento en la superficie ocular.
- Ungüento: Penetran menos que el gel ya que su vehículo, el petrolatum, permanece menos tiempo en la superficie ocular.
Frecuencia de instilación
El rango de utilización de los corticoesteroides oscilará desde la máxima planteada por Leibowitz y cols de aplicar 90 gotas en un día, hasta pautas de mantenimiento de 2 ó 3 gotas a la semana.
La recomendación habitual es la instilación 2-6 veces/día, pero se logra un efecto antiinflamatorio más potente, cuando así se requiere, con su aplicación c/1 hr e incluso c/15 min. Esto debe ser usado por períodos cortos y siempre bajo estrecho seguimiento del paciente, pues también aumenta su efecto tóxico sobre el epitelio corneal. Como estrategia de tratamiento se puede plantear el descenso paulatino, tras iniciar una primera pauta de tratamiento máximo, vigilando la posible reactivación del proceso inflamatorio y la aparición de efectos colaterales. (3,5,10,11)
Uso de corticoesteroides perioculares
La absorción de los corticosteroides perioculares se realiza por vía transescleral y deben ser colocados lo más adyacente posible al sitio donde van a actuar. Están indicados en uveítis del segmento posterior, uveítis intermedia, uveítis anterior aguda grave, en casos resistentes de uveítis anterior crónica y en el momento de la cirugía en los ojos con uveítis. Esta vía está contraindicada en las escleritis y las conjuntivitis, su uso es controversial en las queratitis. Las vías de administración periocular son: la subconjuntival, la subtenoniana anterior y posterior, la transpalpebral, la retrobulbar y los implantes intraesclerales. Esta vía de administración tiene varias ventajas: se trata un solo ojo (el peor), tiene menores efectos sistémicos, es útil en pacientes con bajo cumplimiento del tratamiento tópico o sistémico, se puede garantizar un efecto prolongado con el uso de preparaciones de depósito y se alcanzan concentraciones terapéuticas por detrás del cristalino. (9-11)
Se pueden usar esteroides de corta, intermedia y larga duración (depósito), en correspondencia con el tiempo de acción que puede ser largo, intermedio y prolongado. (Tabla 2).
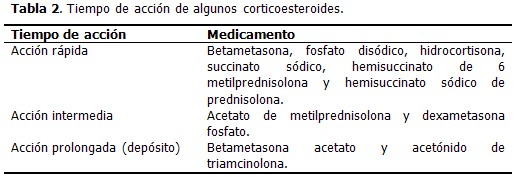
Los de corta duración tienen una rápida acción, desde pocas horas a 24 horas. Los de acción intermedia, duran días o semanas. Los de acción larga, llamados de depósito, duran semanas a 1 ½ mes.
El efecto de los corticosteroides de depósito se inicia 2-3 días después de su administración y su duración es aproximadamente entre 4-6 semanas. En el caso de la triamcinolona, es especialmente útil en las uveítis posteriores y medias no infecciosas y en las anteriores con respuesta insuficiente al tratamiento tópico. La inyección subconjuntival actúa regurgitando el esteroide a la lágrima a través de la conjuntiva. La inyección subtenoniana y retrobulbar proporcionan niveles adecuados de corticoesteroide en retina y vítreo, más que las subconjuntivales. Es la indicación por excelencia en la pars planitis. (5, 9-11)
Las complicaciones de la administración periocular pueden ser:
-Derivadas de la técnica: Inyección accidental intraocular, hemorragia subconjuntival, adherencia subconjuntival, edema palpebral, atrofia óptica por lesión al nervio óptico, Dellen limbar.
-Derivadas de los medicamentos: Posibles efectos secundarios tras la administración de múltiples inyecciones, catarata subcapsular posterior, posibilidad de atrofia subdérmica, glaucoma, ojo rojo, infecciones por herpes y hongos, ptosis palpebral, empeoramiento de uveítis infecciosas, oclusión de la arteria central de la retina. El acetónido de triamcinolona tiene menos tendencia a producir cicatrización y fibrosis periocular que el acetato de metilprednisolona. (9-11)
Uso de corticoesteroides intraoculares
La inyección intravítrea de acetónido de triamcinolona (2 mg en 0,05ml) se ha empleado con éxito en el tratamiento del edema macular cistoide agudo y crónico, y en procesos vasculares proliferativos de vítreo y retina. También existen estudios acerca del uso de la dexametasona intravítrea 400 microgramos/0,1 ml, (sin conservantes y en jeringas diferentes a las usadas para los antibióticos, pues se puede precipitar con vancomicina y la ceftacidima) en la endoftalmitis postoperatoria para reducir la destrucción ocasionada por la inflamación incontrolada, aunque no se han realizado estudios controlados que demuestren su utilidad, y está relativamente contraindicado en diabéticos. (11-28)
Uso de corticoesteroides sistémicos
Para conseguir el mayor efecto antiinflamatorio de los corticoesteroides por vía sistémica, es necesario comenzar con dosis elevadas.
Por ejemplo: 1 mg de prednisona /Kg/día en dosis única por la mañana; una vez controladas las manifestaciones más agudas, se inicia la disminución gradual de la dosis; si fuera necesario prolongar el tratamiento se debe instaurar un régimen de dosificación en días alternos. Se administra el total en una sola dosis cada 48 hrs., de esta manera se minimizan las reacciones adversas. La mayoría de los esteroides sistémicos alcanzan niveles plasmáticos pico luego de una hora de la administración vía oral y vuelven a la normalidad después de las 4-8 horas; la vía endovenosa se recomienda como dosis de carga solamente. La retirada del medicamento debe hacerse en forma paulatina para evitar los efectos de rebote de la inflamación, además existe riesgo de insuficiencia suprarrenal aguda. Si el paciente recibió dosis elevadas o intermedias en un período de 7 a 10 días, el medicamento se puede suspender completamente sin temor a la aparición de los efectos antes mencionados. Si se administraron dosis iguales o menores a 5 mg de prednisona por día durante meses, no deben esperarse signos de supresión suprarrenal. Cuando se usen dosis mayores se recomienda su retirada gradual, por ejemplo: una forma podría ser disminuir 10 mg cada 48-72 hrs. hasta llegar a la producción fisiológica (5mg/d) y luego pasar a un corticoesteroide de acción corta. Se deben medir las concentraciones plasmáticas de los corticoesteroides en la mañana (8 am), si están por encima de 10 mg se puede interrumpir la medicación. (29-31)
Reacciones adversas
Las reacciones adversas oculares del tratamiento con esteroides son múltiples y con diferente grado de gravedad, algunas muy temidas y que requieren de un constante estado de alerta, tal es el caso del incremento de la presión intraocular (PIO), tanto en pacientes glaucomatosos conocidos, como en pacientes normales. La presencia de este fenómeno está definida por una susceptibilidad individual, posiblemente de origen genético, y es menos frecuente con su uso tópico que sistémico. Ante la necesidad de instaurar tratamiento corticoesteroideo, es conveniente realizar controles de PIO y existen estudios que avalan la realización de pruebas de sensibilidad con dexametasona tópica antes de la aplicación de esteroides intraoculares de depósito, para adoptar, llegado el momento, las decisiones y medidas terapéuticas oportunas. Otro efecto adverso temido y común es la aparición de catarata, sobre todo la subcapsular posterior. Su incidencia real no esta definitivamente establecida, pero los niños y jóvenes parecen ser más susceptibles y también se investiga sobre una susceptibilidad individual de tipo genético. En el pasado se pensaba en una susceptibilidad mediada por las dosis y el tiempo de exposición al tratamiento, pero en la actualidad se conoce que la catarata puede aparecer en cualquier régimen de tratamiento, incluso tras terapia por inhalación. Otros efectos que pueden esperarse son: alergia al medicamento con edema palpebral, conjuntivitis papilar, aumento de la susceptibilidad a infecciones, sobre todo, activación de enfermedades virales (herpéticas), bacterianas o micóticas en la cornea, retardo de la cicatrización y predisposición a la necrosis corneal (es importante conocer esto para su uso en la cirugía refractiva corneal y en heridas corneales traumáticas o quirúrgicas), ptosis palpebral, erosión punteada superficial de la cornea y ligeras midriasis, entre otras. (32,33)
Las reacciones adversas sistémicas pueden estar relacionadas con el bloqueo del eje hipotálamo-hipófisis-adrenal, produciéndose una insuficiencia suprarrenal aguda o bien efectos tóxicos por dosis suprafisiológicas: síndrome de Cushing, enfermedades digestivas (gastroduodenitis, úlcera péptica), enfermedades músculo-esqueléticas (osteoporosis, fracturas óseas, aplastamiento vertebral, necrosis aséptica de la cabeza femoral, miopatía cortisónica), enfermedades dérmicas (acné, púrpura, adelgazamiento de la piel, hirsutismo, estrías de la piel), enfermedades cardiovasculares (hipertensión, arritmias, arteritis), enfermedades metabólicas (estado cushingoide, empeoramiento de la diabetes, supresión del crecimiento en niños, alteraciones de la función gonadal, aumento del apetito y de peso corporal, desequilibrio electrolítico), enfermedades psiquiátricas (depresión, irritabilidad, cambios mentales, psicosis cortisónica) y reactivación de infecciones sistémicas como tuberculosis o aumento de la predisposición a las infecciones fundamentalmente micóticas y por bacterias gram negativas. (33-35)
Interacciones medicamentosas
Los esteroides antagonizan los efectos hipoglicemiantes de los antidiabéticos y el efecto antihipertensivo de los alfa y beta bloqueadores, de los antagonistas de los receptores de angiotensina II y de los anticálcicos. Con el ketoconazol, su acción integra un efecto más, el aumento de las propiedades inmunosupresoras de ambos medicamentos. La carbamacepina, los barbitúricos y la rifampicina disminuyen los efectos de los corticoesteroides. La acetazolamida, las tiacidas, los diuréticos del ASA y los simpático-miméticos beta 2, aumentan el riesgo de hipocalcemia. Se aumenta el riesgo de ulceración y sangramiento gastroduodenal con el uso simultáneo de agentes antiinflamatorios no esteroideos (AINEs). Los anticonceptivos orales aumentan las concentraciones plasmáticas de esteroides. (35-38)
CONCLUSIONES
Los corticoesteroides son medicamentos sumamente útiles en la especialidad de oftalmología, pero pueden ser peligrosos si no se usan correctamente, por lo que el acercamiento a sus particularidades para hacer un uso cada vez más idóneo de ellos, es una necesidad, un deber.
REFERENCIAS BIBLIOGRÁFICAS
1. Pérez Tamayo R. De la magia primitiva a la medicina moderna [monografía en Internet]. México, D.F.: Fondo de Cultura Económica; 1997 [citado 14 May 2011]. Disponible en: http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen3/ciencia3/154/html/sec_16.html
2. American Academy of Ophthalmology. Ocular pharmacotherapeutics. En: Fundamentals and principles of Ophthalmology. Basic and clinical science course 2010-2011. San Francisco: American Academy of Ophthalmology; 2010: p. 416-25
3. American Academy of Ophtalmology. Medical Management of Uveitis. En: Intraocular inflammation and uveitis. Basic and clinical science course 2010-2011. San Francisco: American Academy of Ophthalmology; 2010: p. 121-37
4. American Academy of Ophthalmology. Special topics in ocular inmunology, Immunotherapeutics. En: Intraocular inflammation and uveitis. Basic and clinical science course 2010-2011. San Francisco: American Academy of Ophthalmology; 2010: p. 87-97
5. Ruiz Moreno JM. Corticoesteroides tópicos. En: Díaz LLopiz M. Tratamiento de las uveitis. Barcelona: Sandoz Pharma; 2003: p. 23-36
6. Gupta D, Illingworth C. Treatments for Corneal Neovascularization: A Review. Cornea. 2011;30(8):927-938
7. Blair J, Hodge W, Al-Ghamdi S, Balabanian R, Lowcock B, Pan YI, et al. Comparison of antibiotic-only and topical antibiotic-steroid combination treatment in corneal ulcer patients: double-blinded randomized clinical trial. Can J Ophthalmol. 2011;46(1):40-5
8. Acharya NR, Srinivasan M, Mascarenhas J, Ravindran M, Rajaraman R, Zegans M, McLeod S, Lietman TM. The steroid controversy in bacterial keratitis. Arch Ophthalmol. 2009;127(9):1231
9. Benítez del Castillo JM. Corticoesteroides perioculares. En: Díaz LLopiz M. Tratamiento de la uveitis. Barcelona: Sandoz Pharma; 2003: p. 37-44
10. Gil MR, Cortes C. Farmacología de la inflamación y analgesia en oftalmología. En: Cortés Valdés C, Arias Puente A, Encinas Martín JL, García Feijoo J. Farmacología Ocular. Madrid: Sociedad Española de Oftalmología; 2007: p. 163-77
11. Herrero R. Aspectos biofarmacéuticos y farmacocinéticos en oftalmología. Formas farmacéuticas oftálmicas. Nuevas formulaciones de administración ocular. En: Cortés Valdés C, Arias Puente A, Encinas Martín JL, García Feijoo J. Farmacología Ocular. Madrid: Sociedad Española de Oftalmología; 2007: p. 25-45
12. Yu-Wai-Man P, Griffiths PG. Steroids for traumatic optic neuropathy. Cochrane Database Syst Rev. 2011;19(1):CD006032
13. Yilmaz T, Weaver CD, Gallagher MJ, Cordero M, Cervantes RA, Klisovic D, et al. Intravitreal triamcinolone acetonide injection for treatment of refractory diabetic macular edema: a systematic review. Ophthalmology. 2009;116(5):902-11
14. Synek S, Vojniković B. Intravitreal bevacizumab with or without triamcinolone for refractory diabetic macular oedema. Coll Antropol. 2010;34 Suppl 2:99-103
15. Saraiya NV, Goldstein DA. Dexamethasone for ocular inflammation. Expert Opin Pharmacother. 2011;12(7):1127-31
16. Tatsugawa M, Noma H, Mimura T, Funatsu H. High-dose steroid therapy for idiopathic optic perineuritis: a case series. J Med Case Reports. 2010;4:404
17. Gerometta R, Spiga MG, Borrás T, Candia OA. Treatment of sheep steroid-induced ocular hypertension with a glucocorticoid-inducible MMP1 gene therapy virus. Invest Ophthalmol Vis Sci. 2010;51(6):3042-8
18. Hollands H, Seif G, Hollands S, Gale J. A trial of topical prednisolone acetate before intravitreal triamcinolone acetonide decreases intraocular pressure spikes. Can J Ophthalmol. 2010;45(5):484-8
19. Brumm MV, Nguyen QD. Fluocinolone acetonide intravitreal sustained release device--a new addition to the armamentarium of uveitic management. Int J Nanomedicine. 2007;2(1):55-64
20. Mruthyunjaya P, Khalatbari D, Yang P, Stinnett S, Tano R, Ashton P, et al. Efficacy of low-release-rate fluocinolone acetonide intravitreal implants to treat experimental uveitis. Arch Ophthalmol. 2006;124(7):1012-8
21. Kovacs KD, Quirk MT, Kinoshita T, Gautam S, Ceron OM, Murtha TJ, et al. A retrospective analysis of triple combination therapy with intravitreal bevacizumab, posterior sub-tenon´s triamcinolone acetonide, and low-fluence verteporfin photodynamic therapy in patients with neovascular age-related macular degeneration. Retina. 2011;31(3):446-52
22. Soheilian M, Ramezani A, Bijanzadeh B, Yaseri M, Ahmadieh H, Dehghan MH, et al. Intravitreal bevacizumab (avastin) injection alone or combined with triamcinolone versus macular photocoagulation as primary treatment of diabetic macular edema. Retina. 2007;27(9):1187-95
23. Soheilian M, Ramezani A, Obudi A, Bijanzadeh B, Salehipour M, Yaseri M, et al. Randomized trial of intravitreal bevacizumab alone or combined with triamcinolone versus macular photocoagulation in diabetic macular edema. Ophthalmology. 2009;116(6):1142-50
24. Yilmaz T, Weaver CD, Gallagher MJ, Cordero-Coma M, Cervantes-Castaneda RA, Klisovic D, Lavaque AJ, et al. Intravitreal triamcinolone acetonide injection for treatment of refractory diabetic macular edema: a systematic review. Ophthalmology. 2009;116(5):902-11
25. Parravano M, Menchini F, Virgili G. Antiangiogenic therapy with anti-vascular endothelial growth factor modalities for diabetic macular oedema [CDROM]. Cochrane Database Syst Rev. 2009;7(4):CD007419
26. Chen CH, Chen YH, Wu PC, Chen YJ, Lee JJ, Liu YC, et al. Treatment of branch retinal vein occlusion induced macular edema in treatment-naïve cases with a single intravitreal triamcinolone or bevacizumab injection. Chang Gung Med J. 2010;33(4):424-35
27. Inna V, Kennedy A, Ashton P, Gary W. Intravitreous Delivery of the Corticosteroid Fluocinolone Acetonide Attenuates Retinal Degeneration in S334ter-4 Rats. Invest Ophthalmol Vis Sci. 2010;51(8):4243-4252
28. Breusegem C, Vandewalle E, Van Calster J, Stalmans I, Zeyen T. Predictive value of a topical Dexamethasone provocative test before intravitreal triamcinolone acetonide injection. Invest Ophthalmol Vis Sci. 2009;50(2):573-6
29. Demirci H, Christianson MD. Orbital and Adnexal Involvement in Sarcoidosis: Analysis of Clinical Features and Systemic Disease in 30 Cases. Am J Ophthalmol. 2011;151(6):1074-1080
30. Hos D, Saban DR, Bock F, Regenfuss B, Onderka J, Masli S, et al. Suppression of inflammatory corneal lymphangiogenesis by application of topical corticosteroids. Arch Ophthalmol. 2011;129(4):445-52
31. Lee AG, Biousse V. Steroids be offered to patients with nonarteritic anterior ischemic optic neuropathy?. J Neuroophthalmol. 2010;30(2):193-8
32. Polansky JR. Side effects of topical ophthalmics therapy with anti-inflamatory steroids and ß-blockers. Curr Opin Ophthalmol. 1992;3:259-72
33. Haeck IM, Rouwen TJ, Timmer-de Mik L, de Bruin-Weller MS, Bruijnzeel-Koomen CA. Topical corticosteroids in atopic dermatitis and the risk of glaucoma and cataracts. J Am Acad Dermatol. 2011;64(2):275-81
34. Bhat YJ, Manzoor S, Qayoom S. Steroid-induced rosacea: a clinical study of 200 patients. Indian J Dermatol. 2011;56(1):30-2
35. Finocchi C, Ferrari M. Female reproductive steroids and neuronal excitability. Neurol Sci. 2011;32 Suppl 1:S31-5
36. Minguez Muro E. CortiCoesteroides sistémicos y sus complicaciones. En: Díaz LLopis M. Tratamiento de las uveitis. Barcelona: Sandoz Pharma; 2003: p. 61-102
37. Bartlett JD, Jaanus SD. Clinical Ocular Pharmacology. 4th. ed. Woburn: Butterworth- Heinemann; 2001
38. Florez J. Farmacología Humana. 3ra. ed. Barcelona: Masson; 2000
Recibido: 18 de febrero de 2011.
Aprobado: 29 de julio de 2011.
Dayamí Pérez Gómez. Especialista de I Grado en Medicina General Integral. Especialista de I Grado en Oftalmología. Profesora Auxiliar. Correo electrónico: dayione@infomed.sld.cu














