Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.13 no.6 Cienfuegos nov.-dic. 2015
ARTÍCULO ORIGINAL
Morfometría cardiaca en ratas con crecimiento intrauterino retardado
Heart Morphometry in Rats with Intrauterine Growth Restriction
Claudia Joffre FríazI , Ninive Nuñez LópezI , Laura López MarínII , María Antonia CruzI , Laymit Alonso PadillaI
I Instituto de Ciencias Básicas y Preclínicas Victoria de Girón, La Habana, La Habana, Cuba, CP: 11300
II Instituto de Nefrología, La Habana, La Habana, Cuba
RESUMEN
Fundamento: estudios epidemiológicos y experimentales sugieren que el desarrollo de las enfermedades cardiovasculares en la adultez está influenciado por eventos de la vida prenatal o posnatal temprana, independientemente de los factores de riesgo relacionados con el estilo de vida.
Objetivo: caracterizar la morfometría cardiaca en ratas de la línea Wistar portadoras de crecimiento intrauterino retardado, así como determinar las diferencias existentes entre adolescentes y adultos, en ambos sexos y la asociación con algunas variables morfométricas en el momento del nacimiento.
Métodos: se estudiaron 80 crías del grupo control y 80 de un grupo experimental y se analizaron las siguientes variables morfométricas del recién nacido: peso, talla, circunferencia abdominal, diámetro biparental del cráneo, diámetro antero posterior del cráneo, todas en milímetros.
Resultados: el bajo peso al nacer como resultado de crecimiento intrauterino retardado provocó cambios en la morfometría cardiaca, especialmente en el peso del corazón y en el grosor del ventrículo izquierdo. Estos cambios se observan en ambos sexos en la adolescencia y muestran un ligero predominio en el sexo masculino en la adultez.
Conclusiones: los resultados obtenidos permitieron profundizar en el conocimiento de los eventos que participan en el desarrollo cardiaco en respuesta a la restricción de nutrientes durante la vida intrauterina, lo que podría contribuir al planteamiento de estrategias de salud encaminadas a disminuir la morbilidad y mortalidad perinatal de estas enfermedades.
Palabras clave: cardiopatías, enfermedades cardiovasculares, ratas wistar, retardo del crecimiento fetal, animales de laboratorio.
ABSTRACT
Background: epidemiological and experimental studies suggest that cardiovascular disease in adulthood is influenced by prenatal or early postnatal events, regardless of lifestyle-related risk factors.
Objective: to characterize the heart morphometry in Wistar rats with intrauterine growth restriction and to determine the differences between adolescents and adults of both sexes as well as the association with some morphometric variables at birth.
Methods: a total of 80 rats in the control group and 80 in the experimental group were studied. The following morphometric variables were analyzed in the newborns: weight, height in addition to size, weight and volume of the heart, all in millimeters.
Results: low birth weight resulting from intrauterine growth restriction caused changes in heart morphometry, especially in heart weight and thickness of the left ventricle. These changes were observed in both sexes during adolescence and showed a slight predominance in adult males.
Conclusions: these results led to an increased knowledge of the events involved in heart development in response to nutrient restriction in utero, which could contribute to the design of health strategies to reduce morbidity and perinatal mortality from heart diseases.
Key words: heart diseases, cardiovascular diseases, rats, wistar, fetal growth retardation, animals, laboratory.
INTRODUCCIÓN
Durante la gestación pueden producirse numerosas complicaciones que determinan un crecimiento intrauterino retardado(CIUR) y de manera consecuente, bajo peso al nacer. El CIUR constituye la condición patológica que se diagnostica con mayor frecuencia durante la gestación, y afecta hasta un 32 % de las gestaciones en algunos países en vías de desarrollo.1 Más allá de la bien descrita asociación entre el bajo peso al nacer y la alta morbimortalidad perinatal, numerosos estudios sugieren que estos niños son más susceptibles a desarrollar enfermedad cardiovascular en etapas posteriores de la vida.2 Estos hallazgos han sido interpretados de acuerdo a la “hipótesis de los orígenes fetales de la salud y la enfermedad” que sugieren que la nutrición inadecuada durante el periodo fetal puede incrementar la susceptibilidad a padecer enfermedades en periodos posteriores de la vida. Esta hipótesis fue desarrollada por Barker y colaboradores en la década de 1980 cuando establecieron que la incidencia de algunas enfermedades en el adulto se relacionaban con el ambiente intrauterino durante el desarrollo.3 Existen evidencias en animales que sugieren que el feto se adapta a un ambiente intrauterino adverso enlenteciendo su metabolismo y crecimiento a través de un proceso conocido como “programación intrauterina”. Esta estrategia adaptativa aparentemente incrementa la supervivencia a corto plazo pero tiene consecuencias adversas para la salud a largo plazo.2,3 A pesar de la existencia de numerosos estudios que abordan esta asociación, existe aún mucha controversia en relación al hecho de que el retardo en el crecimiento fetal, que se manifiesta en un bajo peso al nacimiento, aumenta el riesgo de padecer enfermedad cardiovascular y por otro lado, además, son contradictorias las evidencias en cuanto a las posibles diferencias entre los sexos. Mientras algunos estudios plantean que la enfermedad cardiovascular podría producirse a través de la “programación intrauterina” que determina cambios metabólicos a largo plazo, otros la relacionan con cambios que se producen en el desarrollo cardiaco en etapas tempranas del desarrollo. La respuesta podría estar en una combinacion de ambos. Con el presente trabajo, en un modelo experimental en ratas de CIUR, se pretendió caracterizar la morfometría cardiaca macroscópica según sexo y grupos etarios (adolecentes y adultos) así como la asociacion entre variables morfométricas al nacimiento y las variables de morfometria cardiaca.
MÉTODOS
Se realizó un estudio experimental, longitudinal, prospectivo. Se utilizaron 30 ratas de la línea Wistar, adultas, con peso aproximado de 200 gramos (g) y 25 machos, con un peso de 270 g. Se realizó el apareamiento y una vez comprobada la cópula se tomó como día cero de la gestación. Las hembras fueron distribuidas al azar en dos grupos: control con 15 ratas y experimental (CIUR) con 15 ratas. A las madres del grupo experimental se les realizó intervención quirúrgica el día 16 de la gestación utilizando el modelo de CIUR de Alfonso y colaboradores;4 las madres del grupo control no fueron intervenidas quirúrgicamente. Se seleccionaron de siete a ocho crías al azar con vistas a homogeneizar la cantidad de crías en ambos grupos. Las crías de las ratas del grupo control (80 crías) y experimental (80 crías) se dividieron primero en dos subgrupos que correspondieron al sexo de las crías y posteriormente cada subgrupo se dividió según la edad en que se le practicaría la eutanasia, 45 días adolescentes y 70 días adultos. Procedimientos técnicos: se tomaron variables morfométricas al nacimiento y variables morfométricas macroscópicas del corazón en la adolescencia y en la adultez. Se procedió a la evisceración y la extracción del corazón. Una vez removido, el corazón fue lavado con agua corriente, pesado y medido previo secado. Se determinó el volumen del órgano por el desplazamiento de agua destilada en una probeta graduada de 20 mililitros (ml). Los corazones fueron seccionados mediante un corte transversal a nivel de los cojinetes endocárdicos y otro paralelo al anterior pero cinco milímetros (mm) por debajo. Los fragmentos de 5 mm de espesor fueron fijados en formol tamponado al 10 % y procesados mediante la técnica de inclusión en parafina. Se realizaron cortes transversales de 5 micrómetros (µm) para posterior tinción con la técnica de hematoxilina y eosina (HE). Variables utilizadas: variables morfométricas del recién nacido: peso, talla, circunferencia abdominal (CA), diámetro biparental del cráneo (DBP), diámetro anteroposterior del cráneo (DAP), todas en milímetros. Variables macroscópicas del corazón: peso del corazón en gramos, volumen del corazón en ml. Mediciones del corazón: se realizó usando pie de rey a lo largo de tres ejes: longitudinal, transverso y sagital en mm. Para medir el grosor y diámetro del ventrículo izquierdo, se utilizó un microscopio estereoscópico a un aumento de 2x acoplado a cámara fotográfica. En la fotografía se midió el grosor del ventrículo izquierdo (entre la pared interna y la externa del borde externo izquierdo del ventrículo izquierdo) y diámetro de la luz del ventrículo izquierdo. Se realizó la medición siguiendo una línea recta, entre los dos puntos más lejanos de la cavidad del ventrículo izquierdo (diámetro mayor). Se utilizó el programa NIH Imagen J y los resultados se expresaron en mm.
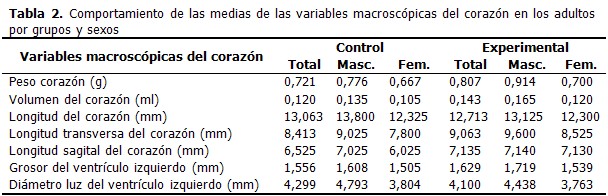
RESULTADOS
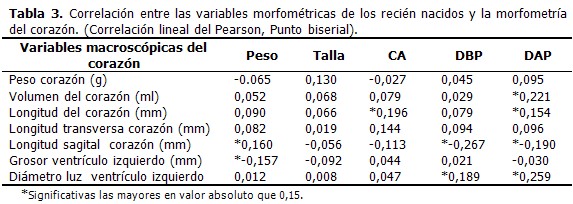
En las crías afectadas por CIUR (del grupo experimental) las medias de los valores de las variables morfométricas al nacer fueron más pequeñas que en las crías control. Todas las diferencias fueron significativas. Las medias del peso, el volumen, la longitud, la longitud sagital y el grosor del ventrículo izquierdo del corazón fueron mayores en las ratas adolescentes del grupo experimental (CIUR), mientras que la longitud transversa y el diámetro de la luz del ventrículo izquierdo del corazón fueron más pequeños en este grupo respecto al grupo control, con diferencias significativas entre el peso y la longitud sagital del corazón entre el total de crías por grupos estudiados. (Tabla 1). Al analizar estas variables por sexos en el grupo control, fueron ligeramente mayores en el sexo masculino con excepción del volumen, el grosor del ventrículo izquierdo y el diámetro de la luz del ventrículo izquierdo del corazón. Sin embargo, no hubo diferencias significativas entre los sexos masculino y femenino. En el grupo experimental (CIUR), todas las medias de las variables estudiadas fueron mayores en el sexo masculino que en el femenino. Las diferencias del peso del corazón entre ambos sexos de este grupo fue significativa (p= 0,04595). Cuando se compararon las diferencias entre las medias de las variables macroscópicas del corazón en los adolescentes del sexo masculino de ambos grupos (control y experimental) se observó que el peso, el volumen, la longitud, la longitud sagital y el grosor del ventrículo izquierdo del corazón fueron mayores en el grupo experimental (CIUR) y como era de esperar, la luz del ventrículo izquierdo del corazón fue menor en este grupo que en el control. Las diferencias entre el peso del corazón (p=0, 00288) y la longitud sagital del corazón (p=0,00027) entre los dos grupos fueron significativas. Las medias de las variables macroscópicas del corazón entre las adolescentes del sexo femenino de ambos grupos (control y experimental) se comportaron de forma similar a las del sexo masculino. Solo hubo diferencias significativas entre las medias de la longitud sagital del corazón (p=0,00870). A continuación se muestran las medias de las variables macroscópicas del corazón de las ratas adultas en los grupos estudiados (control y experimental). El peso, el volumen, la longitud transversa, la longitud sagital y el grosor del ventrículo izquierdo del corazón fueron mayores en el grupo experimental (CIUR) que en el control. Los valores de la longitud y el diámetro del ventrículo izquierdo del corazón, fueron menores en el grupo experimental. Y se encontraron diferencias significativas entre los grupos en el volumen (p= 0,03098), la longitud transversa (p=0,04600) y la longitud sagital (p=0,03231) del corazón. En el grupo control de ratas adultas todas las medias de las variables fueron superiores en el sexo masculino que en el femenino, con diferencias significativas (p=0,00000; p=0,00447; p=0,00327; p=0,006506; p=0,00975; p=0,000356) con excepción del grosor del ventrículo izquierdo. En el grupo experimental (CIUR), las medias de todas las variables se comportaron de manera similar que en el grupo control donde fueron superiores en el sexo masculino. Sin embargo, fueron significativas las diferencias entre el peso (p=0,00007), el volumen (p=0,01919), la longitud transversa (p=0,02231), el grosor del ventrículo izquierdo (p=0,03149) y el diámetro del ventrículo izquierdo del corazón (p=0,02307). Al comparar las medias de las variables macroscópicas entre las ratas adultas masculinas de ambos grupos (control y experimental) observamos que el peso, el volumen, la longitud transversa, la longitud sagital del corazón y el grosor del ventrículo izquierdo del corazón fueron ligeramente mayores en el grupo experimental. Solo fue significativa la diferencia entre los pesos del corazón (p= 0,0476). En el sexo femenino de los grupos (control y experimental), el peso, el volumen, la longitud transversa, la longitud sagital del corazón y el grosor del ventrículo izquierdo fueron ligeramente superiores en el grupo experimental que en el control. Por su parte la longitud y el diámetro del ventrículo izquierdo del corazón fueron superiores en el grupo control. Solo fueron significativas las diferencias entre la longitud transversa (p=0,03746) y la longitud sagital del corazón (p=0,00231). (Tabla 2). Cuando se analizó la correlación entre las variables morfométricas al nacer y las variables macroscópicas del corazón se encontró correlación entre el peso al nacer y la longitud sagital del corazón. Además se mostró una correlación inversa entre el peso al nacer y el grosor del ventrículo izquierdo (GVI). Se demostró la correlación entre la circunferencia abdominal (CA) y la longitud del corazón. Se encontró correlación entre el diámetro biparietal (DBP) y la media del diámetro del ventrículo izquierdo (DVI) e inversamente relacionado con la longitud sagital del corazón. El diámetro anteroposterior (DAP) mostró relación con el volumen y la longitud del corazón, y el diámetro del ventrículo derecho. Además, se encuentra inversamente relacionado con la longitud sagital del corazón. (Tabla 3).
DISCUSIÓN
Los resultados indican que el bajo peso al nacer, como resultado de CIUR, tiene incidencia en la morfometría cardiaca, especialmente en el peso cardiaco y el grosor del ventrículo izquierdo. Aunque estas evidencias comienzan a mostrarse discretamente en la adolescencia en ambos sexos, se hacen más marcadas en la adultez en el sexo masculino. Estos cambios en la morfometría cardiaca se pusieron de manifiesto en las ratas adolescentes que al nacer presentaron CIUR. En este grupo, el aumento de las dimensiones cardiacas está en correspondencia con el aumento de peso del corazón con respecto a las ratas del grupo control. Esta investigación confirma hallazgos previos que documentan un aumento del peso del corazón asociado al bajo peso al nacer.5 Este aumento de peso estaría asociado con el aumento de la transcripción de genes relacionados con la hipertrofia cardiaca, crecimiento compensatorio o remodelamiento. Podría producirse como resultado de la alteración de la expresión de genes como la alfa actina cardiaca, la ciclina G1, la histamina y la subunidad 2 de la NADH deshidrogenasa en respuesta a una restricción significativa de nutrientes, que ha sido asociada a hipertrofia cardiaca en otras especies, incluida el hombre.6 Otros estudios, sin embargo, muestran la presencia de una disminución del peso y del volumen del corazón en ratas adolescentes afectadas por CIUR.7 Por su parte el aumento del grosor del ventrículo izquierdo se acompañó, como se esperaba, de la disminución de la luz ventricular, resultados que coinciden con los reportados en la literatura.6 La hipertrofia ventricular izquierda podría ser el resultado de una hiperplasia compensadora en respuesta a una disminución del número de cardiomiocitos en el momento del nacimiento.5 Este remodelamiento cardiaco en etapas tempranas podría además desencadenar alteraciones fibróticas en etapas posteriores. Estos animales desarrollarían una fibrosis intersticial del ventrículo izquierdo como resultado de un trastorno temprano en la regulación de la proliferación de los cardiomiocitos y una subsecuente hipertrofia celular que podría resultar en una acumulación de colágenos en etapas posteriores de la vida.8 Sin embargo, no quedó descartado que la hipertrofia del ventrículo izquierdo sea también una consecuencia del aumento de la tensión arterial que es más frecuente en afectados por CIUR en las distintas etapas de la vida.9 Algunos autores encontraron que en modelos experimentales que involucran la ligadura de arterias uterinas, la hipertensión aparece en estadios tempranos de la vida. 5, 10 Algunos estudios muestran la presencia de dilatación del ventrículo izquierdo11,12 mientras que otros no encontraron asociación entre el bajo peso al nacer y el diámetro del ventrículo izquierdo.13 Este estudio evidencia la presencia de cambios en la morfometría cardiaca desde la adolescencia en ambos sexos. Los resultados del presente trabajo en relación con el peso del corazón y la presencia de hipertrofia ventricular izquierda se corresponden con estudios que muestran el aumento del peso del corazón en las ratas de uno y otro sexo en periodos tempranos de la vida, afectadas de CIUR.5 Sin embargo, investigaciones realizadas por Kawamura y colaboradores, demostraron la ausencia de hipertrofia cardiaca en ratas adolescentes masculinas portadoras de CIUR. Este resultado es atribuido a la presencia en el miocardio de factores protectores que suprimen el remodelamiento cardiaco durante la adolescencia (altos niveles de ARNm para el Péptido natriurético atrial y cerebral), evitando así la aparición de hipertrofia y fibrosis cardiaca a pesar de la elevación significativa de la presión arterial sistólica.14 El peso del corazón fue ligeramente mayor en el grupo experimental en relación con las mayores dimensiones del mismo. En una revisión de numerosos trabajos realizados en ratas portadoras de CIUR, Porrello y colaboradores (2008) encontraron este mismo resultado.15 Se mantuvo la tendencia observada en las ratas adolescentes al aumento del grosor del ventrículo izquierdo con la disminución concomitante del diámetro ventricular. Este resultado coincide con trabajos que muestran una hipertrofia ventricular izquierda en ratas adultas portadoras de CIUR.8,16 En este estudio, las ratas adultas del grupo experimental (CIUR) mostraron un mayor grosor del ventrículo izquierdo y del peso del corazón en ambos sexos con respecto al grupo control, con una ligera diferencia entre las ratas del sexo masculino. Este estudio coincide con otros trabajos realizados que muestran la presencia de cambios microestructurales y enzimáticos en las células cardiacas en ratas adultas del sexo masculino. Estos hallazgos demuestran que el envejecimiento podría comportarse como un factor estresante no bien tolerado por animales expuestos a hipoxia posnatal y la posible presencia de cierta protección en el sexo femenino contra los efectos del CIUR a largo plazo.17 Otros estudios corroboran este resultado al plantear la aparición de hipertrofia ventricular izquierda como expresión de remodelamiento patológico del ventrículo izquierdo en ratas machos en la adultez como resultado del cambio de la expresión de isoformas de cadenas pesadas de miosina alfa a beta con la consiguiente alteración de la maquinaria contráctil cardiaca (en las ratas la isoforma alfa predomina en el músculo cardiaco sano mientras que la forma beta lo hace durante el remodelamiento ventricular izquierdo patológico con contracción miocárdica lenta y menos eficiente). También reportan una significativa acumulación de colágeno tipo I y III asociada a la reducción de la expresión de metaloproteinasa de la matriz (MMP-2) en el corazón (este proceso ocurre durante el envejecimiento lo cual aumentaría la rigidez de las paredes miocárdicas pero se ha visto un desarrollo acelerado del mismo en las ratas afectadas por CIUR).18 Otros autores, a pesar de encontrar una relación directa entre el CIUR y la incidencia de enfermedades cardiovasculares en la adultez, no pudieron determinar diferencias entre ambos sexos.1 Los resultados de este estudio mostraron una correlación inversa entre el peso al nacer y el grosor del ventrículo izquierdo, el tamaño celular y la presencia de los signos de isquemia. Otras variables morfométricas del recién nacido como la circunferencia abdominal, el diámetro biparietal y el diámetro anteroposterior mostraron una correlación inversa con el tamaño celular. El diámetro anteroposterior mostró además correlación inversa con la presencia de signos de isquemia. Estos resultados coinciden con la bibliografía revisada que relaciona el crecimiento intrauterino retardado con cambios en la morfometría cardiaca y principalmente con el aumento del riesgo de padecer enfermedades cardiovasculares.1,4,8,17 El bajo peso al nacer como resultado de CIUR provoca cambios en la morfometría cardiaca, especialmente en el peso del corazón y en el grosor del ventrículo izquierdo que se acompañan de un aumento del tamaño de los cardiomiocitos y un aumento de la presencia de signos de isquemia. Estos cambios se observan en ambos sexos en la adolescencia y muestran un ligero predominio en el sexo masculino en la adultez. Existe una asociación inversa entre el peso al nacer y el grosor del ventrículo izquierdo, el tamaño de los cardiomiocitos y la presencia de los signos de isquemia en el corazón.
REFERENCIAS BIBLIOGRÁFICAS
1. Rueda-Clausen CF, Morton JS, Lopaschuk GD, Davidge ST. Long-term effects of intrauterine growth restriction on cardiac metabolism and susceptibility to ischaemia/reperfusion. Cardiovasc Res. 2011;90(2):285-94
2. Ross MG, Beall MH. Adult Sequelae of Intrauterine Growth Restriction. Semin Perinatol. 2008;32(3):213-8
3. Risnes KR, Vatten LJ, Baker JL, Jameson K, Sovio U, Kajantie E, et al. Birthweight and mortality in adulthood: a systematic review and meta-analysis. Int J Epidemiol. 2011;40(3):647-61
4. Alfonso C, Tomé O. Obtención experimental de crías con crecimiento intrauterino retardado. Revista Cubana Cienc Vet. 2000;26(1):39-41
5. Menéndez Castro C, Fahlbusch F, Cordasic N, Amann K, Münzel K, et al. Early and Late Postnatal Myocardial and Vascular Changes in a Protein Restriction Rat Model of Intrauterine Growth Restriction. PLoS ONE. 2011;6(5):e20369
6. Ganu RS, Harris RA, Collins K, Aagaard KM. Early origins of adult disease: approaches for investigating the programmable epigenome in humans, nonhuman primates, and rodents. ILAR J. 2012;53(3-4):306-21
7. Cruz Álvarez Y, Tomé López O, Silva S, Cruz García MA. Estudio morfométrico de los órganos de crías de rata con crecimiento intrauterino retardado. Rev Cubana Invest Bioméd [revista en Internet]. 2007;26(1):[aprox. 23p]. Disponible en: http://scielo.sld.cu/scielo.php?pid=S0864-03002007000100004&script=sci_arttext
8. Wang KCW, Zhang L, McMillen IC, Botting KJ, Duffield JA, Zhang S, et al. Fetal growth restriction and the programming of heart growth and cardiac insulin-like growth factor 2 expression in the lamb. J Physiol. 2011;589(Pt 19):4709-22
9. Knight BS, Sunn N, Pennell CE, Adamson SL, Lye SJ. Developmental regulation of cardiovascular function is dependent on both genotype and environment. Am J Physiol Heart Circ Physiol. 2009;297(6):H2234-41
10. Zohdi V, Lim K, Pearson JT, Black MJ. Developmental programming of cardiovascular disease following intrauterine growth restriction. Findings utilising a rat model of maternal protein restriction. Nutrients. 2015;7(1):119-52
11. Patterson AJ, Zhang L. Hypoxia and Fetal Heart Development. Curr Mol Med. 2010;10(7):653-66
12. Crispi F, Bijnens B, Figueras F, Bartrons J, Eixarch E, Le Noble F, et al. Fetal Growth Restriction Results in Remodeled and Less Efficient Hearts in Children. Circulation. 2010;121(22):2427-36
13. Jiang B, Godfrey KM, Martyn CN, Gale CR. Birth Weight and Cardiac Structure in Children. Pediatrics. 2006;117(2):257-61
14. Kawamura M, Itoh H, Yura S, Mogami H, Suga S, Makino H, et al. Undernutrition in Utero Augments Systolic Blood Pressure and Cardiac Remodeling in Adult Mouse Offspring: Possible Involvement of Local Cardiac Angiotensin System in Developmental Origins of Cardiovascular Disease. Endocrinology. 2007;148(3):1218-1225
15. Porrello ER, Widdop RE, Delbridge LM. Early origins of cardiac hypertrophy: Does cardiomyocyte attrition program for pathological ‘catch-up’ growth of the heart?. Clin Exp Pharmacol Physiol. 2008;35(11):1358-64
16. Xu Y, Williams SJ, O’Brien D, Davidge ST. Hypoxia or nutrient restriction during pregnancy in rats leads to progressive cardiac remodeling and impairs postischemic recovery in adult male offspring. FASEB J. 2006;20(8):1251-3
17. Rueda-Clausen CF, Morton JS, Davidge ST. Effects of hypoxia-induced intrauterine growth restriction on cardiopulmonary structure and function during adulthood. Cardiovasc Res. 2009;81(4):713-22
18. Zohdi V, Wood B, Pearson J, Bambery KR, Black MJ. Evidence of altered biochemical composition in the hearts of adult intrauterine growth-restricted rats. Eur J Nutr. 2013;52(2):749-58
Recibido: 12 de enero de 2015.
Aprobado: 23 de noviembre de 2015.
Claudia Joffre Fríaz. Especialista de I Grado en Embriología. Instituto de Ciencias Básicas y Preclínicas Victoria de Girón. Habana. Correo electrónico: claudia.joffre@infomed.sld.cu