Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
MediSur
versión On-line ISSN 1727-897X
Medisur vol.16 no.3 Cienfuegos may.-jun. 2018
ARTÍCULO ORIGINAL
Aislamientos de Acinetobacter en pacientes ingresados en Unidades de Cuidados intensivos
Isolation of Acinetobacter in patients admitted to Intensive Care Units
Midiela López LópezI , Juan Rafael Zerquera RodriguezII , Midiala Iglesias LópezI , Yanet Rodríguez ZuluetaI
I Hospital General Universitario Dr. Gustavo Aldereguía Lima, Cienfuegos, Cuba
II Universidad Ciencias Medicas de Cienfuegos, Cienfuegos, Cuba
RESUMEN
Fundamento: en los últimos años, las bacterias del género Acinetobacter han adquirido importancia epidemiológica de forma gradual y ascendente, debido a su emergencia como patógeno oportunista.
Objetivo: caracterizar los aislamientos microbiológicos de Acinetobacter en pacientes ingresados en Unidades de Cuidados Intensivos en el Hospital Provincial de Cienfuegos.
Métodos: estudio descriptivo que incluyó los 231 aislamientos de Acinetobacter de las muestras provenientes de pacientes de las Salas de Cuidados Intensivos en el período del 1 de septiembre del 2015 hasta el 30 de septiembre del 2016 en el Hospital Provincial de Cienfuegos. Se analizaron las variables: salas de dónde provenía el aislamiento, tipo de muestra, susceptibilidad antimicrobiana in vitro, especie.
Resultados: el mayor número de aislamientos de Acinetobacter se obtuvo en la Unidad de Cuidados Intensivos Polivalentes (62,3 %). Acinetobacter baumannii fue la especie más aislada en todos los servicios para un 92,2 %; las secreciones respiratorias fueron las muestras con más aislamientos(56,3 %). Más de un 80 % de los aislamientos fueron resistentes a la mayoría de los antibióticos β-lactámicos y se encontró un porciento elevado de cepas multirresistencia y panrresistencia(41,6 % y 48,1 % respectivamente).
Conclusiones: el género Acinetobacter se encuentra vinculado a las infecciones asociadas a los Servicios Sanitarios, fundamentalmente el Acinetobacter baumannii y en los cuidados intensivos polivalentes.
Palabras clave: acinetobacter, infecciones por acinetobacter, cuidados críticos.
ABSTRACT
Foundation: in the last years bacterias of the Acinetobacter gender have adquired great epidemiological relevance in gardual ascending way, due to its emergence as an opportunistic pathogen.
Objective: to characterize microbiological isolations of Acinetobacter in patients admitted to the Intensive Care Units at the Provincial Hospital Dr Gustavo Aldereguia Lima.
Methods: descriptive study which included the 231 Acinetobacter isolations of samples from Intensive Care Units in the period September 1st 2015 to September 30th 2016 in the Cienfuegos Provincial Hospital. The following variables were analyzed: Wards from which the isolation was coming from, type of sample, antimicrobial susceptibility in vitro and specie.
Results: the highest number of Acinetobacter isolations was obtained at the Polyvalent Intensive Care Unit (62,3%). Acinetobacter baumannii was the most isolated specie with a 92,2%. Respiratory exudate were the samples with more isolations (53,3%). More than 80% of the isolations were resistant to most β-lactam antibiotics and it was found a high percentage of multi-drug and pan-drug resistant strains (41,6% and 48,1% respectively).
Conclusion: the Acinetobacter gender is linked to infections connected to Sanitary Services mainly the Acinetobacter baumannii and in the Intensive Care Units.
Key words: acinetobacter, acinetobacter infections, critical care.
INTRODUCCIÓN
Las infecciones asociadas a la asistencia sanitaria constituyen un grave problema de la salud pública a nivel mundial por su frecuencia y elevada mortalidad.1 En las dos últimas décadas se se ha producido un aumento de la incidencia de infecciones causadas por bacterias multirresistentes. La diseminación de estos microorganismos en el hospital supone un importante problema epidemiológico y terapéutico que afecta especialmente a pacientes en estado crítico ingresados en la Unidad de Cuidados Intensivos (UCI). Su control resulta extremadamente difícil debido a su elevada capacidad de persistir en el ambiente hospitalario y por su frecuente multirresistencia a los antibióticos.2-4 Actualmente han cobrado notoria importancia y se destacan en estas el hallazgo de especies como Pseudomonas aeruginosa y Acinetobacter sin precisar especie (spp); Acinetobacter baumannii es la especie que con mayor frecuencia se asocia a infecciones graves relacionadas con la asistencia sanitaria y la muerte.5 Se ha sugerido que la piel puede ser fuente de infección por Acinetobacter baumannii como causa de bacteriemia. En estudios realizados se han aislado Acinetobacter baumannii de alimentos como frutas vegetales, lo cual sugiere que puede ser una fuente potencial de colonización del tracto digestivo de pacientes hospitalizados; también ha sido aislado de artrópodos, en elementos hospitalarios, ventiladores, equipos de aspiración, colchones, almohadas, humidificadores, contenedores de agua destilada, dispensadores de jabón y nebulizadores;6 usualmente se han mostrado resistentes a desinfectantes de nivel bajo o intermedio.7 La bacteria se puede diseminar por el aire a distancias cortas mediante gotitas de agua y por la descamación de la piel de pacientes que están colonizados, pero el modo de transmisión más común es por las manos del personal asistencial.8 El manejo de las infecciones causadas por Acinetobacter es complejo debido a que presentan diversos mecanismos de resistencia intrínsecos y adquiridos, como son la producción de βlactamasas, la poca permeabilidad y las bombas de expulsión.9 Acinetobacter afecta, especialmente, a pacientes inmunocomprometidos que han sido sometidos a cirugía mayor o traumatismo, o aquellos con enfermedades subyacentes graves, tales como quemaduras, inmunosupresión y tumores malignos. Entre las infecciones se incluyen: neumonía, principalmente asociadas a ventilación mecánica, septicemia, endocarditis, meningitis, sepsis de la herida y la piel e infección del tracto urinario.10,11 La sociedad americana de enfermedades infecciosas publicó una lista de alarma para llamar la atención sobre los seis microorganismos más peligrosos en estos momentos, no solo por su virulencia, sino por ser resistentes a la gran mayoría de los antibióticos disponibles en la actualidad, en el cuarto lugar de dicha lista se encuentra Acinetobacter baumannii.11,12 Se han reportado altas tasas de resistencia antimicrobiana en Acinetobacter, sus patrones de resistencia varían según especies aisladas y zona geográfica. Se afirma que, pese a haber aumentado la resistencia de Acinetobacter baumannii a todas las familias de antibióticos y de forma generalizada en todo el mundo, todavía se aprecian importantes diferencias entre lugares geográficamente distantes.13 En la actualidad se considera como un patógeno emergente, ya que en pocos años se ha incrementado de modo alarmante el número de aislamientos responsables de infecciones asociadas a los servicios sanitarios en pacientes graves, muchos de ellos son además multirresistentes, lo cual complica enormemente el tratamiento y empeora el pronóstico del paciente infectado por estos microorganismos. Por ser un microorganismo poco estudiado desde el punto de vista microbiológico en el hospital de Cienfuegos, se realizó esta investigación con el objetivo de caracterizar los aislamientos de Acinetobacter en pacientes ingresados en Unidades de Cuidados Intensivos en el Hospital Provincial de Cienfuegos.
MÉTODOS
Se realizó un estudio de tipo descriptivo, observacional, prospectivo utilizando como escenario el Laboratorio de Microbiología del Hospital General Dr. Gustavo Aldereguía Lima, provincia de Cienfuegos, durante el periodo comprendido desde el 1ro de septiembre del 2015 hasta el l 30 de septiembre del 2016, que incluyó los 231 aislamientos provenientes de las Salas de Cuidados Intensivos del Hospital. Una vez recibidas las muestras en el laboratorio, fueron procesadas para la búsqueda del microorganismo, según tipo de muestra, acorde a lo establecido para su identificación como Acinetobacter. Los cultivos se identificaron según la metodología usual del laboratorio, en dependencia del tipo de muestra se seleccionaron los medios de cultivo. La siembra se realizó en placas y se incubaron por 18-24 horas a 35- 37 °C en atmosfera de aerobiosis y transcurrido este tiempo se realizó la lectura de las colonias con características culturales típicas del microorganismo. Luego se realizó la identificación presuntiva de Acinetobacter, la cual se hizo sobre la base de la falta de actividad –citocromooxidasa, carencia de motilidad y resistencia a la penicilina. Para la determinación de las especies de Acinetobacter se utilizó un algoritmo de trabajo según Bouvet y Grimont modificado por Gerner-Smidt y cols: Kligler, motilidad, OF con dextrosa, urea de Christensen, hemolisis en sangre de carnero, desarrollo a 37°C y 44°C, malonato y citrato. Según los resultados obtenidos en las pruebas fisiológicas antes mencionadas se clasificaron en especie cada aislamiento de Acinetobacter. Se determinó la susceptibilidad antimicrobiana in vitro, según método de difusión por discos Bauer Kirby, recomendado por el Clinical and Laboratory Standards Institute (CLSI, antes NCCLS). La determinación de la resistencia bacteriana in vitro según método de difusión por discos de Kirby Bauer, requiere del uso de discos comerciales de papel impregnados con antimicrobianos, con sus respectivas cargas. En este estudio fueron incluidos los siguientes: ampicillin/ sulbactam, ceftazidime, ciprofloxacino, levofloxacino, meropenem, gentamicina, amikacina, piperacilina/tazobactam, cefepime, ceftriaxona, tetraciclina, doxiciclina, tigeciclina, piperacilina y trimethroprin-sulfamethoxazol. Como limitantes se debe señalar la ausencia de discos de imiperem y de las tiras de Épsilon Test de Colistina. La lectura interpretativa de los resultados del antibiograma se efectuó después de 18-24 horas de incubación a 37°C en atmosfera de aerobiosis, luego se midieron los halos de inhibición del crecimiento y se compararon con los diámetros de inhibición estándares del CLSI 2014 teniendo en cuenta tres categorías: sensible, intermedio y resistente. Paralelamente se probaron cepas control de Pseudomona aeruginosa ATCC 27853, Staphylococcus aureus ATCC 25923 y Escherichia coli ATCC 25922, las cuales son las cepas recomendadas por el CLSI, para comprobar la calidad del medio y de los discos. Los microorganismos en estudio se conservaron en medio de solución salina al 0,9 % hasta que concluyó la investigación. Se describió la procedencia de los aislamientos según el tipo de muestra de acuerdo al sitio donde se localizaba el proceso infeccioso, y el servicio de procedencia del paciente en el momento de la recolección de la muestra. La información se recogió mediante un documento de recogida de los datos, en el propio Laboratorio de Microbiología. Los datos fueron procesados por el Programa Microsoft Excel y analizados en SPSS con la versión 21.0 en español. Los resultados se presentan en tablas mediante números absolutos y porcentaje. El trabajo constó con la aprobación del consejo científico y del comité de ética de la investigación de la institución.
RESULTADOS
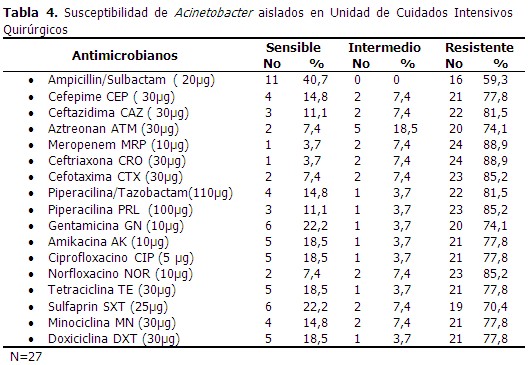
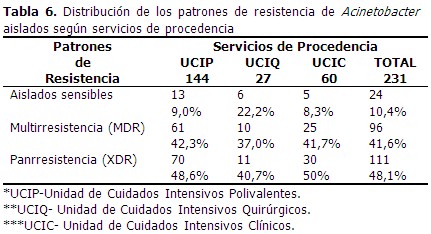
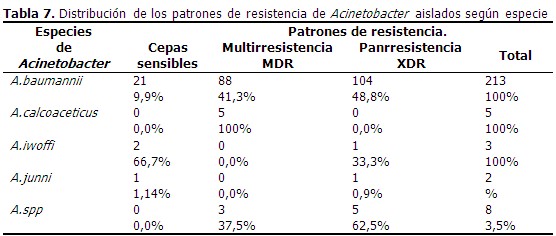
Se procesaron 231 aislamientos, el mayor número procedente de la Unidad de Cuidados Intensivos Polivalentes, seguido de la Unidad de Cuidados Intensivos Clínicos y la Unidad de Cuidados Intensivos Quirúrgicos para un 62,3 %; 26,0 % y un 11,7 % respectivamente. Acinetobacter baumannii fue la especie más aislada en todos los servicios para un 92,2 % y a su vez la más frecuente en Unidad de Cuidados Intensivos Polivalentes pues representó un 93,8 % del total de aislamientos que hubo en el servicio. (Tabla 1). La mayor cantidad de aislamientos se produjo en las secreciones respiratorias (56,3 %), seguido de los obtenidos de las puntas de catéter y hemocultivos con 20,8 % y 13,4 % respectivamente. A. baumannii continuó siendo la especie más encontrada en las muestras estudiadas. (Tabla 2). Al analizar la susceptibilidad in vitro de las cepas de Acinetobacter aislados en Unidad de Cuidados Intensivos Polivalentes ante diferentes agentes antimicrobianos, se observó que dentro de los antibióticos β-lactámicos, todas las cepas fueron resistentes en más de un 80 %, con excepción de ampicillin con sulbactam (AMS) con 69,4 % y la doxiciclina (DXT) con 76,4 %. El mayor porcentaje de resistencia se observó ante ceftriaxona y ceftazidima, con 95,1 %, seguido de la cefotaxima con 92,4 % y en tercer lugar ciprofloxacino y norfloxacino con 91,0 %. (Tabla 3). En los Cuidados Intensivos Quirúrgicos se observó que la resistencia de los antibióticos probados está en su mayoría por encima del 70 %, con mayores porcientos de resistencia a meropenem y ceftriaxona para un 88,9 %, cefuroxima y piperacilina con 85,2 % y ceftazidima y piperacilina con tazobactam con 81,5 % respectivamente. (Tabla 4). La susceptibilidad de Acinetobacter aislados en Unidad Cuidados Intensivos Clínicos, en comparación con el resto de las terapias, mostró porcientos de resistencia más elevados al estar por encima del 85 % excepto al ampicillin con sucbactam (73,3 %), piperacilina con tazobactam (81,7 %), minociclina (81,7 %) y doxiciclina (75,0 %). (Tabla 5). De todos los aislamientos solo 24 fueron sensibles (10, 4 %) 96 mostraron multirresistencia (41,6 %) y 111 mostraron panresistencia (48,1 %). En la Unidad de Cuidados Intensivos Polivalentes se obtuvo el mayor número de aislamientos con multirresistencia y panresistencia, para un 42,3 % y un 48, 6 % respectivamente. (Tabla 6). Al analizar la distribución de los patrones de resistencia de Acinetobacter aislados según especie se comprobó que los mayores porcientos de aislamientos multirresistentes y extremadamente resistentes fueron de Acinetobacter baumannii con 41, 3 % de multirresistencia y 48, 8 % de panresistencia entre los aislamientos de la especie. (Tabla 7).
DISCUSIÓN
En este trabajo se realizó el estudio de todos los aislamientos de Acinetobacter en pacientes graves, realizados en un año. El mayor número se obtuvo en la Unidad de Cuidados Intensivos Polivalentes y fue el Acinetobacter baumannii la especie más aislada, acorde con lo que se describe en las diferentes bibliografías estudiadas.10,14,15 como en el estudio realizado por Nodarse Hernández sobre la identificación fenotípica de los aislamientos de Acinetobacter spp, donde se mostró que dentro de este género sigue siendo A. baumannii la especie más aislada en el ambiente hospitalario, además mostró que más de la mitad de los aislamientos fueron en pacientes ingresados en la Unidad de Cuidados Intensivos de adultos.16 Otros resultados similares son los obtenidos por Hernández Torres en estudio realizado en pacientes atendidos en un hospital universitario de la Ciudad Autónoma de Buenos Aires, Argentina donde se aprecia que la frecuencia de aislamiento de A. baumannii fue de 79,5 %.17 Las diferentes especies de Acinetobacter son patógenos oportunistas que han sido implicados en infecciones nosocomiales que afectan principalmente a pacientes en estado crítico, lo que hace que frecuentemente una de las secreciones donde más se aíslan sean secreciones respiratorias. Lo anterior fue corroborado en nuestro estudio, así como en los resultados obtenidos en uno realizado en el Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández de Matanzas por Arnold Rodríguez en el 2011-2012, en que la secreción endotraqueal resultó la más frecuente,18 al igual que Nodarse Hernández en el Hospital Militar Central Dr. Luis Díaz Soto de La Habana, en el 2015, donde en el aislamiento por muestras sobresalió la secreción bronquial con 46,6 %.16 Además de la importancia que tiene la identificación de la especie de Acinetobacter implicada en el proceso infeccioso para el control y tratamiento correcto de las infecciones producidas por estos microorganismos, también es fundamental la caracterización del perfil de sensibilidad a distintos antibióticos. Esto resulta de gran importancia en el entorno clínico donde lo que se persigue es establecer un tratamiento apropiado y dirigido tanto al tipo de infección como al microorganismo causal, siempre ajustado al perfil de cada paciente. Espinosa Rivera y colaboradores observaron patrones de resistencia muy elevados frente a todos los antibióticos estudiados. La resistencia alcanzó el 98,1 % frente a la ceftriaxona; 96,9 % para la ciprofloxacino y 81,4 % frente al meropenem. Solo frente a colistina muestra una sensibilidad que alcanza el 98 % o el 2 % de resistencia.19 Resultados que no difieren en gran medida de los que se presentan, más no se puede comparar la colistina por la limitación objetiva que se presentó en la presente investigación al no contar con las tiras de Epsilon test. R. Cantón y colaboradores describen el comportamiento de la resistencia a ciertos grupos de antimicrobianos evaluando comportamiento desde el 2000 hasta el 2010. Los antimicrobianos para los que se observó mayor proporción de aislados no sensibles fueron la ceftazidima, la piperacilina y el cipro?oxacino (>94%), seguidos de los carbapenémicos y la tetraciclina (82-86 %), la tobramicina, el sulbactam, la gentamicina y la doxiciclina (60-70 %), la amikacina (49 %) y la minociclina y la rifampicina (30 %). Los que ofrecieron menores porcentajes con los criterios empleados fueron la tigeciclina (24 %) y la colistina (3 %). Las cifras de aislados no sensibles a los carbapenémicos (Imipenem, 82%; Meropenem, 83%; Doripenem, 86%) son particularmente preocupantes, al ser mucho mayores que las observadas en el estudio del año 2000, con cifras para el imipenem y el meropenem fueron del 48 % y del 43 %, respectivamente. Para el resto de los antibióticos β-lactámicos estudiados, también aumentó signi?cativamente el porcentaje de aislados resistentes, incluidos el sulbactam. Por el contrario, la resistencia a los aminoglucósidos disminuyó sustancialmente entre 2000 y 2010: del 96 al 70 % para la gentamicina, del 79 al 60 % para la tobramicina y del 65 al 49 % para la amikacina.20 En nuestro trabajo la resistencia a los aminoglucósidos (gentamicina 85,4% y amikacina 88,2%) se encuentra por encima de lo obtenido en el 2010, en el trabajo anterior, coincide con el nuestro los resultados de la resistencia a β-lactámicos y carbapenémicos en UCIQ donde se pudo apreciar que la resistencia de los antibióticos probados está en su mayoría por encima del 70 %, con los mayores porcientos de resistencia a meropenem y ceftriaxona para un 88,9 %, cefuroxima y piperacilina con 85,2 % y ceftazidima y piperacillina con tazobactam con 81,5 % respectivamente. Como podemos ver la resistencia del género ante los antimicrobianos continúa siendo un reto para el personal médico nuestro y del mundo. En trabajo realizado en las salas de cuidados intensivos de tres hospitales docentes de Hamadan City, en Irán se pudo apreciar una resistencia a imiperem, meropenem, ceftazidima y cefotaxima, cercana a 90 % en imiperem y superior a 95 % en el resto de los antibióticos, valores estos que se relacionan con los resultados del presente trabajo, aunque la resistencia de las cefalosporinas nosotros la tenemos entre los 80-90 % (es decir un poco por debajo que lo demostrado en el anterior trabajo).21 Ali Al Bshabshe y colaboradores en estudio realizado en Saudi Arabia, en un año de análisis (2015) obtuvieron los siguientes resultados A. baumannii con 100% de sensibilidad a la colistina y 74,5 % para rimethoprim + sulfamethoxazol. Los restantes 19 antimicrobianos presentaron baja sensibilidad o ninguna,22 resultados que se corresponde con nuestro trabajo, aunque no se puede comparar la colistina pues no pudo ser utilizada en el presente estudio. Con respecto a la susceptibilidad de los aislamientos de Acinetobacter de la Unidad Cuidados Intensivos Clínicos se puede decir que al compararla con el resto de las terapias tiene los porcientos de resistencia más elevados, por encima del 85 % excepto el ampicillin con sulbactam (73,3 %), piperacilina con tazobactam (81,7 %), minociclina (81,7 %) y doxiciclina (75,0 %).Estos resultados pudieran estar en relación con la calidad de vida de los pacientes que ingresan en el servicio que son por lo general pacientes de edad avanzada por lo que con frecuencia presentan comorbilidades y muchas veces han sido tratados con múltiples antimicrobianos. Cuando comparamos nuestros resultados con los de S Koubaji y colaboradores en el trabajo realizado en Berlín, Germany, se observa que no coinciden, pues ellos obtuvieron resultados en salas de cuidados intensivos, con una resistencia al imipenem en 66 %, 100 % a la amikacina, 100 % a las quinolonas y 16 % de susceptibilidad a la fosfomicina; 94, 11 % susceptibles a la colistina, 94 % a la rifampicina y 100 % a la tigeciclina.23 En Matanzas, Arnold Rodríguez habla de un porcentaje de aislamientos de Acinetobacter multirresistente en UTI de 53,03 % y en servicios abiertos 39,39 %, 1 dato este que se corresponde con nuestros resultados. La mayoría de los estudios de vigilancia indican los porcentajes de cepas sensibles (o resistentes) a una variedad de antibióticos. Sin embargo, pocos evalúan el porcentaje de resistentes a múltiples antibióticos. Por otra parte, cuando se han producido dichas evaluaciones, se han utilizado una variedad de definiciones de multirresistencia. La OMS advierte en Ginebra, Suiza, en enero de 2015, que a partir de ese año asistiríamos a enfermos que morirán por enfermedades infecciosas de origen bacteriano que antes eran curables: estamos en la era postantibiótica. Reflexionemos en función de esto tratando de buscar soluciones a este importante asunto. Se puede concluir que el género Acinetobacter se encuentra hoy estrechamente vinculado a las infecciones asociadas a los servicios sanitarios. En esta investigación la Unidad de Cuidados Intensivos Polivalente fue donde hubo mayor número de aislamientos y la especie que predominó fue Acinetobacter baumannii. En las muestras estudiadas las secreciones respiratorias fueron las más representadas. En general hubo un predominio de los aislamientos con multirresistencia y panresistencia.
REFERENCIAS BIBLIOGRÁFICAS
1. Rodríguez A. Infección por Acinetobacter spp. en Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández de Matanzas. 2011-2012. Rev Méd Electrón [revista en Internet]. 2014 [citado 3 Feb 2015];36(1):[aprox. 12p]. Disponible en: http://www.revmatanzas.sld.cu/revista medica/ano 2014/vol1 2014/tema02.htm
2. Asencio MA, Carranza R, Huertas M. Resistencia a antimicrobianos de los microorganismos más frecuentemente aislados en el Hospital General La Mancha Centro entre junio de 2009 y mayo de 2010. Rev Esp Quimioter [revista en Internet]. 2012 [citado 12 Feb 2016];25(3):[aprox. 14p]. Disponible en: http://pesquisa.bvsalud.org/oncologiauy/resource/es/ibc-103615
3. Orozco-Rico M. Acinetobacter baumannii multidrogo-resistente y pandrogo-resistente: perspectiva, mecanismos de resistencia y tratamiento. Rev Med MD [revista en Internet]. 2011 [citado 18 Mar 2017];3(1):[aprox. 14p]. Disponible en: http://new.medigraphic.com/cgi-bin/resumen.cgi?IDARTICULO=38972
4. Lee K, Yong D, Hoon JS, Chong Y. Multidrug-Resistan Acinetobacter spp.: Increasingly Problematic Nosocomial Pathogens. Yonsei Med J [revista en Internet]. 2011 [citado 19 Nov 2016];52(6):[aprox. 14p]. Disponible en: https://www.eymj.org/DOIx.php?id=10.3349/ymj.2011.52.6.879
5. Galí Navarro MC. Profilaxis antimicrobiana. Estrategias en cirugía cardiovascular. Rev Acta Médica [revista en Internet]. 2011 [citado 11 Nov 2016];13(1):[aprox. 18p]. Disponible en: http://new.medigraphic.com/cgi-bin/resumen.cgi?IDARTICULO=49359
6. Medina Castro OE. Acinetobacter baumannii. Colombia: Universidad Nacional de Colombia. Facultad de Ciencias; 2011
7. Vanegas-Múnera JM, Roncancio-Villamil G, Jiménez-Quiceno JN. Acinetobacter baumannii: importancia clínica, mecanismos de resistencia y diagnóstico. Rev CES Med [revista en Internet]. 2014 [citado 18 Mar 2017];28(2):[aprox. 16p]. Disponible en: http://www.scielo.org.co/pdf/cesm/v28n2/v28n2a08.pdf
8. Arroyave Y, Agudelo H, Rojas A. Caracterización de un brote de infección o colonización por Acinetobacter baumannii, en el Hospital Universitario San José, E.S.E., Popayán, Colombia. Rev Colomb Cir [revista en Internet]. 2014 [citado 12 Mar 2017];29(1):[aprox. 12p]. Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S2011-75822014000100007
9. Vanegas JM, Higuita LF, Vargas CA, Cienfuegos AV, Rodríguez EA, Roncancio GE, Jiménez JN. Acinetobacter baumannii resistente a carbapenémicos causante de osteomielitis e infecciones de la piel y los tejidos blandos en hospitales de Medellín, Colombia. Biomédica [revista en Internet]. 2015 [citado 14 Ene 2016];35(4):[aprox. 12p]. Disponible en: http://www.revistabiomedica.org/index.php/biomedica/article/view/2572
10. Teme C, Franco O, Weber E, Gurrieri A, Samudio G. Acinetobacter en una sala de cuidados intensivos pediátricos. Nuestra experiencia. Pediatría [revista en Internet]. 2010 [citado 12 Mar 2017];37(1):[aprox. 10p]. Disponible en: http://scielo.iics.una.py/scielo.php?pid=S1683-98032010000100004&script=sci_abstract&tlng=es
11. Hart Casares M, Espinosa Rivera F, Halley Posada MC, Martínez Batista ML, Montes de Oca Méndez Z. Resistencia a antibióticos en cepas de Acinetobacter baumannii aisladas de enero a marzo del 2010 en el Hospital Clínico quirúrgico "Hermanos Ameijeiras". Rev Cubana Med [revista en Internet]. 2010 [citado 12 Mar 2017];49(3):[aprox. 14p]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232010000300001
12. Diomedi PA. Infecciones por Acinetobacter baumannii pan-resistente. Consideraciones epidemiológicas y de manejo antimicrobiano actualizado. Rev Chil Infectol [revista en Internet]. 2005 [citado 12 Mar 2017];22(4):[aprox. 22p]. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182005000600003
13. González G, Mella S, Zemelman R, Bello H, Domínguez M. Integrones y cassettes genéticos de resistencia: estructura y rol frente a los antibacterianos. Revista Médica de Chile [revista en Internet]. 2004 [citado 11 Mar 2017];132:[aprox. 14p]. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0034-98872004000500013
14. Hernández A, García E, Yagüe G, Gómez J. Acinetobacter baumannii multirresistente: situación actual y nuevas perspectivas. Rev Esp Quimioter [revista en Internet]. 2010 [citado 14 Mar 2017];23(1):[aprox. 8p]. Disponible en: http://www.seq.es/seq/0214-3429/23/1/hernandez.pdf
15. López BS, Amyes SG. Role of ISAba1 and ISAba125 in Governing the Expression of blaADC in Clinically Relevant Acinetobacter baumannii Strains Resistant to Cephalosporins. J Med Microbiol [revista en Internet]. 2012 [citado 19 Abr 2017];61(Pt 8):[aprox. 8p]. Disponible en: https://www.ncbi.nlm.nih.gov/labs/articles/22499776/
16. Espinosa F, Hart M, Halley M, Pardo A. Resistencia bacteriana de cepas aisladas en el Hospital "Hermanos Ameijeiras". Rev Cubana Med [revista en Internet]. 2008;47(4):[aprox. 8p]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232008000400002
17. Nodarse Hernández R, Fuerte Calvo ME. Identificación fenotípica de cepas de Acinetobacter circulantes. Rev Cub Med Mil [revista en Internet]. 2015 [citado 18 Mar 2017];44(1):[aprox. 12p]. Disponible en: http://www.bvs.sld.cu/revistas/mil/vol44_1_15/mil05115.htm
18. Hernán Rodríguez C, Nastro M, Dabos L, Vay C, Famiglietti A. Frecuencia de aislamiento y resistencia a los antimicrobianos de Acinetobacter spp. recuperadas de pacientes atendidos en un hospital universitario de la Ciudad Autónoma de Buenos Aires, Argentina. Rev Argent Microbiol [revista en Internet]. 2014 [citado 14 Mar 2017];46(4):[aprox. 14p]. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-75412014000500008
19. Arnold Rodríguez M. Infección por Acinetobacter spp. en Hospital Universitario Clínico Quirúrgico Comandante Faustino Pérez Hernández de Matanzas. 2011-2012. Rev Med Electrón [revista en Internet]. 2014 [citado 14 Mar 2017];36(1):[aprox. 12p]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684-18242014000100002
20. Espinosa Rivera F, Hart Casares M, Halley Posada M del C, Zamora Marín R. Control multidisciplinario de la infección nosocomial en un hospital de nivel terciario. Rev Cubana Med [revista en Internet]. 2011 [citado 12 Ene 2017];50(1):[aprox. 14p]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232011000100004
21. Safaria M, Mozaffari Nejad AS, Bahadord A, Jafarie R, Alikhania MY. Prevalence of ESBL and MBL encoding genes in Acinetobacter baumannii strains isolated from patients of intensive care units (ICU). Saudi Journal of Biological Sciences [revista en Internet]. 2015 [citado 12 Mar 2017];22(4):[aprox. 10p]. Disponible en: http://www.sciencedirect.com/science/article/pii/S1319562X15000054
22. Bshabshe AA, Joseph MRP, Hussein AA, Haimour W, Hamid ME. Multidrug resistance Acinetobacter species at the intensive care unit, Aseer Central Hospital, Saudi Arabia: A one year analysis. Asian Pac J Trop Med [revista en Internet]. 2016 [citado 18 Ene 2017];9(9):[aprox. 10p]. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/27633307PMID:27633307DOI:10.1016/j.apjtm.2016.07.016
Recibido: 31 de octubre de 2017.
Aprobado: 06 de junio de 2018.
Midiela López López. Especialista de I Grado en Microbiología. Especialista de I Grado en Medicina General Integral. Profesor Asistente. Hospital General Universitario Dr. Gustavo Aldereguía Lima. Cienfuegos. Correo electrónico: midielall750513@minsap.cfg.sld.cu