Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Habanera de Ciencias Médicas
versión On-line ISSN 1729-519X
Rev haban cienc méd v.6 n.4 Ciudad de La Habana oct.-nov. 2007
Universidad Nacional de Rosario, Argentina
Facultad de Ciencias Bioquímicas y Farmacéuticas
ESTRES OXIDATIVO Y SU EFECTO SOBRE CALIDAD SEMINAL
*Dra. Beatriz Reina Bouvet. Gabriel Carrasco 1854. 2000 Rosario, Santa Fe, Argentina. Teléfono: 0341-4302317 . beatrizbouvet@arnet.com.ar
**Dra. Cecilia Vicenta Paparella. Guemes 2147. 2000 Rosario, Santa Fe, Argentina. Teléfono: 0341-4470462. ceciliapaparella@yahoo.com.ar
***Dr. Rodolfo Néstor Feldman. Dorrego 543. 2000 Rosario, Santa Fe, Argentina. Teléfono: 0341-4252579 . rodolfofeldman@gmail.com
*Bioquímica. Docente Jefa de Trabajos Prácticos del Area Química Analítica Clínica (pregrado) y Especialidad en Bioquímica Clínica: Endocrinología (postgrado) del Departamento de Bioquímica Clínica. Facultad de Ciencias Bioquímicas y Farmacéuticas de Rosario, Argentina.
**Bioquímica. Jefa de Trabajos Prácticos Area Química Analítica Clínica, Departamento de Bioquímica Clínica, Facultad de Ciencias Bioquímicas y Farmacéuticas de Rosario, Argentina.
*** Médico Endocrinólogo y Andrólogo del Servicio de Reproducción, Facultad de Ciencias Médicas de Rosario. Universidad Nacional de Rosario, Argentina.
RESUMEN
La membrana espermática tiene ácidos grasos insaturados que la tornan vulnerable al ataque de sustancias oxígeno reactivas. Los espermatozoides poseen sistemas protectores, pero un desbalance entre pro y antioxidantes produce estrés oxidativo". Objetivo: estudiar en semen de hombres infértiles, el efecto del estrés oxidativo sobre la membrana y núcleo espermático. Se analizaron muestras seminales de 142 hombres infértiles. Se efectuó espermograma, se seleccionaron 83 muestras sin aglutinación ni hiperviscosidad y con concentración espermática mayor a 5 x 10 6 /ml. Se estudió la membrana espermática con Test Hipoosmótico, la condensación cromatínica con Azul de Anilina y el ADN con Naranja de Acridina. Para estrés oxidativo se aplicó el Test MOST (movilidad traslativa final/movilidad traslativa inicial) que evalúa la pérdida de movilidad de los espermatozoides luego de ser incubados por 4 hs. en baño de agua a 40 °C. Se agruparon las muestras en G1: MOST mayor o igual a 0.40 (normal) y G2: MOST menor a 0.40 (anormal). El análisis estadístico demostró diferencia significativa (p<0.003) en las 3 pruebas funcionales. El estrés oxidativo altera estructuras espermáticas esenciales.
Palabras clave : semen, estrés oxidativo, espermatozoide, infertilidad
INTRODUCCION
Los espermatozoides de los mamíferos se caracterizan por su capacidad de generar sustancias oxígeno reactivas (ROS) que incluyen anión superóxido y peróxido de hidrógeno. El efecto tóxico de estos radicales libres sobre el espermatozoide humano se describió en 1943. 1 El metabolismo normal del oxígeno produce ROS, tales como: anión superóxido, peróxido de hidrógeno y el radical hidroxilo, que alteran la función espermática. La membrana espermática tiene alto contenido de fosfolípidos unidos a ácidos grasos insaturados que la hacen vulnerable a cambios peroxidativos, además el espermatozoide humano posee escasa cantidad de citoplasma que limita la acción antioxidante de los sistemas enzimáticos reparadores. La acción de las ROS involucra la peroxidación de los ácidos grasos no saturados de la membrana plasmática, produce cambios en la fluidez de la misma que altera profundamente el comportamiento espermático,y conduce a problemas de migración, capacitación, unión y fusión de las gametas. 2 La calidad de la membrana celular depende de su capacidad de permitir el transporte de determinados fluidos y ciertas moléculas a través de ella. Basándose en esta propiedad se desarrolló un test denominado Test Hipoosmótico, muy utilizado para determinar la integridad funcional de la membrana plasmática. 3
La producción de ROS se puede determinar por diferentes métodos: bioquímicos, luminiscentes, enzimáticos, así como también estimar la resistencia a la lipoperoxidación por medio de bioensayos. Entre estos últimos, el test de estrés espermático (MOST) se ha propuesto como un predictor de la capacidad fertilizante del espermatozoide. Se demostró que la tasa de pérdida de la movilidad in vitro correlaciona con la producción. 4 Un desbalance entre la generación de ROS y los mecanismos de defensa antioxidantes producen una situación de estrés oxidativo (EO). 5
El núcleo espermático presenta una organización muy particular de la cromatina, diferente a la que se encuentra en las células somáticas. Durante la espermatogénesis alrededor de 85 % de las histonas, proteínas clásicas de las células somáticas, son reemplazadas por proteínas de transición y posteriormente por proteínas más pequeñas, altamente básicas llamadas protaminas. Estas protaminas participan en uniones disulfuro e interactúan fuertemente con el ADN compactándolo en una cromatina altamente condensada, química y mecánicamente resistente, que protege la integridad del genoma paterno durante el transporte del espermatozoide por el tracto reproductor masculino y femenino. El EO actualmente considerado como la principal causa de daño del ADN espermático, altera estos procesos bioquímicos que se llevan a cabo durante la espermatogénesis. El colorante Azul de Anilina tiñe selectivamente las histonas que son proteínas ricas en lisina y se utiliza para evidenciar núcleos espermáticos inmaduros. 6 El ADN con estructura cromatínica anormal tiene mayor susceptibilidad a la desnaturalización ácida. El ensayo de Naranja de Acridina evalúa la capacidad del ADN para resistir la desnaturalización ácida inducida por el colorante y se cuantifica a través del cambio metacromático de color verde (ADN nativo) al rojizo (ADN desnaturalizado) (ADN nativo) al rojizo (ADN desnaturalizado) 7.
Objetivo:
Estudiar en muestras de semen de pacientes infértiles, la relación del estrés oxidativo con la integridad de la membrana espermática, la condensación de la cromatina y el ADN nuclear.
MATERIAL Y METODOS
Pacientes: Se analizaron muestras de semen de 142 hombres de 20 a 45 años de edad, quienes consultaron por infertilidad en el Servicio de Reproducción del Hospital Provincial del Centenario desde mayo de 2004 a junio de 2006 . Todos presentaban infertilidad primaria de, al menos, un año de duración; no eran fumadores y tenían evaluación física normal. Las muestras seminales se recogieron por masturbación, luego de 3 a 5 días de abstinencia sexual. Luego de la licuefacción y antes de la hora de eyaculación se efectuó espermograma y estudios funcionales espermáticos según normas OMS. 8 Se seleccionaron 83 muestras, siendo el criterio de exclusión la concentración de espermatozoides móviles post swim-up menor de 5 x10 6 /ml, presencia de leucocitospermia, hiperviscosidad y/o aglutinación.
Determinaciones : Se utilizó para la evaluación morfológica de los espermatozoides tinción de Papanicolaou modificada para semen. 8 La integridad del ADN se estudió con Naranja de Acridina, cuyas propiedades metacromáticas permiten distinguir entre cadena simple de ADN (desnaturalizado) y cadena doble (ADN nativo), la condensación de la cromatina con Azul de Anilina que permite detectar su condensación anormal, secundaria a la retención de histonas durante el proceso espermatogénico. La integridad anatómica y funcional de la membrana espermática se evaluó con el Test Hipoosmótico (TH), luego de incubar la muestra en medio hipoosmótico (150 mOsm/l) se cuantifican los espermatozoides reactivos que han incorporado agua a nivel de la cola y/o del segmento intercalar.
Estudio estadístico : Se aplicó la prueba t Student para comparar los promedios de las variables entre ambos grupos. Un valor de p<0.05 se consideró significativo.
Condensación de la Cromatina. 9 Se lavaron los espermatozoides con PBS. (solución buffer fosfato) y luego de centrifugar a 500 g, se resuspendió el pellet con 25 ul, 50 ul o 100 ul de PBS de acuerdo con la concentración espermática. Se realizó un extendido con 10 ul de la suspensión de espermatozoides y se fijó con metanol de 2 a 3 minutos. Se enjuagó con agua destilada y se secó a temperatura ambiente. Se agregó el colorante Azul de Anilina y luego de 5 minutos, se lavó con agua corriente y una vez seco el extendido, se observó al microscopio óptico con objetivo de inmersión. Se estudiaron 200 espermatozoides como mínimo, diferenciando aquellos maduros no coloreados, de los inmaduros, parcial o totalmente teñidos de azul. El resultado se expresó en porcentajes.
Valores de referencia: > 70 % de espermatozoides maduros (no coloreados).
Integridad de la cromatina. 10 Se colocaron 10 ul de semen fresco y 10 ul de solución Naranja de Acridina entre porta y cubreobjetos. Se incubó durante 5 minutos en cámara húmeda y se observó con microscopio de fluorescencia. Las cabezas de los espermatozoides con ADN en estado nativo emiten fluorescencia verde, mientras que aquellos, cuyo ADN se encuentra desnaturalizado se observan de color rojizo.
Valores de referencia: > 50% de espermatozoides con ADN nativo.
Prueba de estrés espermático modificado (MOST). 4 Para realizar esta prueba se separaron los espermatozoides móviles mediante la técnica de sobrenado ( swim-up ). 11 En un tubo de 13x100 mm de polietileno (Falcon Labware, USA), se lavó 1 ml de semen fresco con 2 ml de Ham F10 suplementado con BSA (albúmina sérica bovina). Se centrífugo 10 min. A 500g, se descartó el sobrenadante. Sobre el pellet se agregó lentamente, con el tubo inclinado a 45 ° y por las paredes, 1 ml de Ham F10 y se incubó durante 1 h a 37 °C en estufa con atmósfera de CO2 a 5 %. Se tomó una alícuota de 10 ul de la parte superior del tubo Falcon y se realizó el estudio de movilidad, y se determinó el porcentaje de espermatozoides móviles traslativos (movilidad inicial). Se colocaron 200 ul, también de la parte superior en tubo Eppendorff y se incubó durante 4 hs a 40 °C en baño de agua. Finalizada la incubación se tomó una alícuota de 10 ul y se determinó nuevamente el porcentaje de espermatozoides con movimiento traslativo (movilidad final). El valor del MOST se calculó como el cociente entre movilidad final y movilidad inicial. Se consideró normal un valor de MOST mayor o igual a 0.40.
Test Hipoosmótico 3-8 Solución de fructosa 2.7% P/V en solución fisiológica (solución A) Solución de Citrato de sodio 1.47% P/V en solución fisiológica (solución B). El medio hipoosmótico se preparó en el momento de utilizar mezclando 0.5 ml de solución A con 0.5 ml de solución B, al que se agregó 0.1 ml de semen fresco, se mezcló e incubó entre 20 y 30 minutos a 37 °C. Se colocó 10 ul de la mezcla incubada entre porta y cubreobjeto, en microscopio con contraste de fases se contaron como mínimo 100 espermatozoides y se determinó el porcentaje de gametas con membrana funcional (colas y/o segmento intercalar hinchados). Valor de referencia: > 60% de espermatozoides reactivos.
RESULTADOS
El 62.6 % de las muestras seminales seleccionadas para este estudio presentaron valor de MOST alterado. Se clasificaron en dos grupos de acuerdo con el resultado obtenido en el test MOST, grupo 1 (G1), formado por 31 muestras con MOST mayor o igual a 0.40 (normal) y el grupo 2 (G2), constituido por 52 muestras con valor de MOST menor a 0.40 (alterado). En la evaluación de la membrana espermática, se observó una marcada disminución en su funcionalidad en las muestras seminales con MOST alterado. (G1: 67.4 +/- 10.9 vs G2: 40.1 +/- 16.1). ( Tabla 1). El análisis estadístico de comparación de los promedios mostró diferencia significativa (p= 0.0021). (Tabla 2).
En cuanto a la integridad del ADN espermático mostró marcada alteración en el grupo con MOST alterado (G1: 89.2 +/- 10.6 vs. G2: 58.1 +/- 18.4). (Tabla 1). El análisis estadístico mostró diferencia significativa (p= 0.0019). (Tabla 2).
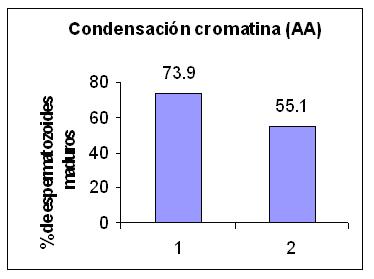
En el estudio de la condensación de la cromatina se observó elevada inmadurez nuclear en las muestras seminales con MOST alterado ( G1: 73.9 +/-13.1 vs G2: 55.1 +/- 12.1). (Tabla 1). La evaluación estadística de los datos mostró diferencia significativa (p= 0.0015).(Tabla 2).
DISCUSION
Más de 40% de las muestras seminales de hombres infértiles presentan niveles aumentados de ROS. Su presencia conduce a inmovilización de los espermatozoides, seguida de envejecimiento y muerte celular. Se desarrollaron distintas metodologías que miden el EO. 12 El MOST evalúa la peroxidación lipídica espontánea que se produce al eliminar el plasma seminal y separar los factores antioxidantes protectores, 13 como prueba de resistencia espermática a la lipoperoxidación forzada es sencillo, objetivo y de bajo costo, reuniendo condiciones suficientes como para convertirse en un test predictor de fertilidad. Como se demostró en anteriores publicaciones, el EO está asociado con la alteración de la integridad anatómica y funcional de la membrana espermática. 14 El daño que produce el EO en la membrana espermática se traduce en alteración de la integridad y funcionalidad de la misma, observándose en el grupo de hombres con MOST anormal resultados anómalos en el Test Hipoosmótico. (Figura 1).
En la evaluación del ADN nuclear se observa una marcada alteración en la integridad de la cromatina, con incremento en el porcentaje de espermatozoides con ADN desnaturalizado en muestras seminales con elevado tenor de EO (MOST alterado). (Figura 2).
En cuanto a la condensación de la cromatina nuclear, en las muestras seminales con incremento de EO se observa un alto porcentaje de espermatozoides con sus núcleos reactivos al colorante Azul de Anilina, lo que sugiere la persistencia de proteínas ricas en lisinas debido a fallas en el proceso espermatogénico. (Figura 3).
Se han propuesto diferentes teorías respecto al daño del ADN en el espermatozoide maduro; una de ellas postula que es debido al anormal empaquetamiento de la cromatina durante la transición de histonas a protaminas complejas, por fallas en el proceso espermatogénico. Otra de las teorías es que el daño del ADN es inducido por los radicales libres presentes en el semen, que alteran la membrana espermática , atacan el ADN e inducen apertura de la doble hélice causando la inviabilidad del espermatozoide. 15-16 El EO puede provenir de una deficiencia del sistema de defensa antioxidante o de un incremento de la población de ROS, cuya alta reactividad puede provocar peroxidación lipídica, daño en la membrana celular y en el ADN espermático. El daño oxidativo puede estar asociado con el incremento de eventos apoptóticos, en células espermáticas anormales se encontraron cadenas de ADN alteradas, con incremento en la sensibilidad a la desnaturalización in situ. Estos autores han demostrado que la activación de endonucleasas endógenas que causan daño extensivo al ADN en células somáticas con características de apoptosis, deben ser las responsables de la eliminación de células germinales defectuosas del pool reproductivo. 17
Todos los espermatozoides de un eyaculado no son iguales desde el punto de vista funcional, pero no se conoce cuáles son los atributos que diferencian un espermatozoide fértil de aquel que no lo es. La integridad del núcleo y la membrana espermática son esenciales para la viabilidad de la gameta masculina y para asegurar cambios fisiológicos necesarios en el proceso de fecundación. Un solo test no es capaz de determinar el estado funcional de la gameta, para su estudio es necesario implementar una serie de determinaciones dirigidas a diferentes organelas que componen el espermatozoide, integrando esta batería de determinaciones para lograr el objetivo.
CONCLUSIONES
Dada la importancia de la peroxidación lipídica en la alteración de la función espermática, la cuantificación de este proceso tiene importancia diagnóstica. El MOST revela los efectos deletéreos que producen los peróxidos grasos sobre la función espermática. Valores bajos de MOST (menores a 0.40) reflejan elevado EO que altera la calidad seminal e interfiere en la capacidad fecundante espermática. Consideramos que la evaluación del EO debe ser incorporada al estudio del semen humano, en forma conjunta con los tests de funcionalidad espermática con el fin de lograr un enfoque andrológico más racional y eficiente.
ABSTRACT: The oxidative stress effect on semen quality.
The spermatozoids have in its plasmatic membrane high concentrations of unsaturated fatty acids, vulnerable to the attack of the reactive oxygen substances. The male gamete has protective systems, the distortion between pro and antioxidizers produces oxidative stress". Objective: to study samples of semen from infertile men, the effect of oxidative stress on the sperm membrane and the nucleus. 142 semen samples were analyzed from infertile men. The sperm study was evaluated according to OMS and 83 samples without agglutination and hiperviscosity with concentration of spermatozoids more of 5 x 10 6 /ml were chosen. The sperm membrane was studied with the Hipoosmotic Test, the maturity of chromatina with blue aniline and the nuclear AND with acridine orange. The EO was evaluated with the MOST test (motility end/motility initial) measuring the loss of motility of the spermatozoids incubated at 40ºC in a water bath for 4 hours, separating the samples in : G1 : MOST major or equal to 0.40 (normal) G2 : MOST under to 0.40 ( abnormal). The statistic analysis of the three tests showed significant difference (p<0.003). The oxidative stress affects essential structures.
Key words : semen,- oxidative stress,,spermatozoids, infertility
REFERENCIAS BI BLIOGRAFICAS
1. Mack Leod J. The role of oxygen in the metobolism and motility of human spermatozoa. Arm J. Physiol. 1943;138:512-6.
2. Knoblovitz P, Rey Valzacchi G. Rol de las especies reactivas del oxígeno en el hombre infértil. Boletín Informativo de la Sociedad Argentina de Andrología. Afiliada a la International Society of Andrology. 1999;8(3):28- 40.
3. Jeyendran R, Van Der Ven H, Pérez-Peláez M, Crabo BG, Zaneveld L. Development of ram assay to assess the functional integrity of the human sperm membrane and its relationship to other semen characteristics. J. Reprod. Fert. 1984;70:219-28.
4. Calamera JC, Doncel GF, Brugo Olmedo S, Kolm P, Acosta AA. Modified sperm stress test: a simple assay that predicts sperm-related abnormal in-vitro fertilization . Hum. Reprod. 1998;13(9):2484 –8.
5. Adel Zalata, Tarek Hafez, Frank Comhaire. Evaluation of the role of reactive oxygen species in male infertility. Hum. Reprod. 1995;10(6):1444-51.
6. Buffone MG, Calamera JC. Evaluación de la estructura e integridad de la cromatina espermática humana en andrología Rev. Arg. Soc. Androl. 2004;13(1):2-14.
7. Calamera JC, Nodar F, Acosta AA. Papel de los test de función espermática Rev. SEGIR Secc. Art. Orig. O de Rev. 1999;2(2):84-98.
8. World Health Organization. WHO laboratory manual for the examination of human semen and sperm cervical-mucus interaction. Cambridge : Cambridge University Press; 1999.
9. Dadoune JP, Mayaux MJ, Guildhard-Moscato. Correlation between defects of chromatin condensation of human spermatozoa stained by aniline blue and semen characteristics. Andrología. 1988;20:211-7.
10. Tejada RI, Mitchell JC, Norman A, Marik J, Friedman S. A test for the practical evaluation of male infertility by acridine orange fluorescence. Fertil. Steril. 1984;42:87-91.
11. Berger T, Marrs RP, Moyer DL. Comparison of techniques for selection of motile spermatozoa Fertil. Steril. 1985;43:268-73.
12. Pérez Gastell PL, Pérez de Alejo JL. Métodos para medir el daño oxidativo. Rev. Cubana Me d. Milit. 2001;29(3):192-8.
13. Tomlinson MJ, White A, Barratt CLR, Bolton AE, Cooke ID. The removal of morphologically abnormal sperm forms by phagocytes: a positive role for seminal leukocytes? Human Reproduction.1992;7(4):517-22.
14. Bouvet BR, Brufman S, Paparella CV, Gatti VN, Feldman RN, Solís EA. Estrés espermático modificado. Respuesta inmune y funcionalidad de la me mbrana del espermatozoide humano. Arch. Esp. de Urol. 2004;57(5):533-7.
15. Barroso G, Morshedi M, Oehninger S. Analysis of DNA fragmentation, plasma membrane translocation of phosphtidylserine end oxidative stress in human spermtozoa Human Reprod. 2000;15(6):1338-44.
16. Erenpreiss J, Bars R, Lipatnikova V, Erenpreisa J, Zalkalns J. Comparative Study of Cytochemical Tests for Sperm Chromatin Integrity. Journal of Andrology. 2001;22(1): 45-53.
17. Xia Wang MD, Rakesh K, Sikka SC, Thomas AJ, Falcone T, Ashok A. Oxidative stress is associated with increased apoptosis leading to spermatozoa DNA damage in patients with male factor infertility. Fertil and Steril. 2003;80(3):531-5.
ANEXO
Tabla 1: Valores de las variables estudiadas en los grupos
| Variables | G1:MOSTmayor o igual 0.40 | G2: MOST menor a 0.40 |
| Integridad del ADN(NA) (%) | 89.2 +/- 10.6 | 58.1 +/-18.4 |
| Condensac cromat (AA) (%) | 73.9 +/- 13.1 | 55.1 +/-12.1 |
| Integr mem esperm(TH) (%) | 67.4 +/- 10.9 | 40.1 +/- 16.1 |
G1: n= 31 hombres con MOST mayor o igual a 0.40 (normal).
G2: n= 52 hombres con MOST menor a 0.40 (anormal).
Tabla 2: Significado estadístico de la comparación de promedios entre ambos grupos
| Variables | G1 vs G2 | Significado estadístico |
| Integridad del ADN | P=0.0019 | Diferencia significativa |
| Condensación cromatina | P= 0.0015 | Diferencia significativa |
| Integridad de la membrana | P= 0.0021 | Diferencia significativa |
G1: MOST mayor o igual 0.40 (normal).
G2: MOST menor a 0.40 (alterado).
Figura 1: Integridad dela membrana espermática (TH)
Espermatozoides reactivos en G1:MOST normal - G2 MOST alterado
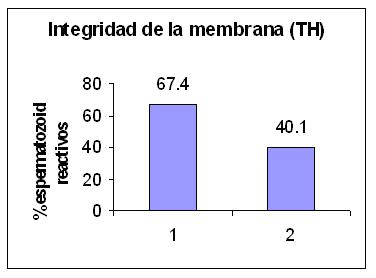 |
Figura 2: Integridad del ADN espermático (NA)
Espermatozoides con ADN nativo en G1 MOST normal - G2 MOST alterado
 |
Figura 3: Condensación de la cromatina (AA)
Espermatozoides con cromatina madura en G1 MOST normal - G2 MOST alterado
 |














