Mi SciELO
Servicios Personalizados
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Habanera de Ciencias Médicas
versión On-line ISSN 1729-519X
Rev haban cienc méd v.8 n.4 Ciudad de La Habana oct.-nov. 2009
CIENCIAS BÁSICAS BIOMÉDICAS
Instituto de Ciencias Básicas y Preclínicas Victoria de Girón
Facultad de Estomatología
Instituto Superior de Ciencias Médicas de La Habana
DISPLASIA EPITELIAL COMO CARACTERISTICA HISTOPATOLOGICA DEL LIQUEN PLANO BUCAL
Epithelial dysplasia as histopathologic characteristic of oral lichen planus
1Dra. Mónica Elena Fernández Jiménez, Dra. CM. Irene Rodríguez Pérez 2, Dra. Josefa Miranda Tarragó3, Dra. Zenia Batista Castro4
1Asistente de Histología. Calle A núm.10103A entre Vento y C. Altahabana. Boyeros. Ciudad de La Habana. Teléfono:2084686.
2Profesor Titular de Histología. Ave 25 núm. 15019. Rpto. Cubanacán. Ciudad de La Habana. Teléfonos:2082852 ó 2084686.
3Profesor Titular de Oncología. Calle 48 núm. 2512 entre 25 y 27. Playa. Ciudad de La Habana. Teléfono: 2059609.
4Asistente de Histología. Calzada 10 de Octubre núm. 271 Apto. 17 entre Vía Blanca y Arango. 10 de Octubre. Ciudad de La Habana. Teléfono:2084686.
RESUMEN
El liquen plano bucal constituye una de las lesiones blancas más frecuentes de la mucosa bucal y posee cierto riesgo de transformación maligna. La presencia de displasia epitelial como predictor histológico de cambios malignos ha sido escasamente estudiada en el liquen plano bucal, por lo que nos propusimos determinar la presencia de displasia epitelial en biopsias de pacientes con dicha enfermedad.
Se emplearon las biopsias de 40 pacientes de la consulta de Patología Bucal de la Facultad de Estomatología del ISCM-H. Las láminas fueron procesadas por la técnica de inclusión en parafina y coloreadas con Hematoxilina/Eosina. Se determinó el tipo de queratinización, el grado de infiltrado inflamatorio, la presencia de degeneración vacuolar y la existencia de displasia epitelial, según los criterios de Smith y Pindborg aprobados por la OMS.
Se encontró displasia epitelial ligera en 57.5%, el resto no presentó displasia. Este alto grado de displasia ligera pudo deberse a que las muestras fueron tomadas de formas erosivas de liquen, a la subjetividad del método o en respuesta al intenso infiltrado inflamatorio también encontrado.
Palabras clave: Liquen plano bucal, displasia epitelial.
ABSTRACT
Oral lichen planus constitutes one of the white injuries that appears with more frecuency in the oral mucosa. It is considered that has certain risk of malignant transformation. The occurrence of epithelial dysplasia, as a possible precursor of malignant transformation, has been rarely studied in oral lichen. The purpose of the current research was to determine the presence of epithelial dysplasia, in oral lichen material.
The oral lichen material from 40 cases from the Department of Oral Pathology of the Faculty of Dentistry of Havana Higher Institute of Medical Sciences was selected. Sections stained with hematoxylin-eosin were examined. We evaluated the kind of keratinization, the degree of inflammatory infiltrate, the presence of vacuolar degeneration and epithelial dysplasia, in this particular case the epithelial dysplasia was evaluated according to the criteria of the Smiths and Pindborg approved by the WHO.
Mild dysplasia was found in 57.5 % of the cases. Moderate and severe dysplasia were not found. These results are probably due to the clinic form of lichen materials, the subjectivity of method or as a response to the intense inflammatory infiltration.
Key words: Oral lichen planus, epithelial dysplasia.
INTRODUCCIÓN
El liquen plano es una enfermedad inflamatoria y eruptiva de la piel, pruriginosa, de marcha crónica o subaguda, que puede involucrar las mucosas, sobre todo, la bucal.1 Es una de las enfermedades más comunes de la piel que se manifiesta en dicha mucosa.2
La mayoría de los pacientes que lo padecen no tienen lesiones en la piel al presentarse las manifestaciones bucales; estas suelen ocurrir meses o semanas antes de la aparición de las lesiones cutáneas, las cuales muchas veces no llegan a manifestarse.2
Su etiología permanece desconocida, se ha postulado que pudiera existir una causa genética, aunque no se ha demostrado que este tenga asociación significativa con un antígeno HLA determinado.3
En la actualidad se acepta que representa una respuesta inmune mediada por células en la que existe una interacción linfocito-epitelio, que culmina con la degeneración del estrato basal epitelial.
Sus manifestaciones se hacen evidentes tanto en el epitelio como en el tejido conectivo subyacente pudiendo presentar cambios displásicos y de queratinización. 4 Existen diferentes criterios histopatológicos para el diagnóstico de esta enfermedad, entre los que se encuentran: presencia de hiperqueratosis, degeneración hidrópica del estrato basal e infiltrado inflamatorio subepitelial «en banda»5
Al describirlo por primera vez se le consideró como una entidad totalmente benigna. No fue hasta años más tarde que se mencionó que este pudiera sufrir una transformación maligna. En 1910, se comunicó un caso de liquen gingival en cuya vecindad había surgido una neoplasia. Desde entonces, se han descrito numerosos casos de malignización de lesiones bucales y algunas lesiones cutáneas de liquen hipertrófico; pero estos casos, según algunos autores, no están bien documentados, pues carecen de datos suficientes, de una descripción detallada de la lesión, de sus características y su evolución.2
En Cuba, Santana planteó en 1983 6 la transformación de un liquen plano de paladar y encía en una paciente de 58 años en un carcinoma espinocelular; y en un estudio de seguimiento por 15 años en el INOR a 82 pacientes encontró que 4 lesiones se malignizaron, presentándose dos en la lengua, una en carrillo y otra en el paladar duro. Dos de dichos pacientes tenían más de 8 años de tratados y los otros dos, más de cinco.7 No existiendo otros reportes, pero sí un estudio de seguimiento clínico instaurado en la consulta de Patología Bucal de la Facultad de Estomatología del ISCM-H desde hace más de 10 años donde se persigue obtener evidencias de esta realidad en pacientes cubanos.6,8
Se ha notificado la presencia de displasia epitelial en estas lesiones, considerándose esta como un predictor histológico de cambios malignos que guarda una mayor relación con el carcinoma in situ, debido a que puede evolucionar hacia el carcinoma epidermoide.9
Algunas de sus formas clínicas son consideradas desde hace años como enfermedad premaligna por la posibilidad de malignizarse, y alcanza cifras de riesgo hasta 5 %.
Actualmente, este porcentaje se le ha adjudicado a una nueva entidad denominada Displasia liquenoide, descrita por Eisenberg en 1992, quien asegura que la displasia liquenoide se describe como una lesión con características histológicas compatibles con liquen plano, encontrándose características de displasia epitelial tales como: pleomorfismo nuclear y celular, hipercromatismo nuclear y alteraciones de la estratificación del tejido; además plantea que esta displasia liquenoide posee potencial de malignización y que con seguridad los pacientes reportados con liquen plano bucal que se han transformado a carcinoma han sido mal diagnosticados o el paciente ha estado expuesto a factores de riesgo. En contraposición, otros autores han reportado casos controlados por varios años, los cuales han evolucionado a carcinomas invasivos.10
La presencia de displasia epitelial ha sido escasamente estudiada en el liquen plano bucal (LPB); sin embargo, ha sido estimada por diferentes autores en alrededor de 10 %.11
En un estudio de 100 casos, realizado en Hungría, se encontró que alrededor de 25 % de los pacientes, esta se hallaba presente, en su forma ligera y moderada.12
En Cuba, en 1990, se realizó un estudio similar y se encontró displasia ligera en 66 % y moderada en 11 % de las muestras analizadas. 11 Por todo lo antes expuesto, nos proponemos determinar la frecuencia de la displasia epitelial en lesiones de liquen plano bucal.
MATERIAL Y MÉTODO
Se analizaron 40 biopsias de pacientes con diagnóstico de LPB, realizado en el Laboratorio de Patología Bucal de la misma facultad entre los años 1991-2001.
Las muestras fueron tomadas bajo anestesia local con lidocaína a 2% con bisturí o ponchador, teniendo en cuenta que el mismo no excediera 5mm en su diámetro mayor.
Las muestras fueron fijadas en formalina neutra a 10% y procesadas mediante la técnica de inclusión en parafina. Se realizaron cortes de 7ìm de grosor en un micrótomo vertical Spencer y se utilizó la coloración de Hematoxilina/ Eosina.
En cada corte observado, se estudiaron de uno a tres campos escogidos al azar; en un microscopio Karl Zeiss, con magnificaciones de 100X, 400X y 1000 X.
Se observó cada una de las muestras, determinando la presencia de las características histopatológicas típicas de las lesiones de LPB, entre las que se encuentran: hiperqueratosis (orto o paraqueratosis), degeneración hidrópica del estrato basal e Infiltrado inflamatorio subepitelial (ligero, moderado o severo).
Además de esta caracterización histopatológica, se hizo especial énfasis en determinar la presencia de displasia epitelial, que es un conjunto de alteraciones citológicas del tejido epitelial, además de clasificarla de acuerdo con su severidad en ligera, moderada o severa, según los criterios de Smith y Pindborg, aprobados por la OMS.13
1. Alteraciones de los clavos interpapilares (10 X):
Ligera: Los clavos interpapilares varían en tamaño, pero todos tienen una forma irregular. (2 puntos).
Severa: Los clavos interpapilares son más irregulares, tienden a correr en distintas direcciones, tienden a unirse y dejar islotes de tejido conectivo aislados. (4 puntos).
2. Estratificación epitelial irregular (10 X):
Ligera: Se pierde el orden regular de los estratos epiteliales en algunas partes del epitelio. Este se refiere a nivel de estratos y no de células. (2 puntos).
Severa: Hay más pérdida de la estratificación que llega a observarse en casi todo el grosor y longitud del epitelio.
3. Queratinización de células aisladas o grupos de ellas por debajo del estrato córneo. (10 X)
Pocas y superficiales: (1 punto).
Muchas y profundas: (3 puntos).
4. Hiperplasia de células basales (10 X):
Ligera: Existe un ligero incremento en el grosor del estrato basal en comparación con el normal. (1 punto).
Severa: Marcado incremento en profundidad del estrato basal. (4 puntos).
5. Pérdida de la adherencia intercelular (10 X):
Ligera: Generalmente se observa en el estrato basal y espinoso bajo. Tiende a complicarse por la presencia de inflamación de los límites con el tejido conectivo. Existen pequeños espacios intercelulares en pequeñas áreas a lo largo de todo el epitelio. En estos espacios se observan células de la inflamación. (1 punto).
Severa: Existe un aumento prominente de los espacios intercelulares que no se acompañan de cambios inflamatorios severos. (5 puntos).
6. Pérdida de la polaridad de las células basales (10 X):
Ligera: Se pierde la posición perpendicular de la célula con respecto a la membrana basal. (2 puntos).
Severa: La desorientación es más severa. (6 puntos).
7. Hipercromasia del núcleo (10 X):
Ligera: La hipercromasia del núcleo se observa en células basales aisladas y pocas o grupos pequeños de las mismas. (2 puntos).
Severa: Los núcleos se encuentran muy teñidos en todo el estrato basal. (5 puntos).
8. Aumento en la relación núcleo-citoplasma (aumento de la densidad) (40 X):
Ligero: Se observa en el estrato basal y espinoso. (2 puntos).
Severo: Este índice aumenta aún más. (5 puntos).
9. Anisocitosis y anisonucleosis. (40 X). Nota: Se refiere solo al tamaño
Ligera: (2 puntos).
Severa: (6 puntos).
10. Pleomorfismo de la célula y el núcleo. (40 X). Nota: Se refiere solo a la forma
Ligera: (2 puntos).
Severa: (6 puntos).
11. Actividad mitótica. (40 X):
Incremento ligero: (1 punto).
Incremento severo: (5 puntos).
12. Nivel de actividad mitótica. (40 X):
Ligera: Solo en la mitad inferior de los estratos. (3 puntos).
Severa: Además de en la anterior también hay en la mitad superior. (10 puntos)
13. Figuras de mitosis anormales. (Aceite de inmersión)
Única: Se observa una mitosis anormal. (6 puntos)
Múltiples: Se observan más de una. (10 puntos)
Para evaluar su grado de severidad se le asignó una puntuación a cada uno de los signos y luego se realizó una sumatoria de los puntos acumulados.
Se concluyó cada una de las muestras analizadas según se expone a continuación:
• 0 -0 puntos: No hay displasia.
• 11 -25 puntos: Displasia ligera.
• 26 -45 puntos: Displasia moderada.
• Más de 45 puntos: Displasia severa.
Se digitalizaron las imágenes en un Microscopio Leyca, acoplado a la computadora programada con el sistema Atiplay.
Se almacenaron los datos en base de datos utilizando el programa de Microsoft Excel. El análisis de los mismos se hizo mediante el empleo de las estadísticas descriptivas con la realización de las tablas de contingencia de dos entradas y el cálculo del estadígrafo x2 correspondiente, empleando el programa SPS versión 9.0.
RESULTADOS
• Tipo de queratinización
Encontramos un predominio de paraqueratosis, observándose en 28 de las biopsias, ya sea sola o combinada con ortoqueratosis para 70%. (Figura 1).
Fig. 1: Epitelio paraqueratósico (a) de la mucosa con infiltrado inflamatorio severo (b) y cURAlavos interpapilares deformados. Coloración H/E. 200 X.
• Degeneración hidrópica del estrato basal
Este signo histopatológico se presentó en 95% de los casos, siendo este signo el principal criterio diagnóstico de esta enfermedad. (Figura 2).
Figura 2. Se observa degeneración hidrópica del estrato basal. Coloración H/E. 400X.
• Infiltrado inflamatorio subepitelial "en banda"
El infiltrado inflamatorio predominó en sus formas moderada y severa, con 42.5 y 52.5% respectivamente. Solamente 2 casos presentaron infiltrado ligero para 5%. (Figura 1).
• Displasia epitelial
Encontramos displasia epitelial ligera en 23 de los cortes para 57.5 %, el resto no presentó displasia.
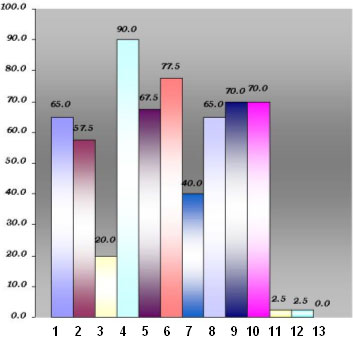
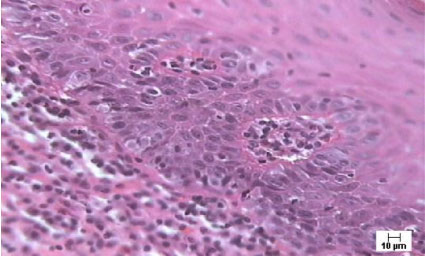
Valorando cada uno de los signos de displasia de manera independiente, según se observa en el gráfico (Figura 3), vemos que la hiperplasia y la pérdida de la polaridad de las células basales fueron los más frecuentes, siendo también los que en mayor número se presentaron en su forma severa. (Figura 4).
Figura 3: Signos de displasia epitelial expresados en porcientos.
Figura 4. Se observa displasia epitelial ligera con signos de hiperplasia y pérdida de la polaridad de células basales, además de pleomorfismo celular y nuclear. Coloración H/E. 400X.
Otros signos de displasia como el pleomorfismo celular y nuclear, la pérdida de la adherencia intercelular y las alteraciones de los clavos interpapilares fueron encontrados con frecuencia.
DISCUSIÓN
• Tipo de queratinización
El predominio de la paraqueratosis, ya sea sola o combinada con ortoqueratosis, concuerda con lo reportado por Urbizo, 11 aunque otros autores refieren la presencia de orto o paraqueratosis indistintamente.2,3
• Degeneración hidrópica del estrato basal
El alto índice de degeneración vacuolar del estrato basal encontrado probablemente se deba al intenso infiltrado inflamatorio subyacente también encontrado, coinci-diendo estos resultados con lo reportado por la mayoría de los investigadores.2,3,5
• Infiltrado inflamatorio subepitelial "en banda"
Este infiltrado inflamatorio tan intenso ha sido estudiado por métodos inmunohistoquímicos y se ha demostrado que al inicio de la enfermedad predominan los linfocitos T CD4 o auxiliadores y con la evolución comienzan a predominar los linfocitos T CD.8
Los mecanismos por los cuales se desencadenan estos eventos inmunológicos son hasta el momento desconocidos, pero al parecer todo comienza con la activación de los linfocitos T CD,4 ejercida por la elaboración de citocinas (interleucina 1) de las células de Langerhans. Los linfocitos CD4 activados producen el interferón-gamma que induce la expresión de HLA-DR y de la molécula de adhesión intercelular 1 (ICAM 1) en queratinocitos y la activación de los CD8 mediante la producción de interleucina 2. Todo ello se traduce en la emigración y reclutamiento de linfocitos T a las zonas afectadas y en los fenómenos posteriores de daño tisular dirigidos hacia las células del estrato basal del epitelio, provocando por ejemplo la degeneración vacuolar antes mencionada.14,15
• Displasia epitelial
La presencia de displasia epitelial ligera en más de 50% de las biopsias estudiadas concuerda con lo reportado por Urbizo, 11 quien realizó un estudio similar y encontró que 66% de las muestras presentaban displasia ligera y 11% displasia moderada; sin embargo, estos resultados parecen tener un porcentaje mucho mayor a lo reportado por la mayoría de los autores, los que refieren cifras entre 10 y 15 %.11,12
Es posible que la alta incidencia de displasia epitelial ligera encontrada en nuestro trabajo se deba a que en nuestro país se le toma biopsia a aquellos pacientes que presentan las formas atípicas de la enfermedad y es conocido que la displasia epitelial predomina en ellas, fundamentalmente en las formas erosivas, 11,12 además de que la trascendencia de la displasia epitelial en el liquen plano es controversial y no se asocia en alto grado a malignización.
También, el diagnóstico y el grado de displasia epitelial es un dato subjetivo y está sujeto a la valoración personal de cada observador, por ello son frecuentes las discrepancias entre ellos de los grados de displasia epitelial; sin embargo, existe un consenso a la hora de señalar la presencia o ausencia de displasia basada en los criterios histológicos.
Dada las diferencias de diagnóstico por parte de los observadores es fundamental considerar la utilización de marcadores biológicos que midan proliferación celular y capacidad de transformación maligna; y de esta manera lograr unificar criterios para establecer un mejor pronóstico.16,17
La importancia de determinar la existencia de displasia epitelial en lesiones bucales, no sólo radica en que se trata de un indicador fundamental para determinar potencial de malignización, sino también para establecer la conducta a seguir.
El significado de la displasia epitelial en el LPB no está aclarado aún y aún se acepta por algunos patólogos bucales la displasia liquenoide, descrita por Einsenberg y Krutchkoff, en 1992. Sin embargo, el encontrar signos de displasia en lesiones que presentan el diagnóstico de liquen y acuñarlas como displasia liquenoide, podría darle una falsa idea de benignidad al clínico y promover que no adopte la terapéutica apropiada.
Obviar el diagnóstico clásico de liquen plano bucal solo por el hecho de presentar displasia epitelial parece, en ausencia de evidencia convincente, no completamente justificado.11
A pesar de estas distintas posiciones, es importante que el clínico esté familiarizado con los aspectos histopatológicos de las lesiones que maneja, el trabajo interdisciplinario con los histopatólogos bucales permitirá llegar a un diagnóstico acertado y así disminuir considerablemente los errores en la selección del tratamiento adecuado. En los casos de liquen plano, debe siempre plantearse la probabilidad de futura malignización por lo tanto el abordaje más conservador debe ser preferido sólo en los casos en que los resultados histopatológicos no muestren ningún cambio displásico, de lo contrario la conducta debe ser más agresiva como sería reemplazar el tratamiento clásico fármaco-terapéutico por un tratamiento quirúrgico conservador previniendo así la posible futura oncoconversión.
CONCLUSIONES
En todas la biopsias estuvieron presentes las características típicas que permitieron el diagnóstico del liquen plano bucal, mientras que la displasia epitelial solo se mostró, en poco más de la mitad de ellas y en la forma ligera. Estas evidencias nos hacen pensar que el significado de la displasia epitelial, como predictor en la transformación maligna en esta enfermedad, difiere en relación con las de otras lesiones similares.
REFERENCIAS BIBBLIOGRÁFICAS
1 San 1. Santana Garay JC. Atlas de Patología del Complejo bucal. La Habana: Ed. Científico Técnica: T 1985. p. 83-9.
2. Shafer WG. Enfermedades de la piel. En: Shafer WC, Levy BM. Tratado de Patología bucal. 2da ed. México: Nueva editorial interamericana; 1986, p. 839-86.
3. Cerrero Lapiedra R, García Nuñez JA, García Pola MJ. Liquen Plano Oral. RCOE. España. 1997;2(8):643-658.
4. Rodríguez Pérez I, Bánóczy J. Oral leukoplakia. A histopathological study. Act Morphologic Acad Sci Hung. 1982;30:289-98.
5. Murphy GF, Mihm MC. La piel. En: Cotran RS, Kumar MD, Collins T. Robbins: Patología Estructural y Funcional. 6ta ed. España: Ed McGrawn- Hill- Interamericana; 2000, p. 1215-58.
6. Santana Garay JC. El carcinoma de lengua. La Habana: Ed Científico-técnica; 1983. p. 75-76.
7. Santana Garay JC. Prevención y diagnóstico del cáncer bucal. La Habana: Ed Ciencias Médicas; 2002,p. 50.
8. Rodríguez Pérez I, Miranda Tarragó J, Santana Garay JC. Caracterización y seguimiento de las lesiones precancerosas de la cavidad bucal. Conferencia Internacional de Prevención del Cáncer Bucal. Congreso Internacional por el Centenario de la Fundación de la Escuela de Odontología de la Universidad de La Habana. Ciudad de La Habana: 2000.
9. Axéll T, Pindborg JJ. Smith CJ, Van der Wall I and an Internatio Collaborative Group on Oral White Lesions. Oral white lesions whith special reference to precancerous and tobacco related lesions: conclusions of an international symposium held in Upsala. J Oral Pathol Med. 1996;25:49-4.
10. Villarroel M, Mata M, Salazar N, Tinoco P, Oliver M. Transformación maligna del liquen plano bucal Vs Displasia liquenoide: presentación de un caso clínico.Acta Odontol Ven. 1997;35(2):61-3.
11. Urbizo J, Rodríguez I, Albrecht M, Banoczy J. Comparative histopathologica studies in oral lichen planus. Act Morphologic Acad Sci Hung. 1990;38: 71-81.
12. DeJong WFB, Albrecht M, Banoczy J, Van der waal I. Epithelial dysplasia in oral lichen planus. A preliminary report of a Dutch-Hungarian study of 100 cases. Int J Oral Surg. 1984;13:221-8.
13. indborg JJ, Reichart PA, Smith CJ. Atlas WHO International Histological Classification of tumors. Springer, limuiden; 1997.
14. Garwal R, Saraswat A. Oral lichen planus: an update. Drugs today. 2002;38(8):533-47.
15. González Moles MA, Ruiz Avila I, Muwaquet Rodríguez S, Fernández Martínez JA. Expresión de los antígenos HLA-DR y de la molécula de adhesión intercelular-1 (ICAM-1) en el liquen plano de la mucosa oral. Oral Med. 1997;2:14-20.
16. Aguirre Echebarría P, Aguirre Urízar JM. Displasia epitelial. Concepto y significación. Av. Odontoestomatol. 2008; 24(1):81-88.
17. Gale N, Pilch BZ, Sidransky D, El Naggar A, Westra W, et al. Epithelial precursors lesions. En: Barnes L, Eveson JW, Reichart, Sidransky D. Eds. Pathology & Genetics Head and Neck Tumours. Lyon: IARC Press-WHO Press; 2005, p. 177-9.