Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Habanera de Ciencias Médicas
versión On-line ISSN 1729-519X
Rev haban cienc méd vol.12 no.2 Ciudad de La Habana abr.-jun. 2013
CIENCIAS BÁSICAS BIOMÉDICAS
Universidad de Ciencias Médicas de La Habana. Instituto de Ciencias Básicas y Preclínicas «Victoria de Girón» (ICBP)
Embriopatía diabética en ratas y efecto de un suplemento nutricional de vitamina E durante la gestación
Diabetic embryopathy in rats and effect of a nutritional supplement of vitamin e during gestation
Tammy Fernández RomeroI, Sonia Clapés HernándezII, Gipsis Suárez RománIII, Alfredo Perera CalderónIV, Víctor M. Rodríguez SosaV, Carlos A. Purón GuzmeliVI, Marta Herrera ÁlvarezVII, Ányelo Antiguas PendásVIII, Tania Castro MartínezIX
IEspecialista Segundo Grado en Bioquímica Clínica. Profesor Auxiliar. tammyfdez@infomed.sld.cu
IIDra. en Ciencia de la Salud. Profesor Titular. sclapes@infomed.sld.cu
IIIEspecialista Primer Grado en Bioquímica Clínica. Asistente. gipsis@giron.sld.cu
IVResidente de Cuarto año de Bioquímica Clínica. Especialista MGI. ajpc@giron.sld.cu
VMSc. Investigador agregado. Instructor. vmrs@giron.sld.cu
VI Instructor. puron@giron.sld.cu
VIIMsC. Profesor Auxiliar. martah@giron.sld.cu
VIIILicenciado en Bioquímica. ICBP «Victoria de Girón». anyelo@giron.sld.cu
IXTécnico medio en laboratorio. ICBP «Victoria de Girón». taniaocm@giron.sld.cu
RESUMEN
Introducción: en modelos experimentales se han obtenido resultados prometedores con el empleo de suplementos antioxidantes en la prevención de la embriopatía diabética. Sin embargo, no siempre el beneficio es claro y queda por aclarar el mecanismo que subyace en esos resultados. Objetivo: evaluar el efecto de la suplementación nutricional con Vitamina E durante la gestación en la descendencia de ratas diabéticas.
Materiales y Métodos: se emplearon ratas con diabetes inducida por estreptozotocina y ratas sanas como controles. Durante la gestación, un grupo de ratas diabéticas y uno de controles recibieron 150 mg/kg/día de vitamina E y los otros grupos el vehículo, hasta el día 11,5 en el que se practicó eutanasia. Se realizó el análisis morfológico de la descendencia y la determinación del contenido de ADN, proteínas y marcadores de estrés oxidativo en embriones. Para el análisis estadístico se emplearon pruebas no paramétricas y las diferencias se consideraron significativas con p < 0,05.
Resultados: en las ratas diabéticas tratadas con Vitamina E se observó menor número de reabsorciones y los embriones tuvieron mayor talla, así como, menor retraso del desarrollo, severidad de las malformaciones y contenido de marcadores de daño oxidativo a proteínas y lípidos. Conclusiones: la suplementación nutricional con Vitamina E durante la gestación en ratas diabéticas disminuyó las pérdidas del producto de la concepción y favoreció el crecimiento y desarrollo de los embriones con menor daño oxidativo a biomoléculas que pudieran sugerir un efecto antioxidante beneficioso de esta vitamina.
Palabras clave: embriopatía diabética, estrés oxidativo, vitamina E.
ABSTRACT
Introduction: experimental models have obtained good results with the supplementation of antioxidants in the prevention of the diabetic embryopathy. However, not always the effect is beneficial and the mechanism of these results is unclear. T
Objective: was to evaluate the effect of nutritional supplementation with vitamin E during gestation on offspring of diabetic rats.
Materials and Methods: we used wistar rats with diabetes induced by streptozotocin and health rats like controls. During gestation, one group of diabetic rats and one group of controls received vitamin E 150mg/kg/day, and the others group the vehicle. Euthanasia was practiced at 11,5 day of pregnancy and we study the morphology of the products, DNA, proteins and oxidative stress markers in embryos. The statistic analyze was performed with non parametric tests and the significant differences were considered with p< 0, 05.
Results: in diabetic rats with vitamin E the embryos were higher and decreased the number of resorptions, the developmental impairment and the content of oxidative damage markers to lipids and proteins in the embryos.
Conclusions: nutritional supplementation with vitamin E during gestation in diabetic rats decreased the loss of the conception products, increased the growth and development of the embryos with decreased oxidative damage to biomolecules that will be suggest a beneficial antioxidant effect of the vitamin.
Key words: diabetic embryopathy, oxidative stress, vitamin E.
INTRODUCCIÓN
Las malformaciones congénitas producidas por la diabetes materna constituyen un síndrome conocido como «embriopatía diabética».1 Los defectos se asocian a la diabetes pregestacional, tipo 1 ó 2, ya que la diabetes gestacional aparece posterior al período de organogénesis.2 Su patogénesis no está totalmente esclarecida pero la hiperglicemia parece ser el estímulo intrauterino más importante, favoreciendo la producción de radicales libres y otras condiciones adversas para la implantación y el desarrollo embrionario y fetal.3
Diferentes modelos experimentales de diabetes y preñez han puesto de manifiesto que la administración de antioxidantes, tanto in vitro 4-7 como in vivo, 8-14 disminuye la dismorfogénesis embrio-fetal. Entre los antioxidantes más empleados se encuentra la Vitamina E, que como á-tocoferol constituye la forma más abundante en el cuerpo humano. Su acción antioxidante se centra en interferir la reacción en cadena de la peroxidación de los lípidos de membrana en situaciones de estrés oxidativo.15 Además, se ha propuesto como un regulador de la expresión de genes y la señalización celular.16
La concentración de á-tocoferol se ha visto incrementada por dosis dependiente en el hígado de fetos de ratas suplementadas durante la gestación;13 la administración por vía oral a la madre pudiera ser una buena manera de incrementar las concentraciones en el embrión-feto.14
En la mayoría de los estudios experimentales de embriopatía diabética en los que se ha empleado la Vitamina E, se han obtenido efectos favorables.8-13 A pesar de lo prometedor de estos resultados los autores sugieren que es necesario continuar las investigaciones en este campo. La combinación de Vitamina E con otros antioxidantes, como vitamina C13 y ácido fólico,14 no ha mostrado efectos sinérgicos o aditivos beneficiosos. También se ha demostrado que altas dosis pudieran provocar efectos adversos en embriones de ratas no diabéticas11, 17 e incremento de las reabsorciones,17 quizás por efecto pro-oxidante y alteraciones en los mecanismos apoptóticos.
El objetivo del presente trabajo fue evaluar el efecto de la suplementación nutricional con Vitamina E durante la gestación de ratas diabéticas sobre el crecimiento y desarrollo de su descendencia.
MATERIAL Y MÉTODOS
Se indujo Diabetes Mellitus en ratas Wistar hembras fértiles y vírgenes, con peso de 200±20g, por inyección intraperitoneal de estreptozotocina (Applichem) 65 mg/kg en 200uL de buffer citrato 0.1M pH 4,7.18 A los 5 días, se diagnosticó la diabetes por niveles de glicemia superiores a 11,1mM,19 mediante glucómetro Bayer y en sangre extraída de la cola. Las ratas fueron apareadas con machos sanos de la misma cepa y se diagnosticó la gestación por la presencia de espermatozoides en el lavado vaginal. 8 Se formaron aleatoriamente dos grupos: DE que recibió Vitamina E (acetato de á-tocoferol) 150mg/kg/día8 en 1ml de NaCl 0,9%, y DV que recibió diariamente el vehículo. Se utilizaron dos grupos control de ratas sanas preñadas, CE y CV, que recibieron la Vitamina E y el vehículo respectivamente. Los preparados se administraron por sonda esofágica8 y se determinó la glicemia los días cero, seis y 11 de la gestación.
Los animales se mantuvieron con ciclos constantes de 12 horas luz/oscuridad, temperatura de 21-23ºC, ventilación continua, libre acceso a agua corriente y alimentación con pienso granulado a libre demanda.8 El día 11,5 de la gestación se practicó eutanasia por desangrado bajo anestesia20 (tiopental sódico 50-60mg/kg y punción de la vena cava inferior).
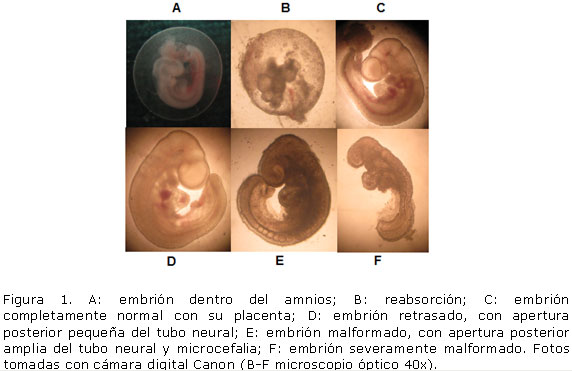
Variables morfológicas 8,21 por observación bajo estereoscopio (aumento 20x y 40x) y microscopio óptico (Partec aumento 40x): total de reabsorciones (saco gestacional sin embrión o con un tejido desorganizado); en embriones: total, talla (longitud coronilla-rabadilla en mm mediante cinta métrica); total de somitas (indicador de diferenciación), clasificación: normal (cierre total del tubo neural, vesículas cerebrales, ópticas y óticas, esbozos de las extremidades anteriores, corazón en asa y plegamiento total); retrasado (apertura pequeña del poro posterior del tubo neural, que en este momento puede representar un retraso del desarrollo); malformado (no cumplió con la morfología esperada). (Figura 1).
Variables bioquímicas: en muestras formadas por pool de homogeneizado14 de cinco embriones en buffer Na2HPO4-KH2PO 4 0.1M EDTA 0.1mM pH 7.8, 500µl/embrión, en ultrasonido con agua helada por 5 segundos22 (40kHz, 150W). En los grupos DE y DV se prepararon 4 muestras: malformados, retrasados, normales de ratas que tuvieron malformados o retrasados, normales de ratas que no tuvieron malformados ni retrasados. De cada grupo control se preparó una muestra de embriones normales. Se determinó el contenido de: proteínas23 y ADN, 24 como indicadores de crecimiento, malonildialdehido (MDA)25 y productos avanzados de oxidación de proteínas (PAOP),26 como marcadores de daño oxidativo a proteínas y lípidos, respectivamente.
Consideraciones éticas: los animales fueron obtenidos del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB). Este trabajo forma parte de un proyecto ramal del Ministerio de Salud Pública, aprobado por el Ministerio de Ciencia, Tecnología y Medio Ambiente.
Procesamiento estadístico: programa INFOSTAT y paquete Estatistica 8. Como las variables no siguieron una distribución normal, se emplearon las pruebas no paramétricas Kruskal Wallis y U de Mann-Withney. Los datos se reportan como valores de la media y porcientos. Las diferencias se consideraron significativas con valores de p < 0,05.
RESULTADOS los grupos de estudio quedaron formados por 15 ratas cada uno. La glicemia promedio fue significativamente superior en las ratas diabéticas (p=0.0000), correspondiendo con una hiperglicemia severa (DV=22,4mM DE=22,3mM). El grupo DV presentó casi el doble de reabsorciones y una disminución significativa del número de embriones con respecto a los grupos CV y DE; este último con valores similares a los encontrados en los controles. (Tabla 1).
Los embriones retrasados fueron superiores en el grupo DV al compararlo con los controles y el DE superior al CE pero similar al CV. Los dos grupos de ratas diabéticas presentaron mayor número de malformaciones que los controles, sin diferencias entre ellos. (Tabla 1).
Los embriones de ratas diabéticas tuvieron menor talla y número de somitas que los controles, y los del grupo DV menor talla que los del DE (Tabla 1). Los malformados fueron los de menor valor de estas variables (p<0,05) y los retrasados del DV presentaron menor talla y somitas que los normales (p<0,05), mientras que los del DE presentaron menor talla (p<0,05) pero similar número de somitas que los normales.
La mayor parte de las malformaciones encontradas se relacionaron con defectos del cierre del tubo neural. En el grupo DV se encontraron defectos de rotación y poca delimitación de los somitas, que no fueron observados en el DE (Figura 1; Tabla 2).
Los embriones de ratas diabéticas presentaron similar contenido de ADN y proteínas y menor que los controles. La relación PAOP/proteínas fue mayor en el DV y similar en el resto de los grupos. El contenido de MDA fue superior en DV al compararlo con DE y los mayores niveles se observaron en CV, siendo esta la única variable que mostró diferencias entre los grupos controles. (Figura 2).
DISCUSIÓN
Los resultados del presente trabajo coinciden con los obtenidos en otras investigaciones en las que la administración de Vitamina E a ratas diabéticas durante la gestación disminuyó las reabsorciones,13,14 (lo que equivale a los abortos en el humano), 19 los retrasos del crecimiento y desarrollo, 8,9,12-14 así como el contenido de proteínas y lípidos oxidados en los embriones.12,13 Aunque no se produjo una disminución del número de malformaciones, como se muestra en otros estudios, 8-14 la severidad fue menor cuando se empleó la Vitamina E.
En las ratas diabéticas el incremento de las reabsorciones, así como la menor talla y contenido de ADN y proteínas de los embriones, 4,8,21,22 evidencian el efecto negativo de la diabetes materna sobre la descendencia. Las malformaciones más frecuentes son los defectos de cierre del tubo neural,3 coincidiendo con lo observado en este estudio.
En modelos animales existen evidencias de que la exposición del ovocito preovulatorio al ambiente diabético puede influir en la expresión de genes involucrados en la organogénesis adecuada, tanto del embrión como de la placenta, antes de que estos genes puedan ser inducidos. La apoptosis de un número limitado de células del blastocisto puede producir retardo del crecimiento, pero la eliminación de una masa celular mayor pudiera conducir a fallos en la implantación o pérdida de embriones completos.1
Los mecanismos anteriores también pudieran explicar la disminución de la fertilidad asociada a la diabetes,1 que no fue observada en este estudio dada la similitud en el número de productos de la gestación encontrados en todos los grupos. Este resultado pudiera deberse a que la fertilidad comienza a disminuir a partir de la segunda semana de diagnosticada la diabetes en las ratas,27 y sólo se incluyeron en el estudio las que se preñaron en las primeras tres semanas de apareamiento.
Adicionalmente, existe una asociación entre el estrés oxidativo y las malformaciones congénitas vinculadas a la diabetes materna. El exceso de glucosa que entra a los tejidos embrionarios durante la organogénesis incrementa la producción de superóxido por las mitocondrias,28 que no puede ser contrarrestado por los sistemas de defensa antioxidante aun inmaduros.29 A su vez, el exceso de especies reactivas del oxígeno puede influir de forma trascendental en el desarrollo embrio-fetal.
Uno de los mecanismos propuestos para explicar los defectos de cierre del tubo neural asociados a la diabetes considera que el exceso de especies reactivas del oxígeno en los embriones estimula la actividad de la proteína quinasa dependiente de AMP (AMPK). De alguna forma aun no esclarecida, AMPK inhibe la expresión de PAX 3, un importante gen para la regulación de la expresión de otros genes que dirigen la morfogénesis.30 Esta inhibición estimula la actividad de p53, la cual es marcada con ubiquitina y degradada en presencia de Pax 3.31 Lo anterior conduce a un incremento de la apoptosis de las células de las crestas neurales, con alteraciones en los procesos en que participan, como el cierre adecuado del tubo neural.30,31
Una posible explicación a los resultados obtenidos en cuanto a las malformaciones pudiera ser que en estos modelos la apertura posterior pequeña del tubo neural es considerada en unos casos como una malformación4-8,10-12,1418,22 y en otros como un retraso del desarrollo.21 Siguiendo estos criterios, los embriones con este defecto son clasificados como malformados o normales. En el presente estudio fueron clasificados como un grupo independiente, en el cual se observó también un retraso en el crecimiento (menor talla que los embriones normales) y en el caso del DV también en la diferenciación (menor número de somitas que los normales). Su número menor en el grupo tratado con Vitamina E, con un número de somitas similar al de los embriones normales evidencia el efecto favorable de la vitamina en el desarrollo embrionario.
De haberse clasificado los embriones retrasados como malformados es probable que se hubiese observado una disminución del número de malformaciones con el empleo de la Vitamina E. Además, al menos parte de las reabsorciones pudieran deberse a la muerte de embriones con malformaciones severas, ya que estos defectos pueden resultar de un mecanismo común.11
CONCLUSIONES
La administración de Vitamina E a ratas diabéticas y sanas durante la gestación no tuvo efectos perjudiciales en la descendencia. En las ratas diabéticas disminuyó las pérdidas del producto de la concepción y favoreció el crecimiento y desarrollo de los embriones con menor daño oxidativo a biomoléculas, sugiriendo un efecto antioxidante beneficioso de esta vitamina.
Basado en estos resultados y en los estudios previos, el empleo de antioxidantes parece ser beneficioso pero no suficiente para prevenir la embriopatía diabética. Es probable que sea necesaria la combinación con otros compuestos para bloquear los mecanismos implicados en la teratogénesis diabética.
REFERENCIAS BIBLIOGRÁFICAS
1. Chappell JH, Dan W, Loeken MR. Diabetes and apoptosis: neural crest cells and neural tube. Apoptosis. 2009; 14: 1472-83.
2. Morgan SC, Relaix F, Sandell LL, Loeken MR. Oxidative stress during diabetic pregnancy disrupts cardiac neural crest migration and causes outflow tract defects. Birth Defects Research (Part A). 2008; 453-63.
3. Mattos I, Rodrigues LT, Damasceno DC, Vieira M. Diabetes and pregnancy: an update of the problem. ARBS Annu Rev Biomed Sci. 2007; 9:1-11.
4. Eriksson UJ, Borg LA. Protection by free oxygen radical scavenging enzymes against glucosa- induced embryonic malformation in Vitro. Diabetología. 1991; 34: 325-31.
5. Wentzel P, Thunberg L, Eriksson UJ. Teratogenic effects of diabetic serum is prevented by supplementation of superoxide dismutase and N- acetylcysteine in rat embryo culture. Diabetologia. 1997; 40: 7-14.
6. Zaken V, Kohen R, Ornoy A. Vitamins C and E improve rat embryonic antioxidant defense mechanism in diabetic culture medium. Teratology. 2001; 64: 33-44.
7. Gäreskog M, Wentzel. N-Acetylcysteine and alpha-cyano-4-hydroxycinnamic acid alter protein kinase C (PKC)-delta and PKC-zeta and diminish dysmorphogenesis in rat embryos cultured with high glucose in vitro. J Endocrinol. 2007; 192 (1): 207-14.
8. Viana M, Herrera E, Bonet B. Teratogenic effects of diabetes mellitus in the rat. Prevention with vitamin E. Diabetologia. 1996; 39: 1041-46.
9. Simán C M, Gittenberg-De A C, Wisse B, Eriksson U J. Malformations in offspring of diabetic rats: Morphometric analysis of neural crest-derived organs and effects of maternal vitamin E treatment. Teratology. 2000; 61: 355-67.
10. Viana M, Castro M, Barbas C, Herrera E, Bonet B. Effect of different doses of vitamin E on the incidence of malformations in pregnant diabetic rats. Annals of Nutrition & Metabolism. 2003; 47 (1): 6-10.
11. Cederberg J, Eriksson UJ. Antioxidative Treatment of Pregnant Diabetic Rats Diminishes Embryonic Dysmorphogenesis. Birth Defects Research (Part A). 2005; 73: 498-505.
12. Wentzel P, Eriksson UJA. Diabetes-Like Environment Increases Malformation Rate and Diminishes Prostaglandin E2 in Rat Embryos: Reversal by Administration of Vitamin E and Folic Acid. Birth Defects Research (Part A). 2005; 73: 506-511.
13. Cederberg J, Simán C M, Eriksson UJ. Combined treatment with vitamin E and vitamin C decreases oxidative stress and improves fetal outcome in experimental diabetic pregnancy. Pediatr Res. 2001: 49: 755-62.
14. Gäreskog M, Eriksson U J, Wentzel P. Combined supplementation of folic acid and vitamin E diminishes diabetes-induced embryotoxicity in rats. Birth Defects Research (Part A). 2006; 76: 483-90.
15. Pazdro Burges RJ. The role of vitamin E and oxidative stress in diabetes complications. Mechanisms of Ageing and Development. 2010; 131(4): 276-86.
16. Hajiani M, Razi F, Golestani A, Frouzandeh M, Owji AA, Khaghani S, et al. Time- and dose-dependent differential regulation of copper-zinc superoxide dismutase and manganese superoxide dismutase enzymatic activity and mRNA level by vitamin E in rat blood cells. Redox Report. 2012; 17 (3): 101-7.
17. Chen C. S, Wells P. G. Enhanced tumorigenesis in p53 knockout mice exposed in utero to high-dose Vitamin E. Carcinogenesis. 2006; 27 (7): 1358-68.
18. Sakamaki H, Akazawa S, Ishibashi M, Izumino K, Takino H, Yamasaki H, et al. Significance of glutathione- dependent antioxidant system in diabetes- induced embryonic malformations. Diabetes. 1999; 48: 1138-44.
19. Damasceno DC, Tadeu Volpato G, Paranhos Calderon IM, Cunha Rudge MV. Oxidative stress and diabetes in pregnant rats. Animal Reproduction Science. 2002; 72: 235-44.
20. American Association for Laboratory Animal Science. Laboratory mouse handbook. Crestwyn Hills Drive: Menphis; 2006.
21. Sivan E, Lee YK, Wu YK, Reece EA. Free radical scavenging enzymes in fetal dysmorphogenesis among offspring of diabetic rats. Teratology. 1997; 56: 343-49.
22. Eriksson UJ, Borg LA. Diabetes and embryonic malformation. Role of substrate- induced free oxygen radical production for dysmorphogenesis in culture rat embryos. Diabetes. 1993; 42: 411-19.
23. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the foling phenol reagent. J Biol Chem. 1951; 193: 265-75.
24. Bunce M. PCR-SSP typing. En: Bidewell Jl, Navarrete C. Histocompatibility testing. England: Imperial College Press; 2000, p. 149-86.
25. Esterbauer H, Cheeseman KH. Determination of aldehydic lipid peroxidation products: malondialdehyde and 4-hydroxynonenal. Meth Enzymol. 1990; 186:407-21.
26. Kalousavá M, Skrha J, Zima T. Advanced glycation end-products and advanced oxidation protein products in patients with Diabetes Mellitus. Physiol Res. 2002; 51:597-604.
27. González E. Diabetes mellitus experimental: etiología de las malformaciones congénitas en descendientes de ratas diabéticas. Rev Cubana Endocrinol. 2002; 13(1):53-63.
28. Gäreskog M, Cederberg J, Eriksson UJ, Wentzel P. Maternal diabetes in vivo and high glucose concentration in vitro increases apoptosis in rat embryos. Reprod Toxicol. 2007: 23(1):63-74.
29. Zangen SW, Ryu S, Ornoy A. Alterations in the Expression of Antioxidant Genes and the Levels of Transcription Factor NF-Kappa B in Relation to Diabetic Embryopathy in the Cohen Diabetic Rat Model. Birth Defects Research (Part A). 2006; 76A:107114.
30. Wu Y, Viana M, Thirumangalathu S, Loeken MR. AMP-activated protein kinase mediates effects of oxidative stress on embryo gene expression in a mouse model of diabetic embryopathy. Diabetología. 2012; 55:245-54.
31. Wang XD, Morgan SC, Loeken MR. Pax 3 stimulates p53 ubiquitination and degradation independent of transcription. PLoS ONE 2011; 6(12): e29379.
Recibido: 8 de marzo de 2013.
Aprobado: 28 de marzo de 2013.