Introducción
El edema macular diabético (EMD) y la retinopatía diabética (RD) constituyen importantes complicaciones de la Diabetes Mellitus (DM), que provocan una significante pérdida visual, conllevan a la baja visión y a la afectación de la calidad de vida en estos pacientes. En el caso del edema, su prevalencia está relacionada directamente con la duración de la enfermedad y se manifiesta más tempranamente tras el diagnóstico de DM del tipo 2 que en pacientes del tipo 1.
El EMD se caracteriza por el engrosamiento de la región macular causada por una ruptura de la barrera hematorretiniana (BHR) a través de los capilares dilatados, microaneurismas y pérdida de los pericitos.1
El Early Treatment Diabetic Retinopathy Study (ETDRS, por sus siglas en inglés) desde 1985 definió el edema macular como un engrosamiento de la retina y /o exudados duros con engrosamiento retinal a un diámetro de disco del centro de la mácula. En 2003, el Global Diabetic Retinopathy Project clasificó la severidad de la enfermedad a través de una escala internacional que incluye como leve, moderado y severo acorde con la afectación del centro de la mácula.2
Recientemente se plantea que la angiogénesis y la inflamación son procesos relacionados con la patogénesis del EMD, pero todavía se necesita aclarar si la sobreexpresión de la angiogénesis observada es causa o consecuencia de procesos inflamatorios a ese nivel.3,4
La patogénesis del EMD explica que se produce la acumulación de líquido en las capas plexiforme externa y nuclear interna de la retina. Las alteraciones en la BHR se traducen en una excesiva permeabilidad capilar que produce fuga de líquido y constituyentes del plasma, como las lipoproteínas.
En un principio el edema es intracelular, siendo las células de Müller las primeras que se afectan, se inflaman, lo que les impide realizar su función regulatoria, estas mueren por apoptosis. Posteriormente el líquido pasa a través de la membrana celular y se acumula en el espacio intersticial, con la formación de quistes en las capas internas retinianas. Son de pequeño tamaño, progresan hacia las capas externas y forman quistes más grandes, los cuales se volverán visibles a la biomicroscopía y a la angiografía fluoresceínica. Igualmente se originan depósitos de lípidos, que se traducen en exudados duros con su típica disposición circinada y acumulación de líquido debajo de la retina neurosensorial y posterior desprendimiento de la misma.5
La tomografía de coherencia óptica (TCO) es una técnica diagnóstica por imagen, basada en el principio de interferometría, que consiste en la realización de cortes tomográficos micrométricos mediante luz sobre el tejido a estudiar, en este caso la retina, y constituye una técnica de no contacto. Antes de la introducción de la misma solo era posible detectar el edema macular mediante oftalmoscopía indirecta y angiografía, pero con esta técnica es posible medir la cuantía del edema e incluso detectar formas subclínicas del mismo.6,7
Existen diferentes tipos de tomógrafos para la realización de la TCO, desde los primeros de Dominio Tiempo, hasta los más complejos de Dominio Espectral, de mayor nivel de resolución, los cuales se han convertido en invaluables herramientas para el diagnóstico y manejo de los diferentes desórdenes retinales, entre ellos el EMD.8,9
Es por esto que han surgido diferentes clasificaciones del EMD desde el punto de vista tomográfico, las cuales han permitido uniformidad al describir los cambios morfológicos y un mejor entendimiento de la entidad, así como una base para los diferentes estudios sobre la misma. Entre estas clasificaciones se destaca la de Panozzo, Parolini, Gusson y colaboradores, basada en los resultados obtenidos con un tomógrafo de Dominio Tiempo, la cual según plantean sus propios autores es simple y útil a la vez.10
Objetivo
Por todo lo señalado anteriormente, se realiza este trabajo con el objetivo de caracterizar los principales cambios tomográficos existentes en pacientes afectados de edema macular diabético evaluados en las consultas de retina de las instituciones participantes.
Material y métodos
Se realizó un estudio descriptivo, prospectivo y de corte transversal en el Servicio de Retina del Hospital Docente Clínico Quirúrgico “Dr. Salvador Allende” y el Centro de Atención Integral al Paciente Diabético entre enero del 2014 y diciembre del año 2016.
El universo fue el total de pacientes diabéticos atendidos en esos años y la muestra 40 pacientes (80 ojos) con diagnóstico clínico de edema macular diabético.
Se tomaron como criterios de inclusión: pacientes diabéticos con diagnóstico clínico de EMD o sospecha del mismo, con medios transparentes o cataratas leves.
Como criterios de exclusión aquellos con cataratas u otra opacidad de medios que por su extensión o densidad entorpecieran el estudio, los operados de cataratas con menos de 4 meses de evolución en los que se sospechó edema macular postquirúrgico asociado, los casos con diagnóstico de retinopatía diabética proliferativa avanzada y mala fijación visual, así como pacientes diabéticos con diagnóstico de otras maculopatías.
A la totalidad de la muestra se les realizó biomicroscopía de polo posterior (BMP) previa midriasis medicamentosa con tropicamida a 1% colirio y la TCO con el tomógrafo de coherencia óptica modelo Stratus 3000-6094, Carl Zeiss Meditec Inc., Dublín, California.
Los protocolos de adquisición utilizados fueron Macular thickness y protocolo de análisis Retinal map11,12) y se creó la base de datos del tomógrafo de coherencia óptica.
Se revisaron las historias clínicas de los pacientes, para obtener sus datos generales y aquellos del interrogatorio que resultaron de interés. Las variables a tener en cuenta fueron: edad, sexo, tiempo de evolución de la Diabetes Mellitus, grosor macular central y la clasificación del EMD basado en los hallazgos en la TCO, según la morfología y por la existencia de tracción epirretiniana:
Atendiendo a la morfología:
E1: Engrosamiento simple (más de 250 micras).
E2: Engrosamiento cistoide.
E3: Desprendimiento del neuroepitelio.
Atendiendo a la existencia de tracción epirretiniana:
T0: Ausencia de la línea hiperreflectante.
T1: Presencia de la línea continua hiperreflectante pegada a la retina, pero sin distorsionarla.
T2: La línea continua hiperreflectante tiene múltiples puntos de unión a la retina y la distorsiona.
T3: Tracción anteroposterior con la configuración típica en “alas de gaviota”.
Los datos recolectados fueron dispuestos en una hoja de cálculo Excel para el conteo de las frecuencias de cada una de las categorías de las variables estudiadas. Se utilizó el porciento como medida de resumen.
Adicionalmente, se exploró la posible existencia de asociación estadística entre el tiempo de evolución de la Diabetes Mellitus y las variables morfología y tracción epirretiniana, para ello se utilizó la prueba Chi Cuadrado con un nivel de significación de 0,05. Para este cálculo se procedió a la agrupación de categorías en vista del cumplimiento del supuesto porciento de frecuencias esperadas por celda. Para la morfología se agruparon las dos últimas categorías y para la tracción epirretiniana se agruparon las tres últimas.
Se tuvieron en cuenta los requerimientos éticos pertinentes, según la Declaración de Helsinki de 1975, en la versión revisada de 2013 y el consentimiento informado ofrecido por los enfermos. El estudio fue avalado por el Comité de Ética de las investigaciones de la Salud y el Consejo Científico de los centros participantes en la investigación.
Resultados
Se estudiaron 40 pacientes (80 ojos) entre 50 y 72 años de edad y de ambos sexos.
Tabla 1 Distribución de pacientes diabéticos según edad y sexo.
| Edad (Grupos de edades) | Sexo | Total | ||||
|---|---|---|---|---|---|---|
| Femenino | Masculino | |||||
| No. | % | No. | % | No. | % | |
| 50- 54 años | 0 | 0 | 7 | 100,0 | 7 | 17,5 |
| 55-59 años | 7 | 87,5 | 1 | 12,5 | 8 | 20,0 |
| 60-64 años | 12 | 63,1 | 7 | 36,8 | 19 | 47,5 |
| 65 años y más | 5 | 83,3 | 1 | 16,6 | 6 | 15,0 |
| Total | 24 | 60,0 | 16 | 40,0 | 40 | 100,0 |
Fuente: Historias clínicas
Se observa en la Tabla 1 que el grupo etario de 60-64 años predominó en la muestra, así como el sexo femenino.
Tabla 2 Distribución de ojos según resultado de la tomografía de coherencia óptica
| Presencia de edema en ojos | No. | % |
|---|---|---|
| Ojos con edema | 58 | 72,5 |
| Ojos sin edema | 22 | 27,5 |
| Total | 80 | 100,0 |
Fuentes: Historias clínicas y base de datos de la TCO.
Se destaca en la Tabla 2 que predominaron los ojos con edema macular diabético en la muestra de 80 ojos estudiada para 72,5 %.
Tabla 3 Clasificación del edema macular diabético según morfología y tiempo de evolución de la Diabetes Mellitus.
| Clasificación del edema según morfología | Años de evolución | Total | ||||
|---|---|---|---|---|---|---|
| Menos de 10 | Más de 10 | |||||
| No. | % | No. | % | No. | % | |
| Ojos con engrosamiento simple (E1) | 3 | 15,0 | 17 | 85,0 | 20 | 34,5 |
| Ojos con engrosamiento cistoide (E2) | 5 | 16,6 | 25 | 83,3 | 30 | 51,7 |
| Ojos con desprendimiento del neuroepitelio (E3) | 1 | 12,5 | 7 | 87,5 | 8 | 13,8 |
| Total | 9 | 15,5 | 49 | 84,5 | 58 | 100,0 |
Fuentes: Historias clínicas y base de datos del TCO.
p=0,9371
Según la clasificación morfológica utilizada en el estudio, se halló el engrosamiento cistoide en 51,7% de los ojos. En total, 84,5% de los ojos con edema correspondieron a pacientes con más de 10 años de evolución de la Diabetes Mellitus. (Tabla 3)
El valor p calculado para la prueba Chi Cuadrado fue superior al nivel de significación planteado lo cual permite afirmar que, desde el punto de vista estadístico, el tiempo de evolución de la diabetes y las características morfológicas del edema macular son independientes.
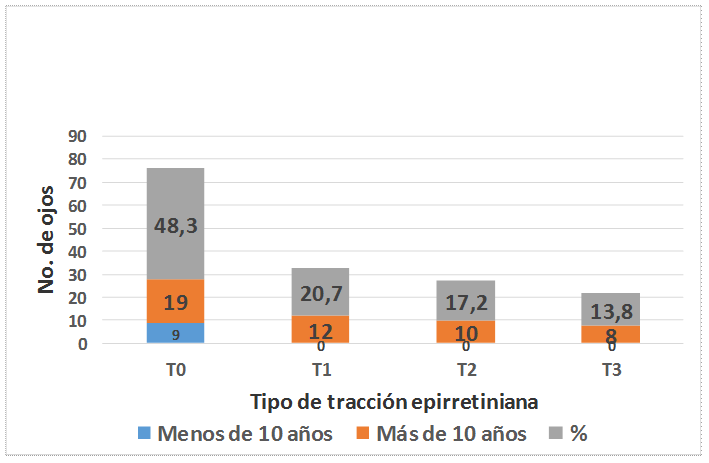
Acorde con la clasificación de la tracción epirretiniana empleada, predominaron los ojos sin línea hiperreflectiva; todos los pacientes con menos de 10 años de evolución se encontraron en este grupo. En 48,3% de los ojos no presentaron edema traccional y solo en 13,8% se observó el signo característico de la tracción anteroposterior de la mácula por el vítreo, en “alas de gaviota”. El valor p calculado para la prueba Chi Cuadrado fue inferior al nivel de significación planteado, esto evidencia la presencia de asociación, desde el punto de vista estadístico. (Figura).
Discusión
En este estudio con pacientes diabéticos al hallarse que el sexo predominante fue el femenino y el grupo etario el de 60-64 años, coincide con trabajos de autores como Ramos y colaboradores.13 En otra muestra de pacientes con diagnóstico de EMD tratados, reportada por Dijk, también excedieron las mujeres y las edades por encima de 60 años.14
Estudios de prevalencia en Diabetes Mellitus tipo 2 muestran que de 2 a 8% de estos diabéticos tienen EMD después de 5 años del diagnóstico, mientras que tienen 28%, 20 años después. En el caso de los diabéticos tipo 1, se reporta 0.0% a los 5 años y 29% después de 20 años de evolución de la enfermedad.15) Se explica así el hecho de que el EMD predomine en las edades avanzadas en la muestra.
En Cuba, la tasa de prevalencia por diabetes se incrementó en 16,3 por 1 000 habitantes en 6 años; en 2015 fue de 56,7 por 1 000 habitantes y en 2016 de 58,3. Esto trae como consecuencia que se incremente el riesgo de aparición de complicaciones oculares como la retinopatía diabética y el EMD.16
En un estudio realizado en 2004-2005 sobre prevalencia de ceguera en la ciudad de La Habana, Río halló que, entre 2 760 enfermos mayores de 50 años encuestados 9,2% presentaban ceguera por retinopatía diabética, con una agudeza visual igual o menor de 20/400 en el mejor ojo con la corrección óptica disponible en el momento de la encuesta.17
La prolongación de la vida en los pacientes diabéticos ha propiciado, la aparición de múltiples complicaciones que se presentan tardíamente en una diabetes de larga duración. Por esto se hace necesario un diagnóstico temprano de la DM en la atención primaria de salud (APS), así como la continuidad del estudio oftalmológico con participación del nivel secundario y terciario de salud, para la prevención de las complicaciones oculares, que llevan invariablemente a la baja visión y en otros casos más comprometidos a la ceguera total.
En un estudio observacional y descriptivo realizado por el Servicio de Vitreorretina del Instituto Cubano de Oftalmología "Ramón Pando Ferrer" en 2015, en 347 enfermos residentes en el municipio capitalino Playa, encontraron que la maculopatía leve fue más frecuente que la severa y la prevalencia de algún grado de retinopatía y de maculopatía fue de 13,1% en el área 1 y 10,6% en el área 2 del municipio estudiado.18 A pesar de que la muestra era pequeña y la prevalencia de retinopatía y/o maculopatía fue baja, se presentaron pacientes con discapacidad visual prevenibles y tratables.
Dado que el EMD es causa importante de pérdida visual en pacientes diabéticos, refiriéndose el término a que anatómicamente hay edema y engrosamiento central en la región macular, lo que hasta hace algunos años solo se diagnosticaba por la BMP y la angiografía fluoresceínica se ve complementado en la actualidad por la información cualitativa y cuantitativa de las estructuras retinales que nos proporciona la TCO.
Con este estudio se constató un predominio del engrosamiento cistoide en la muestra explorada y se verificó la independencia entre la morfología y el tiempo de evolución de la Diabetes Mellitus, por métodos estadísticos, criterios de gran importancia ante el manejo del paciente con DM y la obligatoria responsabilidad del oftalmólogo de preservar en lo posible su capacidad y calidad visual. No obstante, el mayor porcentaje de ojos con edema independientemente de su morfología, se encontró en el grupo de más de 10 años con la enfermedad vascular.
Cualquier acumulación o “encharcamiento” de fluido extracelular, puede resultar en el desplazamiento de las relaciones espaciales normales entre los componentes de retina neuronal, asi como pequeñas cantidades del mismo pueden resultar en el llamado engrosamiento simple y por el contrario grandes cantidades pueden favorecer la formación de espacios libres de células o quistes. Los mismos son espacios negros no reflectivos, rodeados por septos de mediana a baja reflectividad.19,20
Kothari y colaboradores, en su estudio, utilizaron TCO y microperimetría, constataron cuatro patrones morfológicos, con predominio del edema cistoide y el engrosamiento retinal en su muestra.21
En pacientes con grosor macular entre 200 y 300 micras, solo 14% presenta edema foveal oftalmoscópico. Este tipo de edema, no detectable por biomicroscopía, se denomina subclínico. Diferentes estudios han constatado que la TCO es más sensible que la biomicroscopía para detectar discretos cambios en el grosor de la retina y adhesiones vítreorretinales.22
Ozdek y colaboradores encontraron que 40% de los edemas maculares quísticos no eran detectados por biomicroscopía y 63% no eran detectados incluso por angiografía.23) Por su parte, Kang que encontró una buena correlación entre TCO y angiografía, plantea que 60% de los pacientes con engrosamiento foveal, tienen difusión focal en la angiografía.24
Sin dudas, la TCO proporciona un excelente instrumento para estudiar el EMD. Actualmente, con el surgimiento de modelos de tomógrafos más complejos, como el de Dominio Espectral, los investigadores han logrado, con el uso de biomarcadores, incluso realizar estudios para pronosticar la severidad de la retinopatía y del EMD en un futuro, aspectos no evidentes desde el punto de vista clínico.25
Otra de las ventajas constatadas, es que permite, por su mayor poder de resolución, no solamente detectar cambios en el grosor macular, sino también una clara delimitación de cambios microestructurales y lesiones finas en las capas individuales de la retina.26,27) Esto contribuirá a comprender mejor, la relación entre los cambios estructurales, su correlación con la agudeza visual del paciente y con la respuesta de la retina a las diferentes modalidades de tratamiento.
Con respecto a la relación del edema con el tiempo de evolución de la DM existen estudios como el de Mesa y colaboradores donde predominó con la evolución de la Diabetes entre 10 y 20 años.28 Han sido reportados significantes variaciones en la incidencia y prevalencia del EMD, dependiendo del tipo de DM (tipo 1 o 2), modalidad de tratamiento y tiempo de duración de la DM, ya que puede aparecer en cualquier etapa de la Retinopatía Diabética, pero ocurre más frecuentemente cuando es mayor la severidad de esta y el tiempo de evolución de la DM. En el Estudio Epidemiológico de Wisconsin de Retinopatía Diabética (WESDR, por su sigla en inglés), la incidencia a los 10 años fue de 20,1% en los pacientes de tipo 1, de 13,9% en el tipo 2 no insulinodependientes y 25,4% en los insulinodependientes.29
En la muestra presentada se observó predominio del edema sin componente traccional y se comprobó la presencia de asociación entre estas variables.
Thomas en su estudio sobre EMD, encontró engrosamiento hialoideo solamente en 4% de sus pacientes estudiados, así como desprendimiento vítreo posterior (DVP) parcial solo en 10%. Otros autores plantean que aproximadamente 21% de los casos con EMD presentan engrosamiento hialoideo posterior y tracción.30,31
Más recientemente con la TCO de Dominio Espectral, se han identificado con mayor precisión, las anomalías de la interfase vítreomacular, incluyendo la presencia de membranas epirretinales (MER) y tracción vitreomacular (TVM).
Las MER se manifiestan por la presencia de pseudoagujero macular o al observarse una banda hiperreflectiva o membrana. La tracción vitreomacular se identifica por una banda hiperreflectiva elevada que está en oposición con la superficie interna de la retina. Asimismo, se ha podido determinar el estatus de la hialoides posterior cuando está adherida a la mácula.32
Sobre este aspecto es preciso señalar que el hecho de poder valorar más detalladamente la interfase, a través de la TCO, ha permitido comprender el verdadero papel de la tracción en patologías como el EMD y profundizar en estudios sobre uso de la vitrectomía como una de las líneas de tratamiento.
La TVM es causa de edema, esto sucede a través de diferentes mecanismos fisiológicos y mecánicos. Así se plantea que las fuerzas que sean capaces de ejercer las fibras del vítreo, adheridas a las células de Müller, al ocurrir el desprendimiento (DVP), provoca hipertrofia de las mismas, proliferación y fuga de los capilares. También este estrés mecánico mantenido sobre las células de Müller y los astrocitos, puede estimular la liberación de factores inflamatorios y la ruptura de la barrera hematoretiniana, y favorecer el edema macular.33
Se declara como limitación de este estudio que el tomógrafo utilizado fue de Dominio Tiempo, el cual no tiene las mismas ventajas que el de Dominio Espectral ni permite visualizar de forma tan detallada las diferentes capas de la mácula por su mayor poder de resolución.
Conclusiones
La tomografía de coherencia óptica tiene un importante papel en la identificación de los engrosamientos subclínicos y el monitoreo cuantitativo del edema macular en la consulta de Oftalmología. La prevención de esas complicaciones, una vez diagnosticada la Diabetes Mellitas, es el objetivo fundamental de la Medicina cubana en la actualidad y en los años venideros, ya que la prevención de la ceguera evitable es el propósito de la Organización Mundial de la Salud en su programa internacional Vision 2020 y en el programa cubano del Ministerio de Salud Pública sobre Salud Ocular.