Introducción
El cáncer de próstata es una de las neoplasias malignas más frecuentes en adultos varones mayores.1 Se ha reportado una incidencia de 214 casos por
1 000 hombres en países europeos, siendo los factores de riesgo identificados la edad, etnia, antecedentes en tres o más familiares, consumo de alcohol y enfermedades inflamatorias crónicas.1 Sobre el tratamiento, la European Association of Urology recomienda la quimioterapia combinada a base de docetaxel y prednisona en casos de cáncer de próstata resistente a la castración.2 El docetaxel es metabolizado por la enzima CYP3A4, por lo que presenta interacciones con muchos fármacos en tratamiento concomitante,3 entre estos se encuentran algunos antidiabéticos metabolizados por la misma enzima.
En el contexto de la alta prevalencia del cáncer prostático en adultos mayores, el envejecimiento es un factor de riesgo para la toxicidad por quimioterápicos, por lo que son comunes los efectos adversos hematológicos, gastrointestinales, cardiacos, neurológicos y dermatológicos;4 sin embargo, el beneficio suele superar al riesgo. Esta toxicidad puede verse incrementada por enfermedades crónicas.5 Asimismo, los desórdenes endocrinológicos conllevan a una alteración en la producción de energía, y consecuentemente los procesos celulares, entre ellos la fisiología inmunológica, se ven deteriorados, siendo un factor de riesgo para la toxicidad farmacológica.
La Diabetes Mellitus (DM) tipo 2 es una enfermedad endocrina crónica que ha sido propuesta como un modelo de envejecimiento acelerado y se asocia con un estado inflamatorio crónico por la elevación de citoquinas y productos finales de la glicosilación avanzada, y produce daño acumulado en el cuerpo.6 Debido a su fisiopatología, es plausible que incremente el riesgo de toxicidad quimioterapéutica en pacientes oncológicos; no obstante, es importante mencionar que otros estudios encontraron asociación inversa entre el cáncer de próstata y la DM tipo 2.7 A pesar de que es una patología que disminuye la calidad de vida y es prevalente en los adultos mayores, no se ha estudiado su asociación con la toxicidad descrita.
Determinar esta asociación es relevante en este grupo etario, ya que menos de la mitad de diabéticos conoce su diagnóstico, y si se añade el hecho de las importantes cifras de cáncer prostático en el mismo grupo etario, no es sorprendente encontrar preocupante incidencia de este cáncer en diabéticos.
El objetivo de este estudio es determinar la asociación entre DM tipo 2 y el riesgo de toxicidad quimioterapéutica en adultos mayores con cáncer de próstata del Centro Médico Naval (CEMENA) “Cirujano Mayor Santiago Távara”, Callao, Perú.
Materiales y métodos
Se realizó un estudio analítico de tipo cohorte retrospectiva, análisis secundario de la base de datos de una cohorte de seguimiento de pacientes oncológicos realizada en el Servicio de Geriatría del CEMENA (Callao, Perú) entre 2013 y 2016.8
La base original incluyó a 267 pacientes adultos mayores con diagnóstico anatomopatológico de cáncer de próstata reclutados entre septiembre de 2012 y febrero de 2013; como criterios de inclusión solo se admitieron pacientes que llevaron su tratamiento en el mismo hospital y aquellos que aún no habían comenzado su tratamiento antineoplásico. En el estudio original, se registró que la ubicación más frecuente de cáncer fue en la próstata (24.9%), seguido del estómago (16.6%), colon/recto (18.2%), pulmón (17.7%), páncreas (9.4%), siendo el linfoma el menos frecuente (13.3%).
En el presente estudio se incluyó un total de 161 marinos retirados con diagnóstico anatomopatológico de cáncer de próstata entre septiembre de 2012 y febrero de 2013 y que fueron seguidos en el Servicio de Geriatría del CEMENA desde 2013 hasta 2015. La terapia quimioterapéutica incluyó docetaxel. Se excluyeron a pacientes con problemas cognitivos, aquellos con puntuación menor de 23 puntos en el Mini Mental State Examination; pacientes que no accedieron a participar; pacientes con datos faltantes en la ficha de recolección de datos y aquellos que se retiraron del estudio durante el seguimiento.
Las variables principales fueron toxicidad a la quimioterapia, la cual fue definida como el efecto adverso clínico o laboratorial de grado III, IV o V, secundario al tratamiento de quimioterapia de acuerdo con la escala Common Terminology Criteria for Adverse Events v4.0 (National Cancer Institute9 y antecedente de DM tipo 2, que fue medido según el diagnóstico en la historia clínica en el momento del reclutamiento.
Se evaluaron las variables de edad, estado civil (soltero, casado/conviviente, divorciado o viudo), antecedentes personales del cáncer, definido como el antecedente de cualquier tipo de cáncer; antecedentes patológicos, variable cuantitativa que abarca hipertensión, enfermedad pulmonar obstructiva crónica, historia personal del cáncer e hipoalbuminemia, antecedente de consumo de tabaco, se evaluó para conocer el perfil de antecedentes y comorbilidades del paciente; circunferencia de pantorrilla, cuyo punto de corte fue 31 cm, considerando una medida menor de 31cm como pobre masa muscular, según el Mini Nutritional Assessment Short-Form,10 se evalúo para estimar desnutrición en el adulto mayor; actividad física, categorizada en “pobre” o “adecuada”, según el cuestionario Physical Activity Scale for the Elderly;11 dependencia para las actividades básicas de la vida diaria (ABVD), categorizada en “dependientes” o “independientes”, según el Índice de Barthel modificado por Collin y Wade,12 con un punto de corte de 95 puntos, considerando el puntaje mayor a tal valor como “independiente”; esta variable fue de interés para estimar el impacto de la toxicidad en la vida diaria; cantidad de caídas anuales, categorizada como “≥ 1” o “ninguna”; polifarmacia, definida como el uso de 5 ó más drogas de uso habitual bajo prescripción médica,13 esta variable fue de interés para el modelo ajustado del análisis multivariado, y la fragilidad, categorizada en “frágil” o “normal”, según el Fenotipo de Fried modificado, que mide 5 criterios: velocidad de la marcha, fuerza de prensión, agotamiento físico, pérdida de peso y actividad física, siendo frágiles los que cumplan 3 ó más criterios positivos,14 esta variable fue de interés para estimar el impacto de la toxicidad. La vulnerabilidad fue medida por las escalas Vulnerable Elders Survey 13 (VES-13) y G815,16 VES-13 incluye 13 ítems (edad, salud autopercibida y evaluación funcional y física), evaluando un puntaje de 0 al 10 y considerando ≥ 3 como positivo para vulnerabilidad; G8 evalúa ingesta de alimentos, pérdida de peso, movilidad, deterioro neuropsiquiátrico, índice de masa corporal, consumo de fármacos, salud autopercibida y edad, evaluando un puntaje de 0 a 17 y considerando ≤ 14 como positivo para vulnerabilidad, esta variable fue de interés para conocer la predisposición interna para la afectación por la toxicidad. Todas las variables fueron importantes para un punto de vista íntegro de la situación clínica del grupo estudiado, y para el análisis multivariado. Se realizó un seguimiento a los participantes cada 8 semanas durante el período de estudio para determinar la presencia de la toxicidad, esta fue registrada por un geriatra. Los pacientes fueron monitoreados desde su reclutamiento hasta diciembre de 2015.
Se procesó la información recolectada en una base de datos, la cual fue proporcionada por el CEMENA. El análisis estadístico se ejecutó con el programa STATA, versión 14.0. Los porcentajes y frecuencias absolutas de las variables se expresaron como media ± desviación estándar; se compararon las variables discretas mediante el test de Chi cuadrado, mientras que las variables cuantitativas se realizaron mediante T de Student, y para comprobar la normalidad de la variable se empleó el test de Shapiro Wilk. Para obtener la significancia estadística se utilizó un valor p menor o igual que 0.05. Se construyó un modelo de regresión de Cox para predicción de toxicidad a quimioterapia y determinación de factores asociados a la misma.
El estudio respeta los principios de Helsinki en investigación en humanos, además los autores se comprometen a no compartir la base de datos y declaran no tener conflictos de interés. Todos los autores cumplen los criterios de autoría de la International Committee of Medical Journal Editors (ICMJE). El protocolo de investigación fue revisado por el Comité de Ética de la Universidad de San Martín de Porres y del CEMENA.
Resultados
En la Tabla 1, se presentan los factores asociados al riesgo de toxicidad a la quimioterapia. La media de edad fue de 79.2 ± 4.3 años. El 45.3% de pacientes eran casados/convivientes. La prevalencia de DM tipo 2 fue de 23.6% y 14 (8.7%) pacientes tuvieron antecedentes personales de cáncer (diagnóstico previo de cáncer prostático recurrente u otro tipo de cáncer). Se observó una prevalencia de fragilidad de 37.9% (n=61) y de vulnerabilidad, según VES-13, del 26.71% (n=43) y de 24.2% (n=39), según G8.
Tabla 1 Factores asociados a riesgo de toxicidad por quimioterapia.
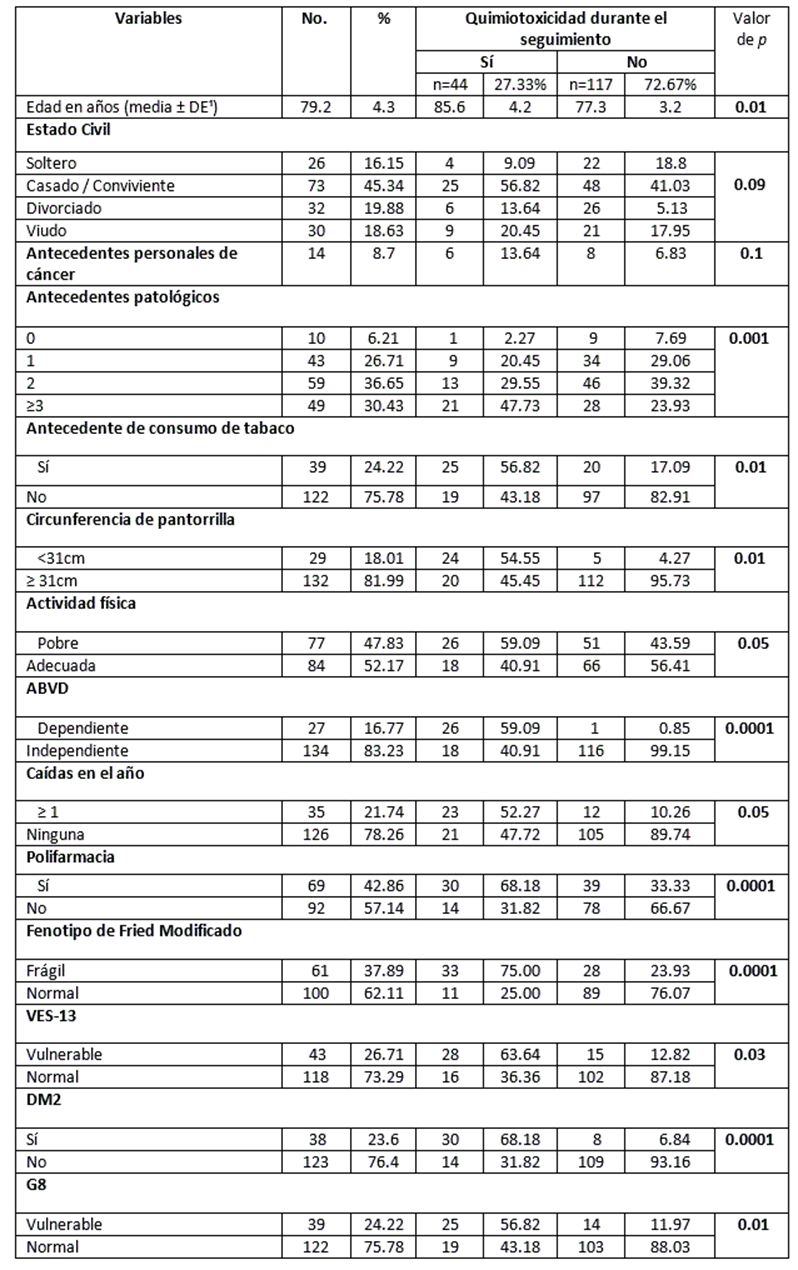
¹ DE: Desviación Estándar; DM2: Diabetes Mellitus tipo 2; VES-13: Vulnerable Elders Survey-13
En la Tabla 2, se presentan los efectos adversos. Los más frecuentes fueron a nivel gastrointestinal (21; 13.04%), linfático/hematológico (13; 8.07%), dérmico (12; 7.45%) y respiratorio (9; 5.59%).
Tabla 2 Efectos adversos desarrollados por quimiotoxicidad durante el tratamiento.
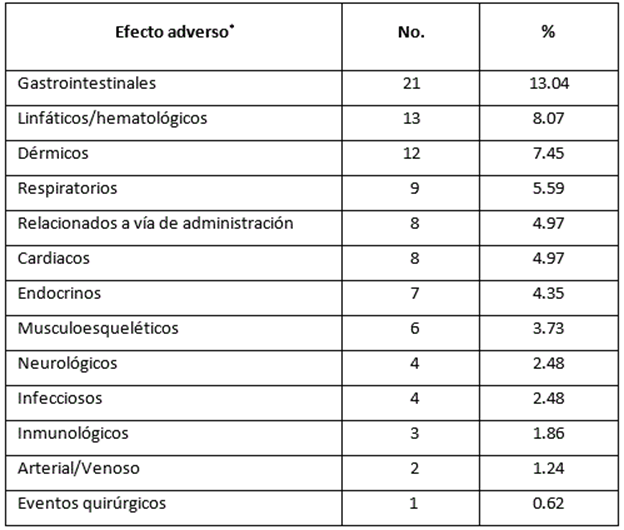
*Se utilizó la escala Common Terminology Criteria for Adverse Events v4.0 (National Cancer Institute)
En la Tabla 3, se presenta el modelo de regresión de Cox ajustado. Los diabéticos tienen un riesgo de toxicidad 1.21 veces mayor en comparación con los no diabéticos.
Tabla 3 Factores predictivos de toxicidad a quimioterapia.
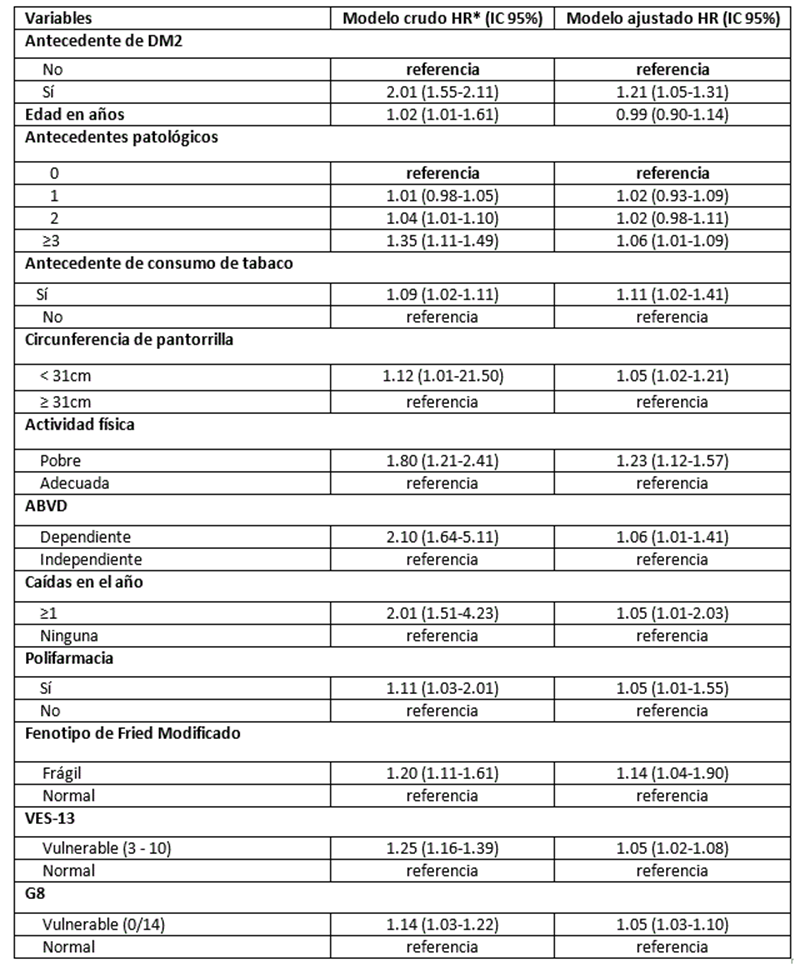
* Modelo ajustado: Ajustado por DM2, edad, antecedentes patológicos, antecedente de consumo de tabaco,
circunferencia de pantorrilla<31, actividad física pobre, dependencia ABVD, caídas en el año,
polifarmacia, fenotipo de FRIED modificado, VES-13, G-8.
Además, el tener 3 ó más antecedentes patológicos, antecedentes de consumo de tabaco, ser sedentario, la polifarmacia y estados de fragilidad y vulnerabilidad, son factores predictivos para quimiotoxicidad además de la DM, edad, antecedentes patológicos, antecedente de consumo de tabaco, circunferencia de pantorrilla, actividad física, dependencia para ABVD, caídas, polifarmacia, fragilidad y vulnerabilidad medida por VES-13 y G8.
Discusión
El presente estudio determinó que el antecedente de Diabetes Mellitus tipo 2 es un factor predictivo para el riesgo de toxicidad por quimioterapia en adultos mayores con cáncer prostático. Se registró con mayor frecuencia la toxicidad a nivel gastrointestinal, hematológico y dérmico. La DM posiblemente influyó en estos efectos adversos debido al aumento de actividad proteica y molecular, crecimiento celular y aumento de tirosín-quinasa,17 siendo estos factores para alteración gastrointestinal, por el desbalance energético; hematológica, porque la reducción de energía reduce el número de neutrófilos, ya que estos necesitan energía; y dérmico, es probable que este último se deba más a las interacciones farmacológicas entre antidiabéticos y quimioterapéuticos. La vía de tirosín-quinasa activa un proceso de señalización que causa mutaciones de novo en el genoma, además está relacionado a la enzima citocromo p450 y el metabolismo farmacológico. Adicionalmente, esta enzima está implicada en el metabolismo de los antidiabéticos y quimioterápicos, por lo que las interacciones entre estos se verán acentuadas en las personas que consumen muchos fármacos. En el presente estudio, la polifarmacia resultó ser factor predictivo de toxicidad; sin embargo, no se puede asumir la predominancia de los antidiabéticos.
Un estudio que evaluó 1 006 hombres con cáncer de próstata resistente al tratamiento hormonal, concluyó que el docetaxel es efectivo, pero incrementa la toxicidad y los efectos adversos, siendo los hematológicos y neurológicos los más frecuentes,18 en nuestro estudio se registraron con mayor frecuencia los efectos adversos a nivel gastrointestinal y hematológico, posiblemente esta diferencia se deba a la diferencia de la flora intestinal de los pacientes y variabilidad de comorbilidades. La diabetes está relacionada a complicaciones gastrointestinales, los más notorios son diarrea y constipación. Los síntomas gastrointestinales pueden explicarse por alteración del eje intestino-cerebro, siendo los potenciales factores patogénicos la neuropatía autonómica (vagal y mioentérica) y periférica, encefalopatía diabética, trastornos psicológicos y farmacoterapia, adicionalmente las alteraciones en el sistema nervioso central pueden causar hipersensibilidad gástrica e hiposensibilidad rectosigmoidea.19 Por otro lado, la DM tipo 2 y el cáncer prostático se pueden relacionar molecularmente mediante el factor de crecimiento insulínico tipo 1 (IGF-1), el cual es expresado por los diabéticos. El IGF-1 está relacionado al aumento de proliferación de células neoplásicas y disminución de receptores de ligando de estrógeno en el tumor,20 reduce la respuesta a los fármacos y la supervivencia del paciente. Sin embargo, otros estudios no han mostrado asociación directa entre riesgo de cáncer de próstata en pacientes diabéticos.7 La variabilidad de la severidad de la enfermedad, síndromes geriátricos y efectos adversos de los pacientes21 explican la significativa asociación de la fragilidad con la toxicidad; el estilo de vida que haya adoptado el paciente es vital al comparar estas diferencias. La dependencia para ABVD y fragilidad resultan ser predictores importantes, ya que son los aspectos que modifican la vida y el curso del tratamiento del paciente.
El tabaquismo está asociado a diferentes tipos de cáncer, especialmente el cáncer de próstata. El antecedente de consumo de tabaco resultó ser un factor predictivo para la toxicidad por quimioterapia. Esta condición ocasiona disfunción endotelial, por lo que el tabaquismo en diabéticos pudo haber aumentado la toxicidad por quimioterapia en el estudio. A pesar de que la edad no sea un factor predictivo de riesgo en el modelo ajustado de nuestro trabajo, diversos estudios indican que es un factor de riesgo para el cáncer de próstata. Por otro lado, en un estudio realizado con pacientes varones del Cancer of the Prostate Strategic Urologic Research Endeavor se observó que los mayores de 75 años presentaron un alto riesgo para este cáncer.22 Sin embargo, Thompson y colaboradores evaluaron las biopsias de próstata de 5519 adultos mayores que participaron en el Prostate Cancer Prevention Trial para desarrollar un modelo predictivo de cáncer de próstata, en el cual no se observó significancia estadística en relación con la edad.23
Otro de los efectos adversos frecuentes es la alopecía, la cual se ha descrito en los efectos adversos de diferentes quimioterápicos usados, así como otros efectos adversos dérmicos, como la xerosis, hiperpigmentación y mucositis.24 En los diabéticos, la alopecía no es frecuente; sin embargo, Galbraith y Pandey estudiaron el rol del factor de necrosis tumoral alfa (TNF-a) en la alopecía, destacan la relación entre esta y la diabetes insulino-dependiente mediante el mecanismo de la proteína TNF-a, siendo significativa en ese estudio.25
La presencia de síndromes geriátricos en pacientes oncológicos requiere instrumentos de medición eficaces, ya que estimarían la probabilidad de desarrollar efectos adversos del tratamiento antineoplásico. En el presente estudio, los pacientes dependientes para ABVD tuvieron un riesgo de toxicidad 1.05 veces mayor que los pacientes independientes, probablemente porque los tratamientos invasivos hospitalarios en adultos mayores están asociados al deterioro funcional y cognitivo.26 La vulnerabilidad en el adulto mayor lo hace propenso a la toxicidad por tratamiento invasivos y prolongados. Además, la sarcopenia, producto de la convergencia de algunas enfermedades crónicas, la edad y fragilidad, está asociada a peor evolución y mayor riesgo de toxicidad en tratamiento de ciertos cánceres; y ha sido propuesta como la otra cara de la diabetes, debido a fenómenos fisiopatológicos como la resistencia a la insulina, autofagia, disfunción mitocondria, entre otros.6,27 A pesar de la eficiencia de las escalas VES-13 y G8, está última tuvo un mejor valor predictivo, probablemente debido al espectro de variables consideradas. Otros estudios han observado asociación entre ambas escalas con quimiotoxicidad y deterioro funcional.28
Las limitaciones del estudio radican en que cada paciente tiene una fecha de ingreso al estudio distinta, pero todos tienen una misma fecha de fin de seguimiento, esta última fue establecida de manera arbitraria para el 31 de diciembre de 2015, por lo que el tiempo de seguimiento podría no ser significativo; la medición de la toxicidad de la quimioterapia fue medida mensualmente según las fichas del servicio de oncología, lo que podría restarle exactitud a la medición de tiempo para evento. La población del estudio proviene de la Marina de Guerra del Perú, por lo que los resultados no pueden ser extrapolables a los adultos mayores en general, y, por ser una población hospitalaria (CEMENA) existiría sesgo de selección. Además, el diagnóstico de DM tipo 2 y otras variables fueron recabadas por autoreporte y/o por revisión de historias clínicas, entonces podrían presentarse sesgos de información y de reporte. Por otro lado, no se contó con información sobre tipo histológico ni inmunohistoquímica, tampoco con las características específicas del tratamiento. A pesar de estas limitaciones, el presente estudio aporta a la prevención de complicaciones en pacientes diabéticos diagnosticados con cáncer de próstata que llevan un tratamiento de quimioterapia, ya que los resultados muestran factores de riesgo clínicos que pueden ser manejados por los especialistas, y así reducir la incidencia de complicaciones.
En lo que respecta a guías de práctica clínica para el diagnóstico y tratamiento de cáncer de próstata, no se consideran protocolos especializados para pacientes diabéticos que consumen quimioterápicos.2 Se dispone de un metaanálisis que evalúa la toxicidad por quimioterapia en pacientes con cáncer de próstata refractario a la terapia hormonal; sin embargo, no se considera la importancia de asociar DM en el análisis,7 por lo cual, los hallazgos de nuestro estudio deberían servir para identificar a la diabetes como un factor de riesgo de toxicidad del tratamiento quimioterápico en pacientes con cáncer de próstata.
Conclusiones
La Diabetes Mellitus tipo 2 es un factor predictivo para el riesgo de toxicidad por quimioterapia en los adultos mayores con cáncer prostático. Existen otros factores como la circunferencia de pantorrilla, dependencia en actividades básicas de la vida diaria, polifarmacia, vulnerabilidad y fragilidad que resultaron predictivos en el estudio. Se recomiendan futuros estudios entre otras enfermedades crónicas y toxicidad quimioterapéutica.














