Introducción
La polineuropatía desmielinizante inflamatoria crónica (CIDP por sus siglas en inglés) es un trastorno autoinmune, desmielinizante e inflamatorio de los nervios periféricos. Inicio insidioso y evolución lenta de manera progresiva o gradual; con un espectro clínico amplio, aunque se caracteriza por la pérdida sensorimotora simétrica crónica, hallazgos neurofisiológicos de desmielinización, disociación albuminocitológica del líquido cefaloraquídeo (LCR) y la capacidad de respuesta al tratamiento inmunosupresor e inmunomodulador. Aparece a cualquier edad, aunque es más frecuente entre los 30 y 60 años. Prevalencia de 1-1,9 por cada 100 mil habitantes por año y una incidencia de 0,15 por cada 100 mil habitantes, con una mortalidad de 3 %; deja secuelas en 60 % de los casos. La CIDP es una enfermedad idiopática, pero puede asociarse a variadas patologías sistémicas.1,2,3,4
Teniendo en cuenta que las células madre se consideran multipotenciales capaces de generar células maduras de tejidos derivados de capas embrionarias distintas como las células madre hematopoyéticas (CMH), que cumplen con el fenómeno de versatilidad o capacidad de transdiferenciación, permitiendo reemplazar células dañadas por células funcionales que restituyan la función normal de los tejidos u órganos; la movilización de las mismas a través de la aplicación del factor estimulador de colonias granulocíticas (F-ECG)-(Leukocim o Hebervital) y la compresión de las extremidades, para lograr su extravasación hacia el espacio intersticial, podría contribuir a la regeneración de los nervios periféricos afectados. La terapia con células madre adultas podría ser un nuevo tratamiento que resulte efectivo en pacientes con polineuropatías de etiología autoinmune.5,6,7,8,9
Ante la limitación de estudios afines en nuestro medio, se propone como objetivo evaluar la eficacia de la movilización de células madre a través de la aplicación del Leukocim en pacientes con CIDP refractarias a quienes se les administró los tratamientos habituales.
Material y Métodos
Se realizó un estudio prospectivo, aleatorizado, a doble ciegas y de grupos paralelos sobre una cohorte de 45 pacientes donde se administró factor estimulador de colonias granulocíticas (F-ECG) humano recombinante de producción nacional-(Leukocim o Hebervital) con edades entre 30 y 70 años; con diagnóstico de CIDP idiopática a 16 pacientes y a 9 con CIDP asociadas con Diabetes Mellitus (DM), esclerosis múltiple (EM), lupus eritematoso sistémico (LES) y hepatitis C crónica durante 10 días, procedentes de las consulta de Neurología del Hospital General Docente “Dr. Enrique Cabrera” de La Habana; tratados anteriormente con otras variantes medicamentosas inmunomoduladoras e inmunosupresoras por más de 3 años, sin respuesta satisfactoria; en el período comprendido entre abril 2016 y octubre 2019.
Se incluyeron los pacientes que cumplieron los criterios clínicos, electrofisiológicos y estudios de LCR según la Academia Americana de Neurología de 1991;10) así como aquellos con previo diagnóstico de CIDP.
Fueron excluidos los pacientes con polineuropatías de otras etiologías como hereditarias, tóxicas-nutricionales, paraneoplásicas o desconocidas; así como aquellas enfermedades crónicas descompensadas, trastornos hematológicos o de hipercoagulabilidad, enfermedades malignas que no se encontraban en remisión completa y evidencia de infección que contraindique su aplicación. La mayoría de los pacientes fue sometido a tratamiento inmunomodulador [Inmunoglobulinas IV (IVIg), esteroides y plasmaféresis e inmunosupresor (aziatropina, metrotexate, ciclosporina y ciclofosfamida); los que se asignaron de forma aleatoria a uno de los grupos de 25 pacientes a recibir el factor estimulador de colonias granulocíticas (F-ECG) y el otro, de 20 pacientes a mantener el tratamiento medicamentoso habitual.
Evaluación clínica antes y después del tratamiento.
Se recogieron datos clínicos que incluyen examen físico general y neurológico, tratamientos previos, datos de laboratorio (Hemograma, química y coagulograma) antes del procedimiento. Durante el transcurso del tratamiento se realizaron exámenes de conteo global y diferencial de leucocitos al quinto y al décimo día. Cada visita de seguimiento se programó al mes, 3, 6, 12, 18, 24 y 36 meses. El examen neurológico y estudios de laboratorios se realizaron en cada visita, y se solicitó a los pacientes que ejecutaran el sistema de puntuación clínica de Toronto (TCSS, siglas en inglés) con previo conocimiento de estos.11 Se realizaron estudios de conducción nerviosa (ECN) antes de iniciar tratamiento y después de iniciar este a los 3 y 12 meses después del proceder. Se prestó atención durante las visitas de seguimiento, específicamente a cualquier posible efecto adverso debido a la aplicación del medicamento. A todos los pacientes que recibieron el tratamiento con el factor estimulador de colonias granulocíticas, se les administró de forma profiláctica una dosis de aspirina 125 mg diario.
Sistema de puntuación clínica de Toronto (TCSS).
El TCSS es un sistema de puntuación cuantitativo para evaluar la severidad de las neuropatías periféricas, que se aplicó antes y en cada visita de seguimiento después del tratamiento, incluidos los síntomas, el reflejo de las extremidades inferiores y las pruebas sensitivas. La puntuación máxima de TCSS es 19. La gravedad de la neuropatía se calificó según Bril, et al.11,12 de 1 a 5 puntos para ninguna neuropatía; 6 a 8 puntos por neuropatía leve; 9 a 11 puntos por neuropatía moderada y 12 a 19 puntos por neuropatía severa.
Mediciones de estudio de conducción nerviosa (ECN).
El ECN se realizó con la Neurónica, versión 5 (Neuronic S.A.), a través del software EMGWorkplace 5.2 (Neuronic S.A.). A ellos se les realizó ECN motora por tramos de los nervios mediano, cubital y peroneo profundo, así como estudio sensitivo de los nervios mediano, cubital, sural y peroneo superficial. También se evaluó la respuesta F de los nervios mediano, cubital y peroneo de forma bilateral en tres momentos: previo al tratamiento, 3 y 12 meses posteriores. En esta evaluación se utilizaron los parámetros técnicos convencionales para este tipo de estudios.
Procedimiento de la obtención de las células madre hematopoyéticas (CMH)
La movilización a sangre periférica de las células madre autólogas hematopoyéticas, se realizó mediante la aplicación subcutánea del factor estimulante de colonias granulocíticas F-ECG (Leukocim o Hebervital) [Bulbo de 0,30 mg (30 MUI)-1ml] en una dosis única diaria de cinco ug/kg/día (0,5 MUI) sin sobrepasar los dos bulbos al día y se administró un bulbo al día durante diez días. Se realizó conteo global y diferencial de leucocitos los días 5 y 10 del tratamiento, lo que permitió el completamiento de la dosis prevista. El proceder se realizó de forma ambulatoria.
La seguridad fue determinada a través de la monitorización de eventos adversos (EA), cambios en signos vitales, físicos y examen neurológico.
Análisis estadístico
Los datos se conformaron en una base de datos Excel. Se realizó procedimiento descriptivo mediante medidas de tendencia central y porcentajes. Las diferencias antes y después del tratamiento se probaron mediante la prueba t de muestras pareadas para variables continuas y la prueba x2 para variables categóricas. Se realizaron comparaciones de grupos múltiples por análisis de covarianza (ANCOVA). Un valor de P <0.05 se consideró estadísticamente significativo. El análisis estadístico se realizó a través del programa estadístico SPSS V.19 para Windows.
Aspectos éticos
El protocolo de estudio fue aprobado por el comité de investigación y ética del Centro, se cumplieron los aspectos éticos institucionales y el consentimiento informado fue obtenido por todos los pacientes que participaron en la investigación.
Resultados
Las características demográficas fueron similares en ambos grupos, para una media de edad de 52 años y el predominio de los hombres de 64,4 %, respecto a las mujeres de 35,6 %; la duración media de la CIDP fue de 4 años; la Diabetes Mellitus fue la patología de mayor asociación y 68,9 % presentó una neuropatía severa, esto fue lo que caracterizó nuestro estudio. (Tabla 1).
Tabla 1 Características demográficas de los dos grupos de tratamiento
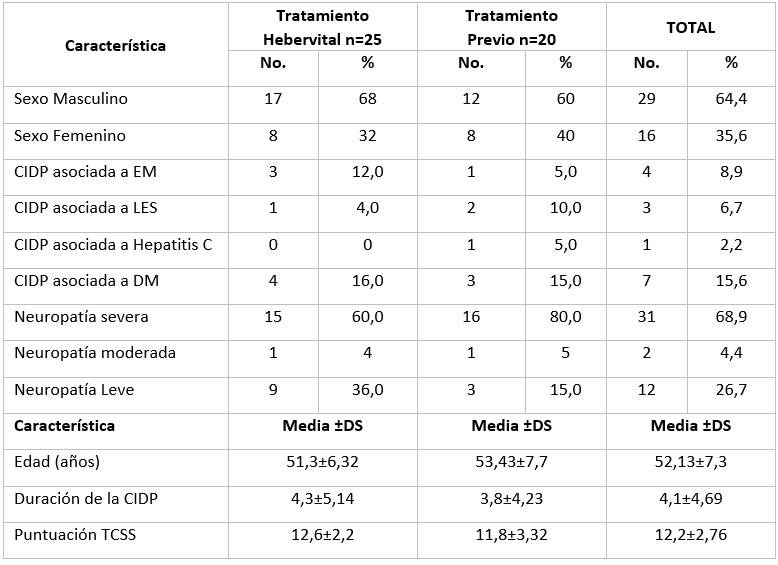
DS: desviación estándar; EM: esclerosis múltiple; LES: lupus eritematoso sistémico; DM: Diabetes Mellitus; TCSS: sistema de puntuación clínica de Toronto.
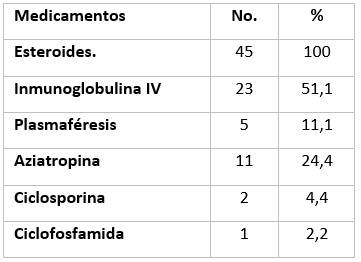
Las variantes medicamentosas usadas previamente al tratamiento son descritas en la Tabla 2. El uso de esteroides ocurrió en la totalidad de los pacientes; así como de inmunoglobulina intravenosa en la mitad de los involucrados en el estudio ante no respuesta favorable a los esteroides. La aziatropina fue el inmunosupresor más usado en aquellos casos de evolución progresiva.
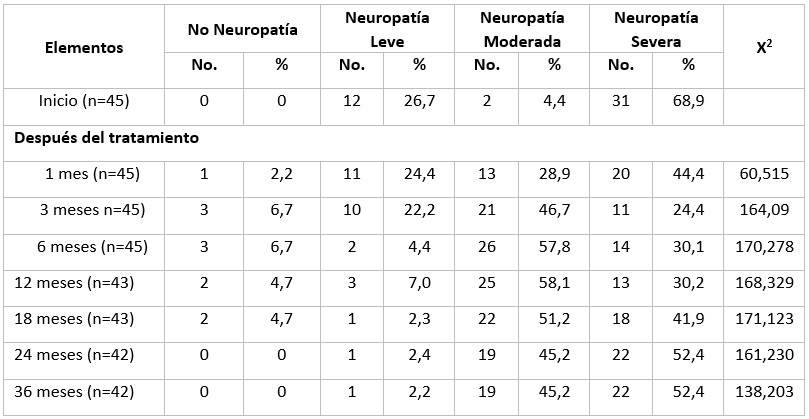
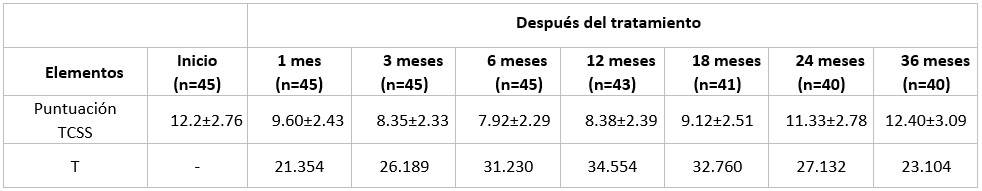
La eficacia clínica del uso del Leukocim se corroboró ante el alivio de los signos y síntomas de la neuropatía, definiéndose mediante TCSS. Las puntuaciones disminuyeron significativamente a los 1 y 3 meses después del tratamiento en comparación con los valores basales. Esta disminución no fue evidente durante el seguimiento hasta 36 meses. Observamos una mejora significativa de las principales manifestaciones de neuropatía, como dolor en las extremidades inferiores, entumecimiento, hormigueo y debilidad solo durante los primeros 3 meses después de la inyección del Hebervital, revirtiendo esta mejora evolutivamente. (Tabla 3).
Tabla 3 Puntuación de TCSS antes y después del tratamiento
P<0.001
Datos presentados como media±DS (desviación estandar); P: Diferencia estadística entre grupo de inicio y cada visita de seguimiento posterior al tratamiento; TCSS: sistema de puntuación clínica de Toronto.
La severidad de TCSS mejoró significativamente en los primeros meses después del tratamiento, en correspondencia con la disminución de la proporción de neuropatía severa de 68,9 % a 46.7 %. Esta cifra continuó disminuyendo a solo 52.4 % a los 36 meses después del tratamiento; mientras que la proporción de neuropatía moderada aumentó gradualmente de 4,4 % a 45.2 % al final de este estudio. Con ninguna neuropatía se incrementó ligeramente la proporción en los primeros meses, retornando a 0.0 % culminado el estudio por el abandono de 3 pacientes que perdieron contacto y no se presentaron en los seguimientos debido a varias razones, como se muestra en la Tabla 4.
El análisis de los resultados de ECN reveló una mejora significativa de la velocidad de conducción y el potencial de acción de los nervios sensoriales y motores después de la movilización de células madre. Tres meses después del tratamiento, VCNm y VCNs aumentaron de 36.29±2.21m/s a 39.33±2.45m/s y 34.74±2.18 m/s a 38.30±2.23 m/s, respectivamente; pero transcurrido los 12 meses después del tratamiento no se evidenciaron cambios significativos. El PAMC mejoró de 4.47±1.25mV al inicio del estudio a 5.30±1.42mV a los 3 meses, y luego disminuyó ligeramente a un nivel de 5.22±1.33mV al año. El PANS aumentó gradualmente de 3.48±1.15mV al inicio del estudio a 4.22±1.89mV a los 3 meses y a 4.41±1.64mV a los 12 meses. (Tabla 5).
Tabla 5 Estudio de conducción nerviosa (ECN) antes y después del tratamiento
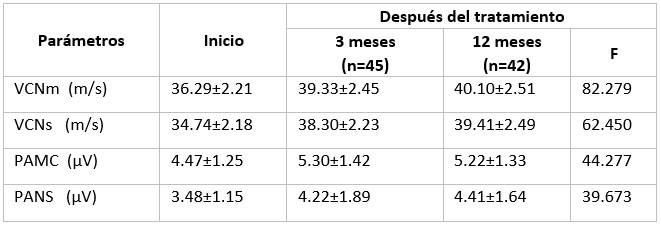
P<0.001
Datos mostrados como media ± Desviación estándar; VCNm: velocidad de conducción nerviosa motora; VCNs: velocidad de conducción nerviosa sensitiva; PAMC: potencial de acción motor compuesto; PANS: potencial de acción nerviosa sensitiva.
No se detectaron casos de rechazo y malignidad durante las visitas de seguimiento. Solo 12 pacientes (26.7%) experimentaron leves molestias, como dolores musculares, articulares y sensación de cansancio generalizados; así como ligero dolor en los sitios de inyección varias horas después de la administración subcutánea. Estos síntomas fueron bien tolerados y desaparecieron al cabo de los 3-5 días tras su administración.
Discusión
La CIDP presenta un espectro clínico amplio, donde existen algunos subtipos de clasificación cuya respuesta y opción terapéuticas son diferentes. Se han reportado casos con inicio en la infancia e incluso formas congénitas con remisión espontánea, aunque es poco frecuente; habitualmente aparece entre los 30 y 60 años. La proporción hombre /mujer es de 2:1. 1,2,6 Este estudio no incluyó edades tempranas, con inicio para una media de edad de 52 años y predominio del sexo masculino mayor de 60%. Tiene un inicio insidioso y evoluciona lentamente, ya sea de manera progresiva o gradual, alcanzando su máxima severidad después de varios meses (8 semanas). Mathey (2015) ha descrito un grupo de pacientes con polineuritis en los que la debilidad progresó de manera constante durante 4 a 8 semanas y que respondieron a los corticosteroides (SGB subagudo), el curso clínico fue monofásico y lentamente progresivo en aproximadamente un tercio como suele suceder en aquellos casos donde emerge de un caso leve o moderado de Síndrome Guillaín Barré (SGB), siendo conceptualizado por algunos neurólogos como la forma crónica del SGB; gradual y progresivo en otro tercio, y recidivante en el tercio restante.2 La mitad de los pacientes estudiados tuvo una evolución clínica recidivante, monofásica y lentamente progresiva en un cuarto, y gradual y progresiva en el cuarto restante antes de iniciar el tratamiento.
La mayoría de los estudios arroja que 25 de los pacientes se asociaron a una afección sistémica, separando así tales casos de la variedad idiopática. Un porciento de estas patologías son de base autoinmune y responden a los corticosteroides, aunque de forma impredecible, y al tratamiento de la enfermedad subyacente.1,2,3,4,6 El estudio arrojó discreto aumento del porciento de asociación a las afecciones sistémicas respecto a otros estudios realizados para 33,4 %.
Los hallazgos típicos en los estudios de conducción nerviosa son de bloqueo de conducción multifocal; latencias distales prolongadas (bloqueo distal); pérdida de respuestas tardías; y dispersión de los potenciales compuestos de acción muscular; todo lo cual refleja la desmielinización en los nervios.
Las terapias inmunomoduladoras e inmunosupresoras están dirigidas a bloquear el proceso inmune para detener la desmielinizacion e inflamación; de este modo mejorar el bloqueo de conducción y crear condiciones propicias para la reparación neural.13,14 Los tratamientos actuales que han sido validados por los ensayos clínicos controlados aleatorios incluyen corticosteroides, plasmaféresis e inmunoglobulinas IV. La favorable respuesta a los esteroides está bien documentada y confirmada en varios ensayos clínicos controlados aleatorizados con el uso de pulso de metilprednisolona intravenosa, pulso oral de prednisona o dexametazona. En la mayoría de los casos se considera uso de metilpredinisolona IV en los primeros días de la semana y luego se continúa por vía oral (1 mg/kg/d) entre 60-80 mg durante 1 mes y continuar con disminución paulatina de 10 mg cada 2 semanas o en dosis alternas hasta que se haya logrado una dosis tan baja como sea posible (20-40 mg) para minimizar los efectos adversos; principalmente en aquellos pacientes esteroides dependientes. Algunos estudios han encontrado que los corticosteroides se pueden retirar sin recaída en algunos pacientes disminuyendo lentamente durante muchos meses o un año y los intentos de retirar los esteroides más rápidamente han llevado a ciclos adicionales o recaídas.15,16 Esta opción terapéutica se usó en la totalidad de los casos del estudio.
En aquellos pacientes con una discapacidad de envergadura se opta como primera línea de tratamiento el uso a corto plazo de la infusión intravenosa de altas dosis de gammaglobulina (2 g/kg en infusiones divididas durante 5 días). Más de la mitad de nuestros pacientes han respondido a este tratamiento, aunque solo durante varias semanas o meses, después de lo cual las infusiones deben repetirse para mantener la mejoría clínica adecuada ajustada a la dosis más baja posible. Similar respuesta se obtuvo en el estudio.
Los principales inconvenientes de IgIV son su gasto y las varias horas necesarias para su infusión; donde se han notificado casos raros de síndrome nefrótico, meningitis aséptica, enfermedad del suero, oclusión venosa o arterial trombótica, incluidos accidente cerebrovascular e hipotensión, especialmente si la infusión es demasiado rápida.17,18
La mitad de los pacientes con CIDP también responden bien a los intercambios de plasma. En un ensayo prospectivo doble ciego, Hahn y colegas (1996) encontraron que el intercambio de plasma administrado dos veces por semana durante 3 semanas tuvo un efecto beneficioso tanto en la discapacidad neurológica como en la conducción nerviosa. La respuesta a la plasmaféresis ha sido comparable a la obtenida con IgIV y con esteroides, pero se ha discernido que algunos pacientes responden a un tipo de tratamiento y no otro. Los efectos de los intercambios de plasma en la mayoría de los pacientes disminuyen en 10 a 21 días, o incluso menos; en algunos, la respuesta dura más tiempo. Por estas razones, se prefirió probar el intercambio de plasma o la inmunoglobulina antes de comprometer a un paciente a un tratamiento a largo plazo con prednisona 19
La relativa facilidad de administrar IgIV favorece su uso primero, seguido de una serie de intercambios de plasma si no hay mejoría. Cuando hay una respuesta clara, 3 ó 4 series breves de intercambios de plasma o infusiones repetidas de inmunoglobulina pueden ser suficientes para llevar al paciente a un nivel mejorado de función. Estos tratamientos pueden complementarse con pequeñas dosis de prednisona cuando las infusiones o intercambios frecuentes se vuelven poco prácticos. En aproximadamente un tercio de los casos, la IgIV y el intercambio de plasma dejan de tener beneficios después de un uso repetido durante 1 o más años.15,18,19
Aparte de la primera línea terapéutica mencionada anteriormente; se considera el uso de inmunosupresores a largo plazo, generalmente en pacientes con pobre respuesta a la primera opción terapéutica. Pueden ser usados de forma independientes con resultados favorables o en combinación con los inmunomoduladores. La aziatropina (durante al menos 3 meses), a 3 mg/kg en una sola dosis diaria es usualmente bien tolerada y más conocida, pero sus efectos son más lentos que la ciclosporina o metrotexate. Ciclofosfamida (50 mg/kg/d IV durante 4 días seguido de un factor estimulante de granulocitos que comienza el décimo día hasta que se recupera el recuento absoluto de neutrófilos, ciclosporina20 y micofenolato21 han probados tener eficacia clínica en muchos informes de la literatura, especialmente para pacientes con resistencia al tratamiento terapéutico de primera línea. Este resultado no difiere de la bibliografía al respecto a pesar del bajo por ciento de los casos con uso de aziatropina y ciclosporina principalmente.
Se informó que Alemtuzumab fue utilizado clínicamente en 2005 en un caso refractario dependiente de IgIV donde el paciente logró una buena eficacia clínica. Los estudios en 2016 mostraron que la dosis promedio deI IgIV disminuyó en un 26 % por mes después del uso de Alemtuzumab, y el intervalo de uso se extendió de 22 días a 136 días.22 Un ensayo controlado aleatorio confirmó que el interferón (IFN-β-1α) no tuvo un efecto obvio en pacientes con CIDP con resistencia a tratamientos de primera línea; sin embargo otros estudios arrojaron que permitió un aumento en el intervalo entre infusiones de IgIV.23
A pesar de la variedad de tratamientos inmunomoduladores e inmunosupresores; no eliminan la posibilidad de que algunos pacientes con CIDP evolucionen a una discapacidad considerable e incluso a la muerte. Por lo que los pacientes pueden elegir el trasplante de células madres como otra opción terapéutica, principalmente las refractarias. Las células madre derivadas de la médula ósea, con reconocida plasticidad y capacidad proliferativa, pueden circular en la sangre periférica y migrar a diferentes tejidos distantes, en los que pueden asentarse y contribuir a la regeneración de sitios dañados Desde el 2002 al 2018, la mayoría de los estudios con CIDP refractaria tratadas5,7) por trasplante de células madres hematopoyéticas (TCMH) en todo el mundo, han demostrado que la frecuencia de recaída de los pacientes disminuyó en grados considerables, disminución de los síntomas, los resultados de los exámenes electrofisiológico evidenciaron una mejoría significativa; así como el progreso de la enfermedad ha sido controlado de manera efectiva. También se observó que los principales cambios neurofisiológicos fueron un incremento en la velocidad de conducción (VCN), potencial de acción motora complejo (PAMC) y en el potencial de acción nerviosa sensorial (PANS); corroborando de esta forma la eficacia del TCMH en pacientes con CIDP7,8,9,10,11,12,13,14 Resultados similares se obtuvieron en este estudio.
Además, la aplicación del trasplante de células mononucleares de sangre periférica (CMN-SP) ofrece una serie de ventajas sobre el de células mononucleares de médula ósea (CMN-MO), como son: la frecuencia menor de efectos adversos, la no necesidad de salón de operaciones ni de anestesia, y una mayor comodidad para el donante que es el propio paciente; este método de obtención y separación de células mononucleares es relativamente simple, poco costoso y por lo tanto, más accesible a los centros con pocos recursos. La metodología utilizada en el estudio abarcó estas ventajas, incluyendo su aplicación ambulatoria y menos invasiva.5,7,8,9,24,25,26,27,28
No se observaron informes de eventos adversos inmediatos y a largo plazo relacionados con la terapia, lo que demuestra la seguridad del trasplante de células hematopoyéticas. No hubo eventos adversos graves relacionados con las aspiraciones de médula ósea y la inyección de BMMNC durante nuestro período de seguimiento; pocos de nuestros pacientes fueron seguidos incluso más tiempo sin informes de efectos secundarios. De manera similar, muchos otros rastros del trasplante de BMNMC también lo han indicado como un enfoque terapéutico seguro, ya que no se produjeron complicaciones durante los seguimientos a largo plazo.29) En coincidencia con el estudio realizado.
Actualmente, todavía no se han publicado resultados de ensayos clínicos como el nuestro donde se aplica la vía o método de movilización de CMH a sangre periférica para tratar la CIDP refractaria.
Hubo varias limitaciones en nuestra investigación. Nuestro estudio solo incluyó pacientes con CIDP refractaria, ya que estos pacientes no respondieron a las terapias convencionales; limitando las opciones terapéuticas; así como la posibilidad de abandono del estudio durante el seguimiento al aplicarse el tratamiento en un solo momento del período de seguimiento y de forma ambulatoria.
Conclusiones
La efectividad de la administración del Leukocim para movilizar células madre hematopoyéticas de sangre periférica en la mejoría de los síntomas clínicos y resultados de estudios neurofisiológicos evolutivamente son mayores que otras variantes terapéuticas, con buena seguridad y tolerabilidad en los primeros meses de su aplicación y no tanto así para su estabilidad en evoluciones crónicas; por lo que puede ser incluido en la terapéutica convencional inicial para la CIDP.