Introducción
La colonización nasofaríngea (CNF) por neumococo se define como el momento inicial en el que la bacteria se aloja en la nasofaringe del individuo. Este evento puede ocurrir tempranamente en el primer semestre de vida y la ocurrencia subsecuente de enfermedad neumocócica estará mediada por los factores de riesgo asociados. La detección y serotipificación se realiza a partir de exudados nasofaríngeos.1
Se calcula que entre 25 % y 60 % de los niños en la edad preescolar, 35 % en la edad escolar y 29% de los adultos jóvenes se colonizan por neumococo y que a su vez está relacionada en el caso de los adultos, a la convivencia con lactantes y párvulos.2
En una revisión sistemática publicada en 2014,3 se reportó el efecto indirecto de la vacunación antineumocócica en la reducción de la colonización nasofaríngea en los convivientes de los niños vacunados, así como la disminución de la prevalencia de la CNF por serotipos vacunales en niños menores de 5 años no vacunados y adultos de la comunidad.
La transmisión intrafamiliar del neumococo se ha constatado no solo entre hermanos, sino entre niños y adultos. Se describe que las cepas que colonizan a los ancianos son similares a la de los niños que conviven con ellos. Además, es importante resaltar que en cada episodio de infección respiratoria viral se incrementa significativamente el riesgo de colonización nasofaríngea y, por tanto, de enfermedad neumocócica invasiva.4
En la revisión de ensayos controlados randomizados, estudios observacionales y de vigilancia desde 1994 hasta 2013 en 14 países,5 se encontraron reducciones de las tasas de CNF y ENI por serotipos vacunales. Se sugirió que el impacto de las PCV sobre la disminución en la CNF debe ser incluido como un predictor de efecto indirecto en el proceso de licenciamiento de las vacunas antineumocócicas.
El Sistema Nacional de Salud cubano a pesar de tener como máxima prioridad la vacunación contra enfermedades infecciosas y tener garantizada una elevada cobertura en la población infantil, no ha podido acceder a la vacuna antineumocócica para garantizar coberturas sostenibles en la población infantil por los altos precios de esta en el mercado.
En Cuba, son pocos los estudios poblacionales que documentan los factores de riesgo relacionados con la colonización nasofaríngea, en niños menores de 5 años vacunados con vacunas conjugadas antineumocócicas.
Esta investigación representa la oportunidad de demostrar los factores de riesgo que pueden estar asociados a la colonización nasofaríngea en niños vacunados, previo al registro e introducción de vacunas conjugadas antineumocócicas en el esquema nacional de vacunación cubano.
Teniendo en cuenta esta problemática de salud en nuestro país nos planteamos como objetivo estimar la prevalencia de los factores de riesgo asociados a colonización nasofaríngea por neumococo en niños vacunados con vacunas conjugadas antineumocócicas.
Material y Métodos
Un año después de la realización del estudio experimental tipo ensayo clínico de no inferioridad, fase II/III, aleatorizado, controlado y doble ciego para evaluar la seguridad y la respuesta inmune del candidato vacunal cubano heptavalente conjugado (PCV7-TT) comparado con la vacuna comercial Prevnar13®, en niños de 1 a 5 años en el municipio de Cienfuegos, se condujo un estudio de seguimiento anidado en el ensayo clínico, con un diseño casos y controles tipo caso-caso (case crossover) donde cada individuo actuó como su propio control.
El horizonte temporal del estudio fue entre noviembre de 2015 y abril de 2016 donde se realizó la toma de muestra de exudados nasofaríngeos.
El universo de estudio lo constituyó los 1 135 niños vacunados en el ensayo clínico fase II/III. Se siguió un muestreo probabilístico, tipo aleatorio simple y se calculó una muestra que representó 50% del total de vacunados, con una precisión de 5 %, nivel de significación de 95 % y un estimado de pérdidas alrededor de 20 %.
Se elaboraron dos listas de aleatorización; una, denominada lista de selección y otra lista de reemplazo. Ambas fueron generadas mediante el lenguaje S, implementación R, versión 3.1.2 o posteriores.6
Si un niño vacunado seleccionado aleatoriamente se trasladó de residencia o no cumplió con los criterios para la toma de muestra (salida del estudio), se procedió a su reemplazo con el criterio de seleccionar el primer niño no incluido en la lista aleatoria 1 (lista de selección) y contenido en la lista aleatoria 2 (lista de reemplazo). Los criterios para reemplazo fueron: a) niño vacunado no existente al momento de la visita (ejemplo: dirección incorrecta, mudanza), b) padres/tutores de niños vacunados con facilidades de horario para entrevista no factible (ejemplo: después de las 5:00 p.m.) y c) padre/tutor de niño vacunado ausente al momento de la visita de campo y después de dos nuevas visitas sin éxito. Se incluyeron finalmente 555 sujetos.
Se excluyeron del estudio los niños que recibieron tratamiento antibiótico siete días previos a la toma de muestra o que los padres no firmaron el consentimiento informado. Se aplicó una encuesta a los padres para determinar las características sociodemográficas y los factores asociados a los cambios en la colonización nasofaríngea en los niños vacunados.
A cada sujeto se le realizó una única toma de muestra de exudado nasofaríngeo. La recolección de la muestra de exudado nasofaríngeo fue realizada por licenciados en microbiología previamente capacitados. Se utilizaron hisopos estériles, flexibles de nylon flocado (COPAN, Italia). Los procedimientos de conservación, transporte de muestra, aislamiento, identificación y serotipificación fueron conducidos por el Laboratorio de Inmunología del Instituto Finlay de Vacunas (IFV), con las recomendaciones de la Organización Mundial de la Salud, año 2013.7
El control de calidad de la serotipificación se realizó en el Laboratorio Nacional de Referencia del Instituto de Medicina Tropical “Pedro Kourí”, de Cuba.
Los encuestadores se capacitaron por la autora de la investigación y al final de cada día, todos los cuestionarios y registros fueron revisados detalladamente con el fin de asegurar la calidad de la información e identificar errores en el registro de información.
Las principales variables del estudio fueron: edad, sexo, lugar de procedencia; colonización nasofaríngea por serotipos vacunales (1,5, 6B, 14, 18C, 19F, 23F) y relacionados (6A y 19A); factores de riesgo individuales (lactancia materna, enfermedades respiratorias asociadas a la infección por neumococo, hospitalización previa en el último año, uso de antibiótico, asistencia a círculos infantiles); y factores de riesgo del hogar (exposición al cigarro, número de personas en el hogar).
Se utilizó la razón de prevalencia como medida de asociación, con intervalos de confianza a 95 % para cada proporción y el nivel de significación para una p ≤ 0.05.
En el análisis bivariado, se describieron los factores de riesgo seleccionados en niños que eliminaron el estado de portador postvacunación (cambio de CNF + a CNF-). De igual forma se realizó con los que no adquieren la CNF (cambio de CNF-a CNF-). En este nivel analítico, se estimó la asociación de factores de riesgo para la eliminación y la no adquisición de la CNF por serotipos vacunales (SV) y por serotipos vacunales más relacionados (SV + SR) en individuos vacunados.
Se realizaron estimaciones de la fuerza de asociación entre la vacunación con PCV y la colonización nasofaríngea en dos subgrupos: cuando la CNF fue por serotipos vacunales (SV) y cuando fue por serotipos vacunales más serotipos relacionados (SV+SR). En todos los casos se obtuvo la OR-P, con sus intervalos de confianza a 95 %, ajustado por grupos de edad considerados en el estudio.
La investigación cumplió los principios éticos para la investigación médica en seres humanos, establecidos en la Declaración de Helsinki en la 64ª Asamblea General, Fortaleza, Brasil, octubre 2013.8 Se cumplió con el deber médico de velar por el bienestar de cada sujeto, respetar los derechos de los niños incluidos en la investigación y se cumplieron los principios éticos de autonomía, beneficencia, no maleficencia y justicia.
El protocolo del estudio fue aprobado por el Comité de Ética de la Investigación Científica (CEI) del Instituto de Medicina Tropical “Pedro Kourí” (IPK) y de la Facultad de Ciencias Médicas “Dr. Raúl Dorticós Torrado” de Cienfuegos.
En todos los casos, se obtuvo el consentimiento informado firmado por los padres o tutores de los niños incluidos en el estudio, para la realización de la encuestas y proceder médico.
El estudio es presentado en correspondencia con las normas internacionales estandarizadas (STROBE), para reportar estudios observacionales.9
El diseño analítico elegido para el estudio de seguimiento tiene como limitación la ausencia de un grupo de comparación concurrente, pues el sujeto de estudio actúa como su propio control en dos cortes transversales independientes. La evaluación de los factores de riesgo asociados a los cambio de la CNF, un año después de la vacunación, limita el conocimiento sobre la dinámica de exposición/eliminación/adquisición de la colonización nasofaríngea. No obstante, al considerar la selección aleatoria de la submuestra y la rigurosidad en la medición del estado de exposición e implementación de la vacunación a través del ensayo clínico controlado, sugiere que no exista una subestimación de la eficacia de la intervención entre los expuestos a la vacunación.
Resultados
Del total de niños elegibles (1 135 vacunados en el ensayo clínico con vacunas conjugadas antineumocócicas), se incluyeron 555 niños distribuidos en grupos de edades, 293 (52,8 %) correspondieron al grupo de edad de 12 a 23 meses y 262 (47,2 %) al grupo de 2 a 5 años, como se observa en la Figura.
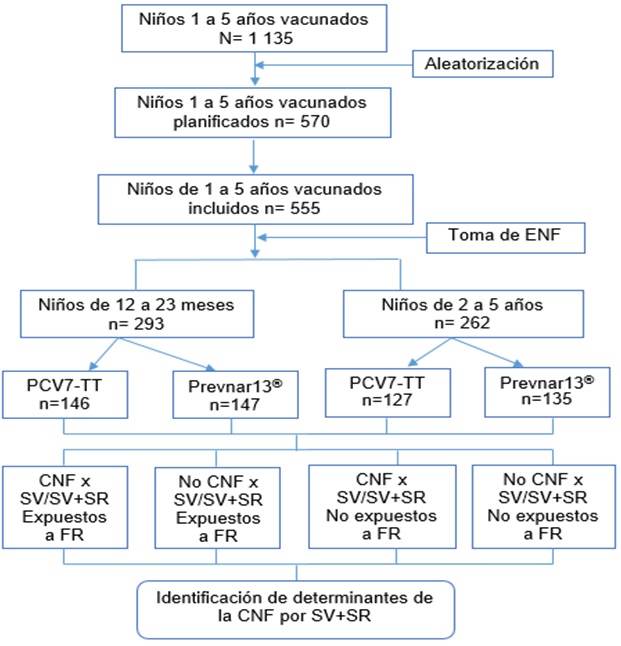
Fig Diagrama de flujo del estudio de los factores de riesgo asociados a la colonización nasofaríngea un año después de la administración de PCV.
Las características demográficas de los vacunados incluidos en el estudio se presentan en la Tabla 1. Existió predominio del sexo masculino (53,5 %). Las áreas de salud I y III aportaron 55,4 % de los niños estudiados.
En el análsis de los cambios en la CNF de los 555 niños estudiados (Tabla 2), se constató que en el grupo de 12 a 23 meses se eliminó la CNF en más de 70 % al año de ser vacunados con PCV. De manera similar, en el grupo de 2 a 5 años la eliminación de los serotipos vacunales y relacionados resultó superior a 80 %, tanto para los vacunados con PCV7-TT como para los vacunados con Prevnar 13®. Es importante destacar que para ambas vacunas y edades, los niños no adquirieron la colonización por neumococo en más de 97 %.
Tabla 2 - Cambios en la colonización nasofaríngea según vacunas y serotipos vacunales y relacionados

Leyenda: CNF: colonización nasofaríngea; SV: Serotipos vacunales; SR: Serotipos relacionados. N1: colonizados prevacunación; n1: eliminan la colonización postvacunación; N2: no colonizados prevacunación; n2: no colonizados postvacunación.
Al evaluar los factores de riesgo asociados a la eliminación y no adquisición de los serotipos vacunales y relacionados en los niños vacunados con las PCV (Tabla 3), se encontró que la edad de 2 a 5 años estuvo significativamente relacionada a la eliminación (p= 0,0383) y la no adquisición (p=0,0069) de estos serotipos.
Tabla 3 Factores de riesgo asociados con la eliminación y no adquisición de la colonización nasofaríngea por serotipos vacunales y relacionados en niños vacunados con PCVs
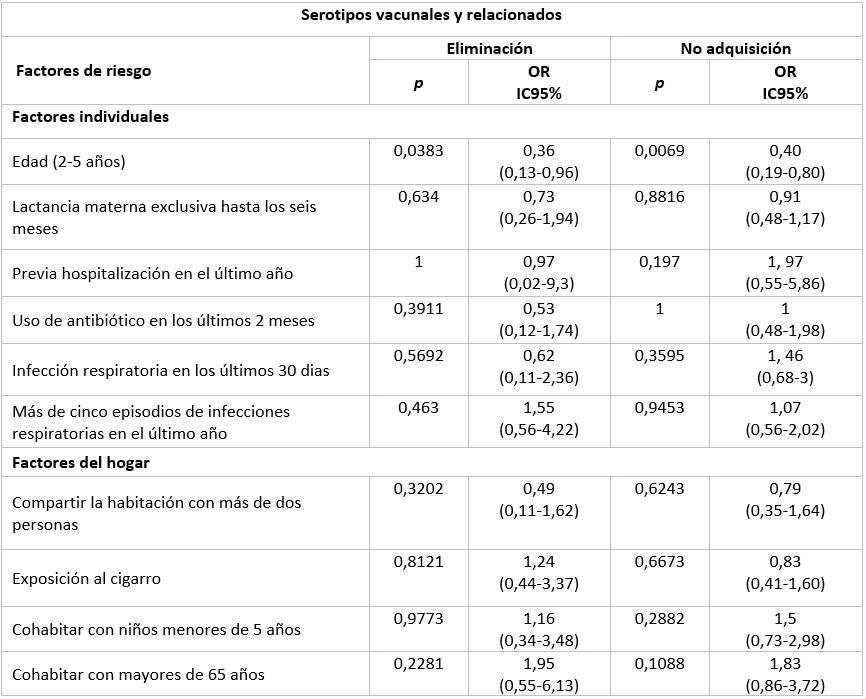
SV: Serotipos vacunales; SR: Serotipos relacionados
De manera general es importante destacar, que la edad entre 2 y 5 años actúa como factor protector para la colonización nasofaríngea con respecto al niño pequeño y a su vez convivir con personas mayores de 65 años constituye un factor de riesgo relacionado con la colonización nasofaríngea.
Discusión
Es importante resaltar que a pesar de la prevalencia de la enfermedad neumocócica invasiva, la colonización nasofaríngea por neumococo tiene mayor significación para el entorno que para el propio colonizado debido a la potencial contagiosidad.10
Numerosas investigaciones han demostrado una disminución de la prevalencia de enfermedad neumocócica invasiva y en la CNF por serotipos vacunales asociado al uso rutinario de vacunas conjugadas antineumocócicas,11,12,13 pero no existe hasta la fecha una evidencia clara del tiempo que demora la adquisición de un nuevo episodio de colonización, sobre todo por serotipos emergentes.14,15 Clásicamente se han asociado varios factores de riesgo que predisponen a padecer la enfermedad neumocócica, entre ellos, las edades extremas, área geográfica, malas condiciones socioeconómicas, hacinamiento, asistencia a guarderías o círculos infantiles, inmunodeficiencias congénitas o adquiridas, infecciones respiratorias previas o concomitantes (principalmente las de origen vírico), convivencia con mayores de 65 años y niños menores de 5 años de edad, estar enfermo con el virus de inmunodeficiencia humana, leucosis o linfomas. Se describen además, enfermedades respiratorias crónicas, trastornos cardíacos, renales, alcoholismo, y tabaquismo, sobre todo en los adultos.16
Las edades en que frecuentemente se produce la colonización nasofaríngea van desde un mes de vida hasta los 5 años y se corresponde precisamente con la mayor incidencia de la enfermedad neumocócica. Se estima que prácticamente todos los niños en algún momento de su etapa preescolar han sido colonizados por neumococo.2
Resulta conocida la presencia de factores que limitan la eliminación del neumococo de la nasofaringe, entre ellos se describen hacinamiento, asistencia a círculos infantiles, exposición al humo del cigarro y uso rutinario de antibióticos, entre otros.17 La convivencia con mayores de 65 años se encontró como factor de riesgo asociado a la colonización nasofaríngea por neumococo. Nos gustaría resaltar que varios autores coinciden que además, el sexo, el hacinamiento, los productos de uso doméstico para cocinar y convivir con menores de 5 años son factores asociados a la CNF por neumococo.14,18
Abdullahi y colaboradores19 observaron durante dos años en 2 840 niños, de 3 a 59 meses de edad, que 1 868 estaban colonizados por neumococo (65,77 %). Describieron además, la transmisión y prevalencia de los 28 serotipos más frecuentes encontrados. Se demostró que la adquisición estaba fuertemente relacionada con la prevalencia del neumococo en la población y con los mecanismos de eliminación dependientes de la madurez inmunológica.
La transmisión intrafamiliar del neumococo se ha constatado no solo entre hermanos, sino entre niños y adultos. Se describe que las cepas que colonizan a los ancianos son similares a la de los niños que conviven con ellos. Además, es importante resaltar que en cada episodio de infección respiratoria viral se incrementa significativamente el riesgo de colonización nasofaríngea y por tanto de enfermedad neumocócica invasiva.20
Los resultados del contexto cubano no difieren significativamente de reportes sobre este tema en otras regiones del mundo, donde se demuestra que la colonización nasofaríngea se asocia a varios factores de riesgo como edad, zona geográfica, hacinamiento, uso de antibióticos, convivencia con ancianos, entre otros.21,22,23 Los autores consideran que la conducción basada en buenas prácticas clínicas y el respeto de los principios y consideraciones éticas añaden confiabilidad y robustez a los resultados que se presentan.
Conclusiones
La colonización nasofaríngea por neumococo está mediada por factores de riesgo que pueden favorecer la eliminación y no adquisición de serotipos de neumococo vacunales y relacionados. La CNF es un proceso dinámico, cambiante, prevenible y puede modificarse con las vacunas antineumocócicas.
Agradecimientos
Los autores expresan sus agradecimientos al Instituto Finlay de Vacunas
para apoyar este estudio y a los equipos locales de investigación de las
áreas de salud del municipio de Cienfuegos y el Hospital Pediátrico
Provincial "Paquito González Cueto"; así como también al personal del
Laboratorio Nacional de Referencia de Neumococo-IPK de La Habana,
por su colaboración en este trabajo.
















