Introducción
El ciclo reproductivo en mamíferos primates se conoce como ciclo menstrual, mientras que en mamíferos no-primates se conoce como ciclo estral.1 Su evaluación es esencial en estudios de reproducción, así como de la influencia del ciclo reproductivo en funciones no reproductivas.2,3,4,5,6,7
El término ciclo estral proviene de la palabra estro, adaptación latina de la palabra griega oistrus que significa locura. Por tanto, el término estro se refiere al período de calor o receptividad sexual en la hembra, también conocido como “celo”.2
Cada ciclo estral en las ratas tiene una duración de 4 días-5 días y se divide por lo general en cuatro fases de diferente duración: proestro (12-14 horas), estro (25- 27 horas), metestro (6-8 horas) y diestro (55-72 horas).8 Sin embargo, en dependencia de los objetivos de la investigación, se pueden tener en cuenta los estados de transición entre las fases.9
Durante el ciclo reproductivo, ocurren cambios en los ovarios, el útero y la vagina, que reflejan el funcionamiento del eje hipotálamo-hipófisis-ovario.1 En la vagina, los cambios pueden evaluarse mediante la observación y análisis de una muestra del contenido vaginal, mediante un microscopio óptico. La muestra puede utilizarse como una preparación fijada y teñida2,9,10 o como una preparación húmeda, inmediatamente después de obtenida, procedimiento que se conoce como citología vaginal directa.2,9,11 Existen numerosos estudios que refieren la utilización de la citología vaginal directa en ratas de laboratorio, pero la información sobre los procedimientos e interpretación de los resultados aparece disgregada en la literatura. Lo anterior dificulta la incorporación del método por los investigadores que no tengan experiencia en su empleo.
El objetivo del trabajo es proponer un protocolo para la realización de la citología vaginal directa de ratas de laboratorio y la interpretación de los resultados.
Material y Métodos
Se combinó la información que aparece en la literatura y la experiencia de más de 10 años de estudios experimentales de reproducción con 250 ratas Wistar hembras, correspondientes a proyectos de investigación del Departamento de Bioquímica del Instituto de Ciencias Básicas y Preclínicas “Victoria de Girón” (ICBP). Los proyectos fueron aprobados por el Consejo Científico y el Comité de Ética de la Investigación del ICBP, y de ellos tres en convocatorias nacionales del Ministerio de Salud Pública (códigos: 1601073, 1901083, 1901084).
Las ratas se obtuvieron del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB) de Cuba y los procedimientos se realizaron siguiendo los preceptos éticos establecidos para el trabajo con estos animales.12
Animales y condiciones ambientales
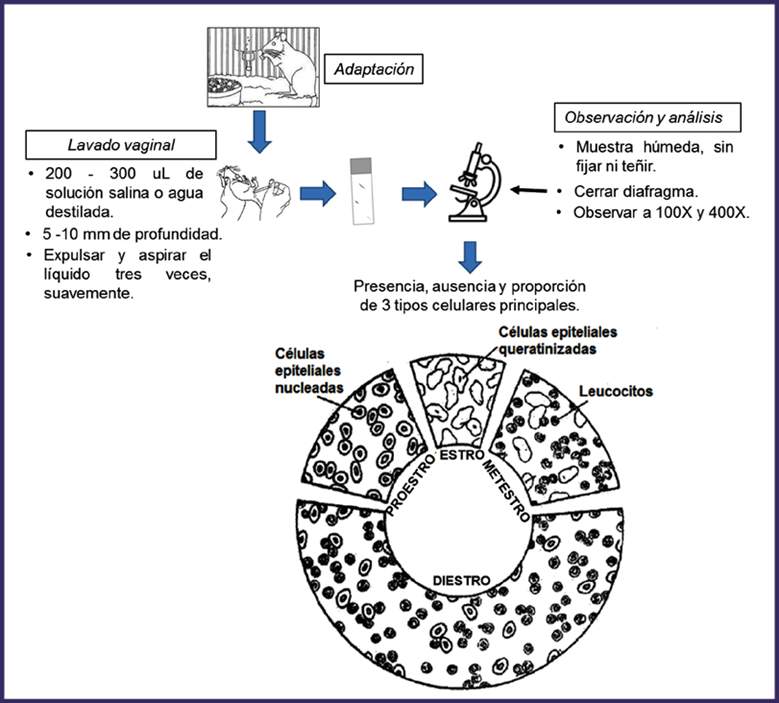
Se emplearon ratas Wistar hembras, fértiles y vírgenes, con peso inicial de 200 g ± 20 g, que se mantuvieron en cajas independientes, con ciclos constantes de luz y oscuridad, a una temperatura de 200 C - 240 C, y con libre acceso al agua y al alimento13 (pienso granulado habitual CENPALAB). Los procedimientos se iniciaron después que los animales permanecieron durante una semana en adaptación al medio. (Figura 1).
Procedimiento para la obtención de la muestra del contenido vaginal (lavado vaginal) (Figura 1)
Tomar 200 uL - 300 uL de solución salina o agua destilada, con una pipeta de volumen variable y punta estéril.
Sacar la rata de la jaula y sujetarla con una mano.
Con la otra mano introducir suavemente la punta de la pipeta en la vagina de la rata, de 5 mm-10 mm de profundidad.
Expulsar y aspirar el líquido tres veces, suavemente.
Extender la muestra sobre un portaobjetos.
Procedimiento para la observación y el análisis de la muestra de lavado vaginal (Figura 1)
Situar el portaobjetos en un microscopio óptico, con la muestra húmeda, sin fijar ni teñir (se empleó un microscopio Motic).
Cerrar el diafragma de campo del microscopio para incrementar el contraste.
Observar la muestra a 100X y 400X de aumento.
Analizar los tipos celulares y su proporción, para identificar la fase o el estado de transición del ciclo estral.
Se obtuvieron imágenes representativas, mediante una cámara digital (Motic) acoplada al microscopio.
Resultados
Mediante la observación y el análisis de las muestras del contenido vaginal de las ratas, se identificaron tres tipos celulares principales:
Células epiteliales nucleadas: redondas, ovales o poligonales, con núcleo redondo u oval y citoplasma de apariencia granular. (Figura 2 A, B).
Células epiteliales anucleadas queratinizadas, conocidas también como células escamosas o cornificadas: grandes, sin núcleo, poligonales, con bordes irregulares, algunas con un área redondeada en la zona donde hubo un núcleo, conocida como “núcleo fantasma”. (Figura 2 C, D).
Leucocitos: células muy pequeñas y redondeadas, del tipo polimorfonucleares neutrófilos. (Figura 2 E, F).
En varias muestras, se encontró un material mucoso, de viscosidad diversa, correspondiente con mucus vaginal. (Figura 2 G, H).
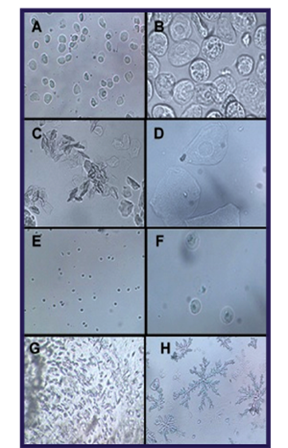
Fig. 2 Fotomicrografías ópticas representativas de los tipos de células y mucus que pueden observarse en la citología vaginal directa de ratasA, C, E y G: aumento 100x; B, D, F y H: aumento 400x. A, B: células epiteliales nucleadas. C, D: células epiteliales anucledas queratinizadas; E, F: leucocitos (polimorfonucleares neutrófilos); G: mucus húmedo; H: mucus seco.
Según la presencia, ausencia y proporción de los diferentes tipos celulares, así como de mucus vaginal, se identificaron las fases y estados de transición del ciclo estral:
Fase proestro: predominio de las células epiteliales nucleadas, de tamaño y apariencia relativamente uniformes, dispersas o formando grupos. Además, pueden observarse leucocitos aislados (proestro temprano) y mucus escaso y transparente, o células epiteliales anucladas queratinizadas aisladas (proestro tardío). (Figura 3 A).
Transición proestro-estro: similar proporción de células epiteliales nucleadas y células epiteliales anucleadas queratinizadas. (Figura 3 B).
Fase estro: predominio de las células epiteliales anucleadas queratinizadas, aisladas o en grupos, algunas dobladas sobre sí mismas o formando estructuras alargadas conocidas como “barras de queratina” (Figura 3 C). Además, pueden observarse células epiteliales nucleadas aisladas (estro temprano).
Fase metestro: presencia de células epiteliales anucleadas queratinizadas y leucocitos en diferentes proporciones (Figura 3 D). Además, pueden aparecer células epiteliales nucleadas grandes en igual proporción que las queratinizadas y los leucocitos. Constituye la transición estro-diestro.
Fase diestro: predominio de leucocitos (Figura 3 E). Además, pueden observarse, de forma aislada, células epiteliales anucleadas queratinizadas (diestro temprano) o células epiteliales nucleadas (diestro tardío), así como mucus escaso, con células adheridas de apariencia pequeña y alargada.
Transición diestro-proestro: similar proporción de leucocitos y células epiteliales nucleadas (Figura 3 F), así como mucus abundante.
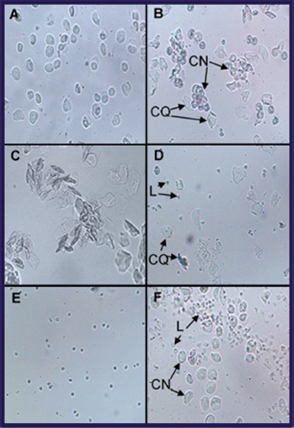
Fig. 3 Fotomicrografías ópticas representativas de las fases y los estados de transición del ciclo estral que pueden observarse en la citología vaginal directa de ratas A: proestro; B: transición proestro-estro; C: estro; D: metestro; E: diestro; F: transición diestro-proestro. CN: célula epitelial nucleada; CQ: célula epitelial anucleada queratinizada; L: leucocito. Aumento 100x.
Discusión
Al igual que en la mujer, los cambios que se producen en la mucosa vaginal de las ratas durante el ciclo reproductivo incluyen una repetida y sincrónica proliferación, apoptosis y diferenciación celular, así como el recambio de la matriz extracelular y la infiltración de leucocitos.2 Estos cambios se deben a modificaciones en las concentraciones de diferentes hormonas del eje hipotálamo-hipófisis ovario: la hormona liberadora de gonadotropinas (GnRH), producida por el hipotálamo; la hormona folículo-estimulante (FSH) y la hormona luteinizante (LH), gonadotropinas producidas por la hipófisis anterior en respuesta a la GnRH; el estradiol y la progesterona, hormonas producidas por los ovarios en respuesta a las gonadotropinas hipofisiarias.1
El estradiol es el principal estrógeno secretado por los ovarios y provoca los cambios citológicos que se producen en la mucosa vaginal durante el ciclo reproductivo.2) La progesterona es el principal progestágeno secretado por los ovarios; el folículo preovulatorio libera pequeñas cantidades, pero la liberación principal la realiza el cuerpo lúteo (estructura que se forma luego de la expulsión del óvulo del folículo). La progesterona está implicada de forma casi exclusiva en la preparación final del útero para la implantación del embrión y de las mamas para la lactancia.1,14,15
En el proestro, que corresponde con la fase folicular del ciclo reproductivo en la mujer,1 la FSH y la LH estimulan el crecimiento folicular y el aumento progresivo de la secreción de estrógenos. El estradiol estimula la estratificación del epitelio vaginal y el inicio de la queratinización.16 Los estrógenos alcanzan su pico máximo a mediados de esta fase y casi al final el folículo también secreta progesterona, pero en menor medida que estrógenos.1,14 (Figura 4).
Cuando los niveles de estrógenos comienzan a incrementarse en el proestro se produce un efecto de retroacción negativa sobre la adenohipófisis que disminuye la secreción de FSH y LH. Sin embargo, al final de esta fase se produce un pico de LH y en menor medida de FSH (Figura 4), de causa poco conocida; se cree que puedan ser debidos a un efecto estimulador por retroacción positiva sobre la adenohipófisis, secundaria al pico máximo de estrógenos o al comienzo de la secreción de progesterona por los folículos.14,15
De 10-12 horas después de producirse los picos de FSH y LH en el proestro, se produce la ovulación en el estro, inducida principalmente por el pico de LH.9 La LH estimula también el desarrollo del cuerpo lúteo,1,14,15 por lo que esta estructura se forma aunque no se produzca la ruptura del folículo y la expulsión del óvulo. Por lo anterior, se debe tener presente que un ciclo estral regular no asegura que haya ocurrido ovulación.
Durante el estro disminuyen los niveles de FSH, LH y estrógenos.1) (Figura 4). Con la disminución del estradiol, en la vagina predominan las células anucleadas queratinizadas.16
El metestro corresponde al inicio de la fase lútea del ciclo reproductivo en humanos.1 En esta fase se observan células anucladas queratinizadas y leucocitos en el lavado vaginal. El cuerpo lúteo secreta progesterona y en menor medida estrógenos; la progesterona se incrementa progresivamente y se produce un nuevo pico de estrógenos, pero menor que el que ocurre en el proestro. El cuerpo lúteo también secreta la hormona inhibina que, junto a los estrógenos y la progesterona, ejerce una retroacción negativa sobre la adenohipófisis y el hipotálamo, por lo que los niveles de FSH y LH se mantienen bajos.1,14) (Figura 4).
El diestro corresponde a la última parte de la fase lútea del ciclo reproductivo en la mujer.1 En esta fase se produce el pico máximo de secreción de progesterona (Figura 4) y las células predominantes en el lavado vaginal son los leucocitos.16
Los bajos niveles de FSH y LH hacen que el cuerpo lúteo involucione. Como consecuencia, la interrupción brusca de la secreción de progesterona, estrógenos e inhibina elimina la inhibición de la adenohipófisis; nuevamente se incrementan los niveles de FSH y LH, con lo cual se inicia el crecimiento de nuevos folículos y un nuevo ciclo reproductivo.14
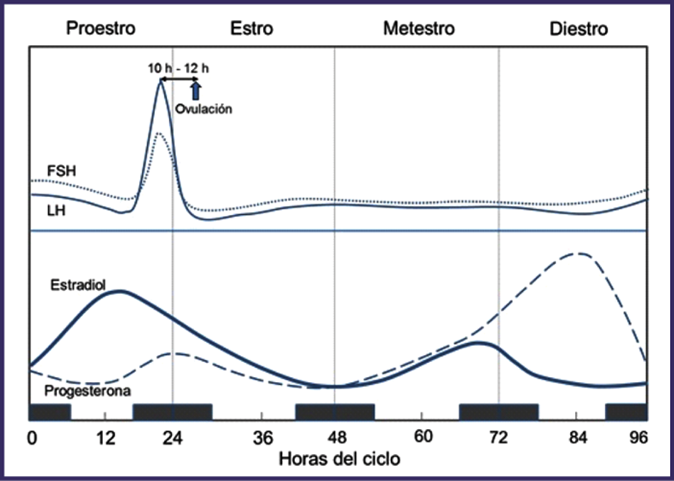
Fig. 4 Cambios en los niveles plasmáticos de las gonadotropinas hipofisiarias y las hormonas ováricas durante el ciclo estral de ratas. FSH: hormona folículoestimulante; LH: hormona luteinizante. Los bloques oscuros en la base de la figura representan la porción oscura de los ciclos luz/oscuridad.
Además del conocimiento de la relación entre los cambios hormonales y el ciclo estral, para la interpretación de la citología vaginal es necesario considerar que los procedimientos inadecuados pueden influir en el resultado. Entre los cuidados que se deben tener destacan:
Debe realizarse al final de la mañana o principio de la tarde, para disminuir la posibilidad de que el ciclo estral se encuentre en un estado de transición entre fases.9
Debe realizarse de forma suave y no más de una vez al día, ya que puede causar irritación vaginal con respuesta inflamatoria y niveles incrementados de leucocitos que interfieren en la evaluación citológica.17
No introducir la punta de la pipeta en la vagina a más de 10 mm de profundidad para evitar la estimulación cervical que puede inducir una pseudo-preñez, estado que se manifiesta por un diestro persistente y abundante mucus, durante un promedio de 14 días.9,11
No introducir la punta de la pipeta en la vagina a menos de 5 mm de profundidad, ya que el tercio distal del canal vaginal está cubierto por células epiteliales características del estro; si estas células son colectadas pueden interferir con la interpretación de la fase del ciclo, particularmente durante el proestro y el diestro.9
La muestra debe observarse inmediatamente después de obtenida, ya que si se emplea agua destilada, las células pueden deformarse o romperse con el paso del tiempo.9) Si se utiliza suero fisiológico y la muestra se seca, se forman cristales de las sales que dificultan la observación y el análisis.
Por otra parte, la duración del ciclo estral puede variar por factores que causan estrés en las ratas, como las características de los ciclos luz/oscuridad,18 la temperatura ambiente,19 el nivel de ruido y la nutrición,17) así las relaciones con otros animales.8,9,20 En este último caso, por ejemplo:
Cuando los machos están presentes en la misma habitación, los ciclos son más regulares.8
Los animales mantenidos en jaulas independientes presentan ciclos más regulares, con duración aproximada de un día menos (4 días) que los enjaulados junto a otros animales (5 días).9
En los animales enjaulados en grupos es común observar estados de diestro y estro extendidos. También es frecuente el anestro,20 que presenta características del estado de transición diestro-proestro (similar proporción de leucocitos y células epiteliales nucleadas), con abundante mucus y detritos celulares; en estos casos, el ciclo puede ser re-instaurado al colocar a las hembras en jaulas pre-tratadas con orina de machos.
Como puede apreciarse, la interpretación de los resultados de la citología vaginal de ratas depende de diversos factores, por lo que se requiere de un entrenamiento adecuado en la realización de los procedimientos, así como del conocimiento de la fisiología y los factores ambientales que influyen en los resultados.
Limitaciones
Aunque el ciclo estral es similar entre diferentes especies y los procedimientos generales para la citología vaginal pueden ser comunes, también existen diferencias que deben ser consideradas. Por tal motivo, el protocolo propuesto en el presente trabajo debe ser empleado solo en las investigaciones con ratas.
Conclusiones
El trabajo constituye un protocolo para el estudio del ciclo estral de ratas de laboratorio, mediante la citología vaginal directa. Provee métodos no invasivos, sencillos y económicos, así como conocimientos esenciales para la interpretación de los resultados, que integran una guía de gran utilidad para los estudios experimentales de reproducción.