INTRODUCCIÓN
El sistema inmunitario cumple un papel primordial en la protección del organismo frente a los agentes infecciosos.1 Los pacientes con inmunodeficiencias presentan limitada capacidad para emitir una respuesta inmunitaria adecuada. Esto les impide combatir a los microorganismos patógenos de manera eficiente, por lo que adquieren infecciones microbianas con mayor frecuencia y severidad,2 de modo que, el uso de sustancias que activen y potencien la respuesta inmunitaria del huésped resultaría una alternativa terapéutica de gran utilidad.
En Perú, el conocimiento de las propiedades curativas de las plantas ha sido utilizado desde épocas remotas, principalmente por las poblaciones indígenas.3 Se han identificado plantas con actividad antibacteriana, antiviral, antimicótica, antitumoral4,5) e incluso actividad inmunomoduladora; es decir, capaces de modificar la magnitud y calidad de la respuesta inmunitaria, ya sea potenciándola o suprimiéndola.6,7
Entre las plantas con alto potencial farmacológico se encuentra Schinus molle L. (molle). Este árbol de la familia Anacardiaceae, presenta rápido crecimiento llegando a medir hasta 15 m de altura. Es originario de la zona altoandina de Sudamérica, y se encuentra distribuido en gran parte del territorio peruano.8 Estudios sobre la composición fitoquímica de sus estructuras han evidenciado la presencia de compuestos bioactivos como terpenos, taninos, flavonoides, antocianinas, ácidos grasos y esteroles, ácido linoleico, felandreno, limoneno, entre otros.9,10
Al S. molle se le atribuyen propiedades antibacterianas, antivirales, antifúngicas y anticancerígenas,11,12,13 por lo que es empleado tradicionalmente por la población para el tratamiento de infecciones gastrointestinales, genitourinarias, reumatismo, sífilis y gonorrea. Diversas investigaciones han demostrado su capacidad inhibitoria sobre Escherichia coli, Shigella flexneri, Bacillus cereus, Bacillus subtilis, Staphylococcus aureus, Staphylococcus aureus resistente a la oxacilina y Candida albicans.14,15
Sin embargo, pese a todas las propiedades que posee, es importante evaluar su toxicidad y asegurar su uso sin riesgo para la salud humana.16) Al respecto, se han publicado ensayos de toxicidad que utilizan una dosis única de la sustancia potencialmente tóxica para minimizar la cantidad de especímenes animales empleados en el experimento.17 El método de las clases de toxicidad aguda (CTA) determina los posibles efectos adversos de una sustancia administrada a dosis única, así también estima la relación cuantitativa entre la intensidad de la respuesta biológica medible y la concentración de la sustancia a administrar (se establece el rango de la concentración letal 50).17,18
Por lo expuesto anteriormente y considerando la escasa información que evidencie la actividad del molle sobre mecanismos de la respuesta inmunitaria innata, la presente investigación tiene como objetivo evaluar la actividad fagocítica y toxicidad in vivo del extracto acuoso de Schinus molle L. en Mus musculus BALB/c, de modo que se recopile evidencia científica de sus propiedades reportadas, garantice su uso terapéutico y contribuya a la revalorización de las especies vegetales medicinales presentes en Perú.
MATERIAL Y METODOS
El presente estudio fue de diseño experimental. La población estuvo conformada por 22 especímenes de Mus musculus BALB/c con 20g ± 24g de peso promedio. La investigación fue ejecutada en el laboratorio de Microbiología de la Universidad Nacional “Pedro Ruiz Gallo”, en la provincia y departamento de Lambayeque-Perú, durante los meses de enero a mayo de 2022.
Los roedores fueron adquiridos del bioterio del Instituto Nacional de Salud (Lima, Perú). Los ejemplares fueron de ambos sexos con edades de entre 30 a 45 días y sin enfermedad previa. Fueron mantenidos en jaulas individuales, a una temperatura ambiental de 22 ± 3°C, con ciclo luz/oscuridad de 12 horas. Se les proporcionó acceso ad-libitum al agua y alimentos, y se registraron los signos vitales diariamente.
Las hojas de S. molle fueron colectadas en los alrededores de la Universidad Nacional “Pedro Ruiz Gallo” (6°42′26″S 79°54′29″O) a 18 m.s.n.m. Una parte del material vegetal fue llevado al Herbario “Pedro Ruiz Gallo” para su identificación, caracterización y certificación.
El extracto acuoso de S. molle fue preparado a partir de hojas en etapa de floración y con las mejores condiciones fitosanitarias. El material vegetal fue lavado con abundante agua destilada estéril y posterior a ello se desinfectó con alcohol de 96o. Se emplearon 10 g de hojas frescas, que fueron colocadas en un vaso de precipitación que contenía 100 ml de agua destilada estéril (1:10m/v). El sistema se llevó a calefacción en plancha a 80oC durante 15 min, seguido de un período de enfriamiento de 10 min a temperatura ambiente (25oC). El preparado fue triturado en agua y filtrado tres veces utilizando papel filtro Whatman N° 1; se obtuvo el extracto a la concentración de 100 mg/ml. El extracto se preservó en refrigeración a 4oC en un recipiente de vidrio ámbar estéril, tapado herméticamente, hasta el momento de la experimentación.
La cepa de Staphylococcus aureus fue proporcionada por el laboratorio de Microbiología de la Universidad Nacional “Pedro Ruiz Gallo”. Fue reactivada en 5 mL de caldo tripticasa de soya durante 24 horas a 37°C en aerobiosis. Posteriormente, el cultivo bacteriano fue centrifugado a 2 500 rpm durante 10 min seguido de dos lavados inmediatos con solución salina fisiológica estéril (SSFE), estandarizándose el inóculo a una concentración de 4 x 106 células/ml.19
El aislamiento y estandarización de los macrófagos peritoneales se realizó a partir de 10 especímenes de ratones de ambos sexos y aparentemente sanos. Los roedores fueron distribuidos de manera aleatoria y equitativamente entre los grupos experimental y control, considerando un período de aclimatación de 5 días y siguiendo las recomendaciones de Saravia, et al.20
A los ejemplares del grupo experimental se les administró vía intraperitoneal 0,5 mL del inóculo de S. aureus y 0,5 mL del extracto acuoso de S. molle por triplicado. Mientras que a los especímenes del grupo control se les suministró 0,5 mL del inóculo de S. aureus y 0,5 mL de SSFE. Posteriormente a 6 horas de la inoculación los especímenes de ambos grupos fueron sacrificados y con ayuda de una torunda estéril se obtuvieron muestras de líquido peritoneal para su análisis a partir de frotis en lámina portaobjeto y tinción con Giemsa.19 El porcentaje de fagocitosis se determinó mediante recuento del número de macrófagos fagocíticos en 100 campos microscópicos y el total de bacterias fagocitadas. Las lecturas se realizaron en microscopio binocular Boeco BM-120 a 1000 aumentos.
Por otra parte, se evaluó la toxicidad del extracto acuoso de S. molle mediante el método de las clases de toxicidad aguda, recomendado por la Organización para la Cooperación y el Desarrollo Económicos (OCDE).18,21 Para ello, se distribuyeron de manera aleatoria y equitativamente 12 ratones de ambos sexos en los grupos control y experimental. Al grupo experimental se le administró el extracto a un volumen de 0,1ml/10g, con una dosis máxima de 2 000 mg/kg por vía oral mediante cánula gástrica, iniciando con los especímenes machos en ayuno de 4 horas. Al grupo control solo se le suministró SSFE. Los roedores fueron sometidos a observación clínica diaria durante 14 días.
Para la evaluación de toxicidad se valoró el peso, tiempo de muerte de los animales y las manifestaciones de signos y síntomas de toxicidad aguda en ojos, piel, mucosas, patrones de comportamiento, actividad sensorial, actividad neuromuscular, problemas respiratorios, cardiovasculares y gastrointestinales. Los especímenes fueron observados hasta que desaparecieron las manifestaciones clínicas de toxicidad, controlándoles el peso en los días 0, 7 y 14 del experimento. Luego, fueron sacrificados por dislocación cervical para la evaluación anatomopatológica de sus órganos.18,21
Los datos obtenidos se recopilaron en una ficha de recolección para su posterior análisis estadístico, el cual fue realizado en los programas Microsoft office excel® 2016 y Minitab® 18 para Windows® versión 8. Se determinó la media y desviación estándar de los valores obtenidos y se aplicó la prueba de normalidad de Kolmogórov-Smirnov, seguido de una prueba T student, para establecer las diferencias significativas (p<0,05) entre la fagocitosis in vivo del grupo experimental y grupo control.
El estudio siguió los lineamientos del International Guiding Principles for Biomedical Research Involving Animal22 y Ethical guidelines for investigations of experimental pain in conscious animals.23 Además, se respetaron los principios éticos de reemplazo, reducción y refinamiento, así como las normas éticas para la experimentación animal de la Guía de Manejo y Cuidado de los Animales, propuestas por el Ministerio de Salud de Perú.24) La investigación se ejecutó posterior a la aprobación del Comité de Ética de la Universidad Nacional de Jaén (Oficio NO 03-2022 / VPI-UNJ/ CE).
RESULTADOS
Se evaluó la actividad del extracto acuoso de Schinus molle sobre el índice fagocítico de macrófagos peritoneales de Mus musculus BALB/c infectados con Staphylococcus aureus. En el grupo experimental, el índice fagocítico fue 57,1 %. Mientras que en el grupo control fue 28,3 %, siendo esta diferencia significativa (Tabla 1).
Tabla 1. Actividad del extracto acuoso de Schinus molle L. sobre el índice fagocítico de macrófagos peritoneales de Mus musculus BALB/c
| Porcentaje de macrófagos | |||
|---|---|---|---|
| Control | 28,3 ± 1,16 | 71,7 ± 1,16 | <0,0001 |
| Experimental | 57,1 ± 1,09 | 42,9 ± 1,09 | |
* Prueba de t student
En el grupo experimental, el promedio de bacterias fagocitadas por los macrófagos peritoneales de Mus musculus BALB/c fue de 21 ± 0,5521 bacterias; superó el control evaluado (p<0,0001) (Tabla 2).
Tabla 2. Actividad in vivo del extracto acuoso de Schinus molle L. sobre las bacterias fagocitadas por macrófagos peritoneales de Mus musculus BALB/c.
| Grupo | p-valor* | ||
|---|---|---|---|
| Control | 10 ± 0,79 | 0 | <0,0001 |
| Experimental | 21 ± 0,55 | 0 | |
* Prueba de t student
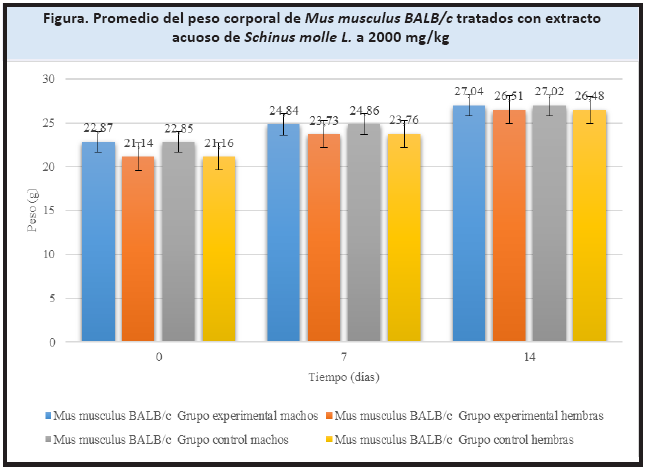
El extracto acuoso de hojas de S. molle a la dosis de 2000 mg/kg no influyó en la ganancia de peso de los ratones tratados, observándose un incremento sostenido de este durante el período de evaluación (Figura).
Los especímenes de Mus musculus BALB/c presentaron signos de piloerección después de 30 min de aplicado el tratamiento. Además, se observó un cambio en el comportamiento de los animales (se percibían inquietos). Los órganos blancos se mantuvieron sin alteraciones o daños visibles, y todos los ratones se mantuvieron vivos hasta finalizado el experimento (Tabla 3).
Tabla 3 Signos y síntomas de toxicidad aguda en Mus musculus BALB/c inoculados con 2000 mg/kg del extracto acuoso de Schinus molle L
| Órganos/Sistema | ||
|---|---|---|
| Autónomo/Cutánea | Piloerección en la primera media hora | Piloerección en la primera media hora |
| Comportamiento | Inquietos en las primeras horas | Inquietos en las primeras horas |
| Sensorial | Ausentes | Ausentes |
| Neuromuscular | Ausentes | Ausentes |
| Cardiovascular | Ausentes | Ausentes |
| Respiratorio | Ausentes | Ausentes |
| Ocular | Ausentes | Ausentes |
| Gastrointestinal | Ausentes | Ausentes |
DISCUSIÓN
Al evaluar la actividad in vivo del extracto acuoso de S. molle sobre la fagocitosis de macrófagos peritoneales, se observó un incremento significativo del índice fagocítico en el grupo experimental (57,1 %), respecto al grupo control (28,3 %) (p<0,0001) (Tabla 1). Además, de mayor cantidad de bacterias fagocitadas y fagosomas formados en los macrófagos de Mus musculus del grupo experimental (p<0,0001) (Tabla 2). Estos resultados coinciden con los obtenidos en estudios sobre el efecto de las plantas Medicago sativa (alfalfa)25 y Coriandrum sativum L. (culantro),26 que demostraron inducir un incremento significativo de la actividad fagocítica de leucocitos y macrófagos, respectivamente.
Asimismo, diversas investigaciones evidenciaron que principios activos como monoterpenos (felandreno, alfa y beta pineno, limoneno), terpenos y flavonoides poseen efecto estimulador de la respuesta inmunitaria.10,27 Dichas sustancias forman parte de la composición bioquímica de las hojas del molle y serían las encargadas de estimular la actividad metabólica de los macrófagos. De modo que, favorecen la síntesis de fagosomas en mayor número y tamaño. Dichos compuestos activan e inducen la liberación del interferón gamma, factor de necrosis tumoral, factor estimulante de colonias de monocitos y granulocitos, incrementando la actividad fagocítica de los macrófagos.28,29
Un hallazgo demostró que el aceite esencial de S. molle activa la cascada de óxido nítrico, interleucina-10 y factor de necrosis tumoral alfa,11 potenciando la fagocitosis. Cabe señalar que, los macrófagos realizan actividad fagocítica y los péptidos obtenidos de la digestión de los patógenos microbianos favorecen la activación de los linfocitos T y B. De modo que los macrófagos no solo tienen un papel importante en la inmunidad innata, sino también en la adaptativa al inducir una mejora de la respuesta inmunológica.30
A través del control frecuente del peso de los ratones, se estableció la cantidad del extracto necesaria para ocasionar signos y síntomas tóxicos en los animales, es decir, el peso indica la cantidad de tejido expuesto a la acción de una sustancia tóxica.21 Además, se demostró que el extracto acuoso no influyó en el incremento de peso de los especímenes evaluados, registrándose dentro de los valores normales (Figura).
La supervivencia de los animales expuestos al extracto acuoso de S. molle a 2000kg/mg, demostró que la dosis letal 50 fue superior a la dosis empleada. También se analizaron los cambios visualizados en los animales tratados, durante los 14 días del experimento, encontrándose signos de piloerección al transcurrir 30 min después de aplicado el tratamiento (Tabla 3). Sumado a ello, se observó cambio en el comportamiento de los ratones tratados; esto estaría relacionado con el proceso de adaptación del animal a la sustancia inoculada. La mayoría de parámetros evaluados no sufrió cambios significativos durante el experimento al ser comparada con el grupo control.
Otros estudios sobre S. molle concluyeron que no presentó toxicidad sobre Musca domestica, Chrysoperla externa, Trichogramma pintoi y Copidosoma koehleri, al no evidenciar signos de mortalidad en larvas y pupas expuestas al extracto de molle.31,32 Dichas investigaciones coinciden con los resultados obtenidos, donde el extracto acuoso del molle a la concentración empleada tampoco fue tóxico para los animales tratados.
En este sentido, la necropsia también resultó de gran utilidad para evaluar la toxicidad del extracto, lográndose visualizar los posibles cambios ocurridos en los órganos de los ratones del grupo experimental. Entre ellos, un ligero cambio de color (palidez) en los riñones de los ratones expuestos al tratamiento (Tabla 3). Al respecto, Murkunde,33 manifestó que la posición anatómica al momento de la muerte puede influir en el color que presentan los órganos al realizar una necropsia, lo que haría sospechar que no se trató de un efecto a causa del extracto acuoso de S. molle.
Cabe señalar que el estudio se limitó a evaluar la actividad del extracto en macrófagos peritoneales. No se incluyeron las evaluaciones de citocinas proinflamatorias como la IL-6 y TNF y otras células de la respuesta inmune (linfocitos), útiles para medir la intensidad de la respuesta biológica establecida. Sin embargo, los resultados obtenidos permitieron demostrar la actividad del molle sobre la primera línea de defensa del huésped.
CONCLUSIONES
El extracto acuoso de S. molle incrementó la actividad fagocítica in vivo de los macrófagos peritoneales de Mus musculus BALB/c. Sumado a ello, se observó un incremento en el tamaño de los macrófagos, número de pseudópodos y de fagosomas (vacuolas formadas alrededor de las bacterias fagocitadas por los macrófagos). No ocasionó la muerte de los animales de experimentación y no manifestó síntomas indicativos de toxicidad ni alteraciones en los órganos estudiados.