Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ingeniería Electrónica, Automática y Comunicaciones
versión On-line ISSN 1815-5928
EAC vol.34 no.3 La Habana sep.-dic. 2013
ARTICULO ORIGINAL
Análisis óptico y digital de la interfaseobjetivo-portamuestra utilizando imágenes obtenidas con microscopio confocal
Optic- digital analysis of objective-carry-sample interphase using images obtained with confocal microscope
MSc. Myriam Herrera Paloma1,MSc.Jesús Daza Figueredo2, Alfredo Moreno Yeras3
1. Departamento de Ciencias Universidad Libre de Colombia, Bogotá, Colombia.E-mail: myrihe@hotmail.com
2. Centro de Microscopía, Pontificia Universidad Javeriana, Bogotá, Colombia.E-mail: jdaza@javeriana.edu.co
3. Departamento de Física General, Instituto Superior Politécnico «José AntonioEcheverría», La Habana,Cuba.E-mail: amore@electrica.cujae.edu.cu
RESUMEN
Todas las especificaciones ópticas de los microscopios son significativasen el momento de obtener imágenes para ser analizadas y procesadas.La interfase, desde la lente del objetivo hasta el portamuestra, es un elemento queintegravarias especificaciones ópticasen el momento de obtener una imagen de calidad. Se obtienen imágenes de diferentes cortes (frames) utilizando portamuestras de vidrio y de membranas poliméricas. Por primera vez se realiza un estudio comparativo entre materiales elegidos para diferentes portamuestras. Se evalúay caracterizala iluminación a la salida de los portamuestras aplicando algoritmos del procesamiento digital de imágenes y utilizando algunos descriptores de la distribución de los niveles de grises y su contraste. De los resultados del estudio se establece como norma lacaracterización de losportamuestras, con el objetivo de disminuir el factor de error al procesar una imagen digital en el estudio de una muestra biológica.
Palabras claves:interfase, procesamiento óptico-digital, microscopio confocal.
ABSTRACT
The optic specifications of microscopes are significant at the moment to obtain images to will be analyze and process. The interphase, from the objective lens until the carry-sample, is anelement that integrates some optic specifications in the moment to obtain aquality image. Images of different frames using carry-samples of glass and of polymeric membranesare obtained. It is evaluated and characterized the illumination to exit of carry-sample applying image processing algorithms and using some describers of the gray levels distributionand their contrast. Of the results of study the characterization of carry-samples settles down as norm, with the aim of diminishing the error factor when processing a digital image in the analysis of a biological sample.
Key words: interphase, optic-digital processing, confocal microscope.
INTRODUCCION
La microscopía se ha convertido en una de las tecnologías indispensable en el campo de la biología, la medicina, la metalurgia, la imageneología, etc.; puesto que con los avances tecnológicosactuales la microscopía aumenta la capacidad de investigar todo lossistemas que se encuentre a escala micrométrica o nanométrica.
Por muy sencillo o sofisticado que sea un instrumento óptico, en la imagen que se obtiene de la muestra a estudiar influyen dos aspectos que determinan la calidad de la misma. Por un lado se encuentra la preparación de la muestra a estudiar. Esta preparación está determinada por los procedimientos y protocolos necesarios a realizar bajo determinados criterios que permitan resaltar u ocultar ciertas características de la muestra que se deseen visualizar y por el otroestán influyendo las características y propiedades del sistema óptico de obtención y registro de la imagen del instrumento óptico utilizado.1
Atendiendo a las características y propiedades de los sistemas ópticos, para obtener una imagen de calidadque permita visualizar el máximo de la información que se encuentra en la muestra, es prioritario conocer:
· el límite de resolución de sistema óptico utilizado.
· la resolución en la profundidad de foco para definir los límitesde los detalles de la muestra en diferentes planos.2
· lascaracterísticas ópticas de la interfasedesde el objetivo del microscopio hasta el plano donde se encuentra la muestra.
· las propiedades físicoquímicas del portamuestrausado.
Relacionado con el límite de resolución de sistema óptico utilizado se evalúa la distancia mínima entre dos puntos cercanos en el objeto que pueden observarse definidosde forma independiente en la imagen. Esta distancia está afectada por el fenómeno óptico de los discos de Airy. Debido a la naturaleza ondulatoria de la luz, al atravesar la apertura circular del objetivo del microscopio, se produce un patrón de difracción resultante, conuna región central brillante conocida como disco de Airy rodeada por varios anillos claros y oscuros concéntricos, denominados patrón deAiry y el cual determina una distribución de iluminación no uniforme.3
La figura 1 muestra la resolución espacial de dos puntos en un sistema óptico: en 1a) y 1b) hay definición de los dos puntos, en 1c) se observa una interferencia destructiva entre los dos puntos y en 1d) se observala condición de resolución límite determinada por el criterio de Rayleigh, donde el disco de Airy para el primer punto está como mínimo a la distancia del primer máximodel patrón de difracción del segundo punto, permitiendo así el límite de la resolución entre dos puntos.
La configuración donde se incluyenlosdiagramas de difracción de Airyestá leyendo la irradiancia registrada de un punto de la muestra como la suma coherente de las contribuciones de cada uno de los círculos expresada por:(ecuación 1)
Donde a es el radio de abertura del objetivo, è la posición angular del punto de observación en la imagen respecto al centro de la abertura, k = 2 π/λ el número de onda y J11 representa la función de Bessel de primera clase de orden 1. La distribución de intensidad asociada a la ecuación (1) recibe el nombre de figura de Airy.5.
La imagen que se obtiene en cualquier sistema óptico, es el resultado de la distribución de la intensidad de la luz en el plano imagen, donde contribuye la radiación reflejada directamente de la muestra, la radiación difractada por los bordes que rodea la muestra, la radiación dispersada por los detalles de la muestra, así como por la doble reflexión de los bordes del portamuestra y los fenómenos refractivos, dispersivos y difractivos que puede aportar el material del portamuestra.4
En tal sentido, las características ópticas de la interfase, desde el objetivo del microscopio hasta el plano donde se encuentra la muestra y las propiedades físicoquímicas del portamuestra usado, son aspectos muy importantes a tener en cuenta en la formación de la imagen.
En muchos casos esta interfase es propia de cada dispositivo óptico, es por ello que el objetivo de esta investigación es el análisis óptico digital de la interfase de un microscopio confocalFluo View 1000, así como realizar una comparación entre diferentes interfases utilizadas.
CONSIDERACIONES DE LA INTERFASE EN ESTUDIO.
La interfasedesde el objetivo del microscopio hasta el portamuestra está formada por varios materiales. En la figura 2 se identifican las diferentes partes que conforma esta interfase.
De acuerdo al principio físico que se utilice en el microscopio, el medio más cercano a la lente del objetivo puede ser: aceite, con índice de refracción n de 1,51503, o aire con n de 1,00029, cuando se utiliza microscopía óptica6. Estos materiales generalmente tienen parámetros de calidad altos, ya que se fabrican con el fin de favorecer a la formación de la imagen con el criterio de afectarla lo menos posible.
Otro medio importante vinculado a esta interfase y que puede afectar la calidad de la imagen es el portamuestra. Las propiedades ópticas, físicas y químicas de los mismos pueden ser muy variadas y están determinadas por las características y principios de obtención de la imagen en los diferentes microscopios. En la microscopía óptica es muy importante conocer las características y la afectación que el portamuestrapuede introducir en la imagen final que se quiere estudiar.
Un fenómeno que se puede manifestar en la microscopía óptica con tejidos biológicos es la fluorescencia. Cuando los tejidos biológicos tiene un comportamiento óptico espontáneo a la fluorescencia, es considerado como autofluorescencia o fluorescencia primaria; en otros tejidos esta condición óptica no es tan evidente, considerándose como una fluorescencia secundaria. En algunos casos, para lograr el fenómeno se hace uso de sustancias químicas llamadas fluorocromos. Los fluorocromos tienen la propiedad de absorber fotones de alta energía procedente de la luz de emisión de la fuente, provocando una redistribución de los electrones que originan la fluorescencia 7.
MATERIALES Y MÉTODOS
Para realizar el estudio de la interfase entre el objetivo y el portamuestra se centrará el trabajo en las afectaciones que pueden introducir el portamuestra en la imagen obtenida. Para este estudio se caracterizarán y analizarán las imágenes obtenidas con dos tipos diferentes de portamuestras utilizados en investigaciones de tejidos biológicos.
La caracterización se basará en la aplicación de algoritmos del procesamiento de imágenes y en el uso de descriptores de la iluminación en diferentes regiones de imágenes obtenidas en un microscopio. Estas distribuciones de iluminación serán obtenidas al escanear en diferentes planos la iluminación después de atravesar portamuestras de diferentes composiciones. Esta iluminación a la salida de los portamuestra está asociada a la absorción de la luz que producen los materiales de los portamuestras.
Para el estudio se utilizaron dos tipos de portamuestras. Uno es de vidrio utilizado muy comúnmente en microscopía y el otro es una rejilla sobre la que se ha colocado una membrana polimérica fabricadas con FormvarCollidion. Estas membranas fueron preparadas con Formvar al 1% con una concentración al 0,5% disuelta en cloroformo, filtrada con multiporo 0,22µm para luego llevar la solución a un agitador magnético a 790 Hz, consiguiendo la homogenización de la solución8.Se estudiarán portamuestras con membrana aún húmeda, con membrana secada con vapores de Xiol y con una membrana con mucho tiempo de secado.
Las imágenes se obtuvieron con un microscopio confocalFluo View 1000, FV 1000 Olympus. Este microscopio permite obtener cortes (frames), bidimensionales en diferentes direcciones para luego hacer con ellos reconstrucciones tridimensionales.
Para el procesamiento de las imágenes y de otros procesamientos estadísticos se utilizaron programas desarrollados para la investigación en lenguaje MATLAB 7.9 (R2009b) (MatWork Inc. USA) y el ImagenJ.
Para el estudio y caracterización de los portamuestras se aplica la siguiente metodología:
· Establecer las condiciones de trabajo en el microscopio confocalFluo View 1000, FV 1000 Olympus.
· Colocar portamuestra de vidrio.
· Realizar escaneo en los planos x-z para dos valores de magnificación (y). Registro de imágenes.
· Preparar membrana polimérica.
· Escanear en plano x-y portamuestra con membrana polimérica aún húmeda. Registro de imágenes.
· Escanear en plano x-y portamuestra con membrana polimérica secada con vapores de Xiol. Registro de imágenes.
· Escanear en plano x-y portamuestra con membrana polimérica con mucho tiempo de secado. Registro de imágenes.
· Mejorar la calidad de las imágenes realizando un preprocesamiento.
· Determinar y aplicar los algoritmos que permitan analizar digitalmente las imágenes para cada portamuestra.
· Comparar los resultados obtenidos para los diferentes portamuestras.
RESULTADOS Y DISCUSIÓN
Portamuestra de vidrio(I).
En la figura 3 se muestra la imagen del escaneo en el plano x-z del portamuestrade vidrio en primera magnificación.En 3a) se presenta la imagen original y en 3b) se muestra la imagen en niveles de grises (8 bits).
Al analizar la figura 3 se observa que por encima y por debajo de la línea amarilla la intensidad no es homogénea. La línea amarilla en la figura 3a) representa la respuesta en fluorescencia del material de vidrio. Además se observa la existencia de trazas de color amarillo perpendiculares a la línea del portamuestra, las cuales manifiestan efectos de difracción que originan pequeñas inhomogeneidadesen el vidrio. En la imagen 3b)se señala la incidencia y propagación de la luz láser a través del portamuestra.
La distribución de los niveles de gris en la superficie de 618 x 576 pixelesdel plano x-z, se muestran en la figura 4. Se puede observar la no homogeneidad de los niveles de grises, valores asociados a la iluminación que existe en cada región.
Para caracterizar las regiones por debajo y por encima del portamuestra se seleccionaron sobre la imagen de la figura 3b) dos zonas de áreas idénticas ubicadas justo encima y debajo del portamuestra (ver figura 4b)) y se realizó un análisis estadístico de los niveles de grises en esas zonas. Se calcularon algunos parámetros que se utilizan como descriptores de la iluminación y su homogeneidad en esas regiones.
La figura 5 muestra los histogramas de esas regiones y en la tabla 1 se resumen parámetros de la estadística de los niveles de grises en las mismas.
* NG: nivel de gris (0-255)
Como se puede observar en la figura 5 los histogramas son asimétricos y muy parecidos, aspectos que se evidencian en que los valores de las medianas y las modas de ambas zonas son idénticas. Una pequeña disminución en la media de la zona superior describe una disminución en la iluminación al atravesar el portamuestra y un ligero aumento de la desviación estándar en esa zona, describe la presencia de datos más dispersos lo que puede indicar la presencia de agentes dispersivos en el portamuestra.
Portamuestra de vidrio (II).
La figura 6 muestra la imagen del escaneo en el plano x-z del portamuestra de vidrio en segunda magnificación. En 6a) se presenta la imagen original y en 6b) se muestra la imagen en niveles de grises (8 bits).
Como se observa la figura 6 presenta una gran similitud a la figura 3, por lo que la descripción de la misma se corresponde con lo comentado anteriormente.
La distribución de los niveles de gris en la superficie de 655 x 773 pixeles del plano x, z, se muestran en la figura 7. Se puede observar la no homogeneidad de los niveles de grises y los valores asociados a la iluminación que existe en cada región.
Para caracterizar las regiones por debajo y por encima de este portamuestra se siguen las acciones que se le realizaron a las imágenes del portamuestra anterior, obteniéndose los resultados que se muestran en la figura 8 y se resumen en la tabla 2.
* NG: nivel de gris (0-255)
Al igual que en el caso del portamuestrade vidrio I, se puede observar en la figura 8 que los histogramas son asimétricos y muy parecidos, aspectos que se evidencian en que los valores de las medianas y las modas son idénticos e iguales a las del portamuestra anterior. Se mantiene una pequeña disminución en el valor de la media de la zona superior, lo cual describe una disminución en la iluminación al atravesar el portamuestra. Se observa un ligero aumento de la desviación estándar en esa zona, lo cual describe la presencia de datos más dispersos lo que puede indicar la presencia de agentes dispersivos en el portamuestra.
Porta-muestra con membranas poliméricas
Después del estudio de portamuestras de vidrios, se pasa a la fabricación de portamuestrascon membranas poliméricas siguiendo los protocolos defabricación de las mismas. Se obtuvieron membranas de diferentes concentraciones y se observó que las de menores concentraciones eran transparentes pero un poco más débiles. Las membranas se colocan sobre rejillas de enmallado de 300 a 400 mesh9(malla de 300 a 400 líneas /pulgada), para poderlas colocar en el microscopio.
En el proceso de fabricación de la membrana polimérica con FormvarCollidionhay un proceso de secado, lo cual puede influir en el comportamiento óptico de la membrana utilizada como portamuestra.
En la figura 9 se muestra esel escaneo en el plano x-y de la membrana polimérica aún húmeda después de su fabricación. La información sobre la superficie es el resultado del barrido, apareciendo el efecto de la interacción de la humedad con la solución que la compone10. En 9a) se observan irregularidades en la distribución de la iluminación asociada a la humedad existente en la imagen original y a la porosidad del portamuestra. Se realiza un preprocesamientode la imagen y en 9b) se muestran las irregularidades con una mayor nitidez.
Una valoración visual de la imagen mostrada en la figura 9b) producida después del preporcesamiento, muestra la no uniformidad en la distribución de los niveles de grises, lo cual es un indicador del la no uniformidad en la distribución del contraste de la misma. A estas imágenes se les pueden caracterizar con algunos descriptores. El histograma nos permite una visualización de la composición y distribución delos valores de niveles de grises. A la imagen de la figura 9b) se le realiza un mapa de la distribución espacial del contraste. (ver figura 10).
Para eliminar rugosidad y obtener un secado homogéneo de la membrana se utilizó vapores de Xilol. La figura 11 muestra el escaneo realizado en el plano x-y para la membrana polimérica secada con estos vapores. En 11a) se presenta la imagen original y en 11b) se muestra la misma imagen en niveles de gris a 8 bits con un preprocesamiento para mejorar el contraste de la imagen original.
De la observación directa de las imágenes anteriores ya se observa una mejor uniformidad en la iluminación que sale del portamuestra de la membrana polimérica colocada sobre la rejilla de 200 mesh (malla de 200 líneas /pulgada). A estas imágenes se les hace un procesamiento digital buscando descriptores de su uniformidad. Se obtiene el histograma y se le hace un mapa de contraste en todo el plano. Estos resultados se muestran en la figura 12.
Al hacer una comparación entre los descriptores de las imágenes asociadas al portamuestra de membrana polimérica húmeda con la seca se pueden observar algunos resultados de interés. En el histograma de la membrana húmeda se observa una mayor variedad de niveles de grises que en la membrana seca. Esto representa una iluminación resultante en todo el plano x-y menos uniforme, lo cual queda reafirmado con el mapa de contraste. Este mapa de contraste está construido a partir del cálculo del contraste en celdas de 5x5 pixeles y permite evaluar el cambio del contraste entre los pixeles vecinos. En las figuras 10b) y 12b) se pueden observar estos mapas y es evidente una mayor uniformidad de la iluminación en el portamuestraseco.
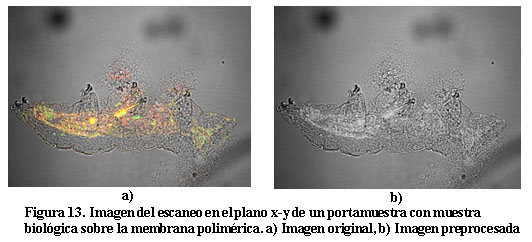
En estos tipos de portamuestras con membranas, también se utiliza para hacer una valoración de las características de las mismas, un portamuestra de membrana con mucho tiempo de secado sobre la que existe una muestra biológica. Este portamuestra se coloca en el microscopio y se realiza el escaneo en el plano x-y. La figura 13 muestra la imagen original y en niveles de grises (8 bits).
Como el objetivo es analizar el portamestra se centrará el análisis en la zona de la imagen anterior en la que no está la muestra biológica. Para separar estas zonas (presencia y no presencia de muestra biológica), se hace un preprocesamiento de la imagen quedando señalada en negro la zona de la muestra biológica, esto permitirá eliminar cualquier indicador asociado a la muestra biológica. Estos resultados se muestran en la figura 14.
De esta imagen se caracterizará la parte que no contiene a la muestra. De esta zona se obtiene un histograma come el que se muestra en la figura 15a) y se le realizar un mapa del contraste (figura 15b)).
Se puede observar que a la izquierda del histograma están los valores correspondientes a la muestra biológica, por lo que los demás datos son representativos del fondo gris correspondiente a la iluminación que deja pasar la membrana. De la figura 16b) solo es importante señalar como se observa un mapa de contraste muy uniforme fuera de la silueta de la muestra biológica, lo cual denota una muy buena uniformidad de la iluminación en esa zona.
CONCLUSIONES
Se realiza una valoración y caracterización de las afectaciones en la calidad de imágenes obtenidas con el microscopio confocalFluo View 1000, FV 1000 Olympus. Esta caracterización se basa en la aplicación de algoritmos del procesamiento digital el uso de descriptores de parámetros asociados a la distribución de niveles de grises en la imagen lo cual está vinculado a la iluminación registrada.
Al realizar una evaluación de la iluminación de salida al atravesar un portamuestra se obtienen afectaciones en la mismaproducto de inhomogeneidades presentes en el portamuestra. Estos elementos afectan la calidad de la imagen.
El uso de portamuestras con membranas poliméricas permite obtener una iluminación más uniforme en todo el plano de escaneo. Es muy importante utilizar portamuestras de membranas con un tiempo de secado óptimo, ya que se evidenció como la humedad afecta a la distribución de la iluminación en todo el campo de registro. Estos tipos de portamuestras minimizan factores que pueden introducir afectaciones en la calidad de la imagen al colocar muestras biológicas
Los resultados y comparaciones entre los diferentes portamuestras estudiados evidencian la necesidad de caracterizar la interfase desde el objetivo hasta el portamuestra antes de iniciar una investigación en la que imperfecciones en las estructuras de los materiales de la interfase introduzcan afectaciones apreciables en las imágenes de las muestras a estudiar.
REFERENCIAS
1. ERSOY Okan k. Diffraction, Fourier Opticsand Imaging,Published by John Wiley & Sons, Inc., Hoboken, New Jersey, 2007, p57-59ISBN-13: 978-0-471-23816-4
2. SINZINGERStefan, JAHNSJürgen Jahns,Microoptics 2a. ed. 2003 Wiley-vchGmbH & Co. KGaA,Weinheim ISBN 3-527-40355-8 p- 278-282
3. SERWAY Reymond A., JEWETT Jr. John W.,FisicaTomo 2, 7a. ed. 2008, Editorial Thomson Learning Academic R. Center, 2008. ISBN 13:978-0-495-11245-7. P 1077 - 1079
4. MURPHY Duglas B., Fundamentals of light microscopy and electronic imaging, John Wiley & Sons, Inc., publication 2001 p- 77 80, ISBN 0-471-25391-X
5. YOUNG Hugh D., FREEDMAN Roger A., Física universitaria con Física moderna, volumen 2, 12ª. ed., Pearson Education, México, 2009, p.1214 1217. ISBN: 978 607- 442 342 4
6. ALFONSO J. E., Teoría básica de microscopía de transmisión, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá, 1a ed. 2010. P. 15 33.
7. PLOEM, J. S. (1967). The use of a vertical illuminator with interchangeable dielectric mirrors forfluorescence microscopy with incident light. Z. wiss. Mikrosk. 68, 129142.
8. PEASE D.C, Histological lechniques for electron microscopy 2a Ed., Academic Press, New York, 1964.
9. MORAN D.T., and POWLEY C.J., Biological specimen preparation for correlative light and electron microscopy, Instrumentation and methods, Ed. M. A. Hayat, Academic Press, New York, 1987. pp.1-22.
10. BALLINAS, L., TERRAZAS. B, R., BARRA G. Mendoza D., «Structural and performance variation of activated carbon polymer» films. Polymers for Adv. 2006, Tech. 17:11-12, 991-999.
Recibido: Julio 2013
Aprobado: Septiembre 2013