Introducción
La industria farmacéutica, desde siempre, ha producido medicamentos de calidad y con total garantía de seguridad. La calidad del medicamento se consigue en todos y cada uno de los pasos de su proceso de producción, desde su investigación hasta el último análisis sobre el producto final, debido a que al elaborar un producto destinado a curar la enfermedad, salvar vidas o mejorar la calidad de vida, no puede haber el mínimo margen para el error [1; 2]. Los principios básicos del aseguramiento de la calidad tienen como objetivo la producción de productos que sean adecuados para su uso previsto (calidad, seguridad y eficacia) [3]. Sin embargo, a pesar de los esfuerzos de control y fabricación, se exige una mejora continua y máximas garantías de la calidad y este máximo grado de seguridad tan solo lo proporcionan los procesos de validación [1; 4; 5]. En la industria farmacéutica es indiscutible la exigencia y estrictas regulaciones que deben tener los procesos para garantizar la calidad a sus productos, donde deben cumplir con las características esperadas para satisfacer las necesidades del consumidor. Por esta razón, se hace necesario ejecutar un proceso de validación de manufactura1 [6; 7].
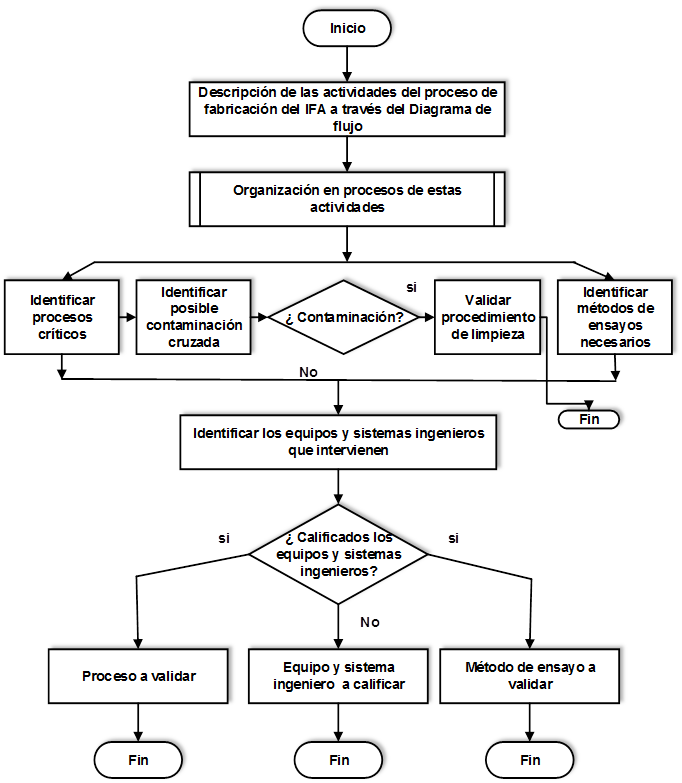
El Centro de Bioactivos Químicos (CBQ) es una organización dedicada a la investigación, producción y comercialización de sustancias químicas que presentan actividad biológica. Los resultados obtenidos por el centro están comprometidos con la línea de desarrollo de la industria farmacéutica y biotecnológica del país, por lo que es necesario fabricar productos con la máxima calidad. Para alcanzar este propósito se realizan los estudios de validación y de esta forma se contribuye al aseguramiento de la calidad de los medicamentos y se cumple con regulaciones establecidas por el Centro para el Control Estatal de la Calidad de los Medicamentos, Equipos y Dispositivos Médicos Fig. 4. Determinación de los objetos a validar en el proceso de fabricación del IFA.
Furvina (CECMED).
Lo anterior, causa que esta investigación constituya una necesidad para la organización, pues solo se había prestado especial atención a la validación de los métodos de ensayos para el control de la calidad de materias primas y producto final, en el proceso de fabricación del Ingrediente Farmacéutico Activo (IFA) Furvina (conocido también como G-1). Se realizaron estos estudios de manera fortuita, no siendo así para la validación de procesos, ni para la cualificación de equipos y sistemas ingenieros; donde no existe ningún antecedente de estos estudios en el centro, al menos de forma organizada, conllevando esta situación problemática al planteamiento del siguiente problema científico a resolver:
La carencia de una estructura clara o metodología que establezca: qué hacer, por qué hacer, cuándo hacer, dónde hacer, cómo hacer y quiénes tienen responsabilidades con los estudios de validación.
La base de los sistemas de calidad en las organizaciones radica en determinar el desglose, la secuencia y la interrelación de la totalidad de sus actividades, para poder actuar en cada una de ellas con el objetivo de mejorarlas [8; 9]. En Cuba la Regulación No. 16-2012 ¨Buenas Prácticas de Fabricación de Productos Farmacéuticos¨ (BPFPF), constituye un sistema de calidad relacionado con los procesos organizativos y de operación, bajo los cuales se fabrican los productos farmacéuticos, teniendo como objetivo principal disminuir los riesgos inherentes a toda la producción de medicamentos. Como uno de los elementos del Sistema de Gestión de la Calidad del CBQ se encuentra el relacionado con la validación, como parte esencial de las BPFPF [10; 11]
El objetivo de este trabajo es diseñar un sistema que permita realizar los estudios de validación en el proceso de fabricación del IFA Furvina, de manera organizada y documentada.
Los principales resultados del trabajo fueron: el sistema de validación para el proceso de fabricación del IFA Furvina, apoyado en la planeación realizada a través del análisis 5W y H, lo que permite determinar los principales elementos o invariantes del sistema; además de una metodología basada en el ciclo Deming, planificar-hacer-verificar-actuar (PHVA) [12; 13]
La realización de los estudios de validación de manera organizada y documentada en el CBQ permite cumplir con una parte esencial de las BPFPF, exigidas por el CECMED, órgano facultado para el otorgamiento de la Licencia Sanitaria de Operación Farmacéutica en Cuba.
II. Métodos
En función de lograr el diseño del sistema de validación, se realizó una organización de las etapas del proceso representando gráficamente los procesos de producción y control de la calidad a través de diagramas de flujo [12]; de modo que se conozcan bien antes del diseño del sistema. Se realizó un diagnóstico a través de una auditoría interna [14], cuyo objetivo es conocer el estado de los estudios de validación en el ámbito de trabajo de esta investigación.
Se planeó el sistema de validación a través del análisis 5W y H (what, why, when, where, who y how), pues dando respuestas a las preguntas que se formulan para este tipo de análisis, se puede determinar los principales elementos o invariantes que deben estar presente en el sistema [5; 15]. Como parte de esta planeación se confeccionó además un procedimiento para identificar los objetos a validar en el proceso de fabricación de la Furvina y se definió la documentación que se debe mantener en este sistema. Se propuso una metodología general para realizar los estudios validación en el CBQ, basada en el ciclo Deming y por último se confeccionó una matriz T con el fin de planear la capacitación necesaria como orientación para la implementación del sistema de validación.
III. Resultados
Se presentan los pasos de la metodología presentada:
1. Organización de las etapas del proceso en el ámbito de trabajo
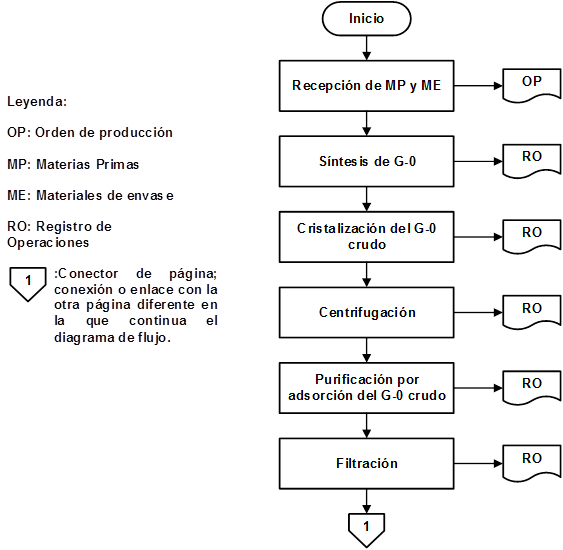
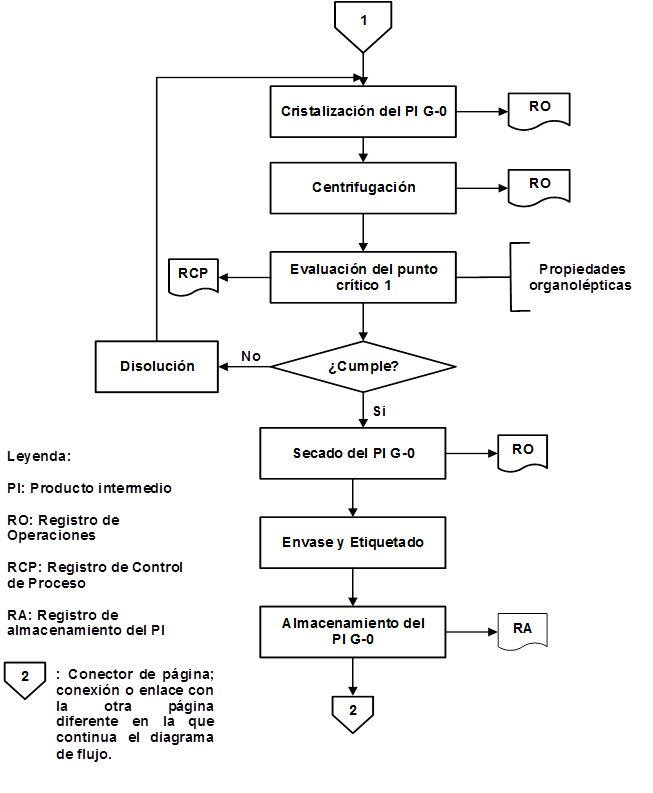
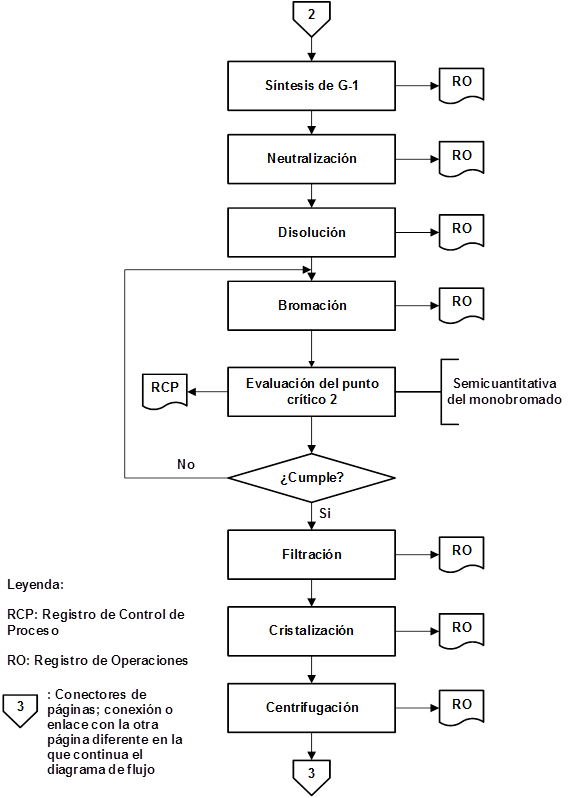
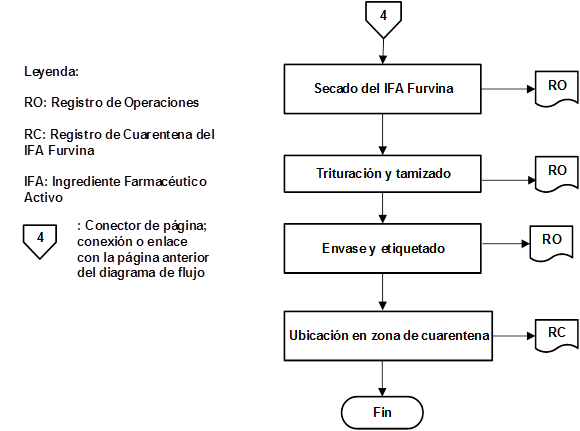
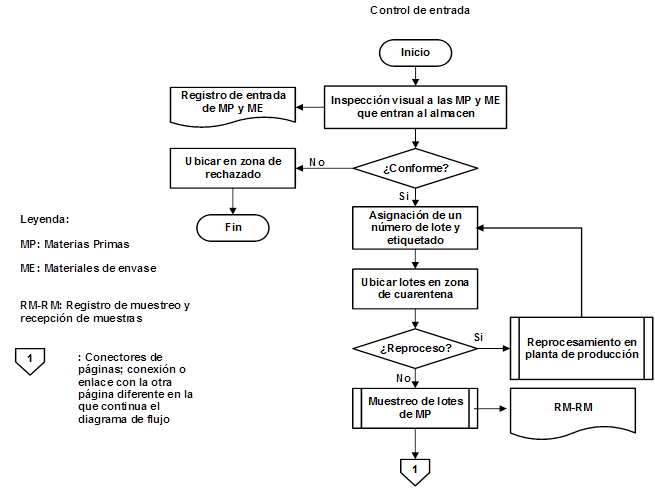
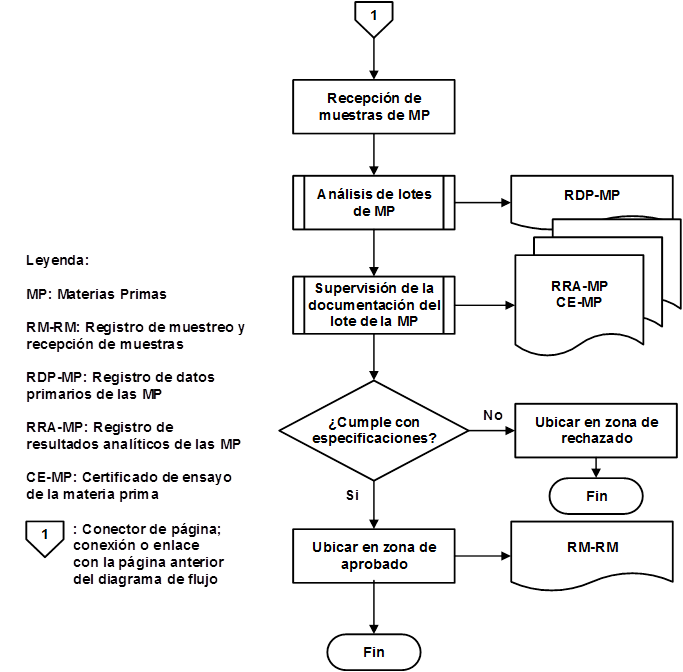
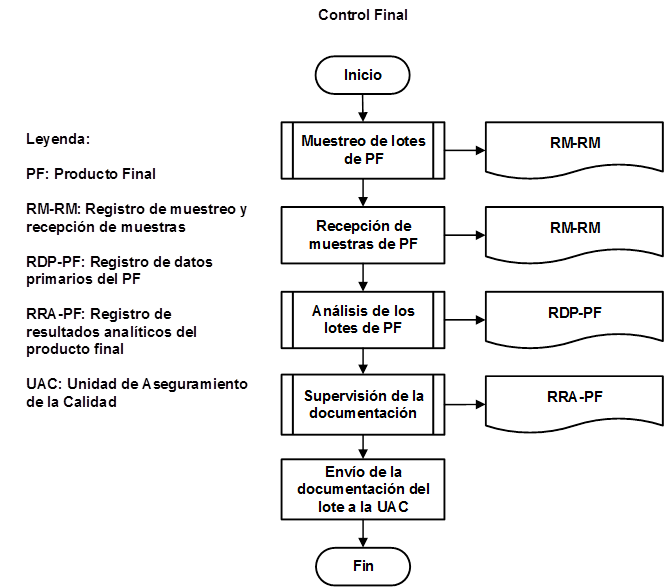
Como resultado de la organización de las etapas que intervienen en la producción de IFA Furvina se obtuvieron los correspondientes diagramas de flujo de los procesos de producción y control de la calidad, los cuales se pueden observar en las figuras 1, 2, 3, 4, 5, 6, 7 y 8, respectivamente.
2. Diagnóstico de la situación de los estudios de validación
Para diagnosticar el estado de los estudios de validación en el ámbito de trabajo de esta investigación se realiza una auditoría en los procesos de producción y control de la calidad, siguiendo los requisitos establecidos en la NC-ISO 19011[14].
En la figura 3 se refleja el diagrama de flujo del proceso de Control de la calidad.
Las no conformidades obtenidas, están centradas fundamentalmente en:
No existe un plan maestro de validación para la planificación de la validación tanto para procesos como para métodos de ensayos.
No existe un procedimiento para la confección de los protocolos de validación de procesos y el existente para la validación de métodos de ensayos, es recomendable mejorarlo con vista a lograr una uniformidad en el formato de este documento, para todos los objetos a validar.
No se han efectuado validaciones de procesos.
No todos los métodos de ensayos están validados, ni existen condiciones para hacerlo, solo se encuentran validados el 42 % de los métodos de ensayos para el control de la calidad y están por validar los del control de proceso.
No se han efectuado calificaciones de equipos y sistemas ingenieros que inciden directamente sobre los procesos y métodos de ensayos, ni existe un procedimiento para la confección de protocolos de validación de este tipo.
No está debidamente capacitado el personal involucrado en la validación para realizar estos estudios.
3. Planeación del Sistema de validación
Para la planeación del sistema de validación se emplea el análisis tipo 5W y H (what, why, when, where, who y how). Para desarrollar esta herramienta se tuvieron en cuenta criterios encontrados en la literatura consultada sobre el tema de validación. [16; 17]. En la Tabla 1 se muestra el resultado de la planeación de 5W y H.
Tabla 1 Planeación del sistema de validación de 5W y H
| Contenido | Procesos | Métodos de Ensayo | Equipos y Sistemas Ingenieros |
|---|---|---|---|
| ¿Qué se valida? |
Críticos y de limpieza (en caso de posible contaminación cruzada). | Necesarios para:
-Control de proceso. -Control de la Calidad. |
De importancia crucial tanto en proceso crítico cómo en métodos de ensayo. |
| ¿Por qué se valida? |
Demostrar que funcionan uniformemente en cada una de sus etapas en ccondiciones normales de operación. | Demostrar que son lo suficientemente fiables para obtener resultados con un alto grado de confianza y seguridad. | Asegurar que funcionan según el uso previsto en condiciones normales de operación. |
| ¿Cuándo se valida? |
-Nuevos procesos y modificaciones. -Cambios en los equipos y sistemas que intervienen. -Cambios en los locales donde se llevan a cabo. |
-Cambios en el método
-Uso de nuevas sustancias químicas. -Uso de nuevos instrumentos. -Que se realicen en nuevas instalaciones. -Que sea desarrollado internamente en el laboratorio. |
-Cambio de ubicación -Cambio en cualquiera de sus componentes. -Causas de problemas en el proceso. -Reparación. -Sospecha de un proceso de medición con resultados incorrectos. -Pérdida de las características metrológicas. |
| ¿Dónde se valida? |
En el lugar donde normalmente se llevarán a cabo los mismos. | En el lugar donde normalmente se llevarán a cabo los mismos. | En el lugar donde normalmente operan los mismos durante su uso. |
| ¿Quién valida? |
Las personas que normalmente los llevan a cabo. | Las personas que normalmente los llevan a cabo. | Las personas que normalmente los operan. |
| ¿Cómo se valida? |
Evaluando el cumplimiento de las especificaciones en cada una de las etapas, al menos tres veces consecutivas. | Evaluando la capacidad del método analítico de conservar a lo largo del tiempo su fiabilidad, a través de diferentes parámetros de validación | Asegurando que:
-cumplan las especificaciones de compra e información escrita proporcionada por el fabricante (CI); -operen de acuerdo a las especificaciones (CO) y -operen según lo previsto (CF) |
3.1 Determinación de los objetos a validar
Con el objetivo de definir hacia donde encaminar los estudios de validación, en el proceso de fabricación del IFA Furvina se diseñó un procedimiento que permite determinar cuáles son los objetos a validar en este proceso, el cual se muestra en la figura 9.
Aplicar el procedimiento descrito anteriormente facilita la determinación de lo que es necesario validar al confeccionar el Plan Maestro de Validación (PMV), documentación imprescindible para desarrollar los estudios de validación.
3.2 Documentación del Sistema de Validación
La validación, no es un descubrimiento innovador, lo novedoso está en la exigencia de precisar y demostrar lo que se hace al respecto, constituyendo la organización y la necesidad de documentar resultados los cimientos de los estudios de validación. Si no se documentan estos estudios es como si no se hubiese hecho nada; de ahí que para lograr resultados exitosos en los estudios de validación, resulta imprescindible evidenciar que se han desarrollado correctamente; por lo que se definen una serie de documentos para llevar a cabo los estudios de validación en la organización. A continuación, se muestra la relación de estos documentos y el contenido de los mismos:
Política de validación: Lineamientos a seguir para desarrollar el estudio de validación.
Plan maestro de validación: Planificación formalizada para realizar los estudios de validación [18; 19].
Protocolo de validación: Descripción detallada de dicho estudio.
Informe de validación: Documento que recoge la información de las actividades de este proceso.
Control de cambio: Procedimiento formal que describe las acciones que se deben realizar si se propone cualquier cambio o modificación después de haberse efectuado la validación inicial.
Declaración de conformidad de la validación: Documento formal de aprobación de los estudios de validación, emitido por la Unidad de Aseguramiento de la Calidad (UAC).
4. Metodología general para realizar los estudios de validación en el proceso de fabricación de IFA Furvina
En la figura 10 se muestra una metodología general que facilita la implementación del Sistema de validación para el proceso de fabricación de IFA Furvina.
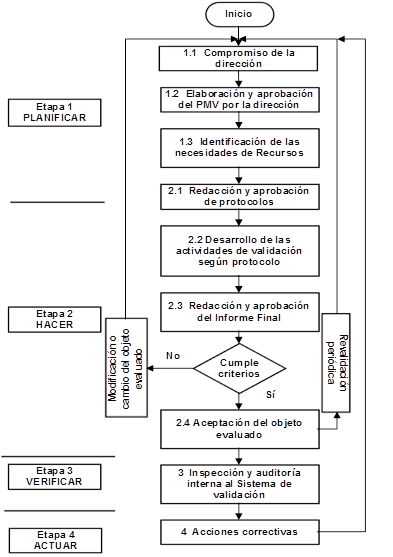
Fig. 10 Metodología general para realizar los estudios de validación en el proceso de fabricación del IFA Furvina.
Planificar
En esta etapa la dirección de la organización, deberá nombrar una persona responsable de los estudios de validación, la que debe organizar un grupo de validación integrado por representantes de las principales áreas involucradas. Deberá proporcionar evidencia de su compromiso con el desarrollo e implementación del sistema de validación, así como con la mejora continua de su eficacia. Puede demostrar su compromiso entre otras formas:
participando en el desarrollo y diseminación de la política de validación y su intención; comunicando a la organización la importancia de satisfacer, en este caso, requisitos reglamentarios establecidos por las BPFPF, acerca de los estudios de validación, exigidos por el CEDMED, pues validando los procesos críticos, métodos analíticos, equipos y sistemas que intervienen en ellos, se contribuye a satisfacer estos requisitos.
demostrando un conocimiento básico de cómo opera el sistema de validación.
participando en la revisión del sistema para asegurar que sea correcto, efectivo y adecuado.
asegurando la disponibilidad de los recursos para llevar a cabo los estudios de validación.
En la etapa de planificación se elabora el PMV, teniendo en cuenta el procedimiento diseñado para la determinación de los objetos a validar. Se establece el calendario de las actividades de validación, el formato de la documentación, así como las acciones que deben realizarse si se propone cualquier cambio o modificación después de haberse efectuado la validación del objeto en cuestión. El PMV debe ser aprobado por la dirección de la organización. Se identifican las necesidades de recursos humanos, materiales y financieros para asegurar su disponibilidad para poder llevar a cabo los estudios de validación de los objetos propuestos en el PMV, así como para mantener el sistema diseñado. La organización debe determinar la competencia necesaria para el personal involucrado en los estudios de validación; así como proporcionar formación o tomar acciones para satisfacer dichas necesidades. En esta etapa queda establecido el: por qué se valida, qué se valida y cuándo hacerlo.
Hacer
Para emprender esta etapa es importante previamente dar educación y capacitación. Los superiores tienen la función de educar y desarrollar a sus subalternos, para luego poder delegar, dar autoridad y libertad para que realicen su trabajo [14]. Aquí se redactan y aprueban los protocolos para el estudio de los objetos a validar determinados en la etapa anterior. Se define el alcance de la validación, las responsabilidades y un cronograma detallado de las actividades a realizar, entre otros aspectos. Una vez desarrollado las actividades de validación según protocolo, se procede a la redacción y aprobación del informe final. En caso de ser aceptado el objeto evaluado, la UAC, emitirá una declaración de conformidad de la validación realizada. Es en esta etapa se establece: dónde se valida, quién valida y cómo hacerlo.
Verificar
Es necesario evaluar el sistema de validación diseñado, para determinar la adecuación y la eficacia del mismo. Esta evaluación puede comprender actividades tales como: auditorías internas al sistema de validación e inspecciones a estos estudios, por parte de la UAC en representación de la dirección. En esta etapa es importante la evaluación relativa a la percepción de las partes interesadas, acerca de si se han cumplido los requisitos establecidos por estos sobre la validación; produciéndose de esta forma un flujo de información entre la organización y los clientes con respecto a su satisfacción.
Actuar
Es en esta etapa donde se deben tomar las acciones necesarias y apropiadas para eliminar las causas de no conformidades referentes a la validación, con el objetivo de prevenir que vuelvan a ocurrir y de esta forma mejorar continuamente el desempeño del sistema diseñado.
5. Orientaciones para la implementación del Sistema de Validación
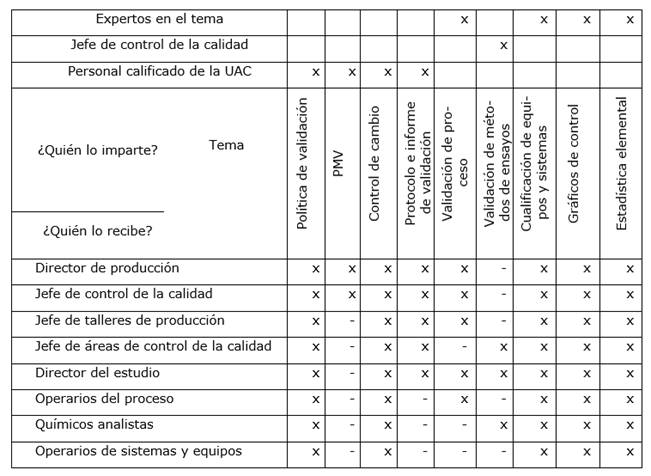
Es necesario capacitar a todo el personal que de una forma u otra está involucrado en los estudios de validación, de ahí que para la planeación de dicha capacitación se confecciona una matriz T, tabla tridimensional compuesta por dos matrices tipo L, que muestra la conexión entre conjuntos de datos. La relación se indica en cada intersección de filas y columnas. En este caso la conexión se establece entre los siguientes factores o datos:
En la figura 5 se muestra dicha matriz. Es muy importante programar la capacitación justo a tiempo; para no caer en el error de efectuar la validación, mucho tiempo después de haberse capacitado el personal involucrado en esta, lo que podría afectar la calidad del desarrollo y los resultados de la misma. La dirección de la organización deberá nombrar a una persona responsable de gestionar los estudios de validación quien formará un grupo integrado por representantes de las áreas de producción, control de la calidad y logística; a quienes se les delega la responsabilidad de orientar y supervisar las acciones propuestas en la metodología representada en la figura 11.
IV. Discusión
La validación de procesos, métodos de ensayo, equipos y sistemas ingenieros, proporcionan al fabricante la confianza de que los productos destinados a los clientes, cumplirán sistemáticamente con las especificaciones predeterminadas; demostrando consistencia en las diferentes etapas del proceso productivo.
El Sistema de validación diseñado constituye una manera de hacer los estudios de validación el proceso de fabricación del IFA Furvina. Establece un método de trabajo donde se instaura un conjunto de elementos interrelacionados, necesarios para llevar a cabo dichos estudios de manera organizada y documentada; siendo esto muy importante para alcanzar los objetivos de calidad del producto. Como aspecto novedoso se considera el diseño de la metodología para realizar los estudios de validación en el proceso de fabricación de IFA Furvina basada en el ciclo PHVA lo que garantiza un mejoramiento continuo del sistema de validación. Se contribuye a la eficacia y eficiencia de dichos estudios; siendo esto importante para alcanzar los objetivos de calidad del producto. El hecho de realizar los estudios de validación evita repeticiones por operaciones no validadas disminuyendo la cantidad de materias primas, materiales, productos, agua y energía usadas en cada uno de los procesos. Se minimiza la contaminación desde la fuente, lo que provoca menor contaminación ambiental y mejoras del desempeño ambiental de la organización.
Este sistema de validación, puede ser aplicado en otras organizaciones donde se fabriquen productos, garantizando su obtención con las características de calidad adecuadas.
V. Conclusiones
La planeación del sistema de validación para el proceso de fabricación del IFA Furvina, a través del análisis 5W y H, permite determinar los principales elementos o invariantes de este sistema.
La metodología general para realizar los estudios de validación facilita la implementación del sistema de validación para el proceso de fabricación de IFA Furvina, garantiza un mejoramiento continuo del mismo y contribuye a la eficiencia y eficacia de estos estudios.
El sistema de validación diseñado, permite que se realicen los estudios de validación para el proceso de fabricación del IFA Furvina, de manera organizada y documentada, en el CBQ.
La implementación del sistema de validación para el proceso de fabricación del IFA Furvina, constituye una acción para dar cumplimiento a requisitos establecidos en la regulatoria correspondiente, sobre el tema de validación.