My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Ingeniería Mecánica
On-line version ISSN 1815-5944
Ingeniería Mecánica vol.17 no.2 La Habana May.-Aug. 2014
ARTÍCULO DE REVISIÓN
Análisis del comportamiento del material de la arteria aorta ascendente para su modelación
Behavior analysis of the ascending aorta artery material for modeling
Diana Otero-Martínez, Luis-L. Otero-Pereiro, Vladimir González-Fernandez
Instituto Superior Politécnico José Antonio Echeverría. Facultad de Ingeniería Mecánica. La Habana. Cuba
RESUMEN
Existen un gran número de enfermedades cardiovasculares que afectan a la población a nivel mundial. Estas están determinadas por las modificaciones que ocurren en los parámetros hemodinámicos y en el comportamiento de las paredes arteriales. Por esta razón se hace necesario el estudio del comportamiento del material de la pared arterial de manera que puedan ser definidas las características que la conforman. La aorta como arteria elástica posee propiedades específicas que le permiten realizar su función. A medida que pasan los años algunas de estas propiedades se pierden debido al cambio ocurrido en cada uno de sus componentes. Por tanto es de vital importancia conocer la composición estructural de la aorta y cómo influye la pérdida de las propiedades de sus componentes en el cambio de comportamiento que tendrá lugar en esta arteria.
Palabras claves: tejido arterial, modelo constitutivo, elasticidad, arteria aorta, características arteriales.
ABSTRACT
There are several cardiovascular diseases affecting world population. These are determined by hemodynamic parameters changes and arterial wall behavior. A study of arterial wall tissue behavior comes to order to define its characteristics, as special elastic properties allow aorta to fulfill its function. Some of the inherent characteristics of arteries are undermine by changes on the arterial wall tissue behavior, mainly caused by the ageing. Accordingly, it is of paramount importance to get to know the aorta wall tissue structure and its significance on the future changes of the behavior of this artery.
Key words: arterial tissue engineering, constitutive modelling, elasticity, aortic wall, characteristics of arteries.
INTRODUCCIÓN
El conocimiento del comportamiento mecánico de la pared arterial tiene su principal aplicación en el campo de la medicina, para el diagnostico y prevención de enfermedades cardiovasculares. Con este objetivo se ha realizado un estudio del comportamiento de las paredes arteriales, tratando aspectos de importancia relevante para el desarrollo de modelos que se ajusten a la realidad.
El comportamiento mecánico de la pared arterial es muy complejo, las grandes arterias, como la aorta, constituyen un filtro hidráulico cuya función principal es amortiguar las oscilaciones del flujo sanguíneo a fin de nutrir con un régimen estacionario a los diferentes tejidos y órganos con sangre oxigenada. La aorta es el receptor de sangre del ventrículo izquierdo durante la contracción del corazón. La sangre de esta fluye a los órganos viscerales y a las regiones periféricas en la circulación sistémica.
En este trabajo haremos una revisión del comportamiento arterial de manera general y nos enfocaremos en la arteria aorta ascendente. Este análisis posibilitara la compresión de los modelos existentes en la literatura actual y cuáles de ellos pueden ser los más apropiados para describir el comportamiento de esta arteria.
Estudios realizados por diferentes autores demuestran que la aorta en su porción torácica es una arteria elástica [9, 21]. La transformación de un flujo sanguíneo pulsátil del VI (ventrículo izquierdo) a un movimiento sanguíneo pulsátil sisto-diastólico arterial, se debe al fenómeno de amortiguación de la aorta debido a la gran elasticidad de su pared que le permite distenderse cuando ingresa sangre durante la sístole del VI y retraerse durante la diástole. Esta propiedad es característica de las arterias elásticas, en cuyo grupo se encuentran las arterias próximas al corazón, de gran diámetro (aorta, troncos arteriales supra aórticos, arterias iliacas). Estas poseen una media rica en fibras elásticas que aseguran las propiedades de distensión arterial. La composición estructural de la aorta en su capa media (fibras elásticas, musculares y colágeno) varía a medida que se aleja del corazón y así, en la aorta abdominal y especialmente en su porción distal y en las arterias de mediano calibre, cede el predominio de fibras elásticas con incremento de las fibras musculares [13, 15, 21]. Esto conlleva a la modelación de la aorta ascendente como una arteria con comportamiento hiperelástico.
La estructura y composición de cada una de sus capas determinara las propiedades y comportamiento de esta arteria. La cantidad existente de cada uno de sus componentes fundamentales, elastina, colágeno y células musculares, determinaran un aumento o disminución del modulo elástico de la pared [13, 19, 25]. Algunos autores señalan que esta variación está influenciada también por el aumento de la edad y los cambios de presión y flujo sanguíneo [26, 39].
En la búsqueda de la ecuación constitutiva que describe el comportamiento arterial, se han realizado algunos modelos, que a través de resortes y elementos contráctiles, simulan el comportamiento de cada uno de los componentes de la arteria. En este caso encontramos el modelo propuesto por Hayashi en el año 2001 [11] y el modelo de Maxwell inicialmente creado para describir el comportamiento del musculo liso vascular. Este último modelo ha sido modificado para tener en cuenta el comportamiento de cada uno de los elementos de la pared arterial [10]. Otros autores utilizan el modelo de Hill tanto para describir el comportamiento del musculo liso como de cada uno de los componentes [39]. Existen otros modelos como estos todos basados en la simulación del comportamiento arterial a través de resorte y elementos viscosos en algunos casos.
Se ha defendido que la arteria tiene un comportamiento adaptativo en respuesta al daño del vaso [9, 33] o dado también por su sensibilidad a los cambios mecánicos [11, 25, 31] como son los cambios de presión y flujo. Este comportamiento ha sido denominado remodelación y es uno de los modelos que se proponen en la literatura conjuntamente con el modelo hiperelástico [12,15] y viscoelástico [9, 15]. Al realizar un análisis de la conducta de la pared arterial ante diversas situaciones se puede decidir cuál de estos modelos se ajusta más al comportamiento que se desee simular según el tipo de arteria y si la misma está sana o no.
MÉTODOS Y MATERIALES
Estructura de las arterias
La pared arterial es uno de los tejidos biológicos blandos del organismo. Se distingue de los tejidos duros por su alta flexibilidad y bajas propiedades mecánicas. Ejemplos de tejidos blandos son los tendones, ligamentos, vasos arteriales y cartílagos articulares.
Los tejidos blandos son estructuras complejas reforzadas con fibras y sus propiedades dependen de la concentración y disposición de sus principales elementos que son la elastina, el colágeno y las células musculares.
La elastina es la proteína principal de las fibras elásticas de las arterias, las venas, la piel y otros órganos. Representa el 40 % del peso seco de la aorta y confiere la propiedad de elasticidad a los órganos que la contienen. Posee un módulo de elasticidad longitudinal de E=0.6 MPa [31].
El colágeno es el elemento estructural básico de los tejidos blandos, el cual aporta la resistencia mecánica. Se trata de una proteína que como la elastina representa uno de los mayores componentes de la matriz extracelular de los tejidos blandos. Tiene un módulo de elasticidad de alrededor de 1000 MPa con una resistencia a tracción de entre 50 y 100 MPa [31]. Los vasos sanguíneos mantienen su forma cilíndrica debido a la estructura de las fibrillas de colágeno que forman una trama en espiral dándole el soporte a la estructura. La concentración de colágeno varía en función de la necesidad que tenga el material de resistir cambios de tracción o volumen [2, 15, 29].
Los músculos de los vasos sanguíneos son lisos y se denominan músculos lisos vasculares. A diferencia de los músculos estriados el musculo liso no es controlado por nervios voluntarios. Pueden estar en estado pasivo o activo tras una estimulación eléctrica que provoca la contracción.
No homogeneidad de la pared arterial
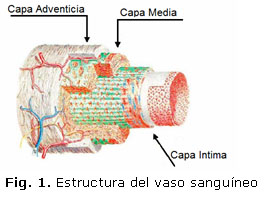
Los vasos sanguíneos parecen homogéneos y se distinguen del tejido conjuntivo a su alrededor. Sin embargo, en su estructura puede ser dividido anatómicamente en tres secciones cilíndricas distintas: la intima, la media y la adventicia (ver Figura 1). Desde el punto de vista de la ingeniería las arterias son consideradas como materiales compuestos reforzados por dos familias de fibras de colágeno [3, 15, 31].
La capa íntima consiste en una fina monocapa de células endoteliales poligonales, estas células son las que están sometidas a la tensión tangencial provocada por el flujo sanguíneo. Una de las misiones de esta capa es mantener la sangre en estado líquido. La media y la adventicia son el principal sostén de cargas y determinan las propiedades mecánicas de la pared. La media es la más espesa de las tres capas y presenta la mayor capacidad de soporte de la estructura, es mucho más rígida que la adventicia y está sujeta a las mayores tensiones [15, 20]. La adventicia está compuesta principalmente de colágeno junto con algo de elastina y fibroblastos. Normalmente se sostiene que la función de la adventicia es fijar los vasos sanguíneos a los tejidos circundantes.
Características de la intima, la media y la adventicia
Intima
Las funciones de esta capa en principio incluyen el mando de permeabilidad de la pared a las macromoléculas como grasa y proteína, y a los glóbulos blancos asociados con los procesos de inflamación y reparación, y está vinculada al control del diámetro.
El espesor de la intima es variable, en las arterias saludables más delgadas, la capa íntima consiste en poco más que la línea endotelial y una membrana con basamento de colágeno. Sin embargo, se pueden encontrar áreas espesas en los vasos aparentemente saludables, aunque generalmente es convenido que el espesor de la intima es una respuesta patológica al daño del vaso como resultado de la proliferación y migración de las células del músculo liso vascular desde la media a la intima [16, 31, 37], también se cree que algunos tipos de espesores de la intima son adaptables en naturaleza [9, 33].
Glagov et al. [9] ha defendido que la fuerte tendencia para esta adaptación es el mantenimiento de los niveles normales de tensión cortante en respuesta a los cambios de velocidad del flujo o diámetro de la pared, o de los niveles normales de la tensión circunferencial en la pared arterial en respuesta a los cambios de la presión transmural.
Media
La segunda capa estructural compartida por todas las arterias es la capa media que como la intima, está compuesta de cantidades inconstantes de proteína, músculo liso vascular, y un gel amorfo de la matriz del material consistente en proteoglicanos y frecuentemente terminado en una matriz de relleno [27, 31, 35]. Es la más espesa de las tres capas y presenta la mayor capacidad de soporte de la estructura.
El colágeno, como la elastina, es sintetizado por las células del músculo liso vascular y posiblemente por las células endoteliales vasculares. El arreglo de estos componentes es complejo y varía de acuerdo a la localización dentro del árbol arterial y su proximidad a las uniones. En las arterias la proporción de elastina a colágeno disminuye con el incremento de la distancia desde el corazón mientras el número de células del músculo liso vascular incrementa por unidad de volumen [29, 31]. En la sección transversal de las arterias grandes como la aorta, la estructura en capas es evidente, consistiendo en lo que parecen ser anillos concéntricos de elastina (lamelas), entre los cuales se encuentran las células del músculo liso y rodeándolas las fibras de colágeno, todo sumergido en la matriz de relleno.
Estudios realizados en la aorta del conejo demostraron que la túnica media está estructurada por lamelas elásticas fenestradas y ligeramente onduladas, disponiéndose predominantemente en sentido circular, observándose un número variable de lamelas (entre 30 y 40 en las porciones ascendente y torácica y entre 10 y 15 en la porción abdominal de la aorta). Los espacios interlamelares elásticos de la túnica media contienen haces de colágeno y fibras musculares lisas.
En el hombre se ha observado gran cantidad de lamelas elásticas en la pared aórtica, sin caracterización de distribución segmentar, entre 40 y 70, [21], siendo su número relativamente mayor a lo observado en la aorta de conejo. A pesar de lo anterior, se ha resaltado la presencia de un número relativamente menor de lamelas elásticas en la porción abdominal de la aorta humana, correlacionándolo como uno de los factores que intervienen en la fisiopatología del aneurisma aórtico, observado con mayor incidencia en el segmento abdominal de la aorta que en el segmento de la aorta ascendente [21].
Los espacios interlamelares en la túnica media de la aorta de conejo, así como en otros mamíferos [15, 21], son ocupados por colágeno, predominantemente fibrilar, por células musculares lisas, células estrelladas y matriz (sustancia intercelular) amorfa. La interrelación característica observada entre las fibras musculares lisas y las fibras elásticas, en esta capa aórtica, donde aparentemente expansiones citoplasmáticas de las primeras se adhieren a las últimas, fue verificada en la aorta de otras especies, con efectiva adhesión entre las lamelas elásticas y las fibras lisas, caracterizando la formación de un sistema músculo elástico en la pared [6]. Según algunos autores éste parece tener un papel tónico eficaz en la propiedad de visco-elasticidad de la pared arterial [4, 31].
Adventicia
El extremo de las tres capas común a todas las arterias es la adventicia, compuesta principalmente de colágeno junto con algo de elastina y fibroplastos. Su frontera con la media está claramente definida por una lámina elástica externa. En las arterias musculares grandes, como la renal y la arteria coronaria entre otras, el colágeno y la elastina son organizados en una estructura por capas, aunque esto es fácilmente discernible desde la media por la falta de células del músculo liso vascular y la prominencia de colágeno. En la aorta torácica, por otro lado, la adventicia consiste en poco más que una malla suelta de fibras de colágeno que unen imperceptiblemente con el tejido conectivo circundante.
Normalmente se sostiene que la función de la adventicia es fijar los vasos sanguíneos a los tejidos circundantes. Esta separación de la adventicia conlleva a una reducción del modulo elástico en el resto de la pared del vaso. En esta capa los cambios de presión influyen más en los alargamientos axiales que en las otras dos. La rigidez de esta capa aumenta con mayor rapidez que la del conjunto capa media-intima [16].
Estudios realizados en la aorta de un cerdo muestran que la capa media posee un modulo elástico de 447 kPa y la adventicia de 111.9 kPa. En la aorta descendente se encuentran valores de 247.4 kPa para la primera y de 68.7 kPa para la segunda [31]
Clasificación de las arterias según la constitución de la media
Según la proporción relativa que constituye esta matriz, se distinguen dos grandes grupos de arterias:
Las arterias elásticas: son las arterias próximas al corazón, de gran diámetro (aorta, troncos arteriales supra aórticos, arterias iliacas), poseen una media rica en fibras elásticas que aseguran las propiedades de distensión arterial
Las arterias musculares: más alejadas del corazón, de diámetro medio o pequeño (~ 2 - 5 mm), son más numerosas (arterias femorales y renales), se caracterizan por la pobreza en fibras elásticas de la capa media. La presencia de numerosas células musculares lisas proporciona la propiedad vasomotora de este tipo arterial.
Estas características hacen que la aorta ascendente, como arteria elástica posea una capa íntima espesa mientras que en las arterias musculares esta capa es delgada. Igualmente la capa media de la aorta es muy espesa en comparación con capa media de las arterias del tipo muscular.
Elasticidad arterial
Es una propiedad importante de las arterias, imprescindible para mantener una presión mínima determinada, constante (más o menos), que es la presión diastólica. Tiene especial valor, ya que existen enfermedades donde se pierde la elasticidad arterial y hay tendencia al aumento de la tensión arterial, como es la arteriosclerosis.
La elasticidad arterial es ejercida por los componentes pasivos (fibras de elastina y colágeno) y los componentes activos (células de músculo liso vascular). La elastina confiere la propiedad de elasticidad y es el material biológico de comportamiento más lineal que se conoce. El colágeno aporta integridad y resistencia mecánica. Otra de las funciones de las fibras de elastina y colágeno es mantener una tensión estable contra la presión transmural presente en el vaso.
En el 2001 Hayashi propuso un modelo para describir la composición de los tejidos blandos basándose en el comportamiento de estos componentes, figura 2, [11, 25].
Se ha realizado numerosos estudios sobre la contribución individual de dichas fibras a la elasticidad total [28, 30, 37], de manera que se verifique cual es el aporte de cada una a el comportamiento arterial. El módulo elástico de la pared arterial fue descompuesto en el correspondiente a las fibras de elastina (EE), el módulo elástico de las fibras de colágeno (Ec) y el reclutamiento de fibras de colágeno (fc) que soportan la tensión parietal a un nivel dado de presión transmural basado en el modelo de dos resortes en paralelo.
Las propiedades mecánicas del músculo liso arterial son descritas adecuadamente para la mayoría de los propósitos en el modelo de Maxwell. El modelo representa un material que responde inmediatamente de manera elástica, pero posteriormente, si la carga se mantiene, tiende a comportarse de manera viscosa (ver Fig. 3). Este modelo a menudo es utilizado para describir la conducta del vaso entero. Relaciona fácilmente la medida de los parámetros mecánicos, como tensión (fuerza), deformación (longitud), desplazamiento (diámetro), y velocidad de los desplazamientos de sus tres componentes globales: un elemento contráctil (CE) que se comporta como un simple elemento viscoso que en reposo no ofrece resistencia al estiramiento, un resorte puramente elástico (SEC) acoplado en serie con el CE y un resorte en paralelo (PEC) el cual representa la conducta elástica de la pared arterial cuando el músculo liso está relajado o bajo tono vasomotor normal, donde su conducta elástica es despreciable [11, 31]
En la figura 3b se obtiene la relación tensión deformación para la respuesta activa, cuando el musculo liso esta activado, y para la respuesta pasiva. Obteniéndose las propiedades estáticas del elemento contráctil.
Este modelo ha sido modificado, figura 4, para tener en cuenta el comportamiento de la elastina y el colágeno. Enfoque que ha permitido una completa evaluación del aporte elástico de los principales componentes estructurales de la pared aórtica [10]. A veces se agrega un cuarto componente, el componente paralelo viscoso (PVC,η), en paralelo a PEC para considerar los efectos de dispersión viscosos internos.
El comportamiento de las fibras de colágeno están representadas por un conjunto de resortes que se enganchan a diferentes grados de extensión, según modelo de Wiederhielm, [10] de esta manera se simula la conducta elástica de las fibras de colágeno. Los términos M y η representan el elemento inercial y la viscosidad parietal.
A partir de este modelo modificado se ha obtenido la ecuación 1 constitutiva que describe el comportamiento de la pared arterial. La tensión total generada por la pared para oponerse al estiramiento se atribuye comúnmente a los efectos combinados de la elasticidad, la viscosidad y la inercia de la pared arterial.
La relación tensión-deformación elástica pura (respuesta pasiva), (ver Fig. 5) se desarrolla siguiendo el mismo lugar geométrico ya sea para aumentos en la deformación como para la disminución, por lo tanto en este diagrama el lazo de histéresis no aparece.
El primer termino comprende la respuesta elástica de las fibras de elastina (σ E), la conducta no lineal de las fibras de colágeno (σc) y un tercer elemento que existe sólo bajo la activación del músculo liso (σSM), ecuaciones 1 y 2. El segundo término comprende el elemento viscoso (σV) y el tercer término el inercial (σM). Estos elementos describen la conducta dinámica de la pared arterial y son responsables del lazo de histéresis de la pared aórtica [5, 10, 39].
La relación Tensión-Deformación aórtica (línea fina) involucra las propiedades elásticas, viscosas e inerciales que generan un lazo de histéresis. La línea gruesa representa el mínimo valor de superficie encontrada mediante la sustracción viscosa.
El comportamiento del musculo liso vascular es simulado también por el modelo de Hill [39], modelo que ha sido modificado para describir asimismo el comportamiento en conjunto con la elastina y el colágeno. Otro autores utilizan modelos distintos de estos dos para la simulación [5,18], de manera general todos los modelos se basan en la simulación de cada uno de los componentes de la pared arterial a través de elementos contráctiles para así obtener la ecuación constitutiva que describe su comportamiento [14, 16 , 31].
El tejido arterial tiene la habilidad de responder a los cambios alterando su geometría. Los estudios experimentales demuestran que un aumento de la presión lleva al crecimiento del tejido vascular [1,7-8]. Fung y Liu encontraron que al inducir hipertensión el diámetro interno de la arteria apenas se modificaba, sin embargo el espesor de la pared aumenta significativamente. Estos cambios de estado de tensión son los que conllevan a cambios geométricos en las arterias, llamado crecimiento, que dan lugar al remodelado vascular (cambio en las propiedades). Los estudios experimentales realizados en la aorta [8, 26, 35] han demostrado que al inducir hipertensión se produce un aumento del espesor de la pared de un 80 % en los 10 primeros días. Según Rachev este tipo de remodelado causado por la hipertensión tiende a mantener la distribución de tensiones y deformaciones en la pared arterial como si estuviera en condiciones normales de presión arterial. El remodelado causado por la hipertensión tiende a producir un aumento no homogéneo del espesor de la pared [26, 36, 39]. Las tensiones y deformaciones que quedan luego de la descarga de presión se llaman deformaciones y tensiones residuales [23, 26].
Las células del músculo liso vascular producen alteraciones en la magnitud de la tensión circunferencial, la respuesta a estos cambios es el remodelado de la pared vascular. La respuesta primaria de las células del músculo liso vascular al incrementar la tensión cíclica es la síntesis de colágeno, aunque algunos estudios experimentales afirman que es la síntesis de elastina, pero no se confirma que así sea dado que la síntesis de esta es sumamente lenta. Estos cambios en el tejido varían la longitud y densidad de las fibras de colágeno [16].
La pared arterial sujeta a tensión cíclica incesante sufre fatiga material, esto afectará a todos los componentes pero es sólo la elastina quien no puede ser resintetizada, trayendo consigo el reemplazo gradual de elastina con colágeno, lo que lleva a un aumento progresivo en el módulo elástico de la pared con la edad [24, 31, 34]. Algunos autores consideran que la variación en la proporción de colágeno con la edad no es influyente en la rigidez de la pared [40]. Estas fibras de colágeno son las que le proporcionan un comportamiento anisotrópico a la pared arterial [13, 22]. Los conductos arteriales grandes, como la aorta, contienen más elastina en la vida temprana que los vasos musculares más pequeños, este es un factor importante en la reducción de la elasticidad de esta arteria con la edad. Una vez que los conductos arteriales empiezan a ponerse más rígidos, su impedancia característica y la presión del pulso para una presión media dada aumentarán. Esto lleva al incremento de la tensión circunferencial, asumiendo que no existe ningún cambio en la distensibilidad, producirá un aumento en la tensión circunferencial y una tendencia a sintetizar más colágeno aumentando así el módulo elástico [13, 19, 25].
Características básicas de la pared aortica
Como ya se ha analizado, la composición de la pared arterial varia a lo largo del árbol arterial. Esto influye en la variación de la curva esfuerzo- deformación según el sitio anatómico, hecho demostrado en los numerosos ensayos experimentales [5, 24, 32]
Dependiendo del tipo de arteria considerada, el comportamiento del material puede ser analizado como perfectamente elástico, para las arterias proximales del tipo elástico, como la aorta, o viscoelástico para las arterias distales del tipo muscular, las cuales a menudo se modelan como pseudos-elásticas.
Cuando un segmento arterial está sujeto a variación de fuerzas cíclicas la respuesta esfuerzo - deformación muestra un lazo de histéresis (ver Fig. 5). El lazo disminuye (decrece) con la sucesión de los ciclos de cargas y descargas tendiendo así a un estado estable.
A partir de un análisis cualitativo de las curvas de tensión-deformación se puede arribar a las siguientes conclusiones:
" La respuesta mecánica del tejido arterial es esencialmente no lineal tanto geométrica como físicamente.
" Las curvas de carga y descarga son casi independientes del rango de deformación y cierran una cerca de la otra.
Por lo tanto se acepta que las arterias son microscópicamente un material elástico no lineal. Al analizar la curva esfuerzo-deformación se puede asumir que el tejido arterial se comporta como un material elástico en la carga y como otro material elástico en la descarga, como ha sido sugerido por Fung [8].
Comportamiento de la pared arterial
Podemos observar tres comportamientos fundamentales:
1- El primero se denomina respuesta pasiva y se caracteriza por grandes deformaciones. Ocurre tras una variación de presión que provoca una deformación elástica instantánea que se manifiesta en un cambio de las dimensiones del vaso.
2- Esta respuesta es seguida de la respuesta activa, que se produce debido a la contracción de las células musculares cuando la acción mecánica persiste. Por ende, si aumenta la tensión circunferencial se producirá una contracción de la arteria con independencia de las células endoteliales, aunque estas son las que detectan los cambios y activan o relajan las células musculares.
3- Si los cambios en la presión o en el flujo se mantienen por un periodo de tiempo prolongado, la arteria responde modificando la geometría (crecimiento) [31], la estructura y la composición. Esta respuesta es lo que se llama remodelación según [25] y está controlada por la respuesta activa.
MODELOS PROPUESTOS
En la literatura se proponen diferentes tipos de modelos en función de la variación del comportamiento arterial.
1- Primer tipo de modelo
Modelos no lineales dadas las grandes deformaciones y rotaciones que presentan las paredes arteriales. Una de las formulaciones de mayor difusión en este tipo de modelos es la de tipo hiperelástico [12, 15].
2- Segundo tipo de modelo.
Contempla el comportamiento reológico debido fundamentalmente a la presencia de células musculares[8], lo que ha motivado el desarrollo de modelos viscoelásticos [15].
3- Tercer tipo de modelo.
Modelos que contemplen comportamientos adaptativos frente a acciones externas [25]. La remodelación consiste en la variación de las propiedades del material (remodelado estructural) y a la variación de la geometría por aumento de masa (remodelado másico), también llamado crecimiento. Distinguiéndose el remodelado positivo del negativo según aumente o disminuya (respectivamente) el lumen.
CONCLUSIONES
La caracterización de la estructura de las paredes arteriales es de vital importancia para la comprensión del comportamiento mecánico de la misma. La arteria tiene un comportamiento no lineal, en dependencia de la función fisiológica que cumple, este puede encontrarse dentro del campo de la hyperelasticidad o de la viscoelasticidad, lo cual se corresponde con la respuesta pasiva y activa respectivamente. Otra forma de comportamiento importante encontrada en estos tejidos fue la remodelación como respuesta a los cambios sostenidos en la presión o en el flujo sanguíneo o el crecimiento en respuesta al daño del vaso.
Los experimentos muestran que la no linealidad física de la pared arterial está caracterizada por el incremento de la rigidez como respuesta al aumento de las deformaciones. El origen de este comportamiento es encontrado en las propiedades mecánicas de los componentes estructurales de la pared arterial: elastina y colágeno. La comprensión del comportamiento de estos componentes, así como de las células musculares, ha demostrado ser fundamental para la determinación de la ecuación constitutiva de la pared arterial.
Debido a las características de la arteria aorta dada por la función fisiológica de la misma, esta se encuentra entre las arterias elásticas. Se ha demostrado que con el paso del tiempo la cantidad de cada uno de los componentes que la conforman varia, esto cambiara el comportamiento de la arteria que perderá su elasticidad a medida que aumente la rigidez. De manera general para una arteria aorta sana esta puede modelarse dentro del campo de la hiperelasticidad.
REFERENCIAS
1. Alford, P. W., Humphrey, J. D. y Taber, L. "And remodeling in a thick-walled artery model: Effects of spatial variations in wall constituents". Biomech. Model. Mechanobiol. 2008, vol. 7, nº 4, p. 245-262. ISSN 1617-7940.
2. Ambrosi, D., Ateshian, G. A., Arruda, E. M., et al. "Perspectives on biological growth and remodeling". Journal of the Mechanics and Physics of Solids. 2011, vol. 59, p. 863-883. ISSN 0022-5096.
3. Balzani, D., Brinkhues, S. Y. y Holzapfel, G. A. "Constitutive framework for the modeling of damage in collagenous soft tissues with application to arterial walls". Comput. Methods Appl. Mech. Engrg. 2012, vol. 213, p. 136-151. ISSN 0045-7825.
4. Daly, S., Prendergast, P. J., Dola, F., et al. "Use of finite element analysis to simulate the hyperelastic behaviour of cardiovascular tissue". En: 12th Conference of the European Society of Biomechanics. Dublin, Ireland. [Consultado el: 10 de enero 2014]. 2000. Disponible en: http://ansys.net/ansys/papers/cardiovascular.pdf
5. Danpinid, A., Luo, J. y Vappou, J. "In vivo characterization of the aortic wall stress-strain relationship". Ultrasonics. 2010, vol. 50, p. 654-665. ISSN 0041-324X.
6. Davis, E. "Smooth muscle cell to elastic lamina connections in developing mouse aorta". Journal of Technical Methods and Pathology. 1993, vol. 68, p. 89-99. ISSN 0023-6837.
7. Fung, Y. C. "Elasticity of soft tissues in simple elongation". Am. J. Physiol. 1967, vol. 213, p. 1532-1544.
8. Fung, Y. C. Mechanical properties of living tissues. 2nd ed. New York, USA: Springer-Verlag, 1993. p. 241-251. ISBN 0387979476
9. Glagov, S., Stary, H. C., Blankenhorn, D. H., et al. "A definition of the intima of human arteries and of its atherosclerosis-prone regions". Arterioscler Thromb Vasc Biol. 1992, vol. 12, p. 120-134. ISSN 1524-4636.
10. Graf, S., Pessana, F. M. y Craiem, D. "Modelización de la pared arterial y su aplicación al diagnóstico no invasivo de arteropatías". En: Biongeniería e informática medica. Argentina. 2003, [Consultado el: 25 de noviembre 2014]. Disponible en: http://www.fac.org.ar/tcvc/llave/c399/graf.htm
11. Hayashi, T. "Atrial septal perforation from tips stent migration". Journal of Vascular and Interventional Radiology. 2004, vol. 15, nº 6, p. 629-632. ISSN 1051-0443.
12. Holzapfel, G. A. "Determination of material models for arterial walls from uniaxial extension tests and histological structure". Journal of Theoretical Biology. 2006, vol. 238, p. 290-302. ISSN 0022-5193.
13. Holzapfel, G. A., Gasser, T. C. y Stadler, M. "A structural model for the viscoelastic behavior of arterial walls: Continuum formulation and finite element simulation". European Journal of Mechanics A/Solids. 2002, vol. 21, p. 441-463. ISSN 0997-7538.
14. Holzapfel, G. A. y Ogden, R. W. Biomechanical modelling at the molecular, cellular and tissue levels. New York, USA: Springer-Verlag, 2009. Vol. 508, [Consultado el: 10 de enero 2014]. Disponible en: http://www.springerlink.com/content/r1qg55/#section=247089&page=1&locus=0 . ISBN 978-3-211-95875-9
15. Holzapfel, G. A. y Ogden, R. W. "Modelling the layer-specific three-dimensional residual stresses in arteries, with an application to the human aorta". J. R. Soc. Interface. 2010, vol. 7, nº 46, p. 797-799. ISSN 1742-5662.
16. Holzapfel, G. A. y Ogden, R. W. "Constitutive modelling of arteries". The Royal Society. 2010, vol. 466, p. 1551-1597. ISSN 1742-5662.
17. Humphrey, J. D. "Continuum biomechanics of soft biological tissues". Proc R Soc Lond A. 2003, vol. 459, p. 3-46. ISSN 1471-2946.
18. Khamdaeng, T., Luo, J., Vappou, J., et al. "Arterial stiffness identification of the human carotid artery using the stress-strain relationship in vivo". Ultrasonics. 2011, vol. 52, nº 3, p. 402-411. ISSN 0041-624X.
19. Labrosse, M. R., Beller, C. J. y Mesana, T. "Mechanical behavior of human aortas: Experiments, material constants and 3-d finite element modeling including residual stress". Journal of Biomechanics. 2009, vol. 42, p. 966-1004. ISSN 0021-9290.
20. Masson, I., Boutouyrie, P., Laurent, S., et al. "Characterization of arterial wall mechanical behavior and stresses from human clinical data". Journal of Biomechanical engineering. 2009, vol. 41, nº 12, p. 2618-2627. ISSN 0148-0731.
21. Mello, J. M., Orsi, A. M., Padovani, C. R., et al. "Structure of the aortic wall in the guinea pig and rat". Brazil Journal of morphology Science. 2004, vol. 21, nº 1, p. 35-38. ISSN 0102-9010.
22. Ogden, R. W. "Anisotropy and nonlinear elasticity in arterial wall mechanics". En: Biomechanical modelling at the molecular, cellular and tissue levels. Vienna, Wien, Austria: Springer, 2009, p. 179-258. [Consultado el: 6 de enero 2014]. Disponible en: http://shellbuckling.com/cv/ogden.pdf ISBN 978-3-211-95875-9.
23. Olson, T. y Klarbring, A. "Residual stresses in soft tissue as a consequence of growth and remodeling: Application to an arterial geometry". Eur. J. Mech./a solids. 2008, vol. 27, nº 6, p. 959-974. ISSN 1471-2946.
24. Pezzani, A. y García-Herrera, C. "Caracterización del comportamiento mecánico de la aorta descendente". En: Anales de Mecánica de la Fractura. Santiago De Chile, Chile. 2011. p. 63-68.
25. Rachev, A., Hayashi K., Stergiopulos N., et al. "Techniques in the Determination of the Mechanical Properties and Constitutive Laws of Arterial Walls". En: Biomechanical Systems. Techniques and Applications, Volume II: Cardiovascular Techniques. Boca Raton, Fla. USA: CRC Press. 2001. ISBN 0-8493-9047-8.
26. Rachev, A., Stergiopulos, N. y Meistert, J. J. "Theorical study of dynamics of arterial wall remodeling in response to changes in blood pressure". Journal of Biomechanics. 1996, vol. 29, nº 5, p. 635-642. ISSN 0021-9290.
27. Rezakhaniha, R., Agianniotis, A. y Schrauwen, J. T. C, et al. "Experimental investigation of collagen waviness and orientation in the arterial adventitia using confocal laser scanning microscopy". Biomech Model Mechanobiol. 2012, vol. 11, p. 461-473. ISSN 1617-7940.
28. Rezakhaniha, R., Fonck, E. y Genoud, C. "Role of elastin anisotropy in structural strain energy functions of arterial tissue". Biomech Model Mechanobiol. 2011, vol. 10, p. 599-611. ISSN 1617-7940.
29. Rezakhaniha, R. S. Biomechanics of vascular wall: The role of structural organization of elastin and collagen. Tutor: Stergiopulos, P. N. Tesis doctoral, Faculté Sciences de la Vie. École Polytechnique Fédérale de Lausanne, Suisse. 2010. [Consultado el: 10 diciembre 2013]. Disponible en: http://infoscience.epfl.ch/record/147982/files/EPFL_TH4712.pdf
30. Roy, S., Boss, C. y Rezakhaniha, R. "Experimental characterization of the distribution of collagen fiber recruitment". Japanese Society of Biorheology. 2010, vol. 24, p. 84-93. ISSN 1867-0474.
31. Soler, J. R. Modelos numéricos para mecánica cardiovascular de las paredes arteriales y sus procesos de adaptación. Tutor: José María Goicolea Ruigómez. Tesis Doctoral. Universidad Politécnica de Madrid, Madrid, España. 2003.
32. Stålhand, J. "Determination of human arterial wall parameters from clinical data". Biomech. Model. Mechanobiol. 2009, vol. 8, nº 2, p. 141-148. ISSN 1617-7940.
33. Stary, H. C. "Natural history and histological classification of atherosclerotic lesions: An update". Arteriosclerosis, Thrombosis, and Vascular Biology. 2000, vol. 20, nº 5, p. 1177-1178. ISSN 1524-4636.
34. Taylor, C. A. y Humphrey, J. D. "Open problems in computational vascular biomechanics: Hemodynamics and arterial wall mechanics". Computational Methodologies Apply to Mechanical Engineering. 2009, vol. 198, p. 3514-3523. ISSN 0045-7825.
35. Tsamis, A. y Stergiopulos, N. "Arterial remodeling in response to hypertension using a constituent-based model". Am. J. Physiol. Heart Circ. Physiol. 2007, vol. 293, p. 3130-3139. ISSN 0363-6135.
36. Valentín, A. y Humphrey, J. D. "Parameter sensitivity study of a constrained mixture model of arterial growth and remodeling". J Biomech Eng. 2009, vol. 131, nº 10, ISSN 0148-0731.
37. Watton, P. N., Ventikos, Y. y Holzapfel, G. A. "Modeling the mechanical response of elastin for arterial tissue". Journal of Biomechanics. 2009, vol. 42, p. 1320-1325. ISSN 0021-9290.
38. Zeinali-Davarani, S., Choi, J. y Baek. "On parameter estimation for biaxial mechanical behavior of arteries". J. Biomech. 2009, vol. 42, p. 524-530. ISSN 0021-9290.
39. Zulliger, M. A., Rachev, A. y Stergiopulos, N. "A constitutive formulation of arterial mechanics including vascular smooth muscle tone". J Physiol Heart Circ Physiol. 2004, vol. 287, p. 1335-1343. ISSN 1522-1539.
40. Zulliger, M. A. y Stergiopulos, N. "Structural strain energy function applied to the ageing of the human aorta". Journal of Biomechanics. 2007, vol. 40, p. 3061-3069. ISSN 0021-9290.
Recibido: 26 de febrero de 2014.
Aceptado: 10 de abril de 2014.
Diana Otero-Martínez. Instituto Superior Politécnico José Antonio Echeverría. Facultad de Ingeniería Mecánica. La Habana. Cuba
Correo electrónico: dotero@mecanica.cujae.edu.cu