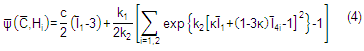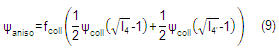Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Ingeniería Mecánica
versión On-line ISSN 1815-5944
Ingeniería Mecánica vol.17 no.3 La Habana sep.-dic. 2014
ARTÍCULO DE REVISIÓN
Evolución de los modelos constitutivos de respuesta pasiva para paredes arteriales
Evolution of constitutive models for passive response of the arterial walls
Guillermo Fernández-Collazo, Tania Rodríguez-Moliner
Instituto Superior Politécnico José Antonio Echeverría. Facultad de Ingeniería Mecánica, La Habana, Cuba
RESUMEN
La respuesta mecánica de las paredes arteriales se modifica como consecuencia del envejecimiento y el desarrollo de enfermedades. Estos cambios se ven reflejados en modificaciones en su estructura, composición, resistencia y forma. La predicción de su comportamiento en dependencia de su estado fisiológico usando modelos biomecánicos se muestra como una potente herramienta en el tratamiento y diagnóstico de aneurismas, ateroesclerosis, hipertensión arterial entre otras. Realizando un profundo análisis de la literatura consultada se presenta un estudio bibliográfico de los modelos constitutivos de paredes arteriales en su respuesta pasiva, clasificándolos y destacando sus principales ventajas, desventajas y la evolución de estos desde los puramente fenomenológicos hasta los más complejos.
Palabras claves: modelos, arterias, respuesta pasiva, biomecánica.
ABSTRACT
The mechanical response of arterial walls is modified as a result of aging and disease development. These changes are reflected in changes in its composition, strength, shape and structure. The prediction of their behavior, depending on their physiological state used biomechanical models is shown as a powerful tool in the treatment and diagnosis of aneurysms, atherosclerosis, hypertension and others. It´s presented in its passive response, a profound analysis of the literature and the bibliographic review of the constitutive models of arterial walls, classifying and highlighting their main advantages, disadvantages and the evolution from purely phenomenological to the most complex response.
Key words: models, artery, passive response, biomechanics.
INTRODUCCIÓN
Las enfermedades cardiovasculares representan una de las principales causas de muerte en muchos países desarrollados y en vía de desarrollo [1]. Muchas de estas afecciones como la angioplastia, aneurisma o arterioesclerosis presentan una íntima relación entre las características biomecánicas de las paredes arteriales y la futura evolución de estas disfunciones [2, 3]. Esta respuesta biomecánica depende no solo de su compleja composición interna sino también de la forma y las concentraciones de cada uno de los componentes biológicos que la integran, destacándose la dirección preferencial de las fibras de colágeno como una de sus características más importantes. Es por esto que un conocimiento profundo de la microestructura de las paredes arteriales es de vital importancia para la comprensión de su funcionamiento y el desarrollo de modelos biomecánicos que contribuyan a un mejor entendimiento de su comportamiento.
Las relaciones constitutivas han sido usadas para describir la mayoría de los comportamientos de las paredes arteriales. Estas descripciones eran realizadas en un inicio teniendo en cuenta relaciones puramente fenomenológicas como los propuestos por Demiray, H. [4], Vaishnav, R. N. y John, T. [5], Chuong y Fung, Y. C. [6], Takamizawa, K. y Hayashi, K. [7] los que analizan el material como un sistema macroscópico, hasta llegar a otros más avanzados capaces de modelar las respuestas pasivas de las arterias tomando en cuenta para su formulación elementos de su estructura y composición interna como la dirección preferencial de las fibras de colágeno dentro de la pared, fracción de área total de elastina y colágeno en la sección transversal de la arteria, aumentando sus capacidades predictivas más que en los puramente fenomenológicos [8, 9].
Uno de los requisitos fundamentales para cuantificar los cambios en la estructura y funcionamiento de las arterias en respuesta a alteraciones en su medio, es el uso de modelos constitutivos que se ajusten a cada condición dada [10]. Ya que las relaciones constitutivas no describen el material en su totalidad, sino que describen el comportamiento del material bajo condiciones específicas, son necesarias múltiples relaciones constitutivas para describir diferentes comportamientos producidos por el mismo material, por lo que podemos encontrar en la literatura diferentes formulaciones como podrían ser las pseudoelásticos, visco-elásticas, mezcla fluido-estructura, daño mecánico continuo entre otras [11].
A pesar de los grandes adelantos que se han dado hacia la obtención de modelos biomecánicos de tejidos blandos que puedan ser aplicados a casos clínicos con una alta fiabilidad y exactitud, todavía presentan deficiencias importantes [12]. En este trabajo se plantea una revisión de los modelos constitutivos que describen la respuesta pasiva de la pared arterial, a partir de una propuesta de organización en función de su aplicabilidad. Esto nos permitirá un mejor entendimiento de su evolución y desarrollo, así como una panorámica de los futuros temas y líneas de investigación en este campo.
MODELOS CONSITUTIVOS
Existen diferentes tipos de vasos sanguíneos, elásticos, musculares y algunos que poseen características elásticas y musculares. Prestaremos mayor interés a los vasos sanguíneos más próximos al corazón de mayor diámetro y longitud, para los que los modelos constitutivos han sido aplicados en mayor medida. Este tipo de vasos sanguíneos están compuestos de tres capas de marcada diferencia en su respuesta mecánica, su estructura y composición. Una de estas capas, la íntima es la capa más interna y la única en contacto directo con la sangre, en paredes sanas es delgada y no aporta grandes propiedades mecánicas a las arterias, no siendo así cuando se acumulan lípidos, restos necróticos, calcio etc. La media formada principalmente por células musculares lisas y la adventicia que recubre a la arteria si aportan propiedades mecánicas al sistema y son tenidas en cuenta en los modelos en arterias sanas.
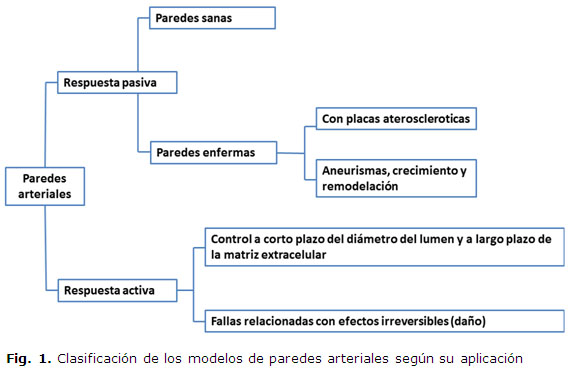
Los modelos constitutivos son ecuaciones que relacionan las tensiones y deformaciones en un sólido continuo. En los modelos de paredes arteriales se plantea la existencia de una energía de deformación que describe la energía por unidad de volumen almacenada en el cuerpo elástico deformado. Tomando como base ésta teoría surgen numerosos modelos que intentan describir y predecir la respuesta de las paredes arteriales. Estos modelos de comportamiento de la pared arterial podrían ser clasificados y analizados bien a partir de sus características biomecánicas como modelos puramente fenomenológicos o estructurales. Entendiendo por fenomenológicos aquellos que no tienen en cuenta las características internas del material y lo analizan como un todo, y por estructurales aquellos que tienen en cuenta las diferencias internas que poseen las arterias. Estas diferencias podría ser su configuración por capas, las concentraciones de sus componentes y las direcciones preferenciales que toman las fibras de colágeno entre otras. Otra forma usualmente utilizada en la literatura es la clasificación de los modelos en dependencia de su respuesta activa o pasiva ante determinadas condiciones de carga. En esta clasificación es común que la respuesta pasiva, no tome en consideración la acción de las células musculares lisas. A partir de esta clasificación se establece una nueva organización de estos modelos teniendo en cuenta su aplicabilidad y uso figura 1. Esta permite una mejor identificación de los modelos existente, así como una identificación rápida de la característica de la pared arterial que describe.
En la figura 1 es posible destacar que son varios los problemas que intentan modelar estas relaciones constitutivas. Esto se debe en gran medida como puede versé en Humphrey, J. D. y Na, S. [11], a que no es posible concebir modelos capases de describir la respuesta de un material complejo en su totalidad como las paredes arteriales. Por otra parte si es posible encontrar en la literatura modelos que describen comportamientos específicos frente a condiciones de carga y trabajo determinadas. Por lo que a continuación serán revisados los modelos de respuesta pasiva más significativos según la clasificación presentada anteriormente, con especial interés en su evolución y desarrollo.
MODELOS DE PAREDES SANAS
Los modelos de paredes arteriales sanas en su respuesta pasiva son las relaciones constitutivas que describen el comportamiento de la pared arterial sin tener en cuenta la acción de las fibras musculares ni la presencia de enfermedades que puedan modificar su comportamiento. Los primeros avances en la obtención de modelos, quedescriben el comportamiento pasivo de las paredes arteriales, estuvieron motivados por la respuesta mecánica de estos frente a determinadas condiciones de carga (inflado, extensión). Entre los modelos fenomenológicos más importantes podemos destacar el propuesto por [6]este asume una respuesta cilíndricamente ortotrópica usando una formulación exponencial de la función de energía. Este modelo al igual que el propuesto porfueron creados para analizar el comportamiento de la arteria carótida pero utilizando una formulación logarítmica. De esta misma manera en [4],se describe las características mecánicas de las paredes arteriales sin ninguna información de su estructura, por lo que su capacidad de predicción y ajuste a la respuestas fisiológicas que presentan las arterias es limitada [8, 13].
Apoyándose en estas formulaciones y en los conocimientos más detallados de la micro estructura de las paredes arteriales, fueron creados otros modelos que van a tener en consideración la forma en la que los diferentes componentes que conforman la pared están entrelazados.
Una de las formulaciones matemáticas más aceptadas dentro de este tema es el modelo presentado por Holzapfel, G. A. y Gasser, T. C. [8].Este propone un modelo simplificado de la pared arterial, asumiendo una respuesta compartida por dos materiales principales que forman la estructura de la pared. La elastina presente como matriz que contiene a las fibras de colágeno es responsable de una respuesta isotrópica, mientras que las fibras de colágenos aportan una fuerte anisotropía. La unión conjunta de estos dos componentes es modelada descomponiendo la función de energía en una suma, una parte dedicada a la respuesta isotrópica y otra a la anisotrópica, descrita en función de las invariantes modificadas. La formulación en términos de las invariantes modificadas ![]() de la función de energía de deformación
de la función de energía de deformación ![]() en función del tensor de Cauchy
en función del tensor de Cauchy ![]() garantiza la independencia al sistema de referencia utilizado y toma en cuenta la casi incompresibilidad del material. Donde k2>0 es un parámetro adimensional y k1>0 caracteriza las tenciones para el ajuste del modelo.
garantiza la independencia al sistema de referencia utilizado y toma en cuenta la casi incompresibilidad del material. Donde k2>0 es un parámetro adimensional y k1>0 caracteriza las tenciones para el ajuste del modelo.
Como simplificación del modelo geométrico de la pared en [8] se considera una estructura de capas figura 2, representando cada una de las capas partes principales de la arteria, la íntima, media y adventicia. En un principio cada una de estas capas es modelada usando la misma función de energía pero con diferentes variables que caracterizan al material. Las variables tienen como objetivo estabilizar el modelo y permitir que este sea ajustado para un correcto funcionamiento del mismo. La utilización del ángulo de las fibras de colágeno φ en una dirección dada como uno de los parámetros que condicionan la respuesta del material fue uno de sus aportes más relevantes, mejorando su capacidad predictiva con respecto a sus precedentes.
Sustentado en estudios de microscopía se conoce que las fibras de colágeno se encuentran bastante alineadas en la capa media, sin embargo, en las capas adventicia e íntima presentan una dispersión con respecto a su dirección principal. A partir de la incorporación del análisis estadístico de la dirección preferencial de las fibras de colágeno es presentado en Gasser, T. C., Ogden, R. W. [14], una nueva función de energía capas de modelar este fenómeno. Este modelo es creado como una generalización del modelo presentado en [8], capaz de modelar la respuesta mecánica teniendo en cuenta la dispersión de las fibras de colágeno, pero no contempla el trabajo de todas las capas a la vez, forma en la que estos tejidos trabajan en su estado normal.
En [15]se presenta un modelo basado en la estructura de capas que presentan estos tipos de tejido pero solo emplea al dirección de las fibras de colágeno, pudiendo incorporarle la dispersión usando la teoría presentada en [14] e incorporarle la dispersión en más pares de fibras de colágeno [16].
A partir de los estudios realizados en [17]es planteado un nuevo modelo basado en la microestructura de las fibras de colágeno [18], ensambladas por puñados de fibrillas de colágeno interconectadas por puentes proteoglicanos que proporcionan la trasmisión de carga entre las fibrillas de colágeno. Este modelo tiene en cuenta tanto el alisamiento y alargamiento de las fibrillas de colágeno como la organización espacial de las fibras de colágeno, usando parámetros materiales y estructurales con un significado físico claro, la función de energía está basada en los estudios realizados por [19]. El cual representa un gran adelanto pues debido a su formulación micro-estructural aumenta sustancialmente el entendimiento de los procesos biomecánicos presentes y puede ser extendido a otros tejidos vivos que presenten semejante estructura de fibras.
A diferencia de los modelos micro-estructurales tratados hasta el momento de los vasos sanguíneos donde es asumida la deformación de cada fibra idéntica a la deformación macroscópica del tejido es presentado en Chen, H., Yi Liu [2] un modelo constitutivo de tejidos fibrosos con una base micro-mecánica, que modifica estas suposiciones y toma en consideración la interacción heterogénea entre las fibras y la sustancia base. Este se sustenta en la teoría de la homogenización expuestas en [20, 21] y tiene en cuenta las ondulación, orientación y distribución espacial de las fibras así como la no linealidad del material a deformaciones finitas.
Un enfoque diferente en el planteamiento de la función de energía es propuesto en Zulliger, M. A., Frideza, P. [9], proponiendo un modelo basado en la forma ondulada que presentan las fibras de colágeno en su estado descargado. Este modelo al igual que el propuesto en [8] descompone la función de energía, usando un modelo neo-Hookean en la respuesta isotrópica del material. En el caso de la anisotropía y la no linealidad se propone que esta es debido a que en un principio no todas las fibras se encuentran en estado de carga (alineadas) pero una vez que es aplicada carga al tejido, la cantidad de fibras soportando cargas aumentara paulatinamente provocando una fuerte no linealidad del tejido y un aumento de su rigidez con un comportamiento típicamente exponencial figura 3. Entre las variables empleadas se encuentran la fracción de área de elastinafelast y de colágenofcoll en la sección transversal así como el módulo de elasticidad de las fibras de colágeno y elastina, las que permiten describir su comportamiento mecánico con un fuerte sentido físico. El modelo matemático en su respuesta anisotrópica está basado en la convolución de dos funciones, una encargada de describir el reclutamiento de fibras, estadísticamente usando la función de densidad de probabilidad log-logarítmica la cual funciona como función modificadora, y la otra describe el comportamiento de una sola fibra por separado. Esta descripción matemática compleja del problema es una de sus principales deficiencias, pues dificulta grandemente su implementación en programas de elementos finitos.
En estudios precedentes se demuestra a partir de pruebas de laboratorio la existencia del reclutamiento de fibras de colágeno cuando el tejido es sometido a cargas [23], y se estudia el arreglo ondulado de las fibras en estado descargado [24], proponiendo una variación al modelo propuesto en [9] en el cual el comportamiento de la matriz de elastina se asume tiene un respuesta anisotrópica. A pesar de que la inclusión de anisotropía a la matriz de elastina como una descripción más exacta del fenómeno físico perfecciona la descripción del modelo, también lo hace más complejo para una futura aplicación en programas de elementos finito con vista a ser usado en casos clínicos.
Este enfoque donde el reclutamiento gradual de las fibras de colágeno es tratado como un mecanismo de variación de la rigidez a partir de un incremento de la tensión en las arterias es tratado también por Hill, M. R., Duan, X. [25]. Realizándose experimentos a ocho arterias carótidas mediante una medición directa del reclutamiento de colágeno cuando se efectúa el alargamiento bajo el incremento de cargas circunferenciales usando pruebas de extensión uniaxial en combinación con el microscopio multifotón MPM. Basado en estos experimentos se crea un nuevo modelo constitutivo en el cual el reclutamiento de las fibras de colágeno comienza a una deformación dada, con un alargamiento de activación representado por una función de distribución de probabilidad. A partir de que se incluyeron de forma directa los datos del reclutamiento, la contribución de las fibras de colágeno fue modelada usando un modelo Neo-Hookean, por lo que fueron necesarias solo dos constantes fenomenológicas del material para ajustar los datos. Para la distribución de la orientación de las fibras fue usada la distribución propuesta por [14].
En la literatura abordada no se encuentra una clara definición del criterio de falla mecánica para este tipo de tejidos. En este sentido la descripción de las fallas en los modelos hiperelásticos de materiales anisotrópicos blandos en su respuesta pasiva en [26] se incorpora una descripción de las fallas introduciendo la energía limite en la función de energía de deformación. Usando limitadores que proporcionan los valores de saturación para la energía de saturación a la cual indica la máxima energía que puede ser guardada y disipada por un volumen de material infinitesimal. El criterio de falla local es calculado incluyendo las tensiones máximas, los alargamientos principales máximos, las tensiones de Von-Mises y la energía de deformación en el momento de la ruptura de la lámina. Mientras en [27] es presentado un modelo de respuesta mecánica de varias capas en tres dimensiones para analizar el efecto de la presión en la falla arterial. La pared arterial es considerada compuesta por cinco diferentes capas. Los efectos tridimensionales son incorporados dentro de todas las capas, incorporando las características elásticas no lineales en la combinación de extensión e inflado. Para la íntima, media y adventicia es usado un modelo de fibras reforzadas, mientras que el endotelio y la lámina interna elástica usa un modelo isotrópico.
Muchos autores han utilizado y modificado estos modelos con el fin de extrapolarlo a otras condiciones y características de las arterias. Un profundo análisis de estos modelos, enfocados a los trabajos en la literatura relacionados con los modelos propuestos por Holzapfel, G. A., Gasser, T. C. y Ogden, R. W. pueden ser encontrado en [28].
Motivado por la necesidad de aplicar modelos usando datos en vivo y cargas fisiológicas dinámicas es usada una solución semianalítica en [29]. La función de energía propuesta es una extensión de los modelos de cuatro fibras propuestos por [30, 31], los cuales tienen su origen en el modelo propuesto por [8]. Se muestra un ejemplo basado en datos obtenidos a partir de mediciones ultrasónicas en ratas vivas en arterias elásticas, usando para la identificación de los parámetros un enfoque de mínimos cuadrados no lineal en el cual los errores son minimizados. Este artículo trata de demostrar la relevancia de este tipo de modelos en estados fisiológicos normales para luego extenderlo a casos con patologías.
Los modelos hiperelásticos, anisotrópicos, no lineales e incompresibles de paredes arteriales están siendo implementados en programas comerciales que emplean la teoría de los elementos finitos. La mayoría de estos programas comerciales asumen que el material es casi incompresible debido a la complejidad numérica asociada a la satisfacción global de esta restricción. En Ní Annaidh, A., Destrade, M. [12] se demuestra la existencia de dos problemas fundamentales en la implementación de este tipo de modelos en programas como ABAQUS, uno asociado a la descomposición de la función de energía de deformación en una parte volumétrica y otra desviadora y otro asociado a la actual formulación de estos en elementos finitos, provocando que pequeñas variaciones en el módulo de Poisson, utilizado para calcular el factor de compresibilidad D seleccionado cercanos a 0.5 por ejemplo 0.48, 0.499, 0.49 resulte en variaciones significativas en la predicción de los estados tensionales calculados.
Otro problema se presenta al usar funciones de penalización para tener en cuenta la incompresibilidad como se muestra en [32], provocando afectaciones a la condición de la matriz de rigidez. Demostrándose que para parámetros de penalización grandes, el rendimiento de la solución por iteración puede ser deteriorado. Como solución a este problema se presenta en [32] un enfoque basado en el método de Lagrange incrementado como soporte de la condición de casi incompresibilidad, pudiendo por medio de este método usar parámetros más pequeños obteniéndose mejores resultados.
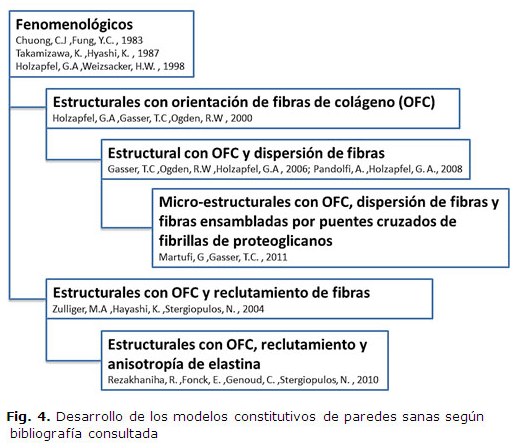
Para una mejor comprensión del desarrollo de los modelos de paredes arteriales que describen su comportamiento pasivo descritos anteriormente se presenta en la figura 4 un resumen de los modelos más referenciados mostrando su evolución. Este desarrollo paulatino hacia un entendimiento de la respuesta mecánica de este material todavía presenta importantes problemas [33]. Destacándose la necesidad de realizar ensayos a los tejidos para su ajuste y los diferentes criterios en la distribución de tenciones lo que dificulta su uso a la hora de modelar exactamente la respuesta mecánica de la arteria de un individuo. No obstante se han realizado importantes adelantos en la aplicación de estos así como en el desarrollo de nuevos campos teóricos que abren nuevas puertas a una aplicación más directa en patologías cardiacas y predicción del desarrollo de enfermedades.
MODELOS DE PAREDES ENFERMAS
Los modelos de paredes enfermas en su respuesta pasiva intentan modelar la respuesta biomecánica de la pared arterial sin tener en cuenta el efecto de las fibras musculares. La aterosclerosis es una de estas enfermedades afectando la capa más interna de la arteria, caracterizada por la acumulación local de lípidos, restos necróticos, calcio etc. La presencia de esta enfermedad en las paredes arteriales se evidencia con un estrechamiento del lumen arterial debido a la acumulación de capas de ateromas en partes locales del árbol arterial. Causando la obstrucción del flujo sanguíneo lo que trae aparejado una fuerte afectación al sistema cardiocirculatorio del paciente que la padece. Esta no debe ser confundida con la arteriosclerosis, enfermedad que se refiere a un endurecimiento (aumento de rigidez) de la pared arterial, a pesar de que en muchos casos las dos coexisten [34].
Los modelos mecánicos que describen el comportamiento de esta enfermedad están dirigidos a la predicción de la formación y desarrollo de las capas de ateromas en arterias de mediano y gran calibre del árbol vascular prestándose especial atención a las bifurcaciones arteriales, y a la respuesta de estos vasos cuando son sometidos a grandes cargas como ocurre en la colocaciones de stenty balloonangioplasty [35-37]. Otros estudios han estado dirigido a la obtención de parámetros como la rigidez, que caractericen la condición de la pared así como la comprensión de su respuesta mecánica y desarrollo de enfermedades [38-40].
La formación de placas de ateromas en las arterias son más frecuentes en bifurcaciones [11, 35, 39] donde el incremento local de las tensiones son más frecuentes. Ya en Humphrey, J. D. y Na, S. [11] se planteó la necesidad de prestar especial interés al análisis de los estados tensionales en las bifurcaciones sugiriendo los modelos elaborados en [41, 42] como punto de partida para la modelación de arterias con estapatología. En Holzapfel, G. A. y Ogden, R. W. [28] se discute la relevancia y aportes a este tema de muchos autores, enfocándose en trabajos que aplican mayormente la teoría presentadas en [8, 14, 43].
Entre los modelos constitutivos más estudiados en los últimos años con relación a estas afecciones se encuentran los modelos relacionados con los tratamientos aplicados a este tipo de afecciones, en los cuales las paredes arteriales son sometidas a grandes presiones como es el caso del (balloonangioplasty) con o sin stent. Los modelos más referenciados en la literatura consultada son los de daño y remodelación de fibras de colágeno, destacándose los trabajos de [35, 44].
La comprensión y caracterización de la respuesta mecánica de las placas de ateromas y de la pared en su conjunto son de vital importancia para la exacta descripción de su comportamiento a partir de modelos. En este sentido en [45] se hace una caracterización del comportamiento mecánico de placas de ateromas extraídas durante las endarterectomy analizadas dentro de las primeras dos horas luego de su extracción. Estas pruebas demostraron que las placas calcificadas son las más rígidas, mientras que las echolucentson las menos rígidas así como una fuerte variación de su comportamiento en muestras tomadas de diferentes locaciones anatómicas. El conocimiento de este comportamiento debe estar aparejado de un cuidadoso análisis de los resultados como de un control estricto de las pruebas a las que son sometidos para la extracción de parámetros. En [40] se hace un estudio relacionado con las muestras extraídas durante las endarterectomy proponiendo las dimensiones apropiadas para su correcto análisis.
Uno de los grandes retos que presenta la comunidad científica es el ajuste de los modelos a las características del individuo, para lo que es necesario la extracción de variables que caractericen el comportamiento de la arteria sin necesidad de realizar pruebas invasivas. En este sentido el tratamiento de imágenes usando tomografía computarizada CT e imágenes de resonancia magnética MRImuestra importantes adelantos, en [39] son utilizadas para cuantificar zonas de aumento de rigidez de la pared, sugiriendo la existencia de relación entre estas zonas y la iniciación de placas aterosclerótica. El uso de la tonometría de aplanamiento y la estimación de movimiento basada en ecografía (applanationtonometry and anultra sound-based motionestimation) podría ser una alternativa para determinar la presencia de rigidez arterial en pacientes vivos [38]. Variables tan importantes para la caracterización de la respuesta mecánica de la pared arterial como la variación en la tensión circunferencial, el módulo de elasticidad tangencial y la rigidez inducida por el incremento de la presión dentro del vaso fueron medidas en [46], usando (B-mode Duplex ultrasono graphy) y un (angiocatheter). Estos adelantos contribuirán en gran medida hacia el uso de los modelos constitutivos de paredes arteriales en pacientes, mejorando la calidad de los tratamientos y promoviendo el desarrollo de nuevas y mejores técnicas.
Los aneurismas son una de las patologías de especial interés a la hora de formular relaciones constitutivas que describan su comportamiento. El crecimiento de estas dilataciones asimétricas focalmente localizadas están caracterizadas por un decrecimiento dramático de las células musculares y fibras elásticas de la pared arterial provocando un incremento de su rigidez y una disminución de su distensibilidad [47]. El desarrollo de estos modelos ha estado marcado por la necesidad de predecir la evolución de esta enfermedad para prevenir una ruptura repentina del aneurisma. Los modelos de cambio de masa y estructura (growth and remodeling) y daño continuo (damage) son en estos momentos los más usados y estudiados en este sentido, pudiendo citar el trabajo realizado en [48].
CONCLUSIONES
La nueva propuesta de organización de los modelos, teniendo en cuenta su aplicabilidad y evolución, permite identificar de manera rápida las características de la pared arterial que describen.
Los modelos publicados en este campo son ajustados a los diferentes casos usando pruebas de extensión e inflado por lo que no pueden ser personalizados a casos reales. En este aspecto se requieren de nuevos métodos de extracción de propiedades mecánicas no invasivas como puede ser el uso de ultrasonidos.
Los modelos constitutivos evolucionaron incorporando elementos de la micro estructura de la pared arterial con el fin de describir con mayor exactitud su comportamiento. Destacándose la descripción del proceso de reclutamiento y dispersión de fibras de colágeno.
REFERENCIAS
1. Nichols, M., Townsend, N., Luengo-Fernandez, R., et al. European Cardiovascular Disease Statistics. European Heart Network AISBL, Brussels and European Society of Cardiology, Sophia Antipolis, 2012. p. ISBN 978-2-9537898-1-2.
2. Chen, H., Yi, L., Zhao, X., et al. "A micromechanics finite-strain constitutive model of fibrous tissue". Journal of the Mechanics and Physics of Solids. 2011, vol. 59, p. 1823-1837. ISSN 0022-5096. DOI 10.1016/j.jmps.2011.05.012
3. Sommer, G. y Holzapfel, G. A. "3D constitutive modeling of the biaxial mechanical response of intact and layer-dissected human carotid arteries". Journal of the Mechanical Behavior of Biomedical Materials. 2012, vol. 5, p. 116-128. ISSN 1757-6161. DOI 10.1016/j.jmbbm.2011.08.013
4. Demiray, H. "A note on the elasticity of soft biological tissues". Journal of Biomechanics. 1972, vol. 5, p. 309-311. ISSN 0021-9290.
5. Vaishnav, R. N., John, T. y Patel, D. J. "Distribution of Stresses and of Strain-Energy Density through the Wall Thickness in a Canine Aortic Segment". Journal of the American Heart Association. 1973, vol. 32, p. 577-583, ISSN 1524-4571. DOI 10.1161/01.RES.32.5.577
6. Chuong, C. J. y Fung, Y. C. "Three-dimensional stress distribution in arteries". Journal of Biomechanical Engineering. 1983, vol. 105, p. 268-274. ISSN 0148-0731.
7. Takamizawa, K. y Hayashi, K. "Strain energy density function and uniform strain hypothesis for arterial mechanics". Journal of Biomechanics. 1987, vol. 20, nº. 1, p. 7-17. ISSN 0021-9290.
8. Holzapfel, G. A. y Gasser, T. C. "A New Constitutive Framework for Arterial Wall Mechanics and a Comparative Study of Material Models". Journal of Elasticity. 2000, vol. 61, p. 1-48. ISSN 0374-3535.
9. Zulliger, M. A., Frideza, P., Hayashi, K., et al. "A strain energy function for arteries accounting for wall composition and structure". Journal of Biomechanics. 2004, vol. 37, p. 989-1000. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2003.11.026
10. Humphrey, J. D. "Stress, strain and mechanotransduction in cells". Journal of Biomechanics. 2001, vol. 123, p. 638-641. ISSN 0021-9290.
11. Humphrey, J. D. y Na, S. "Elastodynamics and Arterial Wall Stress". Annals of Biomedical Engineering. 2002, vol. 30, p. 509-523. ISSN 1573-9686. DOI 10.1114/1.1467676
12. Ní Annaidh, A., Destrade, M., Gilchrist, M. D., et al. "Deficiencies in numerical models of anisotropic nonlinearly elastic materials". Biomech Model Mechanobiol. 2013, vol. 12, p. 781-791. ISSN 1617-7959. DOI 10.1007/s10237-012-0442-3
13. Horny, L., Zitny, R. y Chlup, H. "Strain energy function for arterial walls based on limiting fiber extensibility". En: 4th European Conference of the International Federation for Medical and Biological Engineering (ECIFMBE). Antwerp, Belgium. 2009. p. 1910-1913. ISBN 978-3-540-89207-6.
14. Gasser, T. C., Ogden, R. W. y Holzapfel, G. A. "Hyperelastic modelling of arterial layers with distributed collagen fibre orientations". Journal of the Royal Society Interface. 2006, vol. 3, p. 15-35. ISSN 1742-5662. DOI 10.1098/rsif.2005.0073
15. Kroon, M. y Holzapfel, G. A. "A new constitutive model for multi-layered collagenous tissues". Journal of Biomechanics. 2008, vol. 41, p. 2766- 2771. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2008.05.033
16. Pandolfi, A. y Holzapfel, A. G. "Three-Dimensional Modeling and Computational Analysis of the Human Cornea Considering Distributed Collagen Fibril Orientations". Journal of Biomechanical Engineering. 2008, vol. 130, p. 061006 (061001-061012). ISSN 0148-0731. DOI 10.1115/1.2982251
17. Scott, J. E. "Elasticity in extra cellular matrix 'shape modules' of tendon, cartilage, etc. a sliding proteoglycan-filament model". The Journal of Physiology. 2003, vol. 553, nº. 2, p. 335- 343. ISSN 1469-7793. DOI 10.1113/jphysiol.2003.050179
18. Martufi, G. y Gasser, T. C. "A constitutive model for vascular tissue that integrates fibril, fiber and continuum levels with application to the isotropic and passive properties of the infrarenal aorta". Journal of Biomechanics. 2011, vol. 44, p. 2544-2550. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2011.07.015
19. Choi, H. S. y Vito, R. P. "Two dimensional stress-strain relationship for canine pericardium". Journal of Biomechanical Engineering. 1990, vol. 112, nº. 2, p. 153-159. ISSN 0148-0731.
20. Castañeda, P. P. "Second-order homogenization estimates for nonlinear composites in corporating field fluctuations .I. Theory and .II. Applications". Journal of the Mechanics and Physics of Solids. 2002, vol. 50, p. 737-757. ISSN 0022-5096.
21. Lopez-Pamies, O. y Castañeda, P. P. "Second-order estimates for the macroscopic response and loss of ellipticity in porous rubbers at large deformations". Journal of Elasticity. 2004, vol. 76, p. 247-287. ISSN 0374-3535.
22. Schrauwen, J. T. C., Vilanova, A., Rezakhaniha, R., et al. "A method for the quantification of the pressure dependent 3D collagen configuration in the arterial adventitia". Journal of Structural Biology. 2012, vol. 180, p. 335-342. Disponible en: http://dx.doi.org/10.1016/j.jsb.2012.06.007. ISSN 1047-8477.
23. Roy, S., Boss, C., Rezakhaniha, R., et al. "Experimental characterization of the distribution of collagen fiber recruitment". Journal of Biorheology. 2010, vol. 24, p. 84-93. ISSN 1867-0474. DOI 10.1007/s12573-011-0027-2
24. Rezakhaniha, R., Fonck, E., Genoud, C., et al. "Role of elastin anisotropy in structural strain energy functions of arterial tissue". Biomech Model Mechanobiol. 2011, vol. 10, p. 599-611. ISSN 1617-7959. DOI 10.1007/s10237-010-0259-x
25. Hill, M. R., Duan, X., Gibson, G. A., et al. "A theoretical and non-destructive experimental approach for direct inclusion of measured collagen orientation and recruitment into mechanical models of the artery wall". Journal of Biomechanics. 2012, vol. 45, p. 762-771. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2011.11.016
26. Volokh, K. V. "Modeling failure of soft anisotropic materials with application to arteries". Journal of the Mechanical Behavior of Biomedical Materials. 2011, vol. 4, p. 1582-1594. ISSN 1751-6161. DOI 10.1016/j.jmbbm.2011.01.002
27. Khamdaengyodtai, P., Vafai, K., Sakulchangsatjatai, P., et al. "Effects of pressure on arterial failure". Journal of Biomechanics. 2012, vol. 45, p. 2577-2588. Disponible en: http://dx.doi.org/10.1016/j.jbiomech.2012.07.032. ISSN 0021-9290.
28. Holzapfel, G. A. y Ogden, R. W. "Constitutive modelling of arteries". En: A collection of reviews celebrating the Royal Society 350th Anniversary. 2010. p. 1551-1597. ISBN 9780007302574.
29. Masson, I., Fassot, C. y Zidi, M. "Finite dynamic deformations of a hyperelastic, anisotropic, incompressible and prestressed tube. Applications to in vivo arteries". European Journal of Mechanics-A/Solids. 2010, vol. 29, p. 523-529. ISSN 0997-7538. DOI 10.1016/j.euromechsol.2010.02.007
30. Baek, S., Gleason, R. L., Rajagopal, K. R., et al. "Theory of small on large: Potential utility in computatios of fluid-solid interactions in arteries". Computer Methods in Applied Mechanics and Engineering. 2007, vol. 196, p. 3070-3078. ISSN 0045-7825. DOI 10.1016/j.cma.2006.06.018
31. Masson, I., Boutouyrie, P., Laurent, S., et al. "Characterization of arterial wall mechanical behavior and stresses from human clinical data". Journal of Biomechanics. 2008, vol. 41, p. 2618-2627. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2008.06.022
32. Brinkhues, S., Klawonn, A., Rheinbach, O., et al. "Augmented Lagrange methods for quasi-incompressible materials-Applications to soft biological tissue". International Journal for Numerical Methods in Biomedical Engineering. 2013, vol. 29, p. 332-350. ISSN 2040-7947. DOI 10.1002/cnm.2504
33. Taylor, C. T. y Humphrey, J. D. "Open Problems in Computational Vascular Biomechanics: Hemodynamics and Arterial Wall Mechanics". Computer Methods in Applied Mechanics and Engineering. 2009, vol. 198 (45-46), p. 3514-3523. ISSN 0045-7825. DOI 10.1016/j.cma.2009.02.004
34. Cavalcante, J. L., Lima, J. C., Redheuil, A., et al. "Aortic Stiffness Current Understanding and Future Directions". Journal of the American College of Cardiology. 2011, vol. 54 (14), p. 1511-1522. ISSN 0735-1097. DOI 10.1016/j.jacc.2010.12.017
35. Hariton, I., Debotton, G., Gasser, T. C., et al. "Stress-modulated collagen fiber remodeling in a human carotid bifurcation". Journal of Theoretical Biology. 2007, vol. 248, p. 460-470. ISSN 0022-5193. DOI 10.1016/j.jtbi.2007.05.037
36. Valencia, A. y Baeza, F. "Numerical simulation of fluid-structure interaction in stenotic arteries considering two layer nonlinear anisotropic structural model". International Communications in Heat and Mass Transfer. 2009, vol. 36, p. 137-142. ISSN 0735-1933. DOI 10.1016/j.icheatmasstransfer.2008.10.006
37. Robertson, M. A., Hill, M. R. y Dalong, L. Structurally motivated damage models for arterial walls. Theory and application. En: Modeling of Physiological Flows. Italia: Springer-Verlag. 2012, DOI 10.1007/978-88-470-1935-5_6
38. Khamdaeng, T., Luo, J., Vappou, J., et al. "Arterial stiffness identification of the human carotid artery using the stress-strain relationship in vivo". Ultrasonics. 2011. vol. 52, nº. 3, p. 402-411. ISSN 0041-624X. DOI 10.1016/j.ultras.2011.09.006
39. Ohayon, J., Gharib, A. M., Garcia, A., et al. "Is arterial wall-strain stiffening an additional process responsible for atherosclerosis in coronary bifurcations?: an in vivo study based on dynamic CT and MRI". American Journal of Physiology Heart and Circulatory Physiology. 2011, vol. 301, p. H1097-H1106. ISSN 1522-1539. DOI 10.1152/ajpheart.01120.2010
40. Mulvihill, J. J. y Walsh, M. T. "On the mechanical behaviour of carotid artery plaques: the influence of curve-fitting experimental data on numerical model results". Biomech Model Mechanobiol. 2012. vol. 12, nº. 5, p. 975-985. ISSN 1617-7959. DOI 10.1007/s10237-012-0457-9
41. Loree, H. M., Grodzinsky, A. J., Park, S. Y., et al. "Static circumferential tangential modulus of human atherosclerotic tissue". Journal of Biomechanics. 1994, vol. 27(2), p. 195-204. ISSN 0021-9290.
42. Topoleski, L. D. T., Salunke, N. V., Humphrey, J. D., et al. "Composition- and history-dependent radial compressive behavior of human atherosclerotic plaques". Journal of Biomedical Materials Research. 1997, vol. 35, p. 117-127. ISSN 1552-4965.
43. Holzapfel, G. A., Sommer, G., Gasser, C. T., et al. "Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling". American Journal of Physiology Heart and Circulatory Physiology. 2005, vol. 289, p. H2048-H2058. ISSN 1522-1539. DOI 10.1152/ajpheart.00934.2004
44. Holzapfel, G. A. y Gasser, T. C. "Computational stress-deformation analysis of arterial walls including high-pressure response". International Journal of Cardiology. 2007, vol. 116, p. 78-85. ISSN 0167-5273. DOI 10.1016/j.ijcard.2006.03.033
45. Maher, E., Creane, A., Sultan, S., et al. "Tensile and compressive properties of fresh human carotid atherosclerotic plaques". Journal of Biomechanics. 2009, vol. 42, p. 2760-2767. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2009.07.032
46. Kamenskiy, A. V., Dzenis, Y. A., Mactaggart, J. N., et al. "Nonlinear Mechanical Behavior of The Human Common, External, and Internal Carotid Arteries In Vivo". Journal of Surgical Research. 2012, vol. 176, p. 329-336. ISSN 0022-4804. DOI 10.1016/j.jss.2011.09.058
47. Humphrey, J. D. y Holzapfel, G. A. "Mechanics, mechanobiology, and modeling of human abdominal aorta and aneurysms". Journal of Biomechanics. 2012, vol. 45, p. 805-814. ISSN 0021-9290. DOI 10.1016/j.jbiomech.2011.11.021
48. Marini, G., Maier, A., Reeps, C., et al. "A continuum description of the damage process in the arterial wall of abdominal aortic aneurysms". International Journal for Numerical Methods in Biomedical Engineering. 2012, vol. 28, p. 87-99. ISSN 2040-7947. DOI 10.1002/cnm.1472
Recibido: 24 de febrero de 2014.
Aceptado: 10 de agosto de 2014.
Guillermo Fernández-Collazo. Instituto Superior Politécnico José Antonio Echeverría. Facultad de Ingeniería Mecánica, La Habana, Cuba
Correo electrónico: gfernandezc@mecanica.cujae.edu.cu